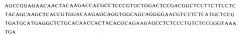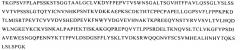Антигенсвязывающие молекулы, которые связывают egfr, кодирующие их векторы и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии и иммунологии. Предложены выделенные полинуклеотиды, кодирующие вариабельные области легкой и тяжелой цепи антитела против человеческого EGFR; анти-EGFR антитело и фрагмент антитела; а также вектор, клетка-хозяин и способ получения анти-EGFR антитела или его фрагмента. Рассмотрены: композиция, содержащая анти-EGFR антитело или его фрагмент, ее применение, а также применение антитела и его фрагмента для лечения расстройств, отличающихся сверхэкспрессией EGFR. Кроме того, описан способ выявления присутствия EGFR в образце с помощью антитела по изобретению. Настоящее изобретение может найти дальнейшее применение в терапии EGFR-опосредованных заболеваний. 22 н. и 48 з.п. ф-лы, 29 ил., 38 табл., 5 пр.
Реферат
Предпосылки создания изобретения
Область изобретения
Настоящее изобретение относится к антигенсвязывающим молекулам (ACM). В конкретных вариантах осуществления настоящее изобретение относится к рекомбинантным моноклональным антителам, включая химерные, приматизированные или гуманизированные антитела, специфические в отношении рецептора человеческого эпидермального фактора роста (EGFR). Кроме того, настоящее изобретение относится к молекулам нуклеиновой кислоты, кодирующим данные ACM, а также векторам и клеткам-хозяевам, включающим данные молекулы нуклеиновой кислоты. Изобретение далее относится к способам получения ACM, представленных в изобретении, и к способам применения данных ACM при лечении заболевания. Кроме того, настоящее изобретение относится к ACM с модифицированным гликозилированием, обладающим улучшенными терапевтическими свойствами, включая антитела с повышенным уровнем связывания Fc-рецептора и повышенной эффекторной функцией.
Предшествующий уровень техники
EGFR и антитела к EGFR
Рецептор человеческого эпидермального фактора роста (известный также как HER-1 или Erb-B1 и обозначаемый в данном контексте как "EGFR") представляет собой трансмембранный рецептор 170 кД, кодируемый протоонкогеном с-erbB и проявляющий присущую ему активность тирозинкиназы (см. статьи Modjtahedi et al., Br. J. Cancer 73: 228-235 (1996); Herbst and Shin, Cancer 94: 1593-1611 (2002)). Элемент базы данных SwissProt Р00533 представляет последовательность EGFR. Кроме того, существуют изоформы и варианты EGFR (например, альтернативные транскрипты РНК, укороченные версии, полиморфизмы и т.п.), включая, но без ограничения идентифицированными элементами базы данных Swissprot NoNo P00533-1, Р00533-2, Р00533-3 и Р00533-4. Известно, что EGFR связывает лиганды, в том числе эпидермальный фактор роста (EGF), трансформирующий фактор роста-α (TGF-α), амфирегулин, гепаринсвязывающий EGF (hb-EGF), бетацеллюлин и эпирегулин (см. статьи Herbst and Shin, Cancer 94: 1593-1611 (2002); Mendelsohn and Baselga, Oncogene 19: 6550-6565 (2000)). EGFR регулирует многочисленные клеточные процессы посредством путей сигнальной трансдукции, опосредуемых тирозинкиназой, включая, но без ограничения перечисленным, активацию путей сигнальной трансдукции, которые контролируют клеточную пролиферацию, дифференцировку, выживаемость клетки, апоптоз, ангиогенез, митогенез и метастазирование (см. статьи Atalay et al., Ann. Oncology 14: 1346-1363 (2003); Tsao and Herbst, Signal 4: 4-9 (2003); Herbst and Shin, Cancer 94: 1593-1611 (2002); Modjtahedi et al., Br. J. Cancer 73: 228-235 (1996)).
Сверхэкспрессия EGFR описана при многочисленных злокачественных состояниях у человека, включая рак мочевого пузыря, головного мозга, головы и шеи, поджелудочной железы, легкого, молочной железы, яичников, толстой кишки, простаты и почки, (см. статьи Atalay et al., Ann. Oncology 14: 1346-1363 (2003); Herbst and Shin, Cancer 94: 1593-1611 (2002) Modjtahedi et al., Br. J. Cancer 73: 228-235 (1996)). При многих из данных состояний сверхэкспрессия EGFR коррелирует или ассоциируется с неблагоприятным прогнозом для пациентов. (см. статьи Herbst and Shin, Cancer 94: 1593-1611 (2002) Modjtahedi et al., Br. J. Cancer 73: 228-235 (1996)). EGFR экспрессируется также в клетках нормальных тканей, особенного эпителиальных тканей кожи, печени и желудочно-кишечного тракта, хотя обычно на более низких уровнях, чем в злокачественных клетках (см. статью Herbst and Shin, Cancer 94: 1593-1611 (2002)).
Неконъюгированные моноклональные антитела (mAb) могут представлять собой эффективные лекарственные средства для лечения рака, как показывает одобрение Управления по контролю над качеством пищевых продуктов и медикаментов США трастуцумаба (Herceptin™; Genentech Inc,), предназначенного для лечения запущенного рака молочной железы (см. статьи Grillo-Lopez, A.-J., et al., Semin. Oncol. 26: 66-73 (1999); Goldenberg, M.M., Clin. Ther. 21: 309-18 (1999)), ритаксимаба (Rituxan™; IDEC Pharmaceuticals, San Diego, CA и Genentech Inc., San Francisco, CA), предназначенного для лечения СВ20-положительной В-клеточной, низкодифференцированной или фолликулярной лимфомы не-Ходжкина, гемтуцумаба (Mylotarg™, Celltech/Wyeth-Ayerst), предназначенного для лечения рецидивирующего острого миелоидного лейкоза и алемтуцумаба (CAMPATH™, Millenium Pharmaceuticals/Schering AG), предназначенного для лечения В-клеточного хронического лимфолейкоза. Успех данных продуктов основан не только на их эффективности, но также на их замечательных профилях безопасности (см. статьи Grillo-Lopez, A.J., et al., Semin. Oncol. 26: 66-73 (1999); Goldenberg, M.M., Clin. Ther. 21: 309-18 (1999)). Несмотря на достижения в области данных лекарственных препаратов, в настоящее время существует большой интерес к получению более высокоспецифической активности антител, чем та, которую обычно получают при терапии с использованием неконъюгированных mAb.
Результаты ряда исследований позволяют предположить, что Fc-рецептор-зависимые механизмы вносят вклад в действие цитотоксических антител к опухолям и показывают, что оптимальное антитело к опухолям предпочтительно связывалось бы с активирующими Fc-рецепторами и минимально с ингибирующим партнером FcγRIIB. (см. статьи Clynes, R.A., et al., Nature Medicine 6(4): 443-446 (2000); Kalergis, A.M. и Ravetch, J.V., J. Exp.Med. 195(12): 1653-1659 (июнь 2002). Например, результаты по меньшей мере одного исследования предполагают, что полиморфизм в рецепторе FcγRIIIa, в частности, сильно ассоциирован с эффективностью терапии антителами, (см. статью Cartron, G., et al., Blood 99(3): 754-757 (февраль 2002)). Данное исследование показало, что у пациентов, гомозиготных по FcγRIIIa, лучше ответ на ритаксимаб, чем у гетерозиготных пациентов. Авторы заключают, что улучшенный ответ обусловлен улучшенным связыванием in vivo антитела к FcγRIIIa, который приводит в результате к повышенной активности ADCC в отношении клеток лимфомы. (см. статью Cartron, G., et al., Blood 99(3): 754-757 (февраль 2002)).
Описаны различные стратегии получения направленности на EGFR и блокирования сигнальных путей EGFR. Маленькие молекулы-ингибиторы тирозинкиназы, такие как джефитиниб, эрлотиниб и Cl-1033, блокируют аутофосфорилирование EGFR на внутриклеточном участке тирозинкиназы, ингибируя таким образом происходящие далее по ходу процесса события передачи сигнала (см. статью Tsao and Herbst, Signal 4: 4-9 (2003)). Моноклональные антитела, с другой стороны, направлены на внеклеточную часть EGFR, что приводит в результате к блокированию связывания лиганда и, таким образом, ингибирует происходящие далее по ходу процесса события, такие как пролиферация клетки (см. статью Tsao and Herbst, Signal 4: 4-9 (2003)).
Генерирован ряд мышиных моноклональных антител, которые осуществляют блокирование in vitro, и которые оценены по их способности воздействовать на рост опухоли на моделях ксенотрансплантатов у мышей (см. статью Masui, et al., Cancer Res. 46: 5592-5598 (1986); Masui, et al., Cancer Res. 44: 1002-1007 (1984); Goldstein, et al., Clin. Cancer Res. 1: 1311-1318 (1995)). Например, EMD 55900 (EMD Pharmaceuticals) представляет собой мышиное моноклональное антитело к EGFR, которое образуется в отношении клеточной линии человеческой эпидермоидной карциномы А431 и было тестировано в клинических исследованиях пациентов с запущенной карциномой сквамозных клеток глотки или гипофаринкса (см. статью Bier et al., Eur. Arch. Otohinolaryngol. 252: 433-9 (1995)). Кроме того, показано, что крысиные моноклональные антитела ICR16, ICR62 и ICR80, которые связывают внеклеточный домен EGFR, эффективны в плане ингибирования связывания рецептора EGF и TGF-α (трансформирующий фактор роста) (см. статью Modjtahedi et al., Int. J. Cancer 75: 310-316 (1998)). Мышиное моноклональное антитело 425 представляет собой другое Mab (моноклональное антитело), которое образуется в отношении клеточной линии карциномы человека А431, и обнаружено, что оно связывается с полипептидным эпитопом на наружном домене рецептора человеческого эпидермального фактора роста, (см. статью Murthy et al., Arch. Biochem. Biophys. 252(2): 549-560 (1987). Потенциальная проблема использования мышиных антител в терапевтическом лечении состоит в том, что нечеловеческие моноклональные антитела могут распознаваться человеком-хозяином как чужеродный белок; вследствие этого повторные инъекции данных чужеродных антител могут привести к индукции иммунных ответов, ведущих к вредным реакциям гиперчувствительности. Для моноклональных антител на основе мышиных данный эффект часто обозначают как ответ человеческого антитела к мыши или ответ "HAMA" либо ответ человеческого антитела к крысе или "HARA". Кроме того, данные "чужеродные" антитела могут быть атакованы иммунной системой хозяина, так что они, в сущности, нейтрализуются до того, как достигнут своего целевого центра. Более того, у нечеловеческих моноклональных антител (например, мышиных моноклональных антител), как правило, отсутствует функциональность человеческого эффектора, т.е. они неспособны в числе прочего опосредовать комплемент-зависимый лизис или лизировать человеческие клетки-мишени посредством антитело-зависимой клеточной токсичности или опосредованного Fc-рецептором фагоцитоза.
Химерные антитела, включающие части антител, выделенные у двух или более различных видов (например, мыши и человека), разработаны в качестве альтернативы "конъюгированным" антителам. Например, в патенте США No. 5891996 (выданном Mateo de Acosta del Rio et al.) обсуждают химерное антитело типа мышь/человек, R3, направленное на EGFR, и в патенте США No. 5558864 обсуждают создание химерных и гуманизированных форм мышиного анти-EGFR Mab 425. Кроме того, IMC-C225 (Erbitux®; ImClone) представляет собой химерное мышиное/человеческое моноклональное антитело к EGFR (на основе мышиного моноклонального антитела М225, которое приводит к ответам HAMA в клинических испытаниях на человеке), которое, как показано, проявляет противоопухолевую активность в различных моделях ксенотрансплантатов человека, (см. статью Herbst and Shin, Cancer 94: 1593-1611 (2002)). Эффективность IMC-С225 приписывают нескольким механизмам, включая ингибирование клеточных событий, регулируемых путями передачи сигнала EGFR и, возможно, повышенной активностью антителозависимой клеточной токсичности (ADCC) (см. статью Herbst and Shin, Cancer 94: 1593-1611 (2002)). IMC-С225 также использовали в клинических испытаниях, в том числе в комбинации с радиотерапией и химиотерапией (см. статью Herbst and Shin, Cancer 94: 1593-1611 (2002)). Недавно фирма Abgenix, Inc. (Fremont, CA) разработала ABX-EGF для терапии рака. ABX-EGF представляет собой полностью человеческое моноклональное антитело к EGFR. (см. статью Yang et al., Crit. Rev. Oncol./Hematol. 38: 17-23 (2001)).
Гликозилирование антител
Олигосахаридный компонент может в существенной степени воздействовать на свойства, относящиеся к эффективности терапевтического гликопротеина, включая физическую стабильность, устойчивость к действию протеазы, взаимодействия с иммунной системой, фармакокинетику и специфическую биологическую активность. Данные свойства могут зависеть не только от присутствия или отсутствия, но также от специфических структур олигосахаридов. Можно вывести ряд общих правил относительно связи структуры олигосахарида и функции гликопротеина. Например, некоторые олигосахаридные структуры опосредуют быстрое выведение гликопротеина из кровотока посредством взаимодействий со специфическими связывающими углеводы белками, тогда как другие могут связываться антителами и запускать нежелательные иммунные реакции, (см. статью Jenkins et al., Nature Biotechnol. 14: 975-81 (1996)).
Клетки млекопитающих являются предпочтительными хозяевами при получении терапевтических гликопротеинов вследствие своей способности гликозилировать белки в наиболее совместимой форме для введения человеку. (см. статьи Cumming et al., Glycobiology 1: 115-30 (1991); Jenkins et al., Nature Biotechnol. 14: 975-81 (1996)). Бактерии очень редко гликозилируют белки и, подобно другим типам обычных хозяев, таким как клетки дрожжей, филаментнозных грибов, насекомых и растений, дают образцы гликозилирования, ассоциированные с быстрым выведением из кровеносной системы, нежелательными иммунными реакциями и, в некоторых особых случаях, пониженной биологической активностью. Среди клеток млекопитающих клетки яичников китайского хомячка (СНО) наиболее широко использовали в два последних десятилетия. Кроме того, что они дают подходящие типы гликозилирования, данные клетки обеспечивают возможность постоянной генерации генетически стабильных высокопродуктивных клональных клеточных линий. Их можно культивировать до высокой густоты в простых биореакторах при использовании бессывороточных сред, и это дает возможность разработки безопасных и воспроизводимых биопроцессов. Другие обычно используемые клетки животных включают клетки почки детеныша китайского хомячка (ВНК), клетки мышиной миеломы NSO и SP2/0. Совсем недавно протестировано также получение трансгенных животных, (см. статью Jenkins et al., Nature Biotechnol. 14: 975-81 (1996)).
Все антитела содержат углеводные структуры в консервативных положениях константных областей тяжелой цепи, причем каждый изотип обладает отличающимся рядом N-связанных углеводных структур, которые регулирующим образом воздействуют на сборку белка, секрецию или функциональную активность, (см. статью Wright, А. и Morrison, S.L., Trends Biotech. 15: 26-32 (1997)). Структура присоединенного N-связанного углевода значительно изменяется в зависимости от степени процессинга и может включать сложные олигосахариды с высоким содержанием маннозы, множеством ветвей, а также биантеннальные олигосахариды. (см. статью Wright, А. и Morrison, S.L., Trends Biotech. 15: 26-32 (1997)). Как правило, имеет место гетерогенный процессинг олигосахаридных структур ядра, присоединенных к определенному центру гликозилирования, так что однородные моноклональные антитела существуют в виде множества гликоформ. Аналогичным образом показано, что основные отличия в гликозилировании антител существуют между клеточными линиями, и даже наблюдают минимальные различия для данной клеточной линии, выращенной в различных условиях культивирования, (см. статью Lifely, M.R. et al., Glycobiology 5(8): 813-22 (1995)).
Одним путем получения большого увеличения активности при сохранении простого процесса продукции и потенциальном избежании существенных нежелательных побочных эффектов является усиление естественных опосредованных клетками эффекторных функций моноклональных антител посредством конструирования их олигосахаридного компонента, как описано в статье Umaña, P. et al., Nature Biotechnol. 17: 176-180 (1999) и патенте США No. 6602684, содержание которых включено в данном контексте в виде ссылки во всей своей полноте. Антитела типа IgGI, наиболее часто используемые антитела в иммунотерапии рака, представляют собой гликопротеины, которые имеют консервативный N-связанный центр гликозилирования в положении Asn297 в каждом CH2-домене. Два сложных биантеннальных олигосахарида, присоединенные к Asn297, скрытые между CH2-доменами, формируют обширные контакты с полипептидным скелетом, и их присутствие важно для опосредования антителом эффекторных функций, таких как антителозависимая клеточная цитотоксичность (ADCC) (см. статьи Lifely, M.R., et al., Glycobiology 5: 813-822 (1995); Jefferis, R., et al., Immunol Rev. 163: 59-76 (1998); Wright, A. and Morrison, S.L., Trends Biotechnol. 15: 26-32 (1997)).
Umaña et al. ранее показали, что сверхэкспрессия в клетках яичников китайского хомячка (СНО)β(1,4)-N-ацетилглюкозаминилтрансферазы III ("GnTIII"), гликозилтрансферазы, катализирующей формирование раздвоенных олигосахаридов, существенно повышает in vitro активность ADCC антинейробластомных химерных моноклональных антител (chCE7), продуцируемых инженерными клетками СНО. (см. статью See Umaña, P. et al., Nature Biotechnol. 17: 176-180 (1999) и Международную публикацию No. WO 99/54342, полное содержание которых включено в данном контексте в виде ссылки). Антитело chCE7 принадлежит к большому классу неконъюгированных mAb, которые обладают высокой аффинностью и специфичностью в отношении опухоли, но имеют слишком низкую активность для клинического применения при образовании стандартными промышленными клеточными линиями, у которых отсутствует фермент GnTIII (см. статью Umana, P., et al., Nature Biotechnol. 17: 176-180 (1999)). Данное исследование было первым, которое показало, что значительное увеличение активности ADCC можно было бы получить конструированием продуцирующих антитело клеток, экспрессирующих GnTIII, что приводит также к увеличению доли связанных с Fc константной области раздвоенных олигосахаридов, включая раздвоенные негликозилированные олигосахариды, выше уровней, обнаруживаемых в природных антителах.
Сохраняется потребность в усовершенствованных терапевтических подходах, направленных на EGFR, предназначенных для лечения нарушений пролиферации клеток у приматов, включая, но без ограничения перечисленным, человека, где данные нарушения характеризуются экспрессией EGFR, особенно патологической экспрессией (например, сверхэкспрессией) включая, но без ограничения перечисленным, рак мочевого пузыря, головного мозга, головы и шеи, поджелудочной железы, легкого, молочной железы, яичников, толстой кишки, простаты и почки.
Краткое описание изобретения
Признавая огромный терапевтический потенциал антигенсвязывающих молекул (ACM), которые обладают специфичностью связывания крысиного антитела ICR62 (например, связывают тот же самый эпитоп) и которые были подвергнуты гликоинженерингу с целью повышения аффинности связывания Fc-рецептора и эффекторной функции, авторы настоящего изобретения разработали способ получения данных ACM. Среди прочего данный способ включает получение рекомбинантных химерных антитела или их химерных фрагментов. Эффективность данных ACM далее повышают путем конструирования профиля гликозилирования Fc-участка антитела.
В соответствии с этим в одном аспекте изобретение направлено на выделенный полинуклеотид, включающий: (а) последовательность, выбранную из группы, состоящей из: SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:58, SEQ ID NO:60, SEQ ID NO:62, SEQ ID NO:64, SEQ ID NO:66, SEQ ID NO:68, SEQ ID NO:70, SEQ ID NO:72, SEQ ID NO:74, SEQ ID NO:122 и SEQ ID NO:124; (6) последовательность, выбранную из группы, состоящей из: SEQ ID NO:76, SEQ ID NO:78, SEQ ID NO:80, SEQ ID NO:82, SEQ ID NO:84, SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:90, SEQ ID NO:92, SEQ ID NO:94, SEQ ID NO:96, SEQ ID NO:98, SEQ ID NO:100, SEQ ID NO:102, SEQ ID NO:104, SEQ ID NO:106 и SEQ ID NO:126 и (в) SEQ ID NO:108. В другом аспекте изобретение направлено на выделенный полинуклеотид, включающий (а) последовательность, выбранную из группы, состоящей из SEQ ID NO:112 и SEQ ID NO:114; (б) последовательность, выбранную из группы, состоящей из SEQ ID NO:116 и SEQ ID NO:118 и (в) SEQ ID NO:119. В одном варианте осуществления любой из данных полинуклеотидов кодирует слитый полипептид.
В следующем аспекте изобретение направлено на выделенный полинуклеотид, включающий последовательность, выбранную из группы, состоящей из SEQ ID No:2; SEQ ID No:4; SEQ ID NO:6; SEQ ID NO:8; SEQ ID No:10; SEQ ID No:12; SEQ ID No:14; SEQ ID No:16; SEQ ID No:18; SEQ ID No:20; SEQ ID No:22; SEQ ID No:24; SEQ ID No:26; SEQ ID No:28; SEQ ID No:30; SEQ ID No:32; SEQ ID No:34; SEQ ID No:36; SEQ ID No:38; SEQ ID No:40 и SEQ ID No:120. В другом аспекте изобретение направлено на выделенный полинуклеотид, включающий последовательность, выбранную из группы, состоящей из SEQ ID No:44; SEQ ID No:46; SEQ ID No:50 и SEQ ID No:52. В одном варианте осуществления данные полинуклеотиды кодируют слитые полипептиды.
Изобретение, кроме того, направлено на выделенный полинуклеотид, включающий последовательность, имеющую идентичность по меньшей мере 80%, 85%, 90%, 95% или 99% с последовательностью, выбранной из группы, состоящей из SEQ ID No:2; SEQ ID No:4; SEQ ID NO:6; SEQ ID NO:8; SEQ ID No:10; SEQ ID No:12; SEQ ID No:14; SEQ ID No:16; SEQ ID No:18; SEQ ID No:20; SEQ ID No:22; SEQ ID No:24; SEQ ID No:26; SEQ ID No:28; SEQ ID No:30; SEQ ID No:32; SEQ ID No:34; SEQ ID No:36; SEQ ID No:38; SEQ ID No:40 и SEQ ID No:120, причем указанный выделенный полинуклеотид кодирует слитый полипептид. В дополнительном аспекте изобретение направлено на выделенный полинуклеотид, включающий последовательность, имеющую идентичность по меньшей мере 80% с последовательностью, выбранной из группы, состоящей из SEQ ID No:44; SEQ ID No:46; SEQ ID No:50 и SEQ ID No:52, причем указанный выделенный полинуклеотид кодирует слитый полипептид.
Изобретение направлено также на выделенный полинуклеотид, кодирующий химерный полипептид, имеющий последовательность SEQ ID No:1. В одном варианте осуществления полинуклеотид включает последовательность, кодирующую полипептид, имеющий последовательность SEQ ID No:1, и последовательность, кодирующую полипептид, имеющий последовательность Fc-участка антитела, или ее фрагмент, выделенные у видов, отличных от крысы. Изобретение направлено также на выделенный полинуклеотид, кодирующий химерный полипептид, имеющий последовательность, выбранную из группы, состоящей из SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No:11; SEQ ID No:13; SEQ ID No:15; SEQ ID No:17; SEQ ID No:19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No:33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39 и SEQ ID No: 121. В одном варианте осуществления полинуклеотид включает последовательность, кодирующую полипептид, имеющий последовательность, выбранную из группы, состоящей из SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No:11; SEQ ID No:13; SEQ ID No:15; SEQ ID No:17; SEQ ID No:19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No:33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39 и SEQ ID No: 121, и последовательность, кодирующую полипептид, имеющий последовательность Fc-участка антитела, или ее фрагмент, выделенные у видов, отличных от крысы.
В еще одном аспекте изобретение направлено на выделенный полинуклеотид, кодирующий химерный полипептид, имеющий последовательность SEQ ID No:43. В одном варианте осуществления полинуклеотид включает последовательность, кодирующую полипептид, имеющий последовательность SEQ ID No:43, и последовательность, кодирующую полипептид, имеющий последовательность Fc-участка антитела, или ее фрагмент, выделенные у видов, отличных от крысы. В еще одном аспекте изобретение направлено на выделенный полинуклеотид, кодирующий химерный полипептид, имеющий последовательность, выбранную из группы, состоящей из SEQ ID No:45; SEQ ID No:49 и SEQ ID No:51. В одном варианте осуществления полинуклеотид включает последовательность, кодирующую полипептид, имеющий последовательность, выбранную из группы, состоящей из SEQ ID No:45; SEQ ID No:49 и SEQ ID No:51, и последовательность, кодирующую полипептид, имеющий последовательность константной области легкой цепи антитела (CL) или ее фрагмент, выделенные у видов, отличных от крысы.
Изобретение направлено также на выделенный полинуклеотид, включающий последовательность, кодирующую полипептид, имеющий VH-область антитела ICR62 или ее функциональные варианты, и последовательность, кодирующую полипептид, имеющий последовательность Fc-участка антитела, или ее фрагмент, выделенные у видов, отличных от крысы. В другом аспекте изобретение направлено на выделенный полинуклеотид, включающий последовательность, кодирующую полипептид, имеющий VL-область антитела ICR62, или ее функциональные варианты, и последовательность, кодирующую полипептид, имеющий последовательность CL-области антитела, или его фрагмент, выделенный у видов, отличных от крысы.
Изобретение, кроме того, направлено на экспрессирующий вектор, включающий любой из вышеописанных выделенных полинуклеотидов, и на клетку-хозяина, которая включает данный экспрессирующий вектор. В следующем аспекте изобретение направлено на клетку-хозяина, включающую любой из вышеописанных выделенных полинуклеотидов.
В одном аспекте изобретение направлено на выделенный полипептид, включающий: (а) последовательность, выбранную из группы, состоящей из: SEQ ID NO:53 SEQ ID NO:55, SEQ ID NO:57, SEQ ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:123 и SEQ ID NO:125; (б) последовательность, выбранную из группы, состоящей из: SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95, SEQ ID NO:97, SEQ ID NO:99, SEQ ID NO:101, SEQ ID NO:103, SEQ ID NO:105 и SEQ ID NO:127 и (в) SEQ ID NO:107, причем указанный полипептид представляет собой слитый полипептид. В другом аспекте изобретение направлено на выделенный полипептид, включающий (а) последовательность, выбранную из группы, состоящей из SEQ ID NO:111 и SEQ ID NO:113; (6) SEQ ID NO:115 и (в) SEQ ID NO:117, причем указанный полипептид представляет собой слитый полипептид. Изобретение направлено также на химерный полипептид, включающий последовательность SEQ ID NO:1 или ее вариант. Изобретение, кроме того, направлено на химерный полипептид, включающий последовательность SEQ ID NO:43 или ее вариант. В одном варианте осуществления любой из данных полипептидов, кроме того, включает человеческий Fc-участок и/или человеческую CL-область. Изобретение направлено также на химерный полипептид, включающий последовательность, выбранную из группы, состоящей из SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No:11; SEQ ID No:13; SEQ ID No:15; SEQ ID No:17; SEQ ID No:19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No:33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39 и SEQ ID No:121, или ее вариант. Изобретение, кроме того, направлено на химерный полипептид, включающий последовательность, выбранная из группы, состоящей из SEQ ID No:45; SEQ ID No:49 и SEQ ID No:51 или ее варианта. В одном варианте осуществления любой из данных полипептидов, кроме того, включают человеческий Fc-участок и/или человеческую CL-область. В одном варианте осуществления человеческий Fc-участок включает IgG1.
В другом аспекте изобретение направлено на полипептид, включающий последовательность, выделенную из антитела ICR62, и последовательность, выделенную из гетерлогичного полипептида, и на антигенсвязывающую молекулу, включающую данный полипептид. В одном варианте осуществления антигенсвязывающая молекула представляет собой антитело. В предпочтительном варианте осуществления антитело являются химерными. В другом предпочтительном варианте осуществления антитело является гуманизированным или приматизированным.
В другом аспекте изобретение направлено на ACM, которая способна конкурировать с крысиным антителом ICR62 за связывание с EGFR и которая является химерной. В одном варианте осуществления ACM представляет собой антитело или ее фрагмент. В следующем варианте осуществления ACM представляет собой рекомбинантное антитело, включающее VH-область, имеющую последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO:1; SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No:11; SEQ ID No:13; SEQ ID No:15; SEQ ID No:17; SEQ ID No:19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No:33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39 и SEQ ID No:121. В другом варианте осуществления ACM представляет собой рекомбинантное антитело, включающее VL-область, имеющую последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO:43, SEQ ID No:45; SEQ ID No:49 и SEQ ID No:51. В следующем варианте осуществления ACM представляет собой рекомбинантное антитело, которое является приматизированным. В еще одном варианте осуществления ACM представляет собой рекомбинантное антитело, которое является гуманизированным. В другом варианте осуществления ACM представляет собой рекомбинантное антитело, включающее человеческий Fc-участок. В следующем варианте осуществления любая из вышеописанных ACM может быть конъюгирована с такой группой, как токсин или радиоактивная метка.
Изобретение, кроме того, направлено на ACM, представленную в настоящем изобретении, причем указанная ACM имеет модифицированные олигосахариды. В одном варианте осуществления модифицированные олигосахариды имеют пониженный уровень фукозилирования по сравнению с немодифицированными олигосахаридами. В других вариантах осуществления модифицированные олигосахариды представляют собой гибрид или комплекс. В следующем варианте осуществления ACM имеет повышенную долю нефукозилированных олигосахаридов или раздвоенных нефукозилированных олигосахаридов на Fc-участке указанной молекулы. В одном варианте осуществления раздвоенные нефукозилированные олигосахариды являются гибридными. В следующем варианте осуществления раздвоенные нефукозилированные олигосахариды представляют собой комплекс. В одном варианте осуществления по меньшей мере 20% олигосахаридов на Fc-участке указанного полипептида являются нефукозилированными или раздвоенными нефукозилированными. В более предпочтительных вариантах осуществления по меньшей мере 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75% либо более олигосахаридов являются нефукозилированными или раздвоенными нефукозилированными.
Изобретение, кроме того, направлено на полинуклеотид, кодирующий любую из вышеописанных ACM, и на экспрессирующие векторы и клетки, включающие данный полинуклеотид.
Изобретение, кроме того, направлено на способ получения ACM, которая способна конкурировать с крысиным антителом ICR62 за связывание с EGFR, и в котором указанная ACM является химерной; указанный способ заключается в:
(а) культивировании клетки-хозяина, включающей полинуклеотид, который кодирует ACM, представленную в настоящем изобретении, в среде в условиях, обеспечивающих экспрессию указанного полинуклеотида, кодирующего указанную ACM, и (б) выделении указанной ACM из полученной в результате культуры.
В другом аспекте изобретение относится к фармацевтической композиции, включающей ACM, представленную в изобретении. Предполагают, что фармацевтическая композиция может, кроме того, включать фармацевтически приемлемый носитель, адъювант или их комбинацию.
В следующем аспекте изобретение относится к способу лечения заболевания, характеризующегося экспрессией EGFR (например, патологической или сверхэкспрессией EGFR). Способ заключается во введении терапевтически эффективного количества ACM, представленной в настоящем изобретении, пациенту, предпочтительно пациенту-млекопитающему и более предпочтительно нуждающемуся в этом человеку. В предпочтительном варианте осуществления заболевание лечат введением ACM, которая представляет собой химерное (например, гуманизированное) антитело или химерный фрагмент антитела. В одном варианте осуществления ACM вводят в количестве от приблизительно 1,0 мг/кг до приблизительно 15,0 мг/кг. В другом варианте осуществления ACM вводят в количестве от приблизительно 1,5 мг/кг до приблизительно 12,0 мг/кг. В следующем варианте осуществления ACM вводят в количестве от приблизительно 1,5 мг/кг до приблизительно 4,5 мг/кг. В следующем варианте осуществления ACM вводят в количестве от приблизительно 4,5 мг/кг до приблизительно 12,0 мг/кг. В следующем варианте осуществления ACM вводят в количестве, выбранном из группы, состоящей из приблизительно 1,5, приблизительно 4,5 и приблизительно 12,0 мг/кг.
В еще одном аспекте изобретение относится к клетке-хозяину, сконструированной для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью GnTIII, в количестве, достаточном для модификации олигосахаридов на Fc-участке ACM, продуцируемой клеткой-хозяином, причем ACM способна конкурировать с крысиным антителом ICR62 за связывание с EGFR и, причем ACM является химерным. В одном варианте осуществления полипептид, обладающий активностью GnTIII, представляет собой слитый полипептид. В другом варианте осуществления ACM, продуцируемая клеткой-хозяином, представляет собой антитело или фрагмент антитела. В одном варианте осуществления антитело или фрагмент антитела является гуманизированным. В следующем варианте осуществления ACM включает участок, эквивалентный Fc-участку человеческого IgG.
Изобретение направлено также на выделенный полинуклеотид, включающий по меньшей мере один (например, один, два, три, четыре, пять или шесть) участок, определяющий комплементарность крысиного антитела ICR62 или его вариант либо укороченную форму, включающую по меньшей мере остатки, определяющие специфичность, для указанного участка, определяющего комплементарность, причем указанный выделенный полинуклеотид кодирует слитый полипептид. Предпочтительно, когда данные выделенные полинуклеотиды кодируют слитый полипептид, который представляет собой антигенсвязывающую молекулу. В одном варианте осуществления полинуклеотид включает три участка, определяющих комплементарность крысиного антитела ICR62, или их варианты либо укороченные формы, включающие по меньшей мере остатки, определяющие специфичность, для каждого из указанных трех участков, определяющих комплементарность. В другом варианте осуществления полинуклеотид кодирует полную вариабельную область легкой или тяжелой цепи химерного (например, гуманизированного) антитела. Изобретение, кроме того, направлено на полипептиды, кодируемые данными полинуклеотидами.
В другом варианте осуществления изобретение направлено на антигенсвязывающую молекулу, включающую по меньшей мере один (например, один, два, три, четыре, пять или шесть) участок, определяющий комплементарность крысиного антитела ICR62 или его вариант либо укороченную форму, включающую по меньшей мере остатки, определяющие специфичность, для указанного участка, определяющего комплементарность, и включающую последовательность, выделенную из гетерологичного полипептида. В одном варианте осуществления антигенсвязывающая молекула включает три участка, определяющих комплементарность крысиного антитела ICR62, или их варианты либо укороченные формы, включающие по меньшей мере остатки, определяющие специфичность, для каждого из указанных трех участков, определяющих комплементарность. В другом аспекте антигенсвязывающая молекула включает вариабельную область легкой или тяжелой цепи антитела. В одном особенно эффективном варианте осуществления антигенсвязывающая молекула представляет собой химерное, например гуманизированное, антитело. Изобретение направлено также на способы получения данных антигенсвязывающих молекул и их применение при лечении заболевания, в том числе злокачественных новообразований, таких как рак мочевого пузыря, головного мозга, головы и шеи, поджелудочной железы, яичников, толстой кишки, простаты, кожи и почки.
Клетка-хозяин, представленная в настоящем изобретении, может быть выбрана из группы, которая включает, но без ограничения перечисленным, клетку HEK293-EBNA, клетку СНО, клетку ВНК, клетку NSO, клетку SP2/0, клетку миеломы YO, клетку мышиной миеломы P3X63, клетку PER, клетку PER.C6 или гибридомную клетку. В одном варианте осуществления клетка-хозяин, представленная в изобретении, далее содержит трансфицированный полинуклеотид, включающий полинуклеотид, кодирующий VL-область крысиного антитела ICR62, или его варианты и последовательность, кодирующую участок, эквивалентный Fc-участку человеческого иммуноглобулина. В другом варианте осуществления клетка-хозяин, представленная в изобретении, далее содержит трансфицированный полинуклеотид, включающий полинуклеотид, кодирующий VH-область крысиного антитела ICR62, или его варианты и последовательность, кодирующую участок, эквивалентный Fc-участку человеческого иммуноглобулина.
В следующем аспекте изобретение направлено на клетку-хозяина, которая продуцирует ACM, которая проявляет повышенную аффинность связывания Fc-рецептора и/или повышенную эффекторную функцию в результате модификации ее олигосахаридов. В одном варианте осуществления повышенная аффинность связывания относится к Fc-рецептору, особенно рецептору FcγRIIIA. Эффекторная функция, рассматриваемая в данном контексте, может быть выбрана из группы, которая включает, но без ограничения перечисленным, повышенную Fc-опосредованную клеточную цитотоксичность, повышенный уровень связывания с NK-клетками (натуральными клетками-киллерами), повышенный уровень связывания с макрофагами, повышенный уровень связывания с полиморфонуклеарными клетками, повышенный уровень связывания с моноцитами, повышенный уровень прямой передачи сигнала индукции апоптоза, повышенный уровень созревания дендритных клеток и повышенный уровень примирования Т-клеток.
В следующем варианте осуществления клетка-хозяин, представленная в настоящем изобретении, включает по меньшей мере одну нуклеиновую кислоту, кодирующую полипептид, обладающий активностью GnTIII, который функционально связан с конститутивным промоторным элементом.
В другом аспекте изобретение направлено на способ получения ACM в клетке-хозяине, заключающийся в: (а) культивировании клетки-хозяина, сконструированной таким образом, чтобы она экспрессировала по меньшей мере один полинуклеотид, кодирующий слитый полипептид, обладающий активностью GnTIII, в условиях, который обеспечивают продукцию данной ACM и которые обеспечивают модификацию олигосахаридов, присутствующих на Fc-участке указанной ACM, и (б) выделении указанной ACM; причем указанная ACM способна конкурировать с крысиным антителом ICR62 за связывание с EGFR и, причем указанная ACM является химерной (например, гуманизированной). В одном варианте осуществления полипептид, обладающий активностью GnTIII, представляет собой слитый полипептид, предпочтительно включающий каталитический домен GnTIII и домен локализации в аппарате Гольджи гетерологичного полипептида, постоянно находящегося в аппарате Гольджи, выбранный из группы, состоящей из домена локализации маннозидазы II, домена локализации β(1,2)-N-ацетилгликозаминилтрансферазы I ("GnTI"), домена локализации маннозидазы I, домена локализации β(1,2)-N-ацетилгликозаминилтрансферазы II ("GnTII") и домена локализации а 1-6 ядерной фукозилтрансферазы. Предпочтительно, когда домен локализации в аппарате Гольджи выделен из маннозидазы II или GnTI. В следующем аспекте изобретение направлено на способ модификации профиля гликозилирования ACM к EGFR, продуцируемой клеткой-хозяином, заключающийся в интродукции в клетку-хозяина по меньшей мере одной нуклеиновой кислоты или экспрессирующего вектора, представленных в