Способ получения нанодисперсных оксидных материалов в виде сферических агрегатов
Иллюстрации
Показать всеИзобретение относится к области синтеза оксидных многофункциональных металлов сложного состава в нанодисперсном состоянии. Описан способ получения нанодисперсных оксидных материалов в виде сферических агрегатов, включающий приготовление раствора, в состав которого входят растворимые соли, содержащие катионы или анионы металлов, с последующим погружением в него органической матрицы для захвата ионов металла из раствора, в котором в качестве органической матрицы используют твердую ионообменную смолу, содержащую акрил-дивинилбензольную или стирол-дивинилбензольную матрицу, предварительно выдержанную в дистиллированной воде, которую помещают в раствор при постоянном перемешивании до полной сорбции ионов металлов, полученный образец предшественника оксида металла извлекают из раствора и сушат, после чего удаляют полимерную органическую матрицу путем ступенчатой термической обработки. Технический результат: получены простые или смешанные оксиды металлов в нанодисперсном состоянии с узким распределением частиц по размеру. 3 з.п. ф-лы, 10 ил., 9 пр.
Реферат
Предлагаемое изобретение относится к области синтеза оксидных многофункциональных металлов сложного состава в нанодисперсном состоянии, в том числе в виде агрегатов правильной сферической формы, и может быть использовано в производстве носителей и катализаторов для различных промышленных процессов переработки углеводородного сырья; синтезе керамических пигментов для лакокрасочных материалов и стекол, прекурсоров карбидов и нитридов металлов; в области получения наполнителей для композиционных материалов, а также легирующих и модифицирующих добавок для сплавов.
В настоящее время научные исследования ученых направлены на разработку новых способов синтеза оксидных функциональных материалов в ультрадисперсном состоянии, основанных на физико-химических процессах, которые позволяют получать материалы на основе мелкодисперсных частиц заранее заданного химического состава, с определенной морфологией.
Известен способ получения нанодисперсных оксидов металлов (RU 2407705, опубликовано 27.12.2010 г. Бюл. №36), включающий приготовление раствора β-дикетонатов одного или более металлов концентрацией 1⋅10-3÷1 моль/л в органическом растворителе или смеси растворителей в присутствии спирта, подвергающегося термической обработке при температуре 95÷250°С в течение 0,1÷8 часов с последующим гидролизом полученного раствора алкоксо-β-дикетонатов соответствующих металлов. Полученные в процессе гидролиза гели подвергают сушке при 15÷250°С при давлении 1⋅10-4÷1 атм до прекращения изменения массы. Термическую обработку ксерогелей с образованием нанокристаллических оксидов металлов проводят в кислородсодержащей атмосфере при температуре 350÷750°С в течение 0,5÷24 часов. Данное изобретение позволяет получать оксиды металлов в высокодисперсном состоянии с узким распределением частиц по размеру со средним размером частиц от 2 до 50 нм золь-гель методом.
К недостаткам данного изобретения можно отнести его многостадийность, использование органических растворителей, что способствует повышению стоимости конечного продукта и опасности процесса.
Известен способ получения оксидов металлов, их смесей и твердых растворов (RU №2226498, дата публикации 10.04.2004). Способ основан на методе термолиза нитратных, хлоридных, уксусных и других солей, который проводят на целлюлозной матрице, предварительно пропитанной солями. Полученные оксиды подвергают высокотемпературной обработке при температуре не ниже 650°С. В качестве целлюлозной матрицы используют отходы целлюлозного производства. Термолиз проводят при температуре 550-600°С. Концентрации растворов по металлу равны 80-120 г/дм3. Технический результат заключается в существенном снижении расходов и упрощении технологического процесса.
Поскольку техническая целлюлоза может содержать неконтролируемые примеси природного происхождения метод не дает гарантии заданной чистоты продуктов, что ограничивает сферу использования целевых продуктов, получаемых по способу, описанному в патенте.
Известен способ получения сложных оксидов металлов (RU 2383495. Опубликовано: 10.03.2010, Бюл. №7). Изобретение заключается в том, что водный раствор солей, легко разлагаемых термически, смешивают с водорастворимым неионогенным полимером, таким как поливиниловый спирт с молекулярной массой от 15000 до 100000 или поливинилпирролидон с молекулярной массой от 25000 до 360000. Полученный полимерно-солевой раствор наносят на подложку и сушат. Образовавшуюся пленку отделяют от подложки и сжигают с инициированием воспламенения. Размер частиц получающегося сложного оксида зависит от молекулярной массы исходного полимера. К недостаткам данного изобретения можно отнести то, что полимерный компонент для регулирования размера частиц получаемых оксидов металлов исходно имеет различное молекулярно-массовое распределение, что сказывается на распределении частиц получаемого материала по размерам и не позволяет получить агломераты правильной формы.
В качестве прототипа был выбран предложенный в 1967 году М.П. Пекини метод получения диэлектрических материалов и тонких пленок на основе титанатов и ниобатов свинца и щелочноземельных элементов и позднее был адаптирован для синтеза многокомпонентных высокодисперсных оксидных материалов (US 3330697, опубликован 11.06.1967 г. ). На первой стадии производится растворение солей металлов, в частности нитратов, в избытке лимонной кислоты для образования металлцитратного комплекса, с последующим добавлением этиленгликоля и нагреванием раствора до 100-140°С, что приводит к образованию гомогенного раствора-золя. Затем из полученного раствора-золя испаряют воду путем его нагревания до 180-200°С, тем самым повышая вязкость раствора, что приводит к образованию полимерного вязкого геля, с последующим удалением из него органических соединений в процессе термолиза. Конечным продуктом является рентгеноаморфный оксидный прекурсор.
По литературным данным в методе Пекини органическая матрица, образовавшаяся в процессе этерификации между хелатообразователем и многоатомным спиртом, захватывает ионы металлов, в которой они слабо связаны (Kaithwas, N. Structural features of Се doped YAG nanoparticles synthesized by modified sol-gel method / N. Kaithwas, M. Dave, S. Kar, K.S. Bartwal // Physica E. - 2012. - V. 44. - P. 1486-1489). Это является общим принципом с предлагаемым способом получения нанодисперсных оксидных материалов в виде сферических агрегатов, поэтому данное изобретение выбрано в качестве прототипа.
Основной задачей предлагаемого изобретения является разработка способа формирования оксидных многофункциональных материалов, в том числе сложного состава, в нанодисперсном состоянии, в том числе в виде агрегатов правильной сферической формы.
При решении поставленной задачи разработан и предложен способ, особенность которого заключается в использовании ионообменных смол для избирательного извлечения иона металла из водного раствора, позволяющих создавать управляемые по составу оксидные материалы в нанодисперсном состоянии, с узким распределением размеров частиц, в том числе в виде агрегатов правильной сферической формы.
Образование сферических агрегатов обеспечивается исходной сферической формой частиц ионообменных смол, а узкое распределение частиц по размерам обусловлено равномерным распределением ионов металлов в ионообменной матрице.
Предлагаемый способ включает в себя приготовление водного или неводного раствора, в состав которого входят растворимая(ые) соль(и), содержащая(ие) ионы металла(ов), с последующим погружением в него набухшей ионообменной смолы, предварительно выдержанной в дистиллированной воде для ускорения процесса сорбции, дальнейшим постоянным перемешиванием до полной сорбции ионов металла(ов), последующим извлечением ионообменной смолы, содержащей ионы одного или нескольких металлов. Полученный предшественник оксида металла сушат в потоке воздуха, инертного газа, или в вакууме при температуре 25-150°С, затем удаляют полимерную органическую матрицу ионита путем ступенчатой термической обработки.
Термическую обработку по удалению различных органических матриц можно выполнять различными процедурами. Хороший результат получают, если ее проводят нагреванием образца на воздухе или потоке кислородсодержащего газа до температуры 400-500°С, выдерживанием при этой температуре не менее 30 минут, дальнейшим нагревом до 700-900°С ступенями по 50-200°С с выдерживанием на каждой ступени в течение 15-30 минут, после чего выдерживают образец при температуре 700-900°С в течение 1-24 часов.
Предлагаемое изобретение отличается от прототипа по нескольким признакам: во-первых, главным условием прототипа является возможность образования хелатного комплекса с металлом, что не дает возможности использования растворимых солей, в которых металл является катионом или входит в состав аниона, во-вторых, в качестве компонента для захвата ионов металла из раствора используются твердые ионообменные смолы, содержащие акрил-дивинилбензольную или стирол-дивинилбензольную матрицу; в-третьих, в предлагаемом способе не проводится испарение воды для формирования полимерных гелей, а используется извлечение ионитов, в объем которых путем сорбции помещены ионы металлов, с их последующей термической обработкой.
Сущность изобретения поясняется примерами, которые иллюстрируются графиками и рисунками.
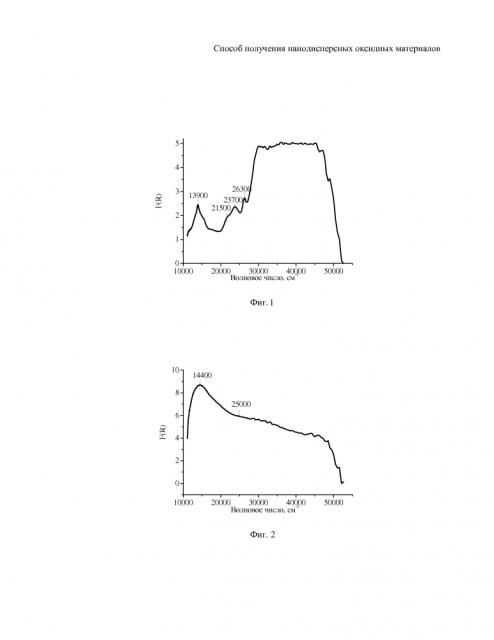
На фиг. 1 приведен спектр ЭСДО оксида никеля, полученного на катионите марки ТОКЕМ-200.
На фиг. 2 приведен спектр ЭСДО оксида кобальта.
На фиг. 3 приведены спектры ЭСДО оксида хрома. Марки анионита: 1 - ТОКЕМ-800; 2 - ТОКЕМ-840; 3 - ТОКЕМ-400.
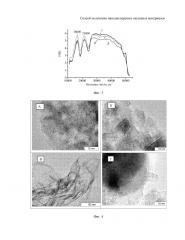
На фиг. 4 приведены электронно-микроскопические снимки образца Al2O3, показывающие наличие различных структур.
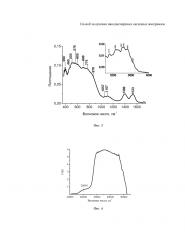
На фиг. 5 приведены ИК спектры образца Al2O3.
На фиг. 6 приведен спектр ЭСДО оксида церия, полученного на катионите марки КБ-125-П.
На фиг. 7 приведен спектр ЭСДО соединений серебра, полученных с использованием катионита марки КБ-125-П.
На фиг. 8 приведен спектр ЭСДО оксида железа.
На фиг. 9 приведен спектр ЭСДО оксида марганца.
На фиг. 10 приведен спектр ЭСДО оксида меди.
Пример 1. Для получения сферических гранул нанодисперсного оксида никеля (NiO) приготовили раствор хлорида никеля(II) в дистиллированной воде концентрацией 0,5 моль/л. Затем в приготовленный раствор поместили слабокислотный пористый катионит (объем катионита брали с расчетом на полную сорбцию катионов никеля, учитывая объемную емкость ионообменника), с акрил-дивинилбензольной матрицей и карбоксильными функциональными группами (марка ТОКЕМ-200). После обесцвечивания раствора погруженный в него ионообменник извлекли и высушили на воздухе при температуре 50°С. Удаление полимерной матрицы производили путем термической обработки катионита, в объем которого помещены катионы никеля(II), при 700°С в течение 2 часов. На спектре ЭСДО (фиг. 1) наблюдаются полосы поглощения (п.п.) с максимумами при 13900, 21500, 23700 и 26300 см-1, обусловленные проявлением d-d-переходов катионов Ni2+ в октаэдрической кислородной координации (Ni2+Oh).
Пример 2. Отличается от примера 1 тем, что сорбцию катионов из водного раствора хлорида кобальта(II) производили с помощью слабокислотного катионита с акрил-дивинилбензольной матрицей и карбоксильными функциональными группами (марка КБ-125-П) катионита при постоянном перемешивании на магнитной мешалке. Сушку подготовленного прекурсора оксида кобальта производили на воздухе при 65°С. Удаление полимерной органической матрицы вели при температуре 500°С в течение 2,5 часов и при температурах: 550, 600, 650, 700°С в течение 30 минут при каждой. На спектре ЭСДО (фиг. 2) наблюдаются п.п. с максимумами при 14400 и широкая п.п. 25000-35000 см-1, обусловленные проявлением d-d-переходов высокоспиновых катионов Со2+ в тетраэдрической кислородной координации (Co2+Td) и низкоспиновых катионов Со3+ в октаэдрической кислородной координации (Co3+Oh). Аналогичные спектры ЭСДО наблюдаются при удалении полимерной матрицы окислением на воздухе при температуре 400°С. Это обусловлено тем, что оксиды кобальта являются катализаторами глубокого окисления.
Пример 3. Отличается от примера 1 и примера 2 тем, что в качестве сорбируемых ионов из водного раствора дихромата калия выступали анионы. В качестве сорбирующего агента использовали три марки анионитов: Сильноосновный гелевый анионит ТОКЕМ-840, сильноосновный анионит гелевой структуры ТОКЕМ-800, слабоосновный анионит ТОКЕМ-400. Все аниониты имеют стирол-дивинилбензольную матрицу с четвертичными аммониевыми (для ТОКЕМ-800, ТОКЕМ-840) и третично аминовыми функциональными группами (для ТОКЕМ-400). В ходе сушки при 80°С в течение 30 минут и удалении органических полимерных матриц путем ступенчатой термической обработки при температурах: 500, 550, 600, 650 и 700°С в течение 120 минут при каждой были получены сферические гранулы (для ТОКЕМ-800 и ТОКЕМ-840) и мелкодисперсный порошок (для ТОКЕМ-400) оксида хрома(III). На спектре ЭСДО (фиг. 3) наблюдаются п.п. с максимумами при 16600 и 21600 см-1, обусловленные проявлением d-d-переходов катионов Cr3+ в октаэдрической кислородной координации (Cr3+Oh), стабилизированных в фазе α-Cr2O3.
Пример 4. Отличается от примера 1 тем, что из водного раствора нитрата алюминия(III) катионы алюминия сорбировали с помощью катионита КБ-125-П с последующей сушкой при комнатной температуре до воздушно-сухого состояния и удалением органической полимерной матрицы путем термической ступенчатой термической обработки: 400, 500, 600, в течение 30 минут при каждой, а также при 700°С в течение 25 часов. В результате получились сферические агрегаты мелкодисперсных частиц оксида алюминия, содержащие смесь аморфных частиц оксида алюминия (фиг. 4А), кристаллитов χ-фазы оксида алюминия (фиг. 4Б) с размерами 10-20 нм, гидроксида алюминия пластинчатой формы (фиг. 4В). В образце также имеются отдельные частицы α-оксида алюминия (фиг. 4Г) 50-100 нм. При прокаливании образца в кислородсодержащей атмосфере при температуре 900°С в образце значительно снижается доля гидроксидов алюминия.
В спектрах ИК наиболее ярко проявляются широкие полосы поглощения в области 500-600 и 750-850 см-1, которые характерны для низкотемпературных и кристаллических оксидов алюминия. ИК спектры полученного образца также подтверждают наличие в образце некоторого количества α-оксида алюминия, полосы поглощения 390, 460, 503 см-1 (фиг. 5.) гидроксида алюминия, полосы поглощения 3110, 3265, 3407, 3440, 3535 см-1, характерных для бемита и гиббсита (фиг. 5, врезка). Рефлексы в рентгенограммах этого образца подтверждают наличие χ-фазы оксида алюминия и других кристаллических примесных фаз в низкой концентрации.
Пример 5. В примере 5, в отличие от примера 4, при формировании оксида церия производили сорбцию катионов церия из водного раствора нитрата церия с помощью катионита ТОКЕМ-200. Условия сушки и удаления полимерной органической матрицы вели при температуре 75°С в течение часа и термической ступенчатой термической обработке: 400, 550, 700 в течение 30 минут при каждой и при 800°С в течение 10 часов, соответственно. В ходе этого образовались сферические агрегаты кораллового цвета. На спектре ЭСДО (фиг. 6) наблюдается сильное поглощение в области выше 25000 см-1, обусловленное проявлением ППЗ лиганд-металл катионов Се4+ в октаэдрической кислородной координации (Се4+Oh), на фоне которого можно выделить край фундаментального поглощения (КФП)
CeO2, равный 3,1 эВ. Плечо в области 15000-25000 см-1 небольшой интенсивности вероятнее всего обусловлено проявлением ППЗ лиганд-металл катионов Се3+ в октаэдрической кислородной координации (Се3+Oh) в небольшом количестве.
Пример 6. В отличие от примера 4, при формировании оксида серебра производили сорбцию катионов серебра из водного раствора нитрата серебра(I) с помощью катионита ТОКЕМ-200. Условия сушки и удаления полимерной органической матрицы вели при температуре 60°С в течение часа и 700°С в течение часа, соответственно. В ходе этого образовались сферические агрегаты черно-коричневого цвета. В спектре (фиг. 7) ЭСДО Ag2O наблюдаются две области поглощения. Интенсивное поглощение в УФ области спектра с максимумом 32000 см-1 обусловлено проявлением крупных частиц Ag0 размером более 200 . При этом поглощение небольшой интенсивности в видимой области спектра ЭСДО с максимумом при 26000 см-1 обусловлено проявлением плазмонного резонанса наночастиц Ag0 с размерами менее 50 нм.
В примере 7, в отличие от примера 4, при формировании оксида церия с помощью катионита ТОКЕМ-200 производили сорбцию катионов железа из водного раствора хлорида железа(II). Условия сушки и удаления полимерной органическом матрицы вели в токе гелия при температуре 25°С в течение часа и 700°С в течение 2 часов, соответственно. В ходе этого образовались сферические агрегаты красно-оранжевого цвета. В спектре ЭСДО (фиг. 8) наблюдается сильное поглощение в области выше 13000 см-1, на фоне которого можно выделить плечо небольшой интенсивности при 13400 см-1 и при 15000, а также две п.п. с максимумами при 20000 см-1 и 28600 см-1, обусловленные проявлением d-d-переходов и ППЗ лиганд-металл катионов Fe3+ в октаэдрической кислородной координации (Fe3+Oh), соответственно, стабилизированных в фазе α-Fe2O3.
Пример 8. В отличие от примера 7, при формировании оксида церия с помощью катионита ТОКЕМ-200 производили сорбцию катионов марганца из водного раствора хлорида марганца(II). Условия сушки и удаления полимерной органической матрицы вели при температуре 25°С в течение часа и 600°С в течение 1 часа, соответственно. В спектре ЭСДО (фиг. 9) наблюдается четыре п.п. с максимумами при 13800, 16000, 20000 и 21300 см-1, первые три из которых обусловлены проявлением d-d-переходов катионов Mn3+ в октаэдрической кислородной координации (Mn3+Oh), последняя п.п. обусловлена катионами Mn2+ в октаэдрической кислородной координации (Mn2+Oh), стабилизированных наиболее вероятно в фазе Mn3O4.
Пример 9. В примере 9, в отличие от примера 7, при формировании оксида церия с помощью катионита ТОКЕМ-200 производили сорбцию катионов меди из водного раствора сульфата меди(II). Условия сушки и удаления полимерной органической матрицы вели вакууме при температуре 60°С в течение часа и 600°С в течение 2 часов, соответственно. В спектре ЭСДО (фиг. 10) наблюдается сильное поглощение в области выше 10000 см-1, на фоне которого можно выделить две интенсивные п.п. с максимумами при 14100 см-1 и 38100 см-1, первая из них обусловлена d-d-переходом катионов Cu2+ в октаэдрической кислородной координации (Cu2+Oh), стабилизированных в фазе CuO, для которой значение КФП равно 1,2 эВ.
Применение способа по изобретению позволяет получать простые или смешанные оксиды металлов в нанодисперсном состоянии с узким распределением частиц по размеру, в том числе сферические агрегаты этих нанодисперсных частиц с размером до 1,25 мм.
1. Способ получения нанодисперсных оксидных материалов в виде сферических агрегатов, включающий приготовление раствора, в состав которого входят растворимые соли, содержащие катионы или анионы металлов, с последующим погружением в него органической матрицы для захвата ионов металла из раствора, отличающийся тем, что в качестве органической матрицы используют твердую ионообменную смолу, содержащую акрил-дивинилбензольную или стирол-дивинилбензольную матрицу, предварительно выдержанную в дистиллированной воде, которую помещают в раствор при постоянном перемешивании до полной сорбции ионов металлов, полученный образец предшественника оксида металла извлекают из раствора и сушат, после чего удаляют полимерную органическую матрицу путем ступенчатой термической обработки.
2. Способ по п. 1, отличающийся тем, что извлеченный образец сушат на воздухе, или в потоке сушащего газа, или в вакууме при температуре 25-150°С.
3. Способ по п. 2, отличающийся тем, что в качестве сушащего газа используют газ из перечня: воздух, инертный газ.
4. Способ по п. 1, отличающийся тем, что термическую обработку по удалению органической матрицы проводят нагреванием образца на воздухе или потоке кислородсодержащего газа до температуры 400-500°С, выдерживанием при этой температуре не менее 30 минут, дальнейшим нагревом до 700-900°С ступенями по 50-200°С с выдерживанием на каждой ступени в течение 15-30 минут, после чего выдерживают образец при температуре 700-900°С в течение 1-24 часов.