Способ персонифицированного подбора дентального имплантата на основе сплавов оксида титана
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для прогнозирования аллергических реакций при использования дентальных имплантатов на основе сплавов оксида титана в реконструктивной хирургии. Предлагаемый способ персонифицированного подбора пациенту дентального имплантата на основе сплавов оксида титана осуществляют в условиях in vitro с помощью тест-системы активации базофилов для оценки аллергической реакции на исследуемый материал методом подсчета разрушенных базофилов в крови пациента. Предварительно выделяют наночастицы с поверхности дентального имплантата путем инкубирования в воде при температуре 37,2°C в течение 5 дней, после чего на полученный супернатант воздействуют ультразвуком 35 кГц в течение 10-20 минут, затем добавляют венозную кровь пациента и моноклональные антитела к молекулам CD203 и CD294, повторно инкубируют в течение 15 минут и с помощью тест-системы методом проточной цитофлуориметрии фиксируют активацию базофилов либо ее отсутствие. Исходя из полученных результатов рассчитывают индекс активации базофилов, и в случае получения отношения количества позитивных базофилов исследуемого образца к количеству негативных базофилов контрольного образца меньше 1 или равного 1 рекомендуют данный имплантат к использованию. Использование способа позволяет прогнозировать и исключить возможные аллергические реакции со стороны иммунной системы пациента в послеоперационном периоде и, соответственно, осуществить индивидуальный подбор различных сплавов металлов и профилактику воспалительных осложнений в отсроченном периоде. 1 табл., 2 пр.
Реферат
Изобретение относится к медицине и предназначено для прогнозирования аллергических реакций как до, так и после использования металлических изделий в реконструктивной хирургии, в частности дентальных имплантатов на основе сплавов оксида титана, с целью индивидуального подбора различных сплавов металлов и профилактики воспалительных осложнений в отсроченном периоде.
Дентальная имплантация как метод комплексной реабилитации пациентов с первичной и вторичной адентией широко распространен как в нашей стране, так и за рубежом. Несмотря на успешное применение данного метода лечения, нельзя отрицать наличие осложнений, связанных с дезинтеграцией дентальных имплантатов, мукозитов, периимплантитов, а также системных реакций неясной этиологии. Возникновение данных осложнений авторы связывают с проявлениями иммунной системы и считают их персонифицированными, исходя из общего состояния пациента на момент обращения, планирования и проведения операции дентальной имплантации. На сегодняшний день успех механизма остеоинтеграции дентальных имплантатов рассматривается с позиции используемого материала, обработки его поверхности, структуры и физических свойств. Способность организма к тканевой репарации и принятию «биоинертного сплава металлов» в виде единого антигена, не принимающего непосредственного участия в происходящих клеточных взаимодействиях со стороны иммунной системы, заставляет усомниться в полноценности данной интерпретации.
При планировании операции дентальной имплантации проводят детальное внеротовое и внутриротовое обследование. Внеротовое обследование включает неврологическое обследование областей, иннервированных тройничным нервом, для выявления двигательных или чувствительных аномалий, функцию и подвижность височно-нижнечелюстного сустава, высоту линии улыбки для оценки косметических параметров, классификацию скелетного соотношения челюстей и др. Внутриротовое обследование включает оценку уровня индивидуальной гигиены, состояние имеющихся зубов, оценку пространства в области адентии, пальпацию альвеолярного гребня в области предполагаемой установки имплантатов, морфологический тип кости, косметический эффект в переднем отделе, антагонисты, объем функциональных возможностей.
Узловым главенствующим моментом в стоматологической имплантации, определяющим эффектом реабилитации, являются особенности реакции мягких тканей и кости на имплантат, что непосредственно связано с реакцией иммунной системы в связи с проведением оперативного вмешательства. Отсюда вытекает необходимость получения предоперационной информации о состоянии не только общего состояния организма пациента, но и необходимость профилактического подхода к прогнозированию возможных осложнений, связанных с реакциями иммунной системы.
Как известно из уровня современных технологий, некоторые металлы или металлические сплавы, такие как: оксид титана, оксид циркония, оксид гафния, оксид тантала, оксид ниобия или их сплавы, - имеют способность к остеоинтеграции, то есть образованию непосредственного контакта с костной тканью. В частности, металлические имплантаты из титана и его сплавов, начиная приблизительно с 1950 года, известны благодаря их способности хорошо связываться с костной тканью (Branemark et al., «Osseointegrated implants in the treatment of the edentulous jaw. Experience from a 10-year period (Остеоинтегрированные имплантаты при лечении лишенной зубов челюсти. 10-летний опыт)», Scand. J. Plast. Reconstr., II, suppl 16 (1977)).
В настоящее время титан, благодаря сочетанию хороших прочностных характеристик, высокой коррозионной стойкости и нетоксичности, является одним из основных материалов при изготовлении различных устройств (дентальные, ортопедические имплантаты) для имплантации в костную ткань. При обычных условиях титан легко окисляется и на его поверхности появляется тонкая пленка аморфного диоксида титана (-5 нм), которая и обеспечивает высокую коррозионную стойкость титана, но при этом характеризуется достаточно длительными сроками интеграции с костной тканью.
Таким образом, титан и его сплавы широко используются в восстановительной хирургии в качестве как зубных, так и ортопедических имплантатов вследствие их превосходной биосовместимости с костной тканью (P.J. Branemark, J. Prosthetik Dent 50: 399-410, 1983; D.J. Bardos, D. Williams (ed), Concise Encyelopedia of Medical je Dental Materials, Pergamon Press, Ox for 1990, p.p. 360-365; R. van Noork, J. Mater. Sci 22: 3801-3811, 1987). Это может быть объяснено уникальными характеристиками поверхности раздела титан-кость. Однако для усиления процессов соединения или сцепления и улучшения прочности связи или сцепления были разработаны и одобрены для клинического применения покрытия с плазменным напылением из апатита, в частности из гидроксиапатита (K. De Groot, J. Ceram. Soc Japan 99: 943-953, 1991).
Сегодня поверхность дентальных имплантатов рассматривается как единая структура, обладающая различными свойствами, в зависимости от особенностей обработки ее поверхности и используемого сплава на основе TiO2. Способность к остеоинтеграции сплава металлов на основе TiO2 может быть рассмотрена с позиции принятия инородного материала, так как любой антиген, попадающий в организм человека, принимает непосредственное участие в сложном каскаде клеточно-молекулярных взаимодействий. Исходом данных взаимодействий может стать как реакция отторжения - дезинтеграция дентального имплантата, так и реакция ограничения антигена, в виде образования фиброзной капсулы, так и принятие - в виде истинной остеоинтеграции, обусловленной формированием костной структуры в процессе тканевой репарации и др.
В стоматологии, как и в других областях медицины, часто используют сплавы металлов на основе титана для имплантации, при этом необходимо прогнозировать течение постимплантационного периода и прогнозировать состоятельность стоматологических имплантатов на основе сплавов титана.
В настоящее время для диагностики гиперчувствительности тканей к материалам, используемым при протезировании и лечении, используют различные микробиологические, цитологические, иммунологические исследования, изучение слюны, крови, мочи, желудочного сока и других биологических жидкостей. В частности, наиболее часто используемыми являются:
- кожные пробы (аппликационные, скарификационно-компрессные) со сплавами металлов, в ходе которых на внутреннюю часть предплечья устанавливается часть исследуемого материала и закрывается лейкопластырем и при возникновении через 24 часа покраснения, зуда и других изменений фиксируют наличие аллергии;
- экспозиционно-провокационная проба, заключающаяся в выведении съемного протеза из полости рта (экспозиция во времени) и введение его туда же (провокация); причем повышенная чувствительность фиксируется при возникновении травматического, токсического и аллергического стоматита;
- эпимукозный аллергологический тест реагирования слизистой оболочки на контакт со стоматологическим материалом проводят с помощью специального устройства, обеспечивающего устойчивый контакт исследуемого материала и слизистой оболочки щеки в течение двух часов. В области контакта исследуемого материала со слизистой оболочкой при положительной реакции наблюдается гиперемия (локализованная или разлитая), отек, складчатость слизистой оболочки. После этого проводят оценку микроциркуляции в тканях слизистой оболочки полости рта с помощью микроскопа МЛК-1 в комплексе с цветной видеокамерой и персональным компьютером с глубиной просмотра до 300 мкм. При положительной реакции на исследуемый материал выявляются структурные изменения и диагностируют наличие повышенной чувствительности (П.Н. Мойсейчик, Г.П. Богдан. Современная стоматология, №3, 2012, с. 35-37; Лабораторные методы обследования. Рузуддинов С.Р., Лобанов Ю.С., Седунов А.А.; Е.Н. Медуницына. Провокационные тесты в аллергологии).
Общим недостатком используемых методов является большая степень субъективизма при оценке чувствительности организма к стоматологическому материалу, возможность негативных последствий тестирования для больного (возникновение стоматита и т.п.).
Способы прогнозирования результатов стоматологической имплантации на этапе планирования включают проведение общего, клинико-рентгенологического и стоматологического обследования, оценку объема костной ткани и прогнозирование достижения клинического успеха (Н. Зицман и П. Шерер. Стоматологическая реабилитация с помощью дентальных имплантов. Клиническое руководство. Издательский дом «Азбука», М., 2005, с. 13-29).
Известны методы лабораторно-инструментальной оценки функционального состояния имплантата: определение плотности кости (денситометрия), ультразвуковая диагностика, исследование десневой жидкости, изучение микроциркуляции слизистой оболочки альвеолярного отростка и десны в зоне расположения имплантата, гнатодинамометрия, функциональные пробы и др. Ценность этих методов не вызывает сомнений (Иванов С.Ю., Шарапов Г.Н., Калашникова О.Ю. и др. Прогнозирование осложнений стоматологической имплантации по показателям перекисного окисления липидов и обмена глутатиона // Новое в стоматологии. - 1999. - №2 (99). - С.74-78; Параскевич В.Л. Диагностика регионарного остеопороза челюстей при планировании имплантации). Однако эти методы не определяют аллергическую реакцию на материал имплантата. Данные методы направлены на местное воздействие уже имеющийся очаг изменений периимплантатных тканей, которые осложняют течение послеоперационного периода.
Известен способ определения противопоказаний к использованию различных видов несъемных протезов путем прогнозирования аллергическо-воспалительной реакции (пат. РФ №2281333). Берут соскоб со слизистой оболочки в месте предполагаемого контакта с протезом и при выявлении лейкоцитоза до 100 в поле зрения и трихомонад Мюллера считают противопоказанным применение протеза с напылением нитрида титана; при выявлении кандид, эозинофилов до 6%, клеток рассасывания инородных тел - протезов с пластмассовой облицовкой; при грамотрицательной кокковой микрофлоре и увеличении числа макрофагов - металлокомпозитных протезов; при грамположительной кокковой микрофлоре - металлокерамических протезов. Недостатками данного метода является неточность в определении иммунологических параметров, непосредственно указывающих на возможность возникновения аллергических реакций, от контактной аллергии, до аллергии немедленного и замедленного типа, так как макрофаги участвуют и в других типах иммунологических реакций.
В травматологии также известны способы прогнозирования результатов эндопротезирования, например, тазобедренного сустава.
Например, при эндопротезировании тазобедренного сустава используют способ прогнозирования результатов эндопротезирования тазобедренного сустава (пат. РФ №2173465) путем исследования крови больного. До операции в ней определяют ядерный индекс нейтрофилов, количество лимфоцитов и фагоцитарную активность нейтрофилов и, если ядерный индекс нейтрофилов превышает 0,05, количество лимфоцитов составляет более 1,8×109/л, а фагоцитарная активность нейтрофилов менее 2,95×109/л - прогнозируют неблагоприятный результат эндопротезирования. Для категории больных, у которых на основании исследования крови определен благоприятный прогноз эндопротезирования, но в анамнезе имеются аллергические заболевания либо у них ранее были установлены металлоконструкции, дополнительно проводят реакцию микропреципитации с компонентами эндопротеза и при положительном результате реакции прогнозируют неблагоприятный исход эндопротезирования. Недостатком способа является использование достаточно большого количества тестов, в том числе не всегда настолько же точных, как проточная цитометрия (иммуноферментное определение IgE).
Известен способ прогнозирования результатов эндопротезирования тазобедренного сустава (пат РФ №2128341). При этом исследуют кровь пациента до операции и через 1 и 3 месяца после нее, определяют уровень сывороточных иммуноглобулинов А и Е, уровень эозинофилов, наличие антител к солям металлов или полимерам эндопротеза и при изменении значений показателей или по крайней мере двух из них в сравнении с дооперационными, повышении уровня иммуноглобулина А более 3,0 г/л, уровня иммуноглобулина Е более чем в два раза, уровня эозинофилов более 7% и наличии антител к солям металлов или полимерам эндопротеза прогнозируют неблагоприятный результат эндопротезирования.
Известна методика исследования аллергическо-воспалительной реакции слизистой оболочки полости рта по реакции специфической агломерации лейкоцитов по методике В.Е.Тугановой и соавторов, позволяющая выявить типы аллергическо-воспалительной реакции, возникающие на различные стоматологические материалы, используемые при протезировании [Руководство по ортопедической стоматологии. Э.С. Каливраджиян и соавт. Изд. Москва, 2005 год, стр. 333-334]. В основе указанной методики лежит эффект усиления агломерации лейкоцитов под влиянием гаптена, что является признаком специфической активации сенсибилизированных клеток. Конечной стадией реакции агломерации является лизис, поэтому полное отсутствие сгруппированных лейкоцитов расценивается как резко положительная реакция. Недостатком данного метода является то, что он основывается только на способности лейкоцитов к группированию (не проводится морфологическая оценка клеток), причем нет дифференцировки между различными видами лейкоцитов. Кроме того, известный метод является недостаточно информативным, т.к. учитывает лишь местную аллергическо-воспалительную реакцию слизистой оболочки полости рта в ответ на введение инородного агента, которым является несъемный протез, в то время как по данным ряда исследователей местные и общие проявления аллергическо-воспалительной реакции могут иметь разнонаправленный характер.
В клинической практике для тестирования аллергии используется непрямая реакция Shelle - тест дегрануляции базофилов [Davenase K, Beauvais F., Amara J. et al. // Nature. - 1988. - Vol.333, N 6176. - Р.816-818]. Сущность этого метода заключается в подсчете с помощью тест-системы процента разрушенных базофилов в крови пациентов, у которых предполагается наличие антител к аллергену. Проба считается положительной, если более 30% базофилов в опытной реакции дегранулированы или разрушены (Частная аллергология. / Под ред. А.Д. Адо. Изд. Москва, 1976 г.). Данный способ тестирования является наиболее близким техническим решением. Сравнение проводится с контрольным исследованием, где вместо аллергена используется изотонический раствор хлорида натрия. Недостатками данного метода являются потребность в специальных реактивах (препараты предполагаемых аллергенов) и оборудовании (планшеты, термостат, центрифуга, камера Горяева). Кроме того, результаты данного теста должны рассматриваться только в комплексе с данными других клинико-лабораторных исследований и для наибольшей достоверности желательно проводить тест в период ремиссии заболевания (Применение прямого теста дегрануляции базофилов для диагностики аллергии. Д.К. Новиков, Э.А. Доценко, Г.Я. Жакова. Кафедра клинической аллергологии ФУВ Витебского медицинского института, 1990 г.), что не позволяет определить тип стоматологического материала еще на стадии составления плана лечения. На сегодняшний день данный метод является устаревшим с точки зрения современной иммунологии.
Общим недостатком данных способов является то, что информацию о предполагаемых результатах эндопротезирования можно получить лишь спустя 1 или 3 месяца после операции.
Известно, что неправильный выбор стоматологического материала для протезирования вызывает неприятные ощущения: чувство жжения в полости рта, сухость, привкус металла, а в более тяжелых случаях приводит к изменению слизистой оболочки полости рта в местах контакта протеза и ткани протезного ложа и также к более тяжелым состояниям, вплоть до развития отека Квинке.
Задача изобретения - разработка персонифицированного метода по подбору системы дентальных имплантатов или любых металлических изделий на основе TiO2 при планировании хирургических вмешательств еще до проведения операции, с целью прогнозирования и исключения возможных аллергических реакций со стороны иммунной системы пациента в послеоперационном периоде, повышение точности оценки до проведения оперативного вмешательства, получение экономического эффекта от протезирования.
При решении поставленной задачи имеет место положительный лечебный эффект, который достигается за счет повышения качества превентивной диагностики и лечения, стабилизирующего течение постимплантационного периода, особенно у лиц с выраженной соматической патологией, например поливалентной аллергией в анамнезе.
Экономический эффект определяется соотношением результата и затрат - если больной будет правильно откорректирован - экономия лекарственных дорогостоящих препаратов, сокращение сроков лечения и нетрудоспособности. Предлагаемый способ диагностики малозатратен и высокоэффективен, способ его применения легко осуществим. Социальный эффект - улучшение качества жизни пациента.
Поставленная задача решается при использовании способа персонифицированного подбора пациенту дентального имплантата на основе сплавов оксида титана в условиях in vitro с помощью тест-системы активации базофилов для оценки аллергической реакции на исследуемый материал методом подсчета разрушенных базофилов в крови пациента. Предварительно выделяют наночастицы с поверхности дентального имплантата путем инкубирования в воде при температуре 37,2°C в течение 5 дней, после чего на полученный супернатант воздействуют ультразвуком 35 кГц в течение 10-20 минут, затем добавляют венозную кровь пациента и моноклональные антитела к молекулам CD203 и CD294, повторно инкубируют в течение 15 минут и с помощью тест-системы методом проточной цитофлуориметрии фиксируют активацию базофилов либо ее отсутствие, исходя из полученных результатов рассчитывают индекс активации базофилов, и в случае получения отношения количества позитивных базофилов исследуемого образца к количеству негативным базофилам контрольного образца меньше 1 или равного 1 рекомендуют данный имплантат к использованию.
В результате проведенных исследований была выявлена диссоциация металлов с поверхности структуры самих дентальных имплантатов в виде наноразмерных частиц при имитации нагрузки, в качестве моделирования силы воздействия при их непосредственном внедрении в костное ложе. Имитация нагрузки была апробирована на различных системах дентальных имплантатов на основе оксидов титана: Astra Tech, Nobel Replace, Shtrauman, Alfa-Bio, Mis, Bio-Gorisont, Roott и др. Впервые были получены супернатанты с наноразмерными частицами сплавов TiO2 под воздействием ультразвука в течение 10 мин 35 кГц, после инкубации дентальных имплантатов в воде для инъекций в течение 5 суток. Качественный и количественный состав наноразмерных частиц фиксировали с помощью метода динамического светорассеяния и просвечивающей электронной микроскопии. При добавлении свежей плазмы крови определяли спонтанное образование комплексов «наноразмерные частицы-белок», что является, по нашему мнению, обоснованием к способности восприятия иммунной системой человека металлов в виде гаптенов. Результатом проведенного исследования явилось подтверждение факта об участии наноразмерных частиц в процессе остеоинтеграции. Клиническим подтверждением данной концепции явилась индивидуальная способность пациентов по-разному реагировать на те или иные супернатанты, содержащие наноразмерные частицы, полученные с различных систем дентальных имплантатов, с помощью постановки базофильного теста Allergenicity Kit компании «Beckman Coulter» в условиях in vitro и венозной крови пациентов.
Были сформированы 3 группы материалов, используемых в реконструктивной хирургической стоматологии. В первую группу вошли новые дентальные имплантаты данных фирм производителей: Astra Tech, Nobel Replace, Root, Straumann. Во вторую группу вошли дентальные имплантаты, ранее не установленные, но прошедшие двойную стерилизацию в условиях автоклава «You joy» при температуре 134°C данных фирм производителей: «Alfa Bio», «Mis», «SIC», «Bio-Gorizont», «Nobel Replace». В третью группу исследования вошли металлические сетки на основе сплава TiO2, также прошедшие двойную стерилизацию в условиях автоклава, для использования в реконструктивной хирургической практики, фирм «Конмет» и «Trinon».
В результате работы авторов, впервые со всех объектов исследования (дентальные имплантаты и металлические сетки на основе разных сплавов TiO2) были получены наноразмерные частицы разных диаметров и состава в водной среде. А именно, в результате инкубации в термостате в течение 5 дней при температуре 37,2°C, погружая в условиях ламинара (полной стерильности) дентальные имплантаты, в стерильную воду для инъекций в отдельные пробирки, образцы обрабатывали ультразвуком 35 кГц. С помощью метода динамического светорассеяния (90 PLUS PARTICAL SIZE ANALYZER BROOKHAVEN INSTRUMENTS CORPORATION) и просвечивающей электронной микроскопии (FEI TECNAI G2 F20 S-TWIN) авторы подтвердили выход металлических наноразмерных частиц с поверхности дентальных имплантатов и металлических сеток на основе сплавов TiO2 во всех случаях. Затем данные супернатанты были использованы для постановки базофильного теста Allergenicity Kit компании Beckman Coulter, позволяющего увидеть активацию базофилов по изменению экспрессии молекул CD203c, на поверхности базофилов при контакте клеток венозной крови обследуемых пациентов с полученными нами наноразмерными частицами в супернатантах. Молекула CD294 была использована для более конкретной локализации пула клеток базофилов.
CD203 - молекула дегрануляции базофилов. CD203c, трансмембранный белок, член семейства эктоэнзимов, участвует в гидролизе внеклеточных олигонуклеотидов, нуклеозидфосфатов и NAD (обладает активностью АТФазы и АТФ пирофосфатазы). Молекулярная масса CD203c составляет от 130 и 150 кДа при восстанавливающих условиях и 270 кД при невосстанавливающих условиях. CD203c экспрессируется на базофилах и тучных клетках и активно экспрессируется на активированных базофилах. Секреторные железы эндометрия и клеток глиомы также положительны. CD203c - это многофункциональный эктоэкзим участия в очистке от внеклеточных нуклеотидов, чьи субстраты включают нуклеозидтрифосфаты, нуклеозидов дифосфаты, сАМР и NAD.
СD294-молекула, также известная как CRTH2, является трансмембранным белком в комплексе с гетеротримером G белка. CRTH2 является рецептором простагландина D2 и экспрессируются на Th2 клетках, эозинофилах и базофилах. CD294 предотвращает апоптоз Th2 клеток и опосредует хемотаксис клеток, экспрессирующих CRTH2 на сайты аллергического воспаления. В данном случае используется для более корректного выявления пула базофилов.
Авторы выявили активацию базофилов с помощью моноклональных антител к молекулам CD203 и CD294 и метода проточной цитометрии (проточный цитометр FC-500). Исходя из процентного соотношения клеток базофилов, экспрессирующих данные молекулы на поверхности клеточной мембраны, можно судить о возможности, невозможности и выраженности аллергической составляющей на используемый сплав и сертифицированную изготовителем поверхность имплантатов, в сравнительном соотношении между тремя, взятыми в качестве примера, системами дентальных имплантатов. Для этого каждый раз сравнивались полученные результаты с отрицательным и положительным контролями. Индивидуальный подбор системы дентальных имплантатов, а также любых металлических конструкций, до проведения операции, с точки зрения иммунологической составляющей, может служить профилактикой осложнений, связанных с воспалительными явлениями от воздействия наночастиц при функционировании под нагрузкой данных изделий у пациентов.
Предлагаемое изобретение отвечает критерию изобретения «новизна», так как проведенные патентно-информационные исследования показали отсутствие сведений, порочащих новизну изобретения.
Предлагаемый способ отвечает критерию изобретения «изобретательский уровень», так как в результате исследований не выявлено технических решений с существенными признаками предлагаемого способа. Предлагаемый способ промышленно применим, что доказано приведенными ниже примерами.
Изобретение иллюстрируется следующими примерами.
Во всех примерах результаты базофильного теста на индивидуальную чувствительность проводились к 3 системам дентальных имплантатов из оксида титана: образец №1 - Shtraumann SIActive, образец №2 - Astra Tech Osseo Speed, образец №3 - Nobel Biocare CC.
Пример 1. Получение базофильного теста
Предварительно высвобождали наночастицы с поверхности дентального имплантата путем инкубирования в термостате в воде для инъекций, погружая в условиях ламинара образцы дентальных имплантатов в отдельные пробирки при температуре 37,2°C. Инкубирование проводили в течение 5 дней. На полученный супернатант воздействовали ультразвуком 35 кГц в течение 10-20 минут. С помощью метода динамического светорассеяния и просвечивающей электронной микроскопии подтвердили выход металлических наноразмерных частиц с поверхности дентальных имплантатов на основе сплавов TiO2 во всех случаях.
Подготовленный таким образом супернатант в объеме 20 мкл и реагенты тест-системы Allergenicity Kit компании Beckman Coulter с использованием моноклональных антител к молекулам CD203 и CD294 добавляют к 100 мкл венозной крови пациента в отдельную пробирку. Проводят совместную инкубацию наночастиц и венозной крови пациента в течение 15 минут и методом проточной цитофлуориметрии фиксируют активацию базофилов либо ее отсутствие. Исходя из результатов отрицательного и положительного контроля и полученных результатов по каждому образцу дентального имплантата, рассчитывали индекс активации базофилов путем получения процентного отношения количества позитивных базофилов исследуемого образца к количеству негативных базофилов контрольного образца.
В качестве клинических примеров использования базофильного теста Allergenicity Kit компании «Beckman Cultre» приводим примеры индивидуальной чувствительности пациента к наночастицам, принимающим непосредственное участие в клеточно-молекулярном механизме распознавания антигенных детерминант в виде NaMePamps, а именно, иммунологически опосредованном механизме остеоинтеграции. Использование моноклональных антител к молекулам CD203c, CD294 значительно упрощает выделение клеток лейкоцитов от дебриса (тени эритроцитов, разрушенные клетки и т.д.).
Клинический пример №1. Пациент А.
Исходя из полученных результатов построены гистограммы для испытуемых образцов дентальных имплантов.
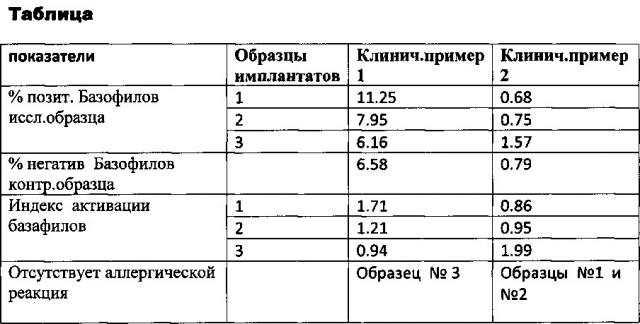
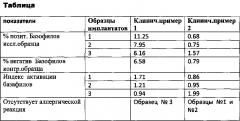
Результаты гистограмм: 6.58% (негативный контроль) <6.16<7.95<11.25% у данного пациента.
Определили процентные отношения позитивных базофилов исследуемого образца к негативным базофилам контрольного образца. Результаты сведены в таблицу.
Образец №1 - данный дентальный имплантат вызывает наибольшую активацию базофилов по сравнению с другими двумя образцами. Индекс активации 1,71.
Образец №2. данный дентальный имплантат вызывает активацию базофилов, по сравнению с образцами №1 и №3. Индекс активации 1,21.
Образец №3 - данный дентальный имплантат не вызывает активации базофилов. Индекс активации 0,94.
Вывод: В данном случае мы можем уверенно говорить о том, что исследуемый образец №3 - Nobel Biocare СС не вызывает активацию базофилов, что указывает на отсутствие вероятности возникновения аллергической реакции на входящие в состав окисной пленки наноразмерные частицы данной системы, а значит, годен для установки данному пациенту.
Клинический пример №2. Пациент В.
Пример осуществлялся аналогично примеру №1.
Результат: 0.79%(негативный контроль) <0.68<0.75%<1.57% у данного пациента.
Образец №1 - данный дентальный имплантат не вызывает активацию базофилов по сравнению с другими двумя образцами. Индекс активации 0,86.
Образец №2 - данный дентальный имплантат не вызывает активацию базофилов по сравнению с образцом №3. Индекс активации 0,95.
Образец №3 - данный дентальный имплантат в большей степени вызывает активацию базофилов, нежели два предыдущих. Индекс активации 1,99.
Вывод: из 3 образцов образец №3 показал активацию базофилов, образец №1, №2 не показали активации базофилов, так как индекс <1. Рекомендована установка дентального имплантата №1 или №2 исходя из трех представленных к выбору.
Результаты клинических примеров 1 и 2 сведены в таблицу.
В случае получения индекса дегрануляции со значением меньше 1 или равным 1, рекомендуют данный дентальный имплантат к использованию.
Исходя из полученных результатов, можно говорить о выраженности аллергической составляющей в каждом конкретном случае, индивидуально, еще до проведения оперативного вмешательства.
Способ персонифицированного подбора пациенту дентального имплантата на основе сплавов оксида титана в условиях in vitro с помощью тест-системы активации базофилов для оценки аллергической реакции на исследуемый материал методом подсчета разрушенных базофилов в крови пациента, отличающийся тем, что предварительно выделяют наночастицы с поверхности дентального имплантата путем инкубирования в воде при температуре 37,2°С в течение 5 дней, после чего на полученный супернатант воздействуют ультразвуком 35 кГц в течение 10-20 минут, затем добавляют венозную кровь пациента и моноклональные антитела к молекулам CD203 и CD294, повторно инкубируют в течение 15 минут и с помощью тест-системы методом проточной цитофлуориметрии фиксируют активацию базофилов либо ее отсутствие, исходя из полученных результатов рассчитывают индекс активации базофилов, и в случае получения отношения количества позитивных базофилов исследуемого образца к количеству негативных базофилов контрольного образца меньше 1 или равного 1 рекомендуют данный имплантат к использованию.