Варианты антимикробного пептида и кодирующие их полинуклеотиды
Иллюстрации
Показать всеНастоящее изобретение касается вариантов антимикробного пептида, выделенного полинуклеотида, вектора экспрессии, клетки-хозяина и способа получения таких вариантов. Представлен выделенный вариант антимикробного пептида, имеющего аминокислотную последовательность SEQ ID NO: 2, где указанный вариант обладает антимикробной активностью в отношении грамотрицательных бактерий и содержит аминокислотную последовательность любую из SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 87, SEQ ID NO: 218, SEQ ID NO: 248, SEQ ID NO: 308, SEQ ID NO: 350, SEQ ID NO: 435 или SEQ ID NO: 450. Способ получения пептида включает культивирование клетки-хозяина, содержащей полинуклеотид, кодирующий описанный пептид, в условиях, подходящих для экспрессии, и выделение указанного варианта пептида. Представленные изобретения могут быть использованы для лечения инфекции, вызванной грамотрицательными бактериями. 6 н. и 2 з.п. ф-лы, 8 табл., 4 пр.
Реферат
Ссылка на перечень последовательностей
Данная заявка включает перечень последовательностей в машиночитаемой форме, включенный сюда посредством ссылки.
Предшествующий уровень техники
Область изобретения
Настоящее изобретение относится к вариантам антимикробного пептида, полинуклеотидам, кодирующим указанные варианты, способам получения указанных вариантов и способам применения указанных вариантов.
Описание предшествующего уровня техники
В литературе описаны несколько классов антимикробных пептидов (AMP), примеры которых включают дефензины и альфа-спиральные пептиды.
Согласно настоящему изобретению предложены варианты антимикробного пептида, выделенного из Arenicola marina и описанного в WO 2007/023163.
Варианты антимикробного пептида по настоящему изобретению обладают лучшей антимикробной активностью по сравнению с исходным антимикробным пептидом. В частности, указанные варианты обладают улучшенной антимикробной активностью в присутствии белков сыворотки и крови. Другим преимуществом вариантов пептида по настоящему изобретению является пониженное связывание с белками, например белками сыворотки и крови, что приводит к улучшенной биодоступности по сравнению с исходным антимикробным пептидом.
Краткое описание сущности изобретения
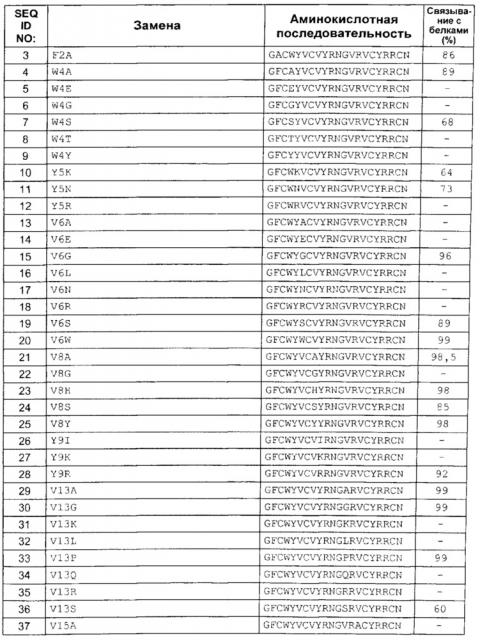
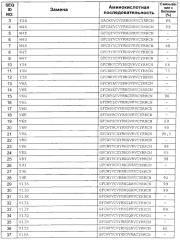
Настоящее изобретение относится к выделенным вариантам антимикробного пептида, имеющего аминокислотную последовательность SEQ ID NO: 2, содержащим замену в одном или более (нескольких) из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 15, 17, 19 и 21 зрелого пептида с SEQ ID NO: 2, обладающим антимикробной активностью.
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим указанные варианты; конструкциям нуклеиновых кислот, векторам и клеткам-хозяевам, содержащим указанные полинуклеотиды; и способам получения указанных вариантов.
Настоящее изобретение также относится к способу лечения микробной инфекции с использованием вариантов по изобретению; и применению вариантов для изготовления лекарственного средства для лечения микробной инфекции.
Подробное описание изобретения
Настоящее изобретение относится к выделенным вариантам антимикробного пептида, имеющего аминокислотную последовательность SEQ ID NO: 2, содержащим замену в одном или более (нескольких) из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 15, 17, 19 и 21 зрелого пептида с SEQ ID NO: 2, обладающим антимикробной активностью.
Определения
Антимикробная активность. Термин «антимикробная активность» определен здесь как способность уничтожать микробные клетки или ингибировать их рост. Подразумевают, что в контексте настоящего изобретения термин «антимикробный» означает наличие бактерицидного, и/или бактериостатического, и/или фунгицидного, и/или фунгистатического эффекта и/или вирулицидного эффекта, где термин «бактерицидный» следует понимать как способный уничтожать бактериальные клетки. Термин «бактериостатический» следует понимать как способный ингибировать бактериальный рост, то есть ингибировать рост бактериальных клеток. Термин «фунгицидный» следует понимать как способный уничтожать грибковые клетки. Термин «фунгистатический» следует понимать как способный ингибировать грибковый рост, то есть ингибировать рост грибковых клеток. Термин «вирулицидный» следует понимать как способный инактивировать вирус. Термин «микробные клетки» обозначает бактериальные или грибковые клетки (включая дрожжи).
Подразумевают, что в контексте настоящего изобретения термин «ингибирование роста микробных клеток» означает, что эти клетки не находятся в состоянии роста, то есть что они не способны к размножению.
В предпочтительном воплощении термин «антимикробная активность» определен как бактерицидная и/или бактериостатическая активность. Более предпочтительно, «антимикробная активность» определена как бактерицидная и/или бактериостатическая активность против Escherichia, предпочтительно Escherichia coli.
Для задач настоящего изобретения антимикробная активность может быть определена способом, описанным Lehrer et al., Journal of Immunological Methods, Vol.137 (2) pp.167-174 (1991). Альтернативно, антимикробная активность может быть определена в соответствии с руководствами Национального комитета по клиническим и лабораторным стандартам (National Committee for Clinical Laboratory Standards, NCCLS) от CLSI (Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute), ранее известного как Национальный комитет по клиническим и лабораторным стандартам).
Пептиды, обладающие антимикробной активностью, могут быть способны уменьшать число жизнеспособных клеток Escherichia coli (DSM 1576) до 1/100 через 8 часов (предпочтительно через 4 часа, более предпочтительно через 2 часа, наиболее предпочтительно через 1 час и, в частности, через 30 минут) инкубации при 37°C в соответствующем субстрате для микробного роста при концентрации пептидов, обладающих антимикробной активностью, 500 мкг/мл, предпочтительно 250 мкг/мл, более предпочтительно 100 мкг/мл, еще более предпочтительно 50 мкг/мл, наиболее предпочтительно 25 мкг/мл и, в частности, 10 мкг/мл.
Пептиды, обладающие антимикробной активностью, могут также быть способны ингибировать рост Escherichia coli (DSM 1576) в течение 8 часов при 37°C в соответствующем субстрате для микробного роста при их добавлении в концентрации 500 мкг/мл, предпочтительно при их добавлении в концентрации 250 мкг/мл, более предпочтительно при их добавлении в концентрации 100 мкг/мл, еще более предпочтительно при их добавлении в концентрации 50 мкг/мл, наиболее предпочтительно при их добавлении в концентрации 10 мкг/мл и, в частности, при их добавлении в концентрации 5 мкг/мл.
Пептидные варианты по настоящему изобретению обладают улучшенной антимикробной активностью по сравнению с антимикробным пептидом с SEQ ID NO: 2. В одном воплощении пептидные варианты по настоящему изобретению обладают более чем 100% антимикробной активностью пептида с SEQ ID NO: 2 в присутствии сыворотки крови.
Вариант. Термин «вариант» означает пептид, обладающий антимикробной активностью, содержащий изменение, то есть замену, вставку и/или делецию, в одном или более (нескольких) положениях. Замена означает замещение аминокислоты, расположенной в том или ином положении, другой аминокислотой; делеция означает удаление аминокислоты, расположенной в том или ином положении; и вставка означает добавление 1-3 аминокислот рядом с аминокислотой, расположенной в том или ином положении.
Мутант. Термин «мутант» означает полинуклеотид, кодирующий вариант.
Антимикробный пептид дикого типа. Термин антимикробный пептид «дикого типа» означает антимикробный пептид, экспрессированный встречающимся в природе микроорганизмом, таким как бактерия, дрожжи или нитчатый гриб, обнаруживаемые в природе.
Исходный пептид или исходный антимикробный пептид. Термин «исходный пептид» или «исходный антимикробный пептид» означает антимикробный пептид, который подвергают изменению для получения ферментных вариантов по настоящему изобретению. Исходный пептид может представлять собой пептид, встречающийся в природе (пептид дикого типа), или его вариант.
Выделенный вариант. Термин «выделенный вариант» означает вариант, модифицированный человеком. В одном аспекте степень чистоты варианта составляет по меньшей мере 1%, например по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 40%, по меньшей мере 60%, по меньшей мере 80% и по меньшей мере 90%, как определено электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE).
По существу чистый вариант. Термин «по существу чистый вариант» означает препарат, содержащий не более 10%, не более 8%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% и не более 0,5% по массе другого пептидного вещества, ассоциированного естественным или рекомбинантным образом. Предпочтительно, степень чистоты варианта составляет по меньшей мере 92%, например по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%, по меньшей мере 99,5% и 100% по массе всего пептидного вещества, присутствующего в препарате. Предпочтительно, варианты по настоящему изобретению представлены в по существу чистой форме. Это может быть обеспечено, например, получением варианта хорошо известными рекомбинантными способами или классическими способами очистки.
Зрелый пептид. Термин «зрелый пептид» означает пептид в его конечной форме после трансляции и любых посттрансляционных модификаций, таких как N-концевой процессинг, C-концевой процессинг, гликозилирование, фосфорилирование и так далее.
Последовательность, кодирующая зрелый пептид. Термин «последовательность, кодирующая зрелый пептид», означает полинуклеотид, кодирующий зрелый пептид, обладающий антимикробной активностью.
Идентичность последовательностей. Родство двух аминокислотных последовательностей или двух нуклеотидных последовательностей описывают параметром «идентичность последовательностей».
Для задач настоящего изобретения степень идентичности последовательностей между двумя аминокислотными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), воплощенного в программе Needle программного пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или более поздней версии. Используемые опционные параметры представляют собой штраф за начало разрыва 10, штраф за продолжение разрыва 0,5 и подстановочную матрицу EBLOSUM62 (EMBOSS-версию BLOSUM62). В качестве процента идентичности используют результат Needle, отмеченный как «наиболее продолжительная идентичность» (полученный с использованием опции -nobrief) и вычисленный следующим образом:
(идентичные остатки × 100)/(длина выравнивания - общее число разрывов при выравнивании).
Для задач настоящего изобретения степень идентичности последовательностей между двумя дезоксирибонуклеотидными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, выше), воплощенного в программе Needle программного пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, supra), предпочтительно версии 3.0.0 или более поздней версии. Используемые опционные параметры представляют собой штраф за начало разрыва 10, штраф за продолжение разрыва 0,5 и подстановочную матрицу EDNAFULL (EMBOSS-версию NCBI NUC4.4). В качестве процента идентичности используют результат Needle, отмеченный как «наиболее продолжительная идентичность» (полученный с использованием опции - nobrief) и вычисленный следующим образом:
(идентичные дезоксирибонуклеотиды × 100)/(длина выравнивания - общее число разрывов при выравнивании).
Фрагмент. Термин «фрагмент» означает пептид, имеющий одну или более (несколько) аминокислот, удаленных с амино- и/или карбоксильного конца зрелого пептида, где указанный фрагмент обладает антимикробной активностью. В одном аспекте фрагмент содержит по меньшей мере 15 аминокислотных остатков, например, по меньшей мере 17 и по меньшей мере 19 аминокислотных остатков (например, аминокислотные остатки 1-20 в SEQ ID NO: 2).
Подпоследовательность. Термин «подпоследовательность» означает полинуклеотид, имеющий один или более (несколько) нуклеотидов, удаленных с 5'- и/или 3'-конца последовательности, кодирующей зрелый пептид, где подпоследовательность кодирует фрагмент, обладающий антимикробной активностью.
Аллельный вариант. Термин «аллельный вариант» означает любые две или более альтернативных форм гена, расположенных в одном и том же локусе хромосомы. Аллельное разнообразие появляется естественным образом в результате мутаций и может приводить к полиморфизму в популяциях. Мутации в генах могут быть молчащими (без изменения кодируемого пептида) или могут кодировать пептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант пептида представляет собой пептид, кодируемый аллельным вариантом гена.
Выделенный полинуклеотид. Термин «выделенный полинуклеотид» означает полинуклеотид, модифицированный человеком. В одном аспекте степень чистоты выделенного полинуклеотида составляет по меньшей мере 1%, например по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 40%, по меньшей мере 60%, по меньшей мере 80%, по меньшей мере 90% и по меньшей мере 95%, как определено электрофорезом в агарозном геле. Полинуклеотиды могут быть геномного происхождения, иметь происхождение от комплементарной ДНК (кДНК), РНК, быть полусинтетического или синтетического происхождения, или представлять собой любые их комбинации.
По существу чистый полинуклеотид. Термин «по существу чистый полинуклеотид» означает полинуклеотидный препарат, свободный от других чужеродных или нежелательных нуклеотидов и представленный в форме, подходящей для применения в системах продуцирования генетически сконструированных пептидов. Таким образом, по существу чистый полинуклеотид содержит не более 10%, не более 8%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% и не более 0,5% по массе другого полинуклеотидного вещества, ассоциированного естественным или рекомбинантным образом. Тем не менее, по существу чистый полинуклеотид может включать встречающиеся в природе 5'- и 3'-нетранслируемые области, такие как промоторы и терминаторы. Предпочтительно, степень чистоты по существу чистого полинуклеотида составляет по меньшей мере 90%, например по меньшей мере 92%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% и по меньшей мере 99,5% по массе. Предпочтительно, полинуклеотиды по настоящему изобретению представлены в по существу чистой форме.
Кодирующая последовательность. Термин «кодирующая последовательность» означает полинуклеотид, непосредственно определяющий аминокислотную последовательность его пептидного продукта. Границы кодирующей последовательности обычно определены открытой рамкой считывания, которая обычно начинается с инициирующего кодона ATG или альтернативных инициирующих кодонов, таких как GTG и TTG, и заканчивается стоп-кодоном, таким как ТАА, TAG и TGA. Кодирующая последовательность может представлять собой ДНК, кДНК, синтетический или рекомбинантный полинуклеотид.
кДНК. Термин «кДНК» означает молекулу ДНК, которая может быть получена обратной транскрипцией зрелой сплайсированной молекулы матричной РНК (мРНК), полученной из эукариотической клетки. В кДНК отсутствуют последовательности интронов, которые могут присутствовать в соответствующей геномной ДНК. Исходный первичный РНК-транскрипт является предшественником мРНК, который проходит процессинг из нескольких стадий, включая сплайсинг, перед образованием зрелой сплайсированной мРНК.
Конструкция нуклеиновой кислоты. Термин «конструкция нуклеиновой кислоты» означает одно- или двухцепочечную молекулу нуклеиновой кислоты, которая выделена из встречающегося в природе гена или модифицирована для содержания сегментов нуклеиновых кислот таким образом, которым они в противном случае не существовали бы в природе, либо которая является синтетической. Термин «конструкция нуклеиновой кислоты» является синонимом термина «кассета экспрессии», когда конструкция нуклеиновой кислоты содержит контрольные последовательности, необходимые для экспрессии кодирующей последовательности по настоящему изобретению.
Контрольные последовательности. Термин «контрольные последовательности» означает все компоненты, необходимые для экспрессии полинуклеотида, кодирующего вариант по настоящему изобретению. Каждая контрольная последовательность может быть нативной или чужеродной по отношению к полинуклеотиду, кодирующему вариант, либо контрольные последовательности могут быть нативными или чужеродными по отношению друг к другу. Такие контрольные последовательности включают, без ограничения, лидерную последовательность, последовательность полиаденилирования, последовательность пропептида, промотор, последовательность сигнального пептида и терминатор транскрипции. По меньшей мере, контрольные последовательности включают промотор и сигналы окончания транскрипции и трансляции. Контрольные последовательности могут быть снабжены линкерами с целью включения специфичных сайтов рестрикции, облегчающих лигирование контрольных последовательностей с кодирующей областью полинуклеотида, кодирующего вариант.
Функционально связанный. Термин «функционально связанный» означает конфигурацию, в которой контрольная последовательность расположена в подходящем положении относительно кодирующей последовательности полинуклеотида, так что контрольная последовательность управляет экспрессией кодирующей последовательности.
Экспрессия. Термин «экспрессия» включает любую стадию, входящую в продуцирование варианта, включая, без ограничения, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Вектор экспрессии. Термин «вектор экспрессии» означает линейную или кольцевую молекулу ДНК, содержащую полинуклеотид, кодирующий вариант, и функционально связанную с дополнительными нуклеотидами, обеспечивающими ее экспрессию.
Клетка-хозяин. Термин «клетка-хозяин» означает клетку любого типа, подходящую для трансформации, трансфекции, трансдукции и тому подобного с использованием конструкции нуклеиновой кислоты или вектора экспрессии, содержащего полинуклеотид по настоящему изобретению. Термин «клетка-хозяин» включает любое потомство исходной клетки, не идентичное исходной клетке в виду мутаций, которые возникают при репликации.
Условные обозначения вариантов
Для задач настоящего изобретения зрелый пептид, раскрытый в SEQ ID NO: 2, используют для определения соответствующего аминокислотного остатка в другом антимикробном пептиде. Аминокислотную последовательность другого антимикробного пептида выравнивают со зрелым пептидом, раскрытым в SEQ ID NO: 2, и на основании этого выравнивания определяют номер аминокислотного положения, соответствующего любому аминокислотному остатку зрелого пептида, раскрытого в SEQ ID NO: 2, с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), воплощенного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277), предпочтительно версии 3.0.0 или более поздней версии.
Идентификация соответствующего аминокислотного остатка в другом антимикробном пептиде может быть подтверждена выравниванием последовательностей нескольких пептидов с использованием "ClustaIW" (Larkin et al., 2007, Bioinformatics 23:2947-2948).
Когда другой фермент отличается от зрелого пептида с SEQ ID NO: 2 настолько, что традиционное сравнение последовательностей не позволяет выявить их родство (Lindahl and Elofsson, 2000, J. Mol. Biol. 295:613-615), могут быть использованы другие алгоритмы попарного сравнения последовательностей. Большей чувствительности при поиске по последовательности можно достичь с использованием поисковых программ, в которых использованы вероятностные представления пептидных семейств (профилей) для поиска в базах данных. Например, программа PSI-BLAST генерирует профили способом повторного поиска в базах данных и позволяет выявлять отдаленные гомологи (Atschul et al., 1997, Nucleic Acids Res. 25:3389-3402). Еще большей чувствительности можно достичь, если семейство или суперсемейство данного пептида имеет одного или более представителей в базах данных структур белков. Такие программы, как GenTHREADER (Jones, 1999, J. Mol. Biol. 287:797-815; McGuffin and Jones, 2003, Bioinformatics 19:874-881), используют информацию из множества источников (PSI-BLAST, предсказание вторичной структуры, профили структурного выравнивания и потенциалы сольватации) в качестве входных данных для нейронной сети, предсказывающей структурные свойства запрашиваемой последовательности. Сходным образом, способ Gough et al., 2000, J. Mol. Biol. 313:903-919, может быть использован для выравнивания последовательности с неизвестной структурой с моделями суперсемейств в базе данных SCOP. Эти выравнивания могут, в свою очередь, быть использованы для получения моделей гомологии для данного пептида, и точность таких моделей можно оценивать с использованием множества инструментов, разработанных для этой цели.
Для белков с известной структурой доступно несколько инструментов и ресурсов для получения и генерирования структурных выравниваний. Например, было проведено структурное выравнивание SCOP-суперсемейств белков, и эти выравнивания доступны для просмотра и загрузки. Выравнивание двух или более белковых структур может быть проведено с использованием ряда алгоритмов, таких как дистанционная матрица выравнивания (Holm and Sander, 1998, Proteins 33:88-96) или комбинаторное расширение (Shindyalov and Bourne, 1998, Protein Engineering 11:739-747), и воплощения этих алгоритмов могут быть дополнительно использованы для поиска интересующей структуры в базах данных по структурам для обнаружения возможных структурных гомологов (например, Holm and Park, 2000, Bioinformatics 16:566-567).
При описании вариантов антимикробных пептидов по настоящему изобретению описанную ниже номенклатуру адаптируют для простоты использования. Используют принятые Международным союзом теоретической и прикладной химии (IUPAC) однобуквенные или трехбуквенные сокращения аминокислот.
Замены. Для аминокислотной замены используют следующую номенклатуру: исходная аминокислота, положение, замещенная аминокислота. Соответственно, замену треонина на аланин в положении 226 обозначают как «Thr226Ala» или «Т226А». Несколько мутаций разделяют знаками сложения («+»), например, «Gly205Arg + Ser411Phe» или «G205R + S411F», что означает замены в положениях 205 и 411 глицина (G) на аргинин (R) и серина (S) на фенилаланин (F), соответственно.
Делеции. Для аминокислотной делеции используют следующую номенклатуру: исходная аминокислота, положение, *. Соответственно, делецию глицина в положении 195 обозначают «Gly195*» или «G195*». Несколько делеции разделяют знаками сложения («+»), например, «Gly195* + Ser411*» или «G195* + S411*».
Вставки. Для аминокислотной вставки используют следующую номенклатуру: исходная аминокислота, положение, исходная аминокислота, встроенная аминокислота. Соответственно, вставку лизина после глицина в положении 195 обозначают «Gly195GlyLys» или «G195GK». Вставку нескольких аминокислот обозначают следующим образом: исходная аминокислота, положение, исходная аминокислота, встроенная аминокислота №1, встроенная аминокислота №2 и так далее. Например, вставку лизина и аланина после глицина в положении 195 обозначают «Gly195GlyLysAla» или «G195GKA».
В таких случаях встроенный(е) аминокислотный(е) остаток(ки) нумеруют путем добавления строчных букв к номеру положения аминокислотного остатка, предшествующего встроенному(ым) аминокислотному(ым) остатку(ам). Таким образом, в приведенном выше примере последовательность будет следующей.
| Исходный | Вариант |
| 195 | 195 195a 195b |
| G | G - K - A |
Несколько замен. Варианты, содержащие несколько замен, разделяют знаками сложения («+»), например, «Arg170Tyr + Gly195Glu» или «R170Y + G195E», что обозначает замену аргинина и глицина тирозином и глутаминовой кислотой в положениях 170 и 195, соответственно.
Разные замены. Когда разные замены могут быть произведены в каком-либо положении, эти разные замены разделяют запятой, например, «Arg170Tyr,Glu» или «R170Y,E» обозначают замену аргинина тирозином или глутаминовой кислотой в положении 170. Так, «Tyr167Gly,Ala + Arg170Gly,Ala» или «Y167G,A + R170G,A» обозначает следующие варианты: «Tyr167Gly + Arg170Gly», «Tyr167Gly + Arg170Ala», «Tyr167Ala + Arg170Gly» и «Tyr167Ala + Arg170Ala».
Исходные антимикробные пептиды
Исходный антимикробный пептид представляет собой: (а) пептид, последовательность которого по меньшей мере на 60% идентична зрелому пептиду с SEQ ID NO: 2; (б) пептид, кодируемый полинуклеотидом, который гибридизуется в условиях средней строгости с (1) последовательностью SEQ ID NO: 1, кодирующей зрелый пептид, или (2) полноразмерной комплементарной цепью (1); или (в) пептид, кодируемый полинуклеотидом, последовательность которого по меньшей мере на 60% идентична последовательности SEQ ID NO: 1, кодирующей зрелый пептид.
В первом аспекте последовательность исходного пептида по меньшей мере на 60%, например по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности зрелого пептида SEQ ID NO: 2, обладающего антимикробной активностью. В одном аспекте аминокислотная последовательность исходного пептида отличается от зрелого пептида с SEQ ID NO: 2 не более чем на десять аминокислот, например на пять аминокислот, на четыре аминокислоты, на три аминокислоты, на две аминокислоты и на одну аминокислоту.
Предпочтительно, исходный пептид содержит аминокислотную последовательность SEQ ID NO: 2 или состоит из нее.
В одном воплощении исходный пептид представляет собой фрагмент пептида с SEQ ID NO: 2, содержащий по меньшей мере 15 аминокислотных остатков, например по меньшей мере 17 и по меньшей мере 19 аминокислотных остатков.
В другом воплощении исходный пептид представляет собой аллельный вариант пептида с SEQ ID NO: 2.
Во втором аспекте исходный пептид представляет собой пептид, кодируемый полинуклеотидом, который гибридизуется в условиях средней строгости, условиях средневысокой строгости, условиях высокой строгости или условиях очень высокой строгости с (1) последовательностью SEQ ID NO: 1, кодирующей зрелый пептид, или (2) полноразмерной комплементарной цепью (1) (J. Sambrook, E.F. Fritsch, and Т. Maniatis, 1989, Molecular Cloning, A Laboratory Manual, 2-я редакция, Cold Spring Harbor, New York).
Полинуклеотид с SEQ ID NO: 1 или его подпоследовательность, а также аминокислотная последовательность SEQ ID NO: 2 или ее фрагмент, могут быть использованы для конструирования нуклеиновокислотных зондов для идентификации и клонирования ДНК, кодирующей исходный пептид, из штаммов разных родов или видов способами, хорошо известными в данной области техники. В частности, такие зонды могут быть использованы для гибридизации с геномной или кДНК интересующего рода или вида после стандартных процедур Саузерн-блоттинга с целью идентификации и выделения его соответствующего гена. Такие зонды могут быть значительно короче полноразмерной последовательности, но их длина должна составлять по меньшей мере 14, например по меньшей мере 25 или по меньшей мере 35 нуклеотидов. Могут быть использованы как ДНК-, так и РНК-зонды. Зонды обычно включают метку для выявления соответствующего гена (например, 32P, 3H, 35S, биотин или авидин). Такие зонды охватываются настоящим изобретением.
Можно проводить скрининг библиотек геномной ДНК или кДНК, полученной из таких других организмов, на предмет ДНК, которая гибридизуется с описанными выше зондами и кодирует исходный пептид. Геномная или другая ДНК из таких других организмов может быть разделена электрофорезом в агарозном или полиакриламидном геле или другими методиками разделения. ДНК из библиотек или разделенная ДНК может быть перенесена и иммобилизована на нитроцеллюлозе или другом подходящем веществе-носителе. Для идентификации клона или ДНК, гомологичных SEQ ID NO: 1 или ее подпоследовательности, это вещество-носитель используют в Саузерн-блоттинге.
Для задач настоящего изобретения гибридизация показывает, что полинуклеотид гибридизуется с меченным нуклеотидным зондом, соответствующим полинуклеотиду, показанному в SEQ ID NO: 1, его комплементарной цепи или его подпоследовательности в условиях от низкой до очень высокой строгости. Молекулы, с которыми гибридизуется зонд, можно выявлять с использованием, например, рентгеновской пленки или любого другого способа выявления, известного в данной области техники.
В одном воплощении нуклеиновокислотный зонд представляет собой SEQ ID NO: 1.
Для длинных зондов длиной по меньшей мере 60 нуклеотидов условия от очень низкой до очень высокой строгости определяют как предварительную гибридизацию и гибридизацию при 42°C в 5Х SSPE, 0,3% додецилсульфате натрия (SDS), 200 микрограмм/мл ДНК гомогенизированных и денатурированных молок лососевых и 25% формамид для условий очень низкой и низкой строгости, 35% формамид для условий средней и средневысокой строгости или 50% формамид для условий высокой и очень высокой строгости, после стандартных процедур Саузерн-блоттинга, оптимально в течение 12-24 часов. Наконец, вещество-носитель отмывают три раза по 15 минут каждый с использованием 2Х SSC, 0,2% SDS при 45°C (условия очень низкой строгости), 50°C (условия низкой строгости), 55°C (условия средней строгости), 60°C (условия средневысокой строгости), 65°C (условия высокой строгости) или 70°C (условия очень высокой строгости).
Для коротких зондов длиной от приблизительно 15 нуклеотидов до приблизительно 60 нуклеотидов условия строгости определяют как предварительную гибридизацию и гибридизацию при температуре на приблизительно 5°C-приблизительно 10°C ниже расчетной температуры плавления (Tm), вычисленной способом Bolton и McCarthy (1962, Proc. Natl. Acad. Sci. USA 48:1390), в 0,9 M NaCI, 0,09 M трис-HCl, pH 7,6, 6 мМ этилендиаминтетрауксусной кислоте (EDTA), 0,5% NP-40, 1X растворе Денхардта, 1 мМ пирофосфате натрия, 1 мМ дигидрофосфате натрия, 0,1 мМ АТР и 0,2 мг дрожжевой РНК на мл после стандартных процедур Саузерн-блоттинга, оптимально в течение 12-24 часов. Наконец, вещество-носитель отмывают один раз в 6Х SCC с 0,1% SDS в течение 15 минут и два раза по 15 минут каждый с использованием 6Х SSC при температуре на 5°C-10°C ниже расчетной Tm.
В третьем аспекте исходный пептид представляет собой пептид, кодируемый полинуклеотидом, последовательность которого по меньшей мере на 60%, например по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности SEQ ID NO: 1, кодирующей пептид, обладающий антимикробной активностью.
Исходный пептид может быть получен из микроорганизмов любого рода. Для задач настоящего изобретения термин «получен из» при использовании здесь в связи с данным источником означает, что исходный пептид, кодируемый полинуклеотидом, продуцируется этим источником или клеткой, в которую был введен указанный полинуклеотид из источника. В одном аспекте исходный пептид секретируется во внеклеточную среду.
Исходный пептид может представлять собой бактериальный антимикробный пептид. Например, исходный пептид может представлять собой пептид грамположительной бактерии, такой как антимикробный пептид Bacillus, Clostridium, Enterococcus, Geobacillus, Lactobacillus, Lactococcus, Oceanobacillus, Staphylococcus, Streptococcus или Streptomyces, или пептид грамотрицательной бактерии, такой как антимикробный пептид Campylobacter, Е. coli, Flavobacterium, Fusobacterium, Helicobacter, llyobacter, Neisseria, Pseudomonas, Salmonella или Ureaplasma.
В одном аспекте исходный пептид представляет собой антимикробный пептид Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis или Bacillus thuringiensis.
В другом аспекте исходный пептид представляет собой антимикробный пептид Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis или Streptococcus equi, subsp. zooepidemicus.
В другом аспекте исходный пептид представляет собой антимикробный пептид Streptomyces achromogenes, Streptomyces avermitilis, Streptomyces coelicolor, Streptomyces griseus или Streptomyces lividans.
Исходный пептид может представлять собой грибковый антимикробный пептид. Например, исходный пептид может представлять собой дрожжевой антимикробный пептид, такой как антимикробный пептид Candida, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia. Например, исходный пептид может представлять собой антимикробный пептид нитчатого гриба, такой как антимикробный пептид Acremonium, Agaricus, Alternaria, Aspergillus, Aureobasidium, Botryospaeria, Ceriporiopsis, Chaetomidium, Chrysosporium, Claviceps, Cochliobolus, Coprinopsis, Coptotermes, Corynascus, Cryphonectria, Cryptococcus, Diplodia, Exidia, Filibasidium, Fusarium, Gibberella, Holomastigotoides, Humicola, Irpex, Lentinula, Leptospaeria, Magnaporthe, Melanocarpus, Meripilus, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Piromyces, Poitrasia, Pseudoplectania, Pseudotrichonympha, Rhizomucor, Schizophyllum, Scytalidium, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trichoderma, Trichophaea, Verticillium, Volvariella или Xylaria.
В другом аспекте исходный пептид представляет собой антимикробный пептид Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis или Saccharomyces oviformis.
В другом аспекте исходный пептид представляет собой антимикробный пептид Acremonium cellulolyticus, Aspergillus aculeatus, Aspergillus awamori, Aspergillus foetidus, Aspergillus fumigatus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Chrysosporium inops, Chrysosporium keratinophilum, Chrysosporium lucknowense, Chrysosporium merdarium, Chrysosporium pannicola, Chrysosporium queenslandicum, Chrysosporium tropicum, Chrysosporium zonatum, Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, Fusarium venenatum, Humicola grisea, Humicola insolens, Humicola lanuginosa, Irpex lacteus, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium funiculosum, Penicillium purpurogenum, Phanerochaete chrysosporium, Thielavia achromatica, Thielavia albomyces, Thielavia albopilosa, Thielavia australeinsis, Thielavia fimeti, Thielavia microspora, Thielavia ovispora, Thielavia peruviana, Thielavia setosa, Thielavia spededonium, Thielavia subthermophila, Thielavia terrestris, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride.
В другом аспекте исходный пептид представляет собой антимикробный пептид Arenicola marina, например антимикробный пептид с SEQ ID NO: 2.
Следует понимать, что для упомянутых выше видов изобретение включает как совершенные, так и несовершенные стадии, а также другие таксономические эквиваленты, например анаморфы, независимо от видового названия, под которым они известны. Специалисты в данной области техники легко распознают идентичность подходящих эквивалентов.
Штаммы этих видов легко- и общедоступны в нескольких коллекциях культур, таких как Американская коллекция типовых культур (АТСС), Германская коллекция микроорганизмов и клеточных культур (DSM), Центральное бюро плесневых культур (CBS) и Коллекция запатентованных культур Службы сельскохозяйственных исследований, Северный региональный исследовательский центр (NRRL).
Исходный пептид может быть идентифицирован и получен из других источников, включая микроорганизмы, выделенные из природы (например, почвы, компостов, воды и так далее), или образцы ДНК, полученные непосредственно из природы (например, почвы, компостов, воды и так далее) с использованием упомянутых выше зондов. Методики выделения микроорганизмов и ДНК непосредственно из природных сред хорошо известны в данной области техники. Полинуклеотид, кодирующий исходный пептид, может затем быть получен сходным образом путем скрининга библиотеки геномной ДНК или кДНК другого микроорганизма или смешанного образца ДНК. После выявления полинуклеотида, кодирующего исходный пептид, с использованием зонда(ов), полинуклеотид может быть выделен или клонирован с применением методик, известных специалистам в данной области техники (см., например, Sambrook et al., 1989, выше).
Исходный пептид может представлять собой гибридный пептид, где часть одного пептида слита с N-концом или C-концом части другого пептида.
Исходный пептид может также представлять собой слитый пептид или расщепляемый слитый пептид, в котором один пептид слит с N-концом или C-концом другого пептида. Слитый пептид получают путем слияния полинуклеотида, кодирующего один пептид, с полинуклеотидом, кодирующим другой пептид. Методики получения слитых пептидов известны в данной области техники и включают лигирование кодирующих последовательностей, кодирующих указанные пептиды, так чтобы они располагались в одной рамке и чтобы экспрессия слитого пептида контролировалась тем(и) же промотором(ами) и терминатором. Слитые белки могут также быть сконструированы с использованием интеиновой методики, где слитые конструкции получают после трансляции (Cooper et al., 1993, EMBO J. 12:2575-2583; Dawson et al., 1994, Science 266:776-779).
Слитый белок может также содержать сайт расщепления между двумя пептидами. При секреции такого слитого белка происходит расщепление сайта с высвобождением двух пептидов. Примеры сайтов расщепления включают, без ограничения, сайты, раскрытые в Martin et al., 2003, J. Ind. Microbiol. Biotechnol. 3:568-576; Svetina et al., 2000, J. Biotechnol. 76:245-251; Rasmussen-Wilson et al., 1997, Appl. Environ. Microbiol. 63:3488-3493; Ward et al., 1995, Biotechnology 13:498-503; и Contreras et al., 1991, Biotechnology 9:378-