Рекомбинантные белки эластазы и способы их получения и применения
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложен аутоактивируемый белок панкреатической эластазы типа I. Предложена молекула нуклеиновой кислоты, кодирующая указанный белок. Предложен вектор для экспрессии указанного белка, содержащий указанную молекулу нуклеиновой кислоты. Предложена клетка-хозяин для продукции указанного белка. Предложен способ получения указанного белка, включающий культивирование указанной клетки-хозяина. Предложен способ получения фармацевтической композиции, содержащей указанный белок. Группа изобретений позволяет получать фармацевтические композиции с низким содержанием трипсина, содержащие зрелый белок панкреатической эластазы типа I, которые могут быть использованы в лечении и профилактике заболеваний биологических каналов (артерий и вен у человека). 10 н. и 18 з.п. ф-лы, 39 ил., 13 табл., 8 пр.
Реферат
В настоящем изобретении испрашивается приоритет предварительной заявки на патент США № 60/992319, поданной 4 декабря 2007, содержание которой во всей своей полноте вводится в настоящее описание посредством ссылки.
1. Область, к которой относится изобретение
Настоящее изобретение относится к рекомбинантным способам изготовления и получения белков эластазы, применяемым для лечения и предупреждения заболеваний биологических каналов. Настоящее изобретение также относится к новым рекомбинантным белкам эластазы и к фармацевтическим композициям, содержащим указанные белки. Кроме того, настоящее изобретение относится к применению фармацевтических композиций, содержащих рекомбинантные белки эластазы, для лечения и предупреждения заболеваний биологических каналов.
2. Предшествующий уровень техники
Эластин представляет собой белок, способный к спонтанному образованию тяжей после его растяжения. Перекрестно-связанный эластин представляет собой главный структурный компонент эластичных волокон, которые сообщают ткани эластичность. Протеиназа может называться эластазой, если она обладает способностью солюбилизировать зрелый перекрестно-связанный эластин (Bieth, JG “Elastases: catalytic and biological properties,” at pp. 217-320 (Mecham Edition, Regulation of Matrix Accumulation, New York, Academic Press, 1986). В нескольких опубликованных патентных заявках (WO 2001/21574; WO 2004/073504; и WO 2006/036804) указывается, что эластаза, взятая отдельно и в комбинации с другими агентами, может оказывать благоприятное действие при лечении заболеваний биологических каналов, включая биологические каналы, которые подвергаются, или могут подвергаться обструкции и вазоспазмам. При лечении человека с применением эластазы, в целях снижения риска иммунной реакции на не-человеческую эластазу, желательно использовать эластазу человека.
Однако в настоящее время не существует каких-либо коммерчески доступных способов получения биологически активной эластазы в достаточно чистой форме и в количестве, достаточном для ее клинического применения. Поскольку эластазы являются эффективными протеазами, которые могут гидролизовать различные белки, не являющиеся эластином, то протеолитическая активность эластазы может создавать проблемы при ее продуцировании рекомбинантными методами. Так, например, активность зрелой эластазы может приводить к повреждению клеток-хозяев, экспрессирующих эту эластазу, к ее собственной деградации или к расщеплению агентов, используемых для облегчения продуцирования или характеризации данной эластазы.
Эластазы часто экспрессируются как препробелки, содержащие сигнальный пептид, пептид активации и зрелую активную часть. Отщепление сигнальной последовательности после секреции приводит к образованию пробелка, который может обладать незначительной ферментативной активностью или вообще не обладать такой активностью, и который имеет аминокислотную последовательность, содержащую пептид активации и зрелый белок. Вообще говоря, при рекомбинантной экспрессии, вместо зрелого активного фермента может быть экспрессирован неактивный предшественник во избежание повреждения клеток, которые экспрессируют этот фермент. Так, например, в патенте США No. 5212068 описано клонирование кДНК панкреатической эластазы человека (называемой там эластазой «IIA», «IIB», «IIIA» и «IIIB»). Различные эластазы были экспрессированы как полноразмерные кДНК, включающие нативные сигнальные последовательности, в COS-1 млекопитающих. Кроме того, сконструированные варианты эластазы, содержащие сигнальную последовательность B. subtilis и сигнальную последовательность β-галактозидазы, были также экспрессированы в B. subtilis и E. coli, соответственно. В патенте США No. 5212068 было также высказано предположение о возможности экспрессии эластаз в S. cerevisiae. В общих чертах, рабочие примеры экспрессии эластазы, приведенные в патенте США No. 5212068 показали, что выделенная эластаза, обладает низкой активностью, либо для получения активной эластазы требуется проведение стадии активации, включающей обработку трипсином. Кроме того, при экспрессии в E. coli, эластазы в большом количестве присутствуют в тельцах включения и лишь небольшое количество экспрессированных эластаз являются растворимыми и активными. Ни один из эластазных препаратов, описанных в патенте США No. 5212068, не был очищен до фармацевтически приемлемой чистоты.
Таким образом, необходимо разработать методы рекомбинантного продуцирования, которые позволяли бы получать терапевтическое количество биологически активных эластаз фармацевтической чистоты и, предпочтительно, позволяли бы избежать проведения стадии активации трипсином, которая является слишком дорогостоящей для ее крупномасштабного применения и может приводить к загрязнению конечного продукта трипсином. Введение трипсинсодержащей эластазы пациенту может приводить к активации активированных протеазой рецепторов 1 и 2, что будет снижать некоторые благоприятные эффекты при лечении эластазы.
Цитирование любой работы или ссылка на нее в разделе 2 или в любом другом разделе настоящей заявки не должно быть истолковано как указание на то, что цитируемая работа является прототипом настоящего изобретения.
3. Описание сущности изобретения
Настоящее изобретение относится к новым эффективным способам получения рекомбинантных белков эластазы и к применению таких рекомбинантных белков в композициях, например, в фармацевтических композициях, эластазных препаратах или лекарственных формах, в целях лечения и предупреждения заболеваний биологических каналов.
Настоящее изобретение относится к аутоактивированным пробелкам эластазы; к нуклеиновым кислотам, кодирующим аутоактивированные пробелки эластазы; к клеткам-хозяевам, содержащим указанные нуклеиновые кислоты; к способам получения аутоактивированных пробелков эластазы и к применению аутоактивированных пробелков эластазы в целях получения зрелых биологически активных белков эластазы, например, к их применению в фармацевтических композициях. Используемый здесь термин «ауто-активированный» (или «аутоактивированный») является синонимом термина «аутоактивирующийся», «самоактивирующийся» и «самоактивированный», и означает, что в данном случае не проводится какая-либо стадия активации. Используемый здесь термин «активация» является синонимом термина «превращение» и не означает, что белок, полученный в результате «активации», обязательно должен обладать ферментативной активностью.
Используемый ниже термин «эластаза», если это не оговорено особо, по существу, означает зрелый белок эластазы, обладающий эластазной активностью, а также незрелый белок эластазы, включая незрелый белок проэластазы (также называемый здесь белком проэластазы) и незрелые белки препроэластазы (также называемые здесь белками препроэластазы).
Предпочтительными эластазами согласно изобретению являются панкреатические эластазы типа I, например, панкреатическая эластаза типа I человека и панкреатическая эластаза типа I свиней. Панкреатические эластазы типа I иногда называются здесь «эластаза-1», «эластаза I», «эластаза типа 1», или «ELA-1». Панкреатическая эластаза типа I человека также называется здесь hELA-1 или ELA-1 человека, а панкреатическая эластаза типа I свиней также называется здесь pELA-1 или ELA-1 свиней.
Зрелый белок эластазы согласно изобретению обычно имеет аминокислотную последовательность, кодируемую природным геном эластазы, или вариант такой последовательности. Предпочтительные варианты последовательностей, включая варианты, содержащие аминокислотные замены, описаны в настоящей заявке. Белок проэластазы представляет собой крупный неактивный предшественник зрелого белка эластазы, а белок препроэластазы также содержит сигнальную последовательность для секреции белка. Пре- и про-последовательности белков эластазы согласно изобретению обычно не являются нативными для генов эластазы, кодирующих зрелые белки эластазы согласно изобретению. Таким образом, в известным смысле, незрелые белки эластазы согласно изобретению являются «химерными» белками, где их зрелые части кодируются природным геном эластазы, а их незрелые части кодируются не-эластазными генными последовательностями.
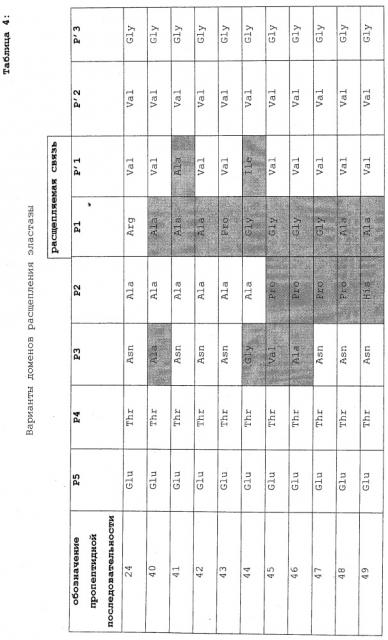
Для облегчения сравнения, белки эластазы согласно изобретению и их компоненты коровой последовательности представлены на фигуре 2. Как показано на фигуре 2, аминокислотные остатки в последовательности проэластазы, которые являются N-концевыми по отношению к расщепляемой связи (то есть связи, которая расщепляется с образованием зрелого белка эластазы), обозначаются здесь как PX, ..., Р5, P4, P3, P2 и P1, где P1 находится непосредственно у N-конца по отношению к расщепляемой связи, а аминокислотные остатки, расположенные у С-конца по отношению к расщепляемой связи (и у N-конца) зрелого белка эластазы, обозначены P1′, P2′, P3′,...,PX′, где P1′ находится непосредственно у С-конца по отношению к расщепляемой связи и представляет собой N-концевой аминокислотный остаток зрелого белка. На фигуре 2 также приводятся нижеследующие компоненты:
(1) Сигнальная последовательность: Последовательность, которая увеличивает количество экспрессируемых молекул, секретирующихся из клетки. Характерной последовательностью являются аминокислоты 1-22 SEQ ID NO:50 или 51.
(2) Пропептид+спейсер: необязательная, но предпочтительная, не-эластазная пропептидная последовательность (такая как пропропептид α-фактора дрожжей), которая может также, но необязательно, включать одну или несколько спейсерных последовательностей (пропептидные последовательности α-фактора дрожжей и спейсерные последовательности Kex2 и STE13, представленные на фигуре 1B). В конкретном варианте изобретения, пропептидная последовательность не включает спейсер.
(3) Пропептид эластазы: Пептид, который, в том случае, если он присутствует у N-конца эластазы, делает данную молекулу неактивной или менее активной по сравнению с соответствующим зрелым белком эластазы. Пропептид эластазы может быть смежным с пептидом активации, либо он может содержать дополнительные аминокислоты, связанные с пептидом активации. Характерными пропептидными последовательностями эластазы являются аминокислоты 1-10 SEQ ID NO:64 и 69.
(4) Пептид активации: Используемый здесь термин «пептид активации», который употребляется в данном описании как синонимом термина «последовательность активации», означает компонент пропептида эластазы, и может быть смежным с эластазным пропептидом. Как показано на фигуре 2, пептид активации содержит аминокислотные остатки P10-P1. Характерная консенсусная последовательность пептида активации представляет собой SEQ ID NO:80; а другими примерами последовательностей пептида активации являются SEQ ID NO: 23, 72 и 73.
(5) Последовательность распознавания: Последовательностью распознавания является компонент пропептида эластазы. Как показано на фигуре 2, последовательность распознавания содержит аминокислотные остатки Р3-Р1. Характерные консенсусные последовательности распознавания представляют собой SEQ ID NO:11-13 и 93, а характерной последовательностью распознавания является SEQ ID NO:20.
(6) Домен расщепления: Область в белке проэластазы, которая охватывает расщепляемую связь. Как показано на фигуре 2, домен расщепления содержит аминокислотные остатки P5-P3′. Характерными последовательностями домена расщепления являются SEQ ID NO:42, 43, 48, 49, 53, 53, 54 и 55.
(7) Сайт расщепления: Другая область в белке проэластазы, которая также охватывает расщепляемую связь. Как показано на фигуре 2, сайт расщепления содержит аминокислотные остатки P4-P4′. Характерной последовательностью сайта расщепления является SEQ ID NO:27.
(8) Белок препроэластазы: Белок, который может содержать все части-компоненты. Характерный белок препроэластазы может содержать пептиды SEQ ID NO:50, 51, 96 или 97, за которыми следует функционально связанный белок SEQ ID NO:64 или SEQ ID NO:69.
(9) Белок проэластазы: Белок, который содержит зрелый белок эластазы, пропептид эластазы и, необязательно, пропептид и спейсерные последовательности. Характерными последовательностями проэластазы являются SEQ ID NO:64 и 69.
(10) Зрелый белок эластазы: Белок, который, при его «правильном» процессинге, обладает эластазной активностью. Характерными зрелыми последовательностями являются SEQ ID NO:1 (последовательность человека) и SEQ ID NO:39 (последовательность свиньи).
Компоненты белка эластазы могут рассматриваться как модульные структурные элементы белков эластазы, белков проэластазы и белков препроэластазы. Так, например, настоящее изобретение относится к белку проэластазы, содержащему последовательность пропептида эластазы и зрелый белок эластазы. Пропептид эластазы может содержать пептид активации. Пропептид эластазы может также содержать последовательность распознавания эластазы. Настоящее изобретение также относится к белку проэластазы, содержащему домен расщепления или сайт расщепления в области, охватывающей область стыка между пропептидом эластазы и зрелым белком эластазы. Белки проэластазы могут также содержать сигнальную последовательность для секреции. Такие белки рассматриваются как белки препроэластазы. Белки препроэластазы могут также содержать пропептид альфа-фактора дрожжей и, необязательно, спейсерную последовательность, расположенную между сигнальной последовательностью и пропептидом эластазы. Белки эластазы согласно изобретению могут также, помимо коровых модульных компонентов, проиллюстрированных на фигуре 2, содержать и другие компоненты. Так, например, белок эластазы может содержать эпитопную метку или гистидиновую метку для очистки. Следует также отметить, что белки эластазы согласно изобретению необязательно должны содержать все компоненты, представленные на фигуре 2, а обычно, они содержат по меньшей мере один из таких компонентов (включая, например, но не ограничиваясь ими, зрелую последовательность эластазы или последовательность проэластазы), представленных на фигуре 2. Характерные белки эластазы согласно изобретению описаны в вариантах осуществления 1-12, 28-39 и 68-69 в нижеприведенном разделе 8, включая характерные белки проэластазы типа I, описанные в вариантах осуществления 13-27 в нижеприведенном разделе 8.
Настоящее изобретение охватывает нуклеиновые кислоты, кодирующие белки эластазы согласно изобретению; способы получения и очистки таких белков; рекомбинантные клетки и супернатанты клеточных культур; композиции, содержащие белки эластазы (например, фармацевтические композиции, лекарственные формы, препараты), применение белков в терапевтических целях; наборы, включающие белки, препараты; фармацевтические композиции и лекарственные формы. Нуклеиновые кислоты, кодирующие белки эластазы согласно изобретению, проиллюстрированы в вариантах осуществления 40-67 в нижеприведенном разделе 8, включая векторы (см., например, варианты осуществления 70-72). В разделе 8 также проиллюстрированы рекомбинантные клетки (см., например, варианты 73-84) и клеточные супернатанты, содержащие белки эластазы (см., например, вариант осуществления 88). Способы получения белков эластазы описаны в вариантах осуществления 89-224, 261-276 и 347-373 в разделе 8. Способы получения эластазных препаратов описаны в вариантах осуществления 225-260 в разделе 8. Способы получения фармацевтических композиций описаны в вариантах осуществления 374-385 в разделе 8. Фармацевтичсекие композиции, содержащие белки эластазы, описаны в вариантах осуществления 277-313 и 386 в разделе 8, а лекарственные формы описаны в вариантах осуществления 415-420 в разделе 8. Препараты белков эластазы описаны в вариантах осуществления 324-346 в разделе 8. Применение белков эластазы в терапевтических целях описано в вариантах осуществления 387-414 в разделе 8. Наборы, содержащие белки, описаны в вариантах осуществления 421-424 в разделе 8.
Различные аспекты изобретения, относящиеся к белкам проэластазы, имеющим последовательности SEQ ID NO:64 и 69, приводятся в разделе 8 под заголовком «Конкретные варианты осуществления изобретения», однако такие варианты осуществления могут относиться и к другим описанным здесь последовательностям белков эластазы.
Описанные здесь способы получения часто включают стадию активации, в которой пептид активации затем удаляют из проэластазной последовательности/отделяют от зрелой эластазной последовательности с получением зрелого белка эластазы. Описанными здесь стадиями активации могут быть стадии аутоактивации, то есть стадии, осуществляемые благодаря эластазной активности, или стадия, не являющаяся стадией аутоактивации, то есть стадия активации, не опосредуемая эластазой, например, стадия, осуществляемая с использованием трипсина.
В некоторых своих аспектах, настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую белок эластазы (включая, но не ограничиваются ими, белок, представленный любой из последовательностей SEQ ID NO:6-9, 64-69, 88-91 или 98-103), содержащий (i) пропептид эластазы, содержащий последовательность пептида активации, содержащую последовательность распознавания эластазы, функционально связанную с (ii) аминокислотной последовательностью белка, обладающего эластазной активностью. Этот белок также содержит, но необязательно, сигнальную последовательность, такую как сигнальный пептид α-фактора дрожжей, и представлен аминокислотной последовательностью SEQ ID NO:34, функционально связанной с указанным пропептидом эластазы. α-Фактор иногда называется здесь «альфа-фактором» или «альфа-фактором скрещивания» или «α-фактором скрещивания». В некоторых конкретных вариантах осуществления изобретения, белок содержит не-эластазный пропептид, такой как пропептид α-фактора дрожжей. В некоторых конкретных вариантах осуществления изобретения, белок может содержать одну или несколько спейсерных последовательностей. Спейсерными последовательностями могут быть, но не ограничиваются ими, сайты расщепления протеазой Kex2 и STE13. В конкретном варианте осуществления изобретения может быть использован спейсер Kex2. В другом варианте осуществления изобретения, спейсер Kex2 может быть функционально связан со спейсером STE13, как показано на фигуре 1B. Сигнальная пептидная последовательность и не-эластазная пропептидная последовательность представлены аминокислотными последовательностями SEQ ID NO:51 или 97. Пептид, содержащий сигнальную пептидную последовательность, не-эластазную пропептидную последовательность и спейсерную последовательность, представлен аминокислотными последовательностями SEQ ID NO:50 или 96.
В других конкретных вариантах осуществления изобретения, сигнальной последовательностью является секреторная сигнальная последовательность млекопитающего, такая как сигнальная последовательность эластазы типа I свиньи или человека (используемые как синонимы термина «панкреатическая эластаза типа I»).
Предпочтительно, последовательность распознавания эластазы представляет собой панкреатическую последовательность распознавания эластазы типа I.
В конкретных вариантах осуществления изобретения, белком, обладающим эластазной активностью типа I, является зрелая эластаза типа I человека, например, белок с аминокислотными последовательностями SEQ ID NO:1, 4, 5, 84 или 87.
Настоящее изобретение также относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую белок, содержащий: (i) сигнальную последовательность, функционирующую в Pichia pastoris и функционально связанную с (ii) последовательностью активации (включая, но не ограничиваясь ими, аминокислотные последовательности SEQ ID NO:23, 72, 73, или 80), содержащей последовательность распознавания протеазы (включая, но не ограничиваясь ими, любую из аминокислотных последовательностей SEQ ID NO:11-23 и 93), которая, в свою очередь, функционально связана с (iii) аминокислотной последовательностью зрелой эластазы типа I человека. В предпочтительном варианте осуществления изобретения, последовательностью распознавания протеазы является последовательность распознавания эластазы типа I человека, а наиболее предпочтительно, последовательность распознавания эластазы SEQ ID NO:20.
Настоящее изобретение также относится к белкам проэластазы (необязательно содержащим сигнальную последовательность, и таким образом, представляющим собой белки препроэластазы) и к зрелым белкам эластазы, кодируемым нуклеиновыми кислотами согласно изобретению, а также к композициям (например, к фармацевтическим композициям, препаратам и лекарственным формам), содержащим указанные зрелые белки эластазы.
В предпочтительном варианте осуществления изобретения, белок проэластазы или зрелый белок эластазы не имеют N-концевого метионинового остатка. Однако в другом варианте осуществления изобретения белок проэластазы или зрелый белок эластазы имеют такой N-концевой метиониновый остаток.
В нижеприведенной таблице 1 систематизированы идентификаторы последовательностей, используемые в описании настоящего изобретения. Предпочтительные белки согласно изобретению содержат любые, или состоят из любых последовательностей SEQ ID NO:1-32, 34, 37-73, 77, 78, 82-92 и 98-105, перечисленных ниже в таблице 1, либо они частично или полностью кодируются нуклеотидными последовательностями SEQ ID NO:33 и SEQ ID NO:81.
| Таблица 1: Систематизированные данные для аминокислотных и нуклеотидных последовательностей SEQ ID NO | ||
| МОЛЕКУЛА | Нуклеотидная или аминокислотная последовательность | SEQ ID NO |
| Зрелая эластаза I человека, включающая первый «валин» с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | Аминокислотная | 1 |
| Зрелая эластаза I человека минус первый «валин» с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 2 |
| Зрелая эластаза I человека минус первые два «валина» с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 3 |
| Зрелая эластаза I человека, где первый «валин» заменен «аланином», с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 4 |
| Зрелая эластаза I человека (изотип 2), включающая первый «валин» | аминокислотная | 5 |
| Сконструированный белок проэластазы N 1 (вариант pPROT42), с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 6 |
| Сконструированный белок проэластазы № 2, с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 7 |
| Сконструированный белок проэластазы № 3, с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 8 |
| Сконструированный белок проэластазы № 4, с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 9 |
| Сконструированный белок проэластазы № 5 (активируемая трипсином последовательность pPROT42) с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 10 |
| Консенсусная последовательность распознавания эластазы 1 (положения Xaa1=P3, Xaa2=P2, Xaa3=P1) | аминокислотная | 11 |
| Консенсусная последовательность распознавания эластазы 2 (положения P3-P2-P1) | аминокислотная | 12 |
| Консенсусная последовательность распознавания эластазы 3 (положения P3-P2-P1) | аминокислотная | 13 |
| Последовательность распознавания эластазы 1 (положения P3-P2-P1) | аминокислотная | 14 |
| Последовательность распознавания эластазы 2 (положения P3-P2-P1) | аминокислотная | 15 |
| Последовательность распознавания эластазы 3 (положения P3-P2-P1) | аминокислотная | 16 |
| Последовательность распознавания трипсина дикого типа (pPROT24) (положения P3-P2-P1) | аминокислотная | 17 |
| Последовательность распознавания эластазы 5 (положения P3-P2-P1) | аминокислотная | 18 |
| Последовательность распознавания эластазы 6 (положения P3-P2-P1) | аминокислотная | 19 |
| Последовательность распознавания эластазы 7 (положения P3-P2-P1 вариантов 48 и 55) | аминокислотная | 20 |
| Последовательность распознавания эластазы 8 | аминокислотная | 21 |
| Активирующая последовательность эластазы 1 человека | аминокислотная | 22 |
| Активирующая последовательность эластазы 2 человека | аминокислотная | 23 |
| Сайт расщепления про-PROT-201 | аминокислотная | 24 |
| Сайт расщепления pPROT40 | аминокислотная | 25 |
| Сайт расщепления pPROT41 | аминокислотная | 26 |
| Сайт расщепления pPROT42 | аминокислотная | 27 |
| Сайт расщепления pPROT43 | аминокислотная | 28 |
| Сайт расщепления pPROT44 | аминокислотная | 29 |
| Сайт расщепления pPROT45 | аминокислотная | 30 |
| Сайт расщепления pPROT46 | аминокислотная | 31 |
| Сайт расщепления pPROT47 | аминокислотная | 32 |
| Кодирующая область эластазы-1 человека (то есть панкреатическая эластаза типа I человека) (NCBI рег. No. NM_001971) | нуклеотидная | 33 |
| Сигнальный пептид альфа-фактора дрожжей | аминокислотная | 34 |
| Праймер 20F | нуклеотидная | 35 |
| Праймер 24R | нуклеотидная | 36 |
| Вариант эластазы с сайтом расщепления pPROT42 P3 и с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 37 |
| Вариант эластазы с сайтом расщепления pPROT42 P2 и с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 38 |
| Зрелая панкреатическая эластаза I свиней (взятая из GenBank рег. № P00772.1) | аминокислотная | 39 |
| Домен расщепления варианта пропептида эластазы 40 | аминокислотная | 40 |
| Домен расщепления варианта пропептида эластазы 41 | аминокислотная | 41 |
| Домен расщепления варианта пропептида эластазы 42 | аминокислотная | 42 |
| Домен расщепления варианта пропептида эластазы 43 | аминокислотная | 43 |
| Домен расщепления варианта пропептида эластазы 44 | аминокислотная | 44 |
| Домен расщепления варианта пропептида эластазы 45 | аминокислотная | 45 |
| Домен расщепления варианта пропептида эластазы 46 | аминокислотная | 46 |
| Домен расщепления варианта пропептида эластазы 47 | аминокислотная | 47 |
| Домен расщепления варианта пропептида эластазы 48 | аминокислотная | 48 |
| Домен расщепления варианта пропептида эластазы 49 | аминокислотная | 49 |
| Сигнальный пептид, пропептид и спейсерная последовательность 1 альфа-фактора дрожжей скрещивания | аминокислотная | 50 |
| Сигнальный пептид и пропептидная последовательность 2 альфа-фактора дрожжей скрещивания | аминокислотная | 51 |
| Домен расщепления варианта пропептида эластазы 52 | аминокислотная | 52 |
| Домен расщепления варианта пропептида эластазы 53 | аминокислотная | 53 |
| Домен расщепления варианта пропептида эластазы 54 | аминокислотная | 54 |
| Домен расщепления варианта пропептида эластазы 55 | аминокислотная | 55 |
| Домен расщепления варианта пропептида эластазы 56 | аминокислотная | 56 |
| Домен расщепления варианта пропептида эластазы 57 | аминокислотная | 57 |
| Домен расщепления варианта пропептида эластазы 58 | аминокислотная | 58 |
| Домен расщепления варианта пропептида эластазы 59 | аминокислотная | 59 |
| Домен расщепления варианта пропептида эластазы 60 | аминокислотная | 60 |
| Домен расщепления варианта пропептида эластазы 61 | аминокислотная | 61 |
| Домен расщепления варианта пропептида эластазы 62 | аминокислотная | 62 |
| Домен расщепления варианта пропептида эластазы 63 | аминокислотная | 63 |
| Эластазный профермент с вариантом домена расщепления 48 и с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 64 |
| Эластазный профермент с вариантом домена расщепления 49 и с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 65 |
| Эластазный профермент с вариантом домена расщепления 52 и с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 66 |
| Эластазный профермент с вариантом домена расщепления 53 и с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 67 |
| Эластазный профермент с вариантом домена расщепления 54 и с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 68 |
| Эластазный профермент с вариантом домена расщепления 55 и с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 69 |
| Эластаза дикого типа + вариант расщепления AlaArg, с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 70 |
| Эластаза дикого типа + вариант расщепления Arg с возможным полиморфизмом в положении 220 (V или L) (нумерация положений дана с учетом препробелка) | аминокислотная | 71 |
| Вариант эластазного пептида активации 48 человека | аминокислотная | 72 |
| Вариант эластазного пептида активации 55 человека | аминокислотная | 73 |
| Консенсусная последовательность домена расщепления эластазы человека; соответствует остаткам P5, P4, P3, P2, P1, P′1, P′2 и P′3 домена расщепления эластазы | аминокислотная | 74 |
| Праймер для ПЦР-мутагенеза, проводимого для конструирования pPROT3 | Нуклеиновая кислота | 75 |
| Праймер для ПЦР-мутагенеза, проводимого для конструирования pPROT3 | Нуклеиновая кислота | 76 |
| Зрелый С-концевой вариант ELA1, описанный Talas et al., 2000, в Invest Dermatol. 114(1):165-70. | аминокислотная | 77 |
| Зрелые варианты ELA-1 с возможным полиморфизмом в положениях 44 (W или R); 59 (M или V); 220 (V или L); и 243 (Q или R) (нумерация положений дана с учетом препробелка) | аминокислотная | 78 |
| Варианты пептида активации (дикого типа, расщепляемого трипсином) с возможным полиморфизмом в положении 10 (Q или H) (нумерация положений дана с учетом препробелка) | аминокислотная | 79 |
| «Консенсусная» последовательность пептида активации | аминокислотная | 80 |
| Кодирующая область ELA-1.2A | аминокислотная | 81 |
| Продукт трансляции ELA-1.2A(активируемая трипсином последовательность pPROT24) | аминокислотная | 82 |
| Продукт трансляции ELA-1.2A (активируемая трипсином последовательность pPROT24) с возможным полиморфизмом в положениях 44 (W или R); 59 (M или V); 220 (V или L); и 243 (Q или R) (нумерация положений дана с учетом препробелка) | аминокислотная | 83 |
| Зрелая эластаза I человека, включающая первый «валин» с возможным полиморфизмом в положениях 44 (W или R); 59 (M или V); 220 (V или L); и 243 (Q или R) (нумерация положений дана с учетом препробелка) | аминокислотная | 84 |
| Зрелая эластаза I человека минус первый «валин» с возможным полиморфизмом в положениях 44 (W или R); 59 (M или V); 220 (V или L); и 243 (Q или R) (нумерация положений дана с учетом препробелка) | аминокислотная | 85 |
| Зрелая эластаза I человека минус первые два «валина» с возможным полиморфизмом в положениях 44 (W или R); 59 (M или V); 220 (V или L); и 243 (Q или R) (нумерация полож |