Секвенирование днк с повторным использованием реагентов на проволочной сетке
Иллюстрации
Показать всеИзобретения относятся к области определения последовательности нуклеиновой кислоты. Предложена группа изобретений, включающая устройство и способ для оптического контроля секвенирования нуклеиновой кислоты, машиночитаемый носитель с компьютерной программой и программный элемент, используемые в вышеуказанном способе, а также применение 5-метил-(2-(2-нитрофенил)пропил)карбонат-dUTP, 5-метил-(2-оксо-1,2-дифенилэтил)карбонат-dUTP в качестве блокатора в секвенировании ДНК в вышеуказанном способе. Устройство включает подложку в виде проволочной сетки для связывания молекулы на поверхности; оптическую схему, выполненную с возможностью направления возбуждающего излучения на подложку, приема, детектирования излучения и направления расщепляющего излучения на подложку; раствор с нуклеотидами и ферментом, где нуклеотиды содержат блокатор. Способ включает обеспечение подложки с молекулой, облучение подложки возбуждающим излучением, ограничение возбуждающего излучения с помощью подложки, прием и детектирование флуоресценции возбужденной флуоресцентной метки нуклеотида, выполнение облучения подложки расщепляющим излучением, ограничение расщепляющего излучения и обеспечение раствора с многочисленными нуклеотидами и ферментом. Изобретения обеспечивают усовершенствование способа определения последовательности нуклеиновой кислоты. 5 н. и 9 з.п. ф-лы, 11 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к определению последовательности нуклеиновой кислоты. В частности, настоящее изобретение относится к устройству для оптического контроля итерационной постадийной реакции для определения последовательности нуклеиновой кислоты, способу оптического контроля итерационной постадийной реакции для определения последовательности нуклеиновой кислоты, программному элементу, машиночитаемому носителю, на котором сохраняется программный элемент, и применению соединения в качестве блокатора в секвенировании ДНК.
УРОВЕНЬ ТЕХНИКИ
Секвенирование ДНК является быстроразвивающейся областью с такими ключевыми игроками, как компании Illumina (с использованием технологии Solexa), Life (с использованием технологии SOLiD) и Roche Diagnostics (с использованием технологии 454). Недостаток методов секвенирования, которые применяют эти компании, состоит в том, что информацию о последовательности получают повторением нескольких стадий, которые предусматривают замену реагентов и промывание. Этот подход является весьма затруднительным и занимающим много времени и отправляет в отходы много дорогостоящих реагентов. Число повторений равно числу нуклеотидов, которые опрашиваются, то есть длине прочтения. При стремлении увеличить длину прочтения эта проблема будет становиться все более серьезной в будущем. В настоящее время это компенсируется высоким уровнем параллелизма на больших планшетах. Однако для применения в клинической практике это является менее желательным. Скорее хотелось бы наличия быстрого ответа и меньшей сложности. В то же время затраты в расчете на пару оснований должны значительно снизиться. Поскольку после каждой стадии, то есть после инкорпорации нуклеотида, вся поверхность должна быть полностью промыта, все реагенты отправляются в отходы. Общее расходование реагентов пропорционально длине прочтения и в настоящее время представляет собой преобладающий фактор расходов на секвенирование.
Процесс секвенирования конкретной мишени, например такой как ДНК, становится более сложным, поскольку после реакции инкорпорации должна следовать реакция активации, и между ними требуются стадии тщательного промывания.
Альтернативные подходы, такие как от фирмы Pacific Biosciences, являются более эффективными, так как в них прослеживается инкорпорация нуклеотидов в режиме реального времени для каждой молекулы отдельно. В этом случае промывание не требуется. С другой стороны, оптические требования для такой системы являются очень жесткими, так как необходима чувствительность к одиночному флуорофору с 4 различными цветами в реальном времени. Это может быть достигнуто только для ограниченной области, так как поле зрения линз объективов с большим увеличением ограничено для практических систем и источника мощного лазерного излучения. При ограниченной области может быть упорядочена только малая выборка образцов, и высок риск ошибок вследствие пропущенных прочтений. Флуоресцентные сигналы от меченых нуклеотидов, в то время как они встраиваются полимеразой, необходимо отличать от сигналов того же типа молекул, которые случайно оказались в том же месте. Это делается анализом длительности импульса флуоресцентного сигнала.
Патентный документ WO 2006/007207 А2 раскрывает способы определения последовательности нуклеиновых кислот, в котором нуклеиновые кислоты присоединяют к поверхности и последовательно подвергают воздействию дезоксинуклеотидтрифосфатов, имеющих присоединенную оптически детектируемую метку. После детектирования метка может быть удалена из ее нуклеотида путем фотоотщепления. В определенных вариантах исполнения детектирование проводят с использованием облучения нераспространяющейся волной.
Патентный документ WO 2006/044078 А2 представляет примеры обратимых блокирующих групп, которые являются фотоотщепляемыми. Патентные документы WO 2009/060360 А2, ЕР 2 221 605 А1 и WO 2009/107041 А1 раскрывают различные варианты применения сенсоров с проволочной сеткой.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Может существовать потребность в предоставлении улучшенного подхода к определению последовательности нуклеиновой кислоты. Настоящее изобретение отвечает этой потребности.
Цель настоящего изобретения можно увидеть в предоставлении усовершенствованного подхода к определению последовательности нуклеиновой кислоты.
Цель настоящего изобретения достигается предметом независимых пунктов формулы изобретения. Дополнительные варианты осуществления и преимущества изобретения входят в зависимые пункты патентной формулы.
Следует отметить, что описываемые здесь варианты осуществления подобным образом имеют отношение к способу оптического контроля итерационной постадийной реакции для определения последовательности нуклеиновой кислоты, устройству для оптического контроля итерационной постадийной реакции для определения последовательности нуклеиновой кислоты, компьютерному программному элементу, машиночитаемому носителю и применению соединения в качестве блокатора в секвенировании ДНК. В различных комбинациях вариантов осуществления могут проявляться синергические эффекты, хотя они могли бы быть не описаны подробно.
Кроме того, следует отметить, что все варианты осуществления настоящего изобретения, касающиеся способа, могли бы быть реализованы в порядке следования стадий, как описано, тем не менее он не должен быть единственным и исключительным порядком следования стадий способа. Настоящим описываются все различные порядки и комбинации стадий способа.
В контексте настоящего изобретения термин «блокатор» следует понимать как фрагмент, который блокирует синтетическую активность фермента в случае, где блокатор введен в молекулу, на которой фермент производит процесс синтеза. Блокатор может представлять собой, например, молекулу-блокатор.
В контексте настоящего изобретения термин «отщепляемый» следует понимать как обеспечивающий возможность отщепления при поглощении расщепляющего излучения с длиной волны λCL.
В контексте настоящего изобретения должно быть понятно, что каждый вариант осуществления раскрытой здесь оптической схемы может быть конфигурирован на испускание поляризованного возбуждающего излучения и поляризованного расщепляющего излучения. Таким образом, могут быть использованы поляризатор или источники уже поляризованного излучения. Подробности будут описаны позже.
Кроме того, термин «возбуждающее излучение» в контексте настоящего изобретения применим к излучению с длинами волн λEx1, λEx2, λEx3 и λEx4 соответственно.
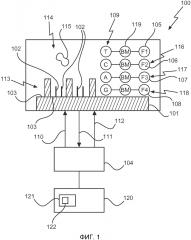
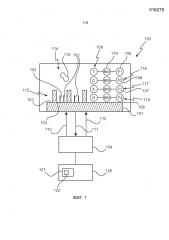
Согласно одному примерному варианту осуществления изобретения, представлено устройство для оптического контроля последовательности ДНК. В частности, устройство конфигурировано для оптического контроля итерационной постадийной реакции для определения последовательности нуклеиновой кислоты путем синтеза. В альтернативном варианте, вместо секвенирования синтезом, следует полагать входящим в область настоящего изобретения также синтез лигированием. Представляемое устройство включает подложку для иммобилизации по меньшей мере одной молекулы на первой поверхности подложки. Кроме того, устройство включает оптическую схему, которая конфигурирована для направления возбуждающего излучения с по меньшей мере первой длиной λEx1 волны возбуждения на подложку для возбуждения флуоресцентной метки первого нуклеотида, который инкорпорирован в молекулу, которая иммобилизована на первой поверхности подложки. Оптическая схема дополнительно конфигурирована для приема и детектирования излучения флуоресценции, испускаемого флуоресцентной меткой первого нуклеотида, который инкорпорирован в иммобилизованную молекулу. Кроме того, оптическая схема конфигурирована для направления расщепляющего излучения с длиной λCL волны расщепляющего излучения, предпочтительно УФ-излучения, на подложку для оптического индуцирования реакции фотохимического расщепления на первом инкорпорированном нуклеотиде для отщепления блокатора и флуоресцентной метки от первого инкорпорированного нуклеотида. Кроме того, подложка конфигурирована для ограничения возбуждающего излучения и конфигурирована для обеспечения тем самым нераспространяющейся волны возбуждающего излучения на первой поверхности подложки. Кроме того, подложка конфигурирована для ограничения расщепляющего излучения, предпочтительно УФ-излучения, и дополнительно конфигурирована для обеспечения тем самым нераспространяющейся волны расщепляющего излучения на первой поверхности подложки.
Здесь предлагается устройство, которое способно объединить достоинства известных устройств для секвенирования. Устройства обеспечивают возможность простого в совокупности считывания, но без необходимости вообще в стадиях промывания или при сокращении их числа, что означает однократную загрузку реагента для всех прочтений.
Другими словами, в настоящем изобретении представлено устройство для секвенирования, которое позволяет проводить секвенирование в единственной текучей среде и в котором не требуются или нужны в меньшем количестве стадии промывания. Необходимый объем реагента, то есть расходы, снижается на величину, равную длине прочтения (50-100). На основе строгого ограничения возбуждающего излучения на подложке, то есть нанофотонной поверхностной структуре типа проволочной сетки, реакция секвенирования может быть считана без промывания поверхности. Для создания нераспространяющейся волны также может быть использовано полное внутреннее отражение.
Постадийное секвенирование достигается применением нуклеотидов с оптически отщепляемыми блокирующими группами. После считывания встроенный нуклеотид деблокируется посредством расщепляющего излучения, например такого как УФ-излучение, через ту же нанофотонную подложку. Этим обеспечивается то, что будут деблокированы только связанные нуклеотиды. Стоимость и скорость секвенирования ДНК строго соотносятся с расходованием реагента. Скорость и сложность оборудования, инструментов и картриджей для секвенирования в большой степени определяются необходимостью в действиях с текучей средой для повторяющихся реакционных стадий и стадий промывания. Оба эти аспекта улучшаются настоящим изобретением, приводя к значительному упрощению и снижению стоимости секвенирования.
Как будет подробно разъяснено в дальнейшем, оптическая схема может быть также конфигурирована для направления возбуждающего излучения с первой, и второй, и третьей, и четвертой длиной λEx1, λEx2, λEx3 и λEx4 волны возбуждения на подложку для возбуждения флуоресцентной метки первого нуклеотида, инкорпорированного в молекулу, иммобилизованную на первой поверхности подложки. Тем самым может быть обеспечено то, что, например, четыре различных нуклеотида, например, таких как аденин (А), и гуанин (G), и тимин (Т), и цитозин (С), можно различить, когда для соответственных нуклеотидов используют специфические и различающиеся флуоресцентные метки. Однако, если желательно, также излучение только одной, или двух, или трех из четырех описанных выше длин λEx1, λEx2, λEx3, и λEx4 волн возбуждения может быть направлено устройством на подложку для возбуждения молекулы, то есть на флуоресцентную метку нуклеотида, который инкорпорирован в иммобилизованную молекулу. Подробности касательно четырех цветовых систем, в которых используются четыре различные флуоресцентные метки для вышеописанных нуклеотидов А, G, С и Т, будут разъяснены далее более подробно с привлечением нижеследующих фиг. 1 и 2. Иммобилизованная молекула могла бы представлять собой фрагмент ДНК и может пониматься как нуклеиновая кислота, последовательность нуклеотидов которой определяется в настоящем изобретении.
Кроме того, квалифицированный специалист в области технологии секвенирования или секвенирования ДНК осведомлен о том факте, что излучение с длинами λEx1, λEx2, λEx3 и λEx4 волн выбирают в комбинации с четырьмя флуоресцентными метками, используемыми, например, для нуклеотидов А, G, С и Т. Другими словами, длины волн выбирают таким образом, что применяемые флуоресцентные метки могут быть оптически возбуждены соответствующим возбуждающим излучением. Кроме того, длину λCL волны выбирают так, чтобы желательная реакция отщепления применяемых нуклеотидов могла быть оптически инициирована путем облучения указанным расщепляющим излучением.
В качестве одного примерного варианта осуществления может быть применена следующая длина волны, хотя квалифицированный специалист в этой области технологии может использовать отличную от конкретно раскрытой длину волны.
Длины волн возбуждения могли бы быть выбраны на основе следующего: оптимальное разнесение длин волн возбуждения в пределах видимой области спектра и в соответствии со спектрами поглощения наиболее часто применяемых красителей, например, FAM, HEX, Cy3, Cy5, Alexa Fluor 700 или Atto700, или подобных. Длины волн возбуждения также могут быть скорректированы сообразно доступности источников излучения, например, таких как твердотельные лазерные источники света с излучением, например, на длинах волн 405, 532, 633 и 780 нм. Однако изобретение не ограничивается указанными длинами волн возбуждения. Максимум эмиссии соответствующего красителя может быть выбран таким образом, чтобы не происходило перекрывание с длиной волны возбуждения соседнего окружения. Кроме того, расщепляющее излучение, предпочтительно УФ-излучение, может быть в диапазоне 250-400 нм, предпочтительно 300-370 нм. Однако изобретение не ограничивается указанными длинами волн возбуждения.
Следует отметить, что молекула, которая иммобилизована на первой поверхности подложки, может представлять собой, например, фрагмент ДНК, ДНК, РНК, мРНК, или еще одну нуклеиновую кислоту. Кроме того, с первой поверхностью подложки может быть связан также фермент, который будет описан здесь позже. В контексте настоящего изобретения термин «связанный» следует понимать как состояние, в котором элемент иммобилизован на первой поверхности подложки.
В дополнение, подложка предусматривает участки, которые могут быть покрыты клонами идентичных молекул, чтобы усилить оптический сигнал, который принимается при детектировании флуоресценции. Поэтому подложка может быть обеспечена как матрица таких участков с соответственно различными клонами, чтобы повысить производительность секвенирования.
Другими словами, представленное выше устройство согласно настоящему изобретению позволяет проводить основанный на сборке процесс оптического секвенирования без стадий промывания, чтобы весь процесс определения последовательности нуклеиновой кислоты мог быть проведен в единственном растворе на подложке. Стадии процесса могут контролироваться оптически. Процесс деблокирования, который в настоящем изобретении следует понимать как активацию, инкорпорированного нуклеотида может быть проведен путем облучения поверхности селективным нераспространяющимся излучением расщепляющего излучения. Такое облучение предпочтительно выполняют с использованием УФ-излучения. Процесс описывается как направление расщепляющего излучения с длиной λCL волны расщепляющего излучения на подложку для оптического инициирования реакции фотохимического расщепления у первого инкорпорированного нуклеотида. Поэтому представляемое устройство конфигурировано для отщепления только флуоресцентной метки от первого инкорпорированного нуклеотида путем облучения подложки нераспространяющейся волной расщепляющего излучения. Таким образом, только инкорпорированные нуклеотиды будут деблокированы, активированы или отщеплены благодаря локализации нераспространяющегося поля расщепляющего излучения. То же самое нераспространяющееся поле облучения используется представляемым устройством для считывания флуоресценции инкорпорированных оснований или нуклеотидов относительно фона флуоресцентных меток в растворе. Локализация оптического поля возбуждающего излучения, которое включает по меньшей мере первую длину λEx1 волны возбуждения, достигается нераспространяющимся полем указанного возбуждающего излучения.
Например, нераспространяющаяся волна расщепляющего излучения и нераспространяющаяся волна возбуждающего излучения могут быть генерированы подложкой представляемого устройства, оснащенного проволочной сеткой. Это может позволить использование фокусированного луча с высокой интенсивностью так, чтобы фотооптическая реакция проходила с высокой скоростью на весьма ограниченной площади очень близко к поверхности. Оптическая схема может включать соответствующие оптические элементы для возбуждения и детектирования флуоресценции, то есть считывания, и соответствующие оптические элементы для деблокирования, то есть активации, в едином блоке оптического устройства, или также может быть включена в физически различающиеся элементы.
Кроме того, в оптической схеме может быть предусмотрен соответствующий источник возбуждающего излучения. Кроме того, в конфигурацию оптической схемы может входить источник излучения для эмиссии расщепляющего излучения. Облучение для расщепления, то есть деблокирования и считывания, то есть возбуждения и детектирования флуоресценции, необязательно может проходить через одни и те же линзы. Однако, если желательно, могут быть предусмотрены также две различные оптические системы для деблокирования и считывания.
Поле нераспространяющейся волны, используемое в настоящем изобретении, экспоненциально затухает по мере удаления от первой поверхности с длиной затухания, зависящей от комплексного показателя преломления материала, например металла, проволочной сетки, и комплексного показателя преломления среды между проволоками, при условии, что величина просвета (апертура) между металлическими проволоками является меньшей, чем оптическое разрешение при данной длине волны. Например, апертура может составлять 70 нм, что является гораздо ниже, чем предельная также для УФ-излучения. Длина затухания оценивается как 16,8 нм (см. ниже), которая означает, что поле сокращается до 1/е интенсивности облучения на этом расстоянии от поверхности раздела между металлической проволокой и подложкой. Оно могло бы слегка отличаться от первой поверхности вследствие подтравливания первой поверхности между проволоками.
Другими словами, представляемое устройство создает поверхность селективного облучения расщепляющим излучением и поверхность облучения возбуждающим излучением. Подложка может быть конфигурирована как нанофотонная поверхностная структура таким образом, что генерируются описанные выше оптические ограничения возбуждающего излучения и расщепляющего излучения и дополнительно нераспространяющиеся волны расщепляющего излучения и возбуждающего излучения. Помимо прочего, комбинация возбуждающего излучения, то есть считывающей оптики, и расщепляющего излучения позволяет проводить итерационную постадийную реакцию для определения последовательности нуклеиновой кислоты путем синтеза. Это дает то преимущество, что могут быть исключены стадии промывания. Таким образом, описанные выше стадии и циклы, которые выполняются с помощью представляемого устройства, могут быть повторены многократно для обеспечения постадийной инкорпорации одного или более дополнительных нуклеотидов в иммобилизованную молекулу, и после этого считывание того, был ли указанный нуклеотид инкорпорирован или нет, как было описано выше.
Кроме того, устройство может быть конфигурировано для получения данных, которые описывают различия нуклеиновых кислот, которые были инкорпорированы в иммобилизованную молекулу, основываясь на постадийном оптическом воздействии, которое оптически контролируется устройством.
Кроме того, подложка может быть выполнена из полимера, например полициклоолефина, поликарбоната, сложного полиэфира или РММА (полиметилметакрилата). Могут быть также применены металл и полупроводники.
Согласно еще одному примерному варианту осуществления изобретения, устройство дополнительно включает молекулу, которая иммобилизована на первой поверхности подложки. Кроме того, устройство включает раствор с многочисленными нуклеотидами и ферментом. Нуклеотиды в нем соответственно включают блокатор. Блокатор конфигурирован для блокирования синтетической активности фермента, когда соответствующий фрагмент инкорпорирован в молекулу, иммобилизованную на первой поверхности устройства.
Если желательно, блокатор включает флуоресцентную метку. Однако блокатор и флуоресцентная метка могут быть инкорпорированы или позиционированы на первом нуклеотиде в различных положениях. Они могут быть отщеплены в одном едином процессе расщепления или в различных процессах расщепления. Это справедливо для каждого варианта осуществления настоящего изобретения.
Представляемый здесь вариант осуществления обеспечивает то преимущество, что реакция инкорпорирования останавливается сама по себе вследствие присутствия блокатора. Например, для блокирования синтетической активности фермента может быть использован блокатор, действующий на основе стерического затруднения. Это позволяет проводить локальное считывание реакции, которая протекает на многих участках одновременно. В прототипе действие применяемых ферментов в образце в устройстве не может быть синхронизировано. Однако настоящее изобретение обеспечивает возможность инкорпорации нуклеотидов, которая преимущественно может быть выполнена шаг за шагом вместе со считыванием после каждой стадии. Преимущество достигается применением вышеописанных блокаторов, которые могут представлять собой блокированные нуклеотиды, которые блокируют активность фермента после того, как нуклеотид был инкорпорирован. Для продолжения инкорпорации следующего нуклеотида требуется активное деблокирование, которое настоящее изобретение обеспечивает с помощью оптической схемы, которая конфигурирована для направления расщепляющего излучения для отщепления блокатора. Блокатор может включать флуоресцентную метку.
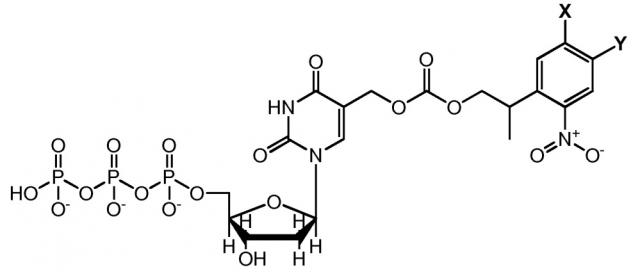
В качестве примерных вариантов осуществления блокаторы могут быть выполнены как 3'-блокированный обратимый терминатор или как 3'-неблокированный обратимый терминатор, как описано и определено в статье автора Michael L. Metzker «Sequencing technologies, the next generation» («Технологии секвенирования, новое поколение») в издании Nature Review Genetics, том 11 (2010), стр. 31-46. В ней, также называемые «неблокированными», указанные блокаторы, такие как 3'-неблокированный обратимый терминатор, могут быть использованы как блокирующие активность фермента. Обратимые терминаторы можно понимать как лиганды, присоединенные к нуклеотид/рибозному фрагменту, которые останавливают инкорпорацию любого последующего нуклеотида после инкорпорации. Они являются обратимыми, когда при отщеплении химическим или фотохимическим путем этот процесс может быть незавершенным, и полимераза может встраивать следующий нуклеотид. Кроме того, 3'-блокированный обратимый терминатор, согласно авторам Metzker и др., может быть изменен, например, химически, чтобы сделать его пригодным к фотоотщеплению. Тогда фотоотщепление действием расщепляющего излучения может быть выполнено с помощью настоящего изобретения. В дополнение, в качестве блокаторов могут быть применены другие комплексы в комбинации с соответствующим ферментом, как будет описано позже. Квалифицированный специалист знает, какая комбинация фермента и блокатора приводит к желательному эффекту блокирования синтетической активности фермента.
Применяемая здесь терминология относительно указанных блокаторов согласуется с содержанием указанной статьи и приспособлена к ней. Указанный второй класс соединений дает дополнительное преимущество, так как представляет ситуацию с неблокированным 3'-положением рибозного фрагмента, и инкорпорация следующего нуклеотида предотвращается объемистой группой, которая также содержит флуоресцентную метку, присоединенную к фрагменту пары оснований в 5'-положении рибозного фрагмента. Вывод об этом также может быть сделан из следующей фиг. 6 и ее описания. Удлинение нуклеотидного олигомера предотвращается, пока эта группа присоединена. Однако инкорпорация следующего нуклеотида становится возможной после удаления объемистой группы. Настоящее изобретение обеспечивает такое удаление инициированием реакции фотохимического отщепления. Более благоприятно то, что в настоящем изобретении такая реакция отщепления используется только очень близко к поверхности, на которой иммобилизована молекула, благодаря тому обстоятельству, что генерируется нераспространяющаяся волна расщепляющего излучения.
В дополнение к нижеследующему описанию, должны приниматься во внимание подробности фиг. 6, 8 и 10, на которых представлены блокаторы с включенной флуоресцентной меткой.
Согласно еще одному примерному варианту осуществления настоящего изобретения, блокатор представляет собой фотоотщепляемый 3'-неблокированный обратимый терминатор.
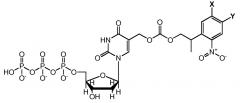
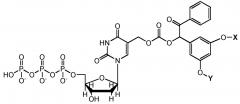
Согласно еще одному примерному варианту осуществления, блокатор выбирают из группы, состоящей из нитрофенилэтильных производных аналогов 5-метил-(2-(2-нитрофенил)пропил)карбоната-dUTP, аналога 5-метил-(2-оксо-1,2-дифенилэтил)карбоната-dUTP и любых их комбинаций.
Согласно еще одному примерному варианту осуществления, подложка конфигурирована как проволочная сетка для возбуждающего излучения и для расщепляющего излучения.
Проволочная сетка может включать структуру из металлических проволок, например, на стеклянной подложке. Промежуток между проволоками действует как плакированный пластинчатый волновод, в котором главную роль играют два основополагающих принципа. Например, для поперечной электрической (TE) волны поляризованного возбуждающего излучения, падающего на проволоки подложки согласно настоящему изобретению, создаваемой модой между проволоками, является мода нераспространяющейся волны, имеющей, например, длину затухания 16,8 нм для λ=630 нанометров. При этом предполагается, что проволоки подложки заполнены средой, имеющей показатель преломления воды, n=1,33. Для поперечной магнитной (TM) волны поляризованного излучения создаваемая мода для проволочной сетки называется модой распространяющейся волны, имеющей длину затухания 1,2 мкм в этом примере. Например, в одном примере высота проволоки может составлять 60 нанометров. В этом случае TM-поляризованная мода пропускается с потерей излучения порядка 10% или менее, тогда как ТЕ-поляризованная мода скоротечно затухает.
Иной путь к пониманию проволочной сетки состоит в представлении, например, алюминиевых проволок в качестве металла, который отражает возбуждающее излучение с поляризацией параллельно проволокам (ТЕ-поляризация) и который пропускает поляризацию ортогонально проволокам (TM-поляризация). Максимальное пропускание TM-поляризованного излучения может быть выше 95%. Нераспространяющееся поле в случае падающего возбуждающего ТЕ-излучения изображено на обеих фиг. 3а и 3b. Возбуждающее излучение и расщепляющее излучение, испускаемые оптической схемой согласно настоящему изобретению, могут иметь такую картину поляризации в этом и каждом другом варианте осуществления настоящего изобретения.
Квалифицированный специалист в этой области техники сделает из представленного выше описания однозначный вывод, что геометрические параметры применяемой проволочной сетки должны быть приспособлены к возбуждающему излучению и к расщепляющему излучению, которые испускаются оптической схемой. Например, такое условие, что апертура проволочной сетки между проволоками должна быть меньше оптического разрешения данной длины волны, то есть апертура << оптическое разрешение ~λ/2 NA (числовой апертуры). В контексте нижеследующих фигур апертуры обозначены щелевидными проемами.
Применение подложки с проволочной сеткой в представляемом устройстве обеспечивает предельное оптическое ограничение. Указанные преимущества реализуются в комбинации с быстрым фотохимическим расщеплением, которое используют для отъединения так называемого блокатора на нуклеотиде, чтобы предотвратить продолжение инкорпорации следующего нуклеотида. Применение проволочной сетки имеет дополнительное преимущество в высокой независимости от угла падения. Поэтому она может быть применена в сочетании с фокусированными пучками для достижения высокой локальной интенсивности, в то же время удерживая остальные части без освещения. Другими словами, проволочная сетка позволяет возбуждать и делать чувствительными только те молекулы, например фрагменты ДНК, которые находятся очень близко к поверхности в поле нераспространяющейся волны, и тем самым не детектировать или не воздействовать на любой меченый нуклеотид вне поля нераспространяющейся волны. Например, поле нераспространяющейся волны может быть протяженным на примерно 20 нанометров от первой поверхности подложки. Это может быть действительным как для возбуждающего излучения, так и для расщепляющего излучения.
Подложка из проволочной сетки включает вторую поверхность, противоположную первой поверхности, и оптическая схема конфигурирована для облучения второй поверхности подложки возбуждающим излучением и расщепляющим излучением. Другими словами, подложки в оптической схеме позиционированы относительно друг друга таким образом, что расщепляющее излучение и возбуждающее излучение направляются непосредственно на вторую поверхность подложки. Это можно рассматривать как облучение подложки сзади. На передней поверхности, первой поверхности, регулярная проволочная структура представлена проволочной сеткой. Между регулярной металлической проволокой, то есть в промежутках между проволоками сетки, находится связанная, или иммобилизованная, молекула, например фрагмент ДНК.
Термин «возбуждающее излучение» в контексте настоящего изобретения имеет отношение к излучению с длинами λEx1, λEx2, λEx3 и λEx4 соответственно. Следовательно, для всех четырех длин волн возбуждения подложка обеспечивает то, что достигаются такое ограничение и создание нераспространяющейся волны соответствующего излучения. Если желательно, большее или меньшее число источников излучения и/или флуоресцентных меток могут быть применены без выхода за пределы настоящего изобретения.
Согласно еще одному примерному варианту осуществления изобретения, реакция расщепления имеет продолжительность tcleavage, которая зависит от интенсивности облучения расщепляющим излучением. Кроме того, инкорпорация второго нуклеотида в иммобилизованную молекулу занимает время tincorporation. Представляемое здесь устройство включает оптическую схему, которая конфигурирована и настроена для создания облучения расщепляющим излучением с такой интенсивностью, что tcleavage<tincorporation.
Фоторасщепление должно происходить только в тех молекулах, которые уже инкорпорированы и иммобилизованы на поверхности. Реакция в массе приводила бы к деблокированным реагентам, которые могли бы встраиваться без видимого проявления и тем самым обусловливать ошибки в результатах секвенирования. Поэтому важно проводить облучение только локально в течение короткого периода времени, чтобы сделать реакцию расщепления быстрой по сравнению со скоростью инкорпорации нуклеотидов ферментом. Принципы действия фермента и блокатора уже были описаны выше. Настоящее изобретение применимо в пределах описываемого здесь примерного варианта осуществления. Представляемые варианты осуществления позволяют синхронизировать инкорпорацию следующих нуклеотидов и обеспечивают то, что детектированный сигнал флуоресценции является высоконадежным.
Тот факт, что расщепляющее излучение находится в нераспространяющейся моде относительно подложки, обеспечивает то преимущество, что повторяющееся экспонирование не ведет к появлению в растворе флуоресцентных меток, которые обесцвечены и которые утрачивают свою функцию. Другими словами, представляемый вариант осуществления предотвращает такое обесцвечивание и утрату функциональности флуоресцентных меток в растворе.
Для улучшенной синхронизации инкорпорации нескольких нуклеотидов на нескольких иммобилизованных молекулах стадия деблокирования расщепляющим излучением должна проводиться настолько быстро, насколько возможно, то есть при самой высокой возможной интенсивности расщепляющего излучения. Это может быть достигнуто фокусированием расщепляющего излучения, предпочтительно УФ-излучения, с помощью линзы и сканированием поверхности путем перемещения линзы или подложки. Стадия деблокирования может быть проведена после прочтения стадии секвенирования. Это прочтение может быть проведено сканированием фокусированным пучком или пошаговым сканированием с облучением поля. Также может быть возможным применение расщепляющего излучения в виде однократной вспышки, например УФ-излучения, на всей поверхности в целом. Принимая во внимание скорость реакции инкорпорации основания для реакции секвенирования, продолжительность локального облучения расщепляющим излучением должна составлять, например, менее 1 минуты.
Согласно еще одному примерному варианту осуществления, подложка включает несколько смежных положений связывания для иммобилизации молекул на первой поверхности вдоль первого направления. Кроме того, устройство конфигурировано для выполнения оптического сканирования путем перемещения подложки и оптической схемы относительно друг друга вдоль первого направления. Кроме того, устройство конфигурировано для выполнения оптического сканирования таким образом, что каждое положение связывания сначала облучается возбуждающим излучением по меньшей мере с первой длиной λEx1 волны, и впоследствии, во-вторых, облучается расщепляющим излучением с длиной λCL волны расщепляющего излучения при перемещении вдоль первого направления.
Другими словами, представлено сочетание расщепляющего излучения и возбуждающего излучения, которое обеспечивает дополнительное преимущество в одновременном считывании флуоресцентных сигналов и использовании реакции расщепления, так что могут быть инкорпорированы следующие нуклеотиды. Это делается в режиме сканирования, который может обеспечивать высокую локальную интенсивность применяемого электромагнитного излучения без необходимости в высокомощном источнике излучения. В этой конфигурации могут быть применены сфокусированные световые пучки расщепляющего излучения и возбуждающего излучения. В этом случае стадия деблокирования может быть проведена после считывания стадии секвенирования. В одном предпочтительном варианте осуществления сканирование для прочтения может сочетаться с деблокирующим сканированием объединением обоих световых пучков в едином исполнительном механизме. Кроме того, если желательно, даже могла бы быть применена единственная линза для согласования двух световых пучков. В альтернативном варианте, могут быть объединены две линзы в одной стадии или же две отдельные стадии могут действовать синхронно. Это может быть реализовано в подходе с пошаговым сканированием для прочтения, в котором стадия расщепления также проводится в режиме пошагового сканирования путем облучения того же участка, как источником возбуждающего излучения.
Если желательно, представляемое устройство конфигурировано для выполнения такого оптического сканирования в одном непрерывном перемещении вдоль подложки. При этом допускается повторяющееся непрерывное сканирование. Таким образом, устройство конфигурировано, во-первых, для считывания того, инкорпорирован ли первый нуклеотид в молекулу, например фрагмент ДНК, или нет, и, во-вторых, конфигурировано для инициирования реакции фотохимического расщепления на ранее считанном нуклеотиде в случае, если он инкорпорирован в молекулу.
Согласно еще одному примерному варианту осуществления изобретения, п