Способ мониторинга эффективности противоопухолевой терапии немелкоклеточного рака легкого
Иллюстрации
Показать всеИзобретение относится к области медицины, конкретно к онкологии, и касается способов мониторинга эффективности противоопухолевого лечения немелкоклеточного рака легкого. Способ включает определение уровней экспрессии микроРНК-маркеров в периферической крови больного после хирургического лечения, причем определяют уровни микроРНК-19б, микроРНК-125б и сочетания микроРНК-125б/микроРНК-19б через 2 недели, 3 и 6 месяцев, 1 и 2 года после проведенного лечения. При получении линейной модели динамики изменения уровней экспрессии микроРНК, характеризующейся постепенным увеличением микроРНК-19б, снижением микроРНК-125б и сочетания микроРНК-125б/микроРНК-19б относительно исходных значений, определяют прогрессирование заболевания, а при получении квадратичной модели динамики изменения уровней экспрессии микроРНК, характеризующейся чередованием увеличения или снижения уровней экспрессии исследуемых микроРНК на снижение либо увеличение аналогичных показателей относительно исходных значений, определяют ремиссию заболевания. Изобретение обеспечивает повышение точности ранней диагностики прогрессирования немелкоклеточного рака легкого за счет проведения регулярного сравнительного анализа целевых профилей экспрессии микроРНК на этапах динамического наблюдения. 3 табл., 2 пр.
Реферат
Изобретение относится к области медицины, конкретно к онкологии, и касается способов мониторинга эффективности противоопухолевой терапии немелкоклеточного рака легкого.
Рак легкого в России до настоящего времени занимает лидирующие позиции в структуре онкологической заболеваемости и смертности [1]. В 75-80% выявляется немелкоклеточный рак легкого (НМРЛ), при этом в большинстве случаев на момент постановки диагноза больные имеют распространенные стадии опухолевого процесса, при которых результаты лечения остаются неудовлетворительными. Анализ неудач хирургического лечения показал, что наиболее частой причиной смерти оперированных больных являются гематогенные метастазы (60-70%) и локо-регионарные рецидивы (30-40%). В связи с этим в последние годы активно разрабатываются методы комбинированного лечения НМРЛ и диагностические подходы по раннему выявлению признаков прогрессирования заболевания.
Помимо проведения стандартных клинико-инструментальных исследований существенную помощь в мониторинге эффективности проводимого противоопухолевого лечения оказывают данные об изменении содержания в крови молекулярно-генетических маркеров, информативность которых к настоящему времени изучена при многих злокачественных новообразованиях, в том числе и при раке легкого [2].
С указанных позиций в последние годы активно проводятся исследования микроРНК, которые являются одними из ключевых участников патогенеза онкологических заболеваний и представляют собой класс коротких некодирующих РНК, играющих важную роль в регуляции многих биологических процессов, таких как клеточный цикл, рост клеток, миграция, апоптоз, дифференцировка и реакция на стресс. Показано, что изменение профиля экспрессии микроРНК обнаружено при развитии практически всех злокачественных опухолей, причем miPHK могут выступать как в роли онкогенов (увеличение их уровня), так и опухолевых супрессоров (снижение их уровня) [3].
В настоящее время известно большое количество микроРНК-маркеров, ассоциированных с раком легкого. Так, по данным Chen X. с соавт. [4] была создана диагностическая модель, включающая 10 микроРНК-маркеров, которая позволяет с высокой чувствительностью (93%) и специфичностью (90%) дифференцировать больных раком легкого от здоровых лиц.
В исследованиях последних лет доказано, что изменения уровня и состава циркулирующих нуклеиновых кислот (ДНК, микроРНК) связано с развитием рака легкого, прогрессией заболевания и выживаемостью [5, 6]. Показано, что повышение уровня онкомаркера (в частности, метилированных последовательностей в составе циркулирующих ДНК крови) на несколько месяцев опережает клинические симптомы и возможности инструментальных методов подтверждения рецидива заболевания [7]. Однако, несмотря на растущее число исследований, посвященных циркулирующим микроРНК, до сих пор нет единого мнения о том, панель каких микроРНК может быть использована для клинической диагностики и мониторинга рака легкого.
Наиболее близким к предлагаемому способу мониторинга противоопухолевого лечения немелкоклеточного рака легкого является способ, выбранный за прототип [8], включающий проведение сравнительного исследования профилей экспрессии микроРНК у больных раком легкого до лечения и через 7-10 дней после хирургического лечения. В процессе работы авторы определяли уровни 90 микроРНК в плазме крови с использованием коммерчески доступного анализа, основанного на ОТ-ПЦР (miRCURY LNA, "Exiqon", Дания). Было показано, что уровни пяти микроРНК: 205, 19а, 19b, 30b и 20а - существенно снижались после оперативного вмешательства и свидетельствовали о ремиссии заболевания. Однако для мониторинга указанный способ имеет ряд недостатков: 1) область применения его ограничена - с помощью известного способа можно проводить мониторинг эффективности лечения только у больных с локализованными формами плоскоклеточного рака легкого, нет данных по больным с аденокарциномой и при наличии местнораспространенных форм НМРЛ;
2) использование двух контрольных точек (до и после операции) дает возможность мониторировать изменение уровня микроРНК непосредственно после хирургического удаления опухоли, но не позволяет осуществлять регулярную и своевременную диагностику на протяжении первых 24-х месяцев наблюдения, которые являются самыми критичными с позиций риска развития прогрессирования заболевания;
3) исследование профиля экспрессии микроРНК с использованием данного коммерческого анализа позволяет проводить определение уровня экспрессии одновременно нескольких микроРНК (90 мишеней), но требует большого количества исходного генетического материала (до 500 нг РНК);
4) высокая стоимость проведения подобного исследования (20000-25000 руб.);
5) трудоемкость данного способа для анализа экспрессии микроРНК.
Новый технический результат - повышение точности ранней диагностики прогрессирования немелкоклеточного рака легкого за счет проведения регулярного сравнительного анализа целевых профилей экспрессии микроРНК на этапах динамического наблюдения.
Для достижения нового технического результата в способе мониторинга эффективности противоопухолевой терапии немелкоклеточного рака легкого, включающем определение уровней экспрессии микроРНК-маркеров в периферической крови больного после хирургического лечения, определяют уровни микроРНК-19б, микроРНК-125б и сочетания микроРНК-125б/микроРНК-19б через 2 недели, 3 и 6 месяцев, 1 и 2 года после проведенного лечения и при получении линейной модели динамики изменения уровней экспрессии микроРНК, характеризующейся постепенным увеличением микроРНК-19б, снижением микроРНК-125б и сочетания микроРНК-125б/микроРНК-19б относительно исходных значений, определяют прогрессирование заболевания, а при получении квадратичной модели динамики изменения уровней экспрессии микроРНК, характеризующейся чередованием увеличения или снижения уровней экспрессии исследуемых микроРНК на снижение, либо увеличение аналогичных показателей относительно исходных значений, определяют ремиссию заболевания.
Изобретение соответствует критерию "новизна", так как для мониторинга НМРЛ ранее не использовались микроРНК-196, микроРНК-125б и сочетание микроРНК-125б/микроРНК-19б в указанной схеме и последовательности.
Изобретение соответствует критерию "изобретательский уровень", так как оно явным образом не следует для специалиста из уровня техники.
Изобретение соответствует критерию "промышленно применимо", так как оно может использоваться в клинической практике для мониторинга НМРЛ.
Способ осуществляют следующим образом: Больным НМРЛ проводят хирургическое или комбинированное лечение, включающее предоперационную химиолучевую терапию и радикальную операцию. В контрольные точки: через 2 недели, 3 и 6 месяцев, 1 и 2 года после оперативного вмешательства - проводят клинико-инструментальное обследование и исследуют профили экспрессии микроРНК. Методика определения молекулярно-генетических маркеров включает 2 этапа:
1) Получение плазмы крови и выделение микроРНК. Образцы венозной крови стабилизируют и фракционируют на плазму и клетки крови в течение 4 часов с момента ее забора. Образцы центрифугируют 20 мин при 400×g, затем переносят плазму в отдельные пробирки и центрифугируют повторно 20 мин при 1200×g. Полученный супернатант аликвотируют и хранят при t -80°С. Непосредственно перед проведением молекулярно-генетического анализа замороженные образцы плазмы крови размораживают и центрифугируют 5 мин при 3000×g для удаления криопреципитата. Полученный супернатант используют для выделения микроРНК. МикроРНК выделяют с помощью метода, основанного на фенол-хлороформной экстракции [9]. Плазму крови инкубируют с однофазным экстракционным раствором. Тотальную микроРНК очищают на стекловолокнистых фильтрах (BioSilica Ltd, г.Новосибирск, Россия), затем проводят переосаждение РНК с использованием гликогена и растворение в воде (без РНК-аз).
2) Реакция обратной транскрипции и количественная ПЦР в режиме реального времени. Реакцию обратной транскрипции проводят по методике, описанной ранее [10]. Каждую реакцию проводят в конечном объеме 10 мкл, содержащем 3 мкл РНК, 50 нМ специфического праймера для каждой микроРНК, 1 U ингибитора RiboLockRNAse (Fermentas, Vilnius, Lithuania), 100 U MMLV обратной транскриптазы (Fermentas, Vilnius, Lithuania), 1×MMLV буфер и 250 мкМ dNTP. Условия реакции были следующими: 16°С - 30 мин, 42°С - 30 мин, 70°С - 10 мин. Далее полученную кДНК используют для постановки количественной TaqMan ПЦР. Амплификацию осуществляют в приборе iCycler iQ5 Real-Time PCR Detection System (Bio-Rad, USA). Анализ проводят в дублях и в качестве стандарта оценивают уровень экспрессии микроРНК-16. Каждую реакцию ставят в общем объеме 30 мкл, содержащем компоненты: 2,5 мкл продукта реакции обратной транскрипции, 1,25 U Taq ДНК полимеразы (BiolabMix, Россия), 1×ПЦР-буфер, 4 мМ MgCl2, 250 мкМ dNTP, 600 нМ прямой праймер, 800 нМ универсальный обратный праймер и 300 нМ специфической TaqMan пробы (табл.1). Амплификацию проводят в течение 50 циклов в следующем режиме: 95°С - 15 сек, 60°С - 60 сек. Специфические праймеры и олигонуклеотидные пробы для реакции обратной транскрипции и количественной ПЦР в режиме реального времени синтезируют в лаборатории медицинской химии (ИХБФМ СО РАН, г. Новосибирск).
Уровень экспрессии микроРНК рассчитывают по методу dCt. В качестве внутреннего стандарта используют микроРНК-16, уровень экспрессии которой относительно стабилен. В связи с этим микроРНК-16 выступает в качестве подходящего рефери при анализе профиля микроРНК в плазме/сыворотке [11]. Таблица 1. Последовательности праймеров и проб, использованных для ПЦР в реальном времени
Обоснование способа: Разработка методов, пригодных для выявления НМРЛ на доклинической или ранней стадии по анализу маркеров в крови и других биологических жидкостях, представляет собой важнейшее направление в современной онкологии. С указанных позиций наиболее перспективными кандидатами для мониторинга НМРЛ являются молекулярно-генетические маркеры на основе циркулирующих в крови внеклеточных нуклеиновых кислот, представленных ДНК, РНК и микроРНК.
В последние годы выявлено большое количество циркулирующих микроРНК, ассоциированных с раком легкого [6]. Важно, что по изменению уровня экспрессии микроРНК можно на несколько месяцев раньше выявить развитие или прогрессирование НМРЛ, чем при проведении клинико-инструментальных исследований. В связи с этим в мировой науке стремительно увеличивается количество исследований по циркулирующим микроРНК, которые проводятся с целью ранней диагностики рака легкого, определения прогноза, оценки эффективности лечения и выживаемости [8, 12, 13]. Необходимо отметить, что менее всего освещены вопросы мониторинга НМРЛ. Так, в доступной литературе отсутствует четкое мнение о том, какие микроРНК необходимо исследовать и в какие временные интервалы. Это может быть обусловлено рядом причин как технического, так и общего характера, а именно: отсутствие универсальных эффективных протоколов подготовки образцов, выделения и анализа микроРНК, разные способы нормировки данных, не всегда корректно формируются группы больных (ввиду недоучета патогенетически значимых признаков) и др.
Отбор микроРНК для использования их в качестве маркеров в предлагаемом способе осуществлялся по следующим критериям: а) доказано их присутствие в плазме крови; б) уровень экспрессии этих микроРНК значимо отличается (увеличение уровня) у больных раком легкого по сравнению со здоровыми донорами [14, 15]. Так, были выбраны следующие микроРНК-мишени:
1) микроРНК-19b – опухоль, ассоциированная микроРНК, усиливает пролиферацию и ангиогенез посредством ТР53, BCL2, PTEN и Prkaa-1 (согласно базе данных miRTarBase - http://mirtarbase.mbc.nctu.edu.tw).
2) микроРНК-125b – опухоль, ассоциированная микроРНК, принимает участие в регуляции клеточного цикла и апоптоза через р53, ВАК и erbВ2-3 (согласно базе данных miRTarBase - http://mirtarbase.mbc.nctu.edu.tw).
3) сочетание микроРНК-125б/микроРНК-19б.
Анализ изменения уровня экспрессии вышеуказанных микроРНК в крови больных НМРЛ на этапах динамического наблюдения - через 2 недели, 3 и 6 месяцев, 1 и 2 года после хирургического лечения позволяет точно и своевременно диагностировать рецидив заболевания на ранней (субклинической) стадии, когда опухоль еще не визуализируется при проведении стандартного инструментального обследования и не имеет клинических проявлений. При выявлении маркерного рецидива НМРЛ больным показано углубленное клинико-инструментальное обследование, на основании которого вырабатывается стратегия дальнейшего противоопухолевого лечения.
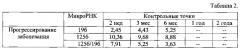
Клинический пример 1: Больной С., 62 года, под наблюдением в Томском НИИ онкологии с 10.03.2009 г. При обследовании установлен диагноз: Центральный рак н/долевого бронха слева с переходом на междолевую шпору и главный бронх. Ст. III, T3N1M0. Гистология - Плоскоклеточный неороговевающий рак низкой степени дифференцировки. В плане комбинированного лечения проведено 2 курса химиотерапии по схеме паклитаксел/карбоплатин с эффектом - стабилизация опухолевого процесса. 15.07.2009 г.выполнена операция - Комбинированная пневмонэктомия слева с резекцией перикарда и левого предсердия. В послеоперационном периоде в запланированные контрольные точки согласно предлагаемому способу проводили забор крови на молекулярно-генетические исследования (табл. 2) параллельно с клинико-инструментальным обследованием. Через 6 месяцев после операции выявлена линейная зависимость в нарастании уровня экспрессии микроРНК-19b и снижении уровня экспрессии уровня микроРНК-125b и сочетания микроРНК-125б/микроРНК-19б. Состояние больного было удовлетворительное, жалоб не предъявлял, объективный статус - без отрицательной динамики. При проведении комплексного инструментального обследования - признаков прогрессирования заболевания выявлено не было. По прошествии 3-х месяцев у больного появились боли в груди справа и сухой кашель, отмечалась потеря веса. Проведено инструментальное обследование, по результатам которого диагностирован отдаленный метастаз в нижнюю долю правого легкого. В связи с этим больной получал паллиативную химиолучевую терапию, однако через 6 месяцев умер от прогрессирования основного заболевания.
Клинический пример 2:
Больной Т., 57 лет, под наблюдением в Томском НИИ онкологии с 16.06.2009 г. При обследовании установлен диагноз: Центральный рак н/долевого бронха справа с переходом на промежуточный и с/долевой бронх. Ст.III, T3N2M0. Гистология №17225-41/09 от 24.09.09 – Умеренно дифференцированный неороговевающий плоскоклеточный рак с метастазами в 4 бифуркационных лимфоузла. В рамках комбинированного лечения проведено 2 курса химиотерапии по схеме паклитаксел/карбоплатин с эффектом - частичная регрессия опухолевого процесса. 17.09.2009 г. выполнена операция - Пневмонэктомия справа с интраоперационной лучевой терапией в дозе 15 Гр на фоне радиосенсибилизации гемзаром. В послеоперационном периоде согласно предлагаемому способу проводили забор крови на молекулярно-генетические исследования (табл. 3) параллельно с клинико-инструментальным обследованием. Динамика изменений уровня экспрессии микроРНК была представлена квадратичной моделью (увеличение/снижение уровня экспрессии микроРНК чередовалось со снижением/увеличением показателя относительно исходных значений). По результатам комплексного клинико-инструментального обследования, проводимого на протяжении 2-х лет, признаков прогрессирования НМРЛ выявлено не было.
Данным способом мониторинг эффективности противоопухолевого лечения НМРЛ после хирургического лечения проведен у 4 больных в возрасте 57-62 года. В 3 случаях больные - мужчины, в 1 случае - женщина. Распространенность опухолевого процесса соответствовала III стадии. По гистологическому типу преобладал плоскоклеточный рак (3 случая) над аденокарциномой (1 случай). Хирургическое лечение проведено у всех больных в радикальном объеме - выполнено 3 пульмонэктомии и 1 лобэктомия. При динамическом наблюдении из 4-х больных прогрессирование НМРЛ выявлено у 2-х больных: в обоих случаях на 6 месяце зафиксирован маркерный рецидив - динамика изменений уровней экспрессии микроРНК была представлена линейной моделью (постепенное увеличение микроРНК-19б, снижение микроРНК-125б и сочетания микроРНК-19б-микроРНК-125б относительно исходных значений), при этом по данным инструментального обследования рецидив заболевания зафиксирован только через 9 месяцев после операции. В случае ремиссии НМРЛ после проведенного лечения у 2-х больных динамика изменений уровней экспрессии микроРНК была представлена квадратичной моделью (увеличение или снижение уровней экспрессии микроРНК чередовались со снижением либо увеличением аналогичных показателей относительно исходных значений).
На основании проведенного исследования было показано, что при прогрессировании заболевания динамика изменений уровня экспрессии микроРНК в плазме крови больного позволяет на 3 месяца раньше диагностировать рецидив НМРЛ, чем клинико-инструментальные методы обследования, в результате чего анализ уровня экспрессии микроРНК-19б, микроРНК-125б и их сочетания может эффективно применяться для мониторинга рака легких.
Таким образом, предлагаемый способ мониторинга основан на экспериментальных и клинических исследованиях. Как показали клинические исследования, использование данного способа мониторинга позволяет достичь нового технического результата, а именно повысить точность ранней диагностики прогрессирования немелкоклеточного рака легкого за счет проведения регулярного сравнительного анализа целевых профилей экспрессии микроРНК на этапах динамического наблюдения.
Источники информации
1. Злокачественные новообразования в России в 2011 году (заболеваемость и смертность) / Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России. - 2013. - 289 с.
2. Пономарева А.А., Рыкова Е.Ю., Чердынцева Н.В. и др. Сравнительный анализ эпигенетических и белковых маркеров в крови больных немелкоклеточным раком легкого // Сибирский онкологический журнал. - 2011. - №5 (47). - С. 40-45.
3. Yuxia М., Zhennan Т., Wei Z. Circulating miR-125b is a novel biomarker for screening non-small cell lung cancer and predicts poor prognosis // J. Cancer Res. Clin. Oncol. - 2012. - Vol.38. - P. 2045-2050.
4. Chen X., Hu Z., Wang W. et al. Identification of ten serum microRNAs from a genome-wide serum microRNA expression profile as novel noninvasive biomarkers for non small cell lung cancer diagnosis // Int. J. Cancer. - 2012. - Vol.130. - P. 1620-1628.
5. Vlassov V.V., Laktionov P.P., Rykova E.Y. Circulating nucleic acids as a potential source for cancer biomarkers // Curr. Mol. Med. - 2010. - Vol.10. - P. 142-165.
6. Власов B.B., Рыкова Е.Ю., Пономарева A.A. и др. Циркулирующие микроРНК крови при раке легкого: перспективы использования для диагностики, прогноза и оценки эффективности терапии // Молекулярная биология. - 2015. - Т. 49. - №1. - С. 55-66.
7. Ponomaryova A., Rykova Е., Cherdyntseva N. et al. Potentialities of aberrantly methylated circulating DNA for diagnostics and post-treatment follow-up of lung cancer patients // Lung Cancer. - 2013. - Vol.81. - P. 397-403.
8. Aushev V.N., Zborovskaya I.B., Laktionov K.K. et al. Comparisons of microRNA patterns in plasma before and after tumor removal reveal new biomarkers of lung squamous cell carcinoma // PLoS One. - 2013. - Vol.8. - P. e78649.
9. Zaporozhchenko I.A., Morozkin E.S., Skvortsova Т.Е. et al. A phenol-free method for isolation of microRNA from biological fluids // Anal. Biochem. - 2015. - Vol.479. - P. 43-47.
10. Chen X., Ba Y., Ma L. et al. Characterization of microRNAs in serum: A novel class of biomarkers for diagnosis of cancer and other diseases // Cell Res. - 2008. - Vol.18. - P. 997-1006.
11. Huang Z., Huang D., Ni S. et al. Plasma microRNAs are promising novel biomarkers for early detection of colorectal cancer // Int. J. Cancer. - 2010. - Vol.127. - P. 118.
12. Hu Z., Chen X., Zhao Y. et al. Serum microRNA signatures identified in a genome-wide serum microRNA expression profiling predict survival of non-small cell lung cancer // J. Clin. Oncol. - 2010. - Vol.28. - P. 1721-1726.
13. Le H.B., Zhu W.Y., Chen D.D. et al. Evaluation of dynamic change of serum miR-21 and miR-24 in pre- and postoperative lung carcinoma patients // Med. Oncol. - 2012. - Vol.29. - P. 3190-3197.
14. Markou A., Sourvinou I., Vorkas P.A., et al. Clinical evaluation of microRNA expression profiling in non small cell lung cancer // Lung Cancer. - 2013. - Vol.8. - P. 388-396.
15. Vosa U., Vooder Т., Kolde R. et al. Meta-analysis of microRNA expression in lung cancer // Int. J. Cancer. - 2013. - Vol.132. - P. 2884-2893.
Приложение
Таблица 1. Последовательности праймеров и проб, использованных для ПЦР в реальном времени.
Примечания: RT - праймер для обратной транскрипции; F - прямой праймер; Pr - олигонуклеотидная проба
Таблица 2. Динамика показателей уровня микроРНК при прогрессировании, dCt
Таблица 3. Динамика показателей уровня микроРНК при ремиссии, dCt
Способ мониторинга эффективности противоопухолевой терапии немелкоклеточного рака легкого, включающий определение уровней экспрессии микроРНК-маркеров в периферической крови больного после хирургического лечения, отличающийся тем, что определяют уровни микроРНК-19б, микроРНК-125б и сочетания микроРНК-125б/микроРНК-19б через 2 недели, 3 и 6 месяцев, 1 и 2 года после проведенного лечения и при получении линейной модели динамики изменения уровней экспрессии микроРНК, характеризующейся постепенным увеличением микроРНК-19б, снижением микроРНК-125б и сочетания микроРНК-125б/микроРНК-19б относительно исходных значений, определяют прогрессирование заболевания, а при получении квадратичной модели динамики изменения уровней экспрессии микроРНК, характеризующейся чередованием увеличения или снижения уровней экспрессии исследуемых микроРНК на снижение либо увеличение аналогичных показателей относительно исходных значений, определяют ремиссию заболевания.