Способ прогнозирования высокого риска репродуктивных потерь в первом триместре беременности
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к акушерству и гинекологии, и предназначено для прогнозирования высокого риска репродуктивных потерь в первом триместре беременности. Из периферической венозной крови женщин выделяют ДНК с последующей амплификацией полиморфных вариантов A66G гена MTRR, -31С-Т (rs1143627) IL-1β, -174G-C (rs1800795) IL-6 и С677Т (rs1801133) MTHFR. При выявлении одного из четырех генотипов: -31СТ IL-1β / -174GG IL-6 / 677СТ MTHFR / 66GG MTRR; -31СТ IL-1β / -174СС IL-6 / 677СС MTHFR / 66AG MTRR; -31CC IL-1β / -174CC IL-6 / 677CC MTHFR/ 66AG MTRR; -31CC IL-1β / -174GC IL-6 / 677CT MTHFR/ 66AG MTRR прогнозируют высокий риск репродуктивных потерь в первом триместре беременности. Изобретение позволяет формировать среди женщин группы риска репродуктивных потерь в первом триместре беременности и своевременно реализовывать в этих группах необходимые лечебно-профилактические мероприятия. 1 ил., 1 табл., 7 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области молекулярной биологии и генетики и может быть использовано в акушерстве и гинекологии в качестве генетических маркеров при диагностике репродуктивных патологий первого триместра беременности как на этапе планирования беременности, так и на доклинической стадии.
Уровень техники
Репродуктивные потери у человека составляют около 50% по отношению к общему числу зачатий. Частота невынашивания беременности остается высокой, несмотря на достигнутые успехи в профилактике и лечении нарушений репродукции человека. В настоящее время различные виды самопроизвольного прерывания беременности рассматривают в качестве мультифакторных заболеваний, развитие которых может быть запущено комбинацией нескольких факторов. Индивидуальный вклад каждого фактора может быть незначительным, и только их сумма ведет к развитию заболевания. Подавляющая часть работ, направленных на исследование генетических причин невынашивания беременности, связана с изучением аллельных вариантов генов одной функциональной генной сети, например генов фолатного цикла, генов системы детоксикации ксенобиотиков, генов, кодирующих факторы свертывающей системы крови. В то же время известно, что ранние этапы эмбрионального развития базируются на механизмах, лежащих в основе функционирования нескольких функциональных групп белков и генов, их кодирующих.
Из существующего уровня техники для оценки риска репродуктивных потерь по причине отслойки хориона и плаценты в первом триместре беременности известен способ, который заключается в амплификации аллельных вариантов - 675 5G/4G гена ингибитора активатора плазминогена 1 типа при помощи метода ПНР (RU 2494400, опубл. 27.09.2013) /1/. Вероятность развития отслойки хориона и плаценты у женщин с высоким риском самопроизвольных репродуктивных потерь при генотипе 4G/4G прогнозируют как 50%, при генотипе 4G/5G - как 35,3%. Однако в данном способе учитывается влияния только одного гена, тогда как патогенез ранних эмбриональных потерь сложен и многокомпонентен. Кроме того способ характеризуется ограничением контингента для возможности применения, так как изобретением определена возможность прогнозирования развития отслойки хориона и плаценты только у женщин с высоким риском самопроизвольных репродуктивных потерь.
Известен способ оценки предрасположенности к развитию привычного невынашивания беременности (RU 2330071 С1, опубл. 27.07.2008) /2/. Способ предусматривает анализ сочетания полиморфизмов С677Т гена MTHFR и R353Q гена фактора VII свертывания крови и составление заключения о риске развития привычного невынашивания беременности. Генотип RRTT квалифицируется как крайне неблагоприятный. Ограничением данного способа является учет влияния только двух генов, повышающих риск, прежде всего, тромботических осложнений, и не учитывающий роль иммунологических факторов в развитии беременности.
На основе комбинации генов цитокинов известен способ прогнозирования риска развития преэклампсии тяжелого течения (RU 2568892 С1, опубл. 20.11.2015) /3/, который предусматривает выделение ДНК из периферической крови женщин и анализ полиморфизмов -308G/A TNFα, +36A/G TNFR1, -801G/A SDF1, C/G МСР-1. Повышенный риск развития преэклампсии тяжелого течения прогнозируют при наличии сочетания генетических вариантов -308А TNFα, +36GG TNFR1 и -801A SDF1. Ограничением данного способа является прогнозирование осложнений беременности лишь со второго триместра.
Известен способ определения наследственной предрасположенности к развитию привычного невынашивания беременности (RU 2532367 С2, опубл. 10.11.2014) /4/, осуществляемый путем выделения геномной ДНК из образцов крови обследуемого лица с последующим генотипированием полиморфных вариантов 34V/L гена FXIII, М235Т гена AGT, 4a/b гена eNOS, PLA1/A2 гена GpIIIa и 353R/Q гена FVII. В данном способе после установления генотипов по всем 5 генам определяют влияние выявленных аллелей на формирование предрасположенности к привычному невынашиванию беременности путем подсчета суммарного балла. Значение суммарного балла менее 0,16 является основанием для отнесения обследуемого лица к группе с низким риском, значение от 0,16 до 0,4 баллов - к группе со средним риском, а значение более 0,4 баллов - к группе с высоким риском формирования привычного невынашивания беременности. Данный способ учитывает влияние только полиморфизмов генов системы гемостаза, что не позволяет дать объективную оценку риска невынашивания беременности.
Наиболее близким по выполнению к заявляемому изобретению является способ прогнозирования отслойки хориона в первом триместре беременности (RU 2566729 С1, опубл. 27.10.2015) /5/, принимаемый за прототип, в котором осуществляют выделение ДНК из крови пациента с последующей амплификацией полиморфных вариантов Arg353Gln (G10976А) гена коагуляционного фактора VII и Ile22Met (A66G) гена метионинсинтазы редуктазы MTRR при помощи метода ПЦР. При выявлении сочетания гетерозиготы GA полиморфного варианта Arg353Gln (G10976А) гена коагуляционного фактора VII с гомозиготой GG полиморфного варианта Ile22Met (A66G) гена метионинсинтазы редуктазы MTRR прогнозируют риск развития отслойки хориона в первом триместре беременности.
Ограничение способа-прототипа состоит в том, что отслойка хориона является лишь одним из возможных осложнений гестационного периода первого триместра, более того, отслойка хориона в первом триместре беременности возможна при отсутствии сочетания полиморфизмов гена коагуляционного фактора VII и гена метионинсинтазы редуктазы MTRR. В способе-прототипе учитывается роль только факторов, влияющих на процессы коагуляции, тогда как ранние этапы онтогенеза определяются взаимодействием факторов нескольких функциональных групп, что не позволяет дать объективную оценку риска репродуктивных потерь первого триместра.
Раскрытие изобретения
Техническим результатом настоящего изобретения является повышение достоверности прогнозирования высокого риска репродуктивных потерь в первом триместре беременности путем использования нового сочетания генетических вариантов 677СТ MTHFR, 66AG MTRR, -31СТ IL-1β и -174GC IL-6, т.е. генотипа по 4-м аллельным вариантам генов двух функциональных групп - провоспалительных цитокинов и фолатного цикла.
Указанный технический результат достигается тем, что способ прогнозирования высокого риска репродуктивных потерь в первом триместре беременности включает выделение ДНК из периферической венозной крови женщин с последующей амплификацией полиморфного варианта A66G гена метионинсинтазы редуктазы MTRR.
Согласно изобретению проводят амплификацию аллельных вариантов генов провоспалительных цитокинов -31С-Т (rs1143627) IL-1β, -174G-C (rs1800795) IL-6 и ферментов фолатного цикла С677Т (rs1801133) MTHFR и при выявлении одного из четырех генотипов:
-31СТ IL-1β / -174GG IL-6 / 677СТ MTHFR / 66GG MTRR;
-31CT IL-1β / -174CC IL-6 / 677CC MTHFR / 66AG MTRR;
-31CC IL-1β / -174CC IL-6 / 677CC MTHFR/ 66AG MTRR;
-3ICC IL-1β / -174GC IL-6 / 677CT MTHFR / 66AG MTRR
прогнозируют высокий риск репродуктивных потерь в первом триместре беременности.
Из уровня техники не известна возможность прогноза возникновения репродуктивных потерь в первом триместре беременности по наличию сочетаний генетических вариантов полиморфизмов -31С-Т IL-1β (rs1143627), -174G-C IL-6 (rs1800795), C677T MTHFR (rs1801133), A66G MTRR (rs1801394). Использование генетических маркеров двух функциональных групп повышает достоверность диагностики репродуктивных патологий первого триместра беременности как на этапе планирования беременности или на доклинической стадии репродуктивной патологии.
На чертеже представлена электрофореграмма результатов амплификации аллелных вариантов -31С-Т (rs1143627) гена IL-1β.
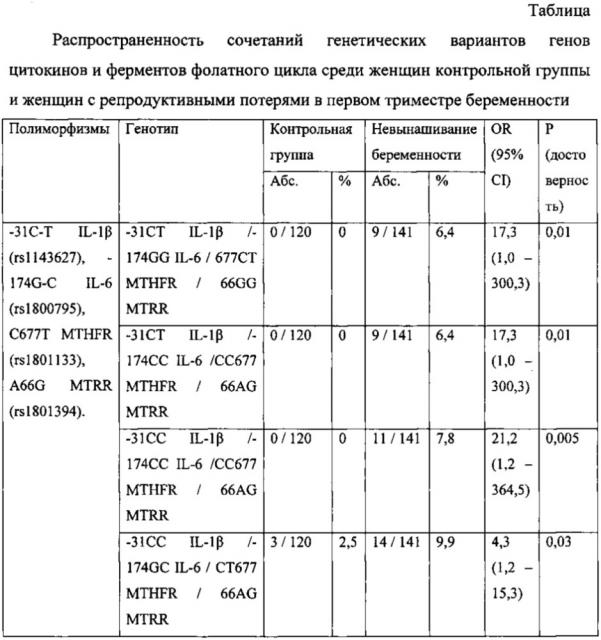
В Таблице представлена распространенность сочетаний генетических вариантов генов цитокинов и ферментов фолатного цикла среди женщин контрольной группы и женщин с репродуктивными потерями в первом триместре беременности.
Осуществление изобретения
ДНК выделяют из образцов периферической венозной крови женщин термокоагуляционным методом с использованием коммерческого набора реагентов «ДНК-Экспресс-кровь» (Литех, Россия) согласно инструкции производителя.
В пробирку типа Эппендорф вносят 1000 мкл цельной крови женщин, центрифугируют пробу со скоростью 3000 об/мин в течение 5 мин. Аккуратно удаляют плазму. Закрывают пробирку и замораживают ее при -20°С до полного замораживания форменных элементов не менее 1 часа. Размораживают содержимое пробирки при комнатной температуре. Вносят в пробирку реактив «ДНК-экспресс-кровь» объемом, равным объему оставшихся в пробирке форменных элементов. Содержимое пробирки тщательно перемешивают на вортексе. Устанавливают пробирку в предварительно прогретый до 99°С термостат и выдерживают в течение 15 мин. По окончании охлаждают до 70°С. Центрифугируют пробирку со скоростью 12000 об/мин при комнатной температуре в течение 60 сек. Полученный супернатант используют в качестве исследуемого образца ДНК.
Выделенную ДНК затем подвергают полимеразной цепной реакции с использованием наборов реагентов SNP-экспресс (Литех, Россия) согласно инструкции производителя:
1. Приготавливают пронумерованные пробирки для проведения амплификации вместимостью 0.6 мл в соответствии с количеством анализируемых проб плюс отрицательный контроль. Для каждой пробы готовят две пробирки: «норма» и «полиморфизм».
2. Из компонентов комплекта SNP-экспресс готовят рабочие смеси реагентов для амплификации из расчета на 1 пробу: 17.5 мкл разбавителя, 2.5 мкл реакционной смеси, 0.2 мкл Taq-полимеразы. Готовят две рабочие смеси: с реакционной смесью «норма» и реакционной смесью «полиморфизм».
3. Добавляют по 20 мкл соответствующей рабочей амплификационной смеси во все пробирки, подготовленные для амплификации.
4. Добавляют во все пробирки по одной капле (25 мкл) минерального масла.
5. В пробирку с рабочей амплификационной смесью «норма» и в пробирку с рабочей смесью «полиморфизм» вносят по 5 мкл образца ДНК.
6. Закрытые пробирки быстро осаждают на вортексе.
7. Переносят пробирки в прогретый до 94°С программируемый термостат и проводят амплификацию в следующем режиме: 94°С - пауза; 93°С - 1 минута; 93°С - 10 с, 64°С - 10 с, 72°С - 20 с, всего 35 циклов и 72°С - 1 минута в конце процесса.
Детекцию (разделение) продуктов амплификации аллельных вариантов провоспалительных цитокинов -31С-Т IL-1β (rs1143627), -174G-C IL-6 (rs1800795) и ферментов фолатного цикла С677Т MTHFR (rs1801133), A66G MTRR (rs1801394) проводят методом горизонтального электрофореза в 3% агарозном геле и фиксируют электрофореграмму на трансиллюминаторе GelDoc (BioRad (см. чертеж). Как следует из электрофореграммы, в лунки №1, 3, 5, 7, 9 первой справа дорожки добавлена амплификационная смесь с праймерами на «нормальную» аллель исследуемого гена. В лунки №2, 4, 6, 8, 10 - амплификационная смесь с праймерами на полиморфный вариант гена. В лунки №1-2, 3-4, 5-6, 7-8, 9-10 добавлены образцы ДНК исследуемых женщин. В парные лунки (например: 1-2, или 3-4) вносили ДНК одного и того же человека. В лунках №1, 3, 5, 7, 9 реакция прошла - у данных лиц выявлена «нормальная» аллель исследуемого гена. В лунках №2, 4, 6, 10 продукты амплификации не обнаружены, что указывает на отсутствие полиморфного варианта гена. В лунке 8 выявлен ПЦР-продукт, соответствующий полиморфному варианту гена.
Затем выявляют ассоциации сочетаний генетических вариантов с ранними репродуктивными потерями биоинформатическим методом - Multifactor Dimensionality Reduction (программа MDR, v. 1.1.0 www.epistasis.org/mdr.html) для моделирования геномных взаимодействий высокого порядка при изучении характера межгенных взаимодействий для популяционно-генетических исследований мультифакторных полигенных заболеваний, использующих относительно небольшие объемы выборок больных и здоровых. О риске развития репродуктивных потерь судили по отношению шансов (odds ratio - OR). OR указан с 95%-ым доверительным интервалом (CI) (см. таблицу). Статистически значимыми считались различия при уровне значимости p<0,05.
Выявленные варианты генотипов:
-31СТ IL-1β / -174GG IL-6 / 677СТ MTHFR / 66GG MTRR;
-31СТ IL-1β / -174СС IL-6 / 677СС MTHFR / 66AG MTRR;
-31CC IL-1β / -174CC IL-6 / 677CC MTHFR / 66AG MTRR;
-31CC IL-1β / -174GC IL-6 / 677CT MTHFR / 66AG MTRR
свидетельствуют о высоком риске репродуктивных потерь.
Возможность использования заявляемого способа для прогнозирования высокого риска ранних эмбриональных потерь подтверждается результатами наблюдений 141 пациентки с невынашиванием беременности первого триместра и 120 женщин контрольной группы. Средний возраст женщин составил 29 лет. В контрольную группу вошли только те женщины, у которых в анамнезе отсутствовали случаи невынашивания беременности.
Сбор анамнестических данных и формирование исследуемых групп женщин был проведен сотрудниками кафедры акушерства и гинекологии Ростовского государственного медицинского университета, а также врачами акушерами гинекологами городской больницы №8 г. Ростова-на-Дону и роддома №5.
Лабораторные исследования проведены на базе лаборатории генетики человека и животных Южного федерального университета. Проведение исследования было одобрено Комитетом по биоэтике Южного федерального университета.
Аллельные варианты генов 31С-Т IL-1β (rs1143627), -174G-C IL-6 (rs1800795) C677T MTHFR (rs1801133), A66G MTRR (rs1801394) были отобраны по результатам научных публикаций с учетом их патогенетического вклада в формирование ранних репродуктивных потерь, а также результатов собственных исследований по генотипированию женщин с репродуктивными потерями в первом триместре.
Существенный вклад в патогенез ранних эмбриональных потерь вносят иммунные и аутоиммунные факторы (Керчелаева С.Б., 2003) /6/. Иммунологические нарушения могут быть обусловлены особенностями генотипа, в том числе и по генам цитокинов, которые являются эндогенными медиаторами межклеточных взаимодействий. Ранние этапы эмбриогенеза зависят от соотношения функциональной активности про- и противовоспалительных цитокинов, опосредующих иммунный ответ материнского организма на развивающийся плод, контролирующих процессы формирования плаценты и ангиогенеза (Амчиславский Т. и др., 2003) /7/. Активность иммунологических реакций, реакций воспаления может определяться особенностями функционирования фолатного цикла.
Цитокины представляют группу полипептидов, основной функцией которых является обеспечение взаимодействий между клетками. Цитокины участвуют в регуляции разнообразных физиологических процессов; входят в систему контроля выживаемости клеток, активируют или подавляют их рост, дифференцировку. Цитокин-зависимыми процессами являются этапы созревания яйцеклетки, процессы оплодотворения, адгезии, имплантации, а также формирования плаценты. Все эти процессы предусматривают активное межклеточное взаимодействие с участием нескольких семейств цитокинов. Важнейшими из них являются цитокины семейства IL-6, TGF-β, IL-1, а также хемокины (Dimitriadis Е. et al., 2005) /8/.
Нарушение интенсивности воспалительных реакций, в том числе и из-за особенностей генотипа по генам цитокинов, может быть фактором риска для протекания беременности (Daher S., 2012) /9/. Например, чрезмерный синтез IL-1β может привести к значительной интенсификации воспалительных реакций. Провоспалительные цитокины могут выступать важным звеном между воспалением и гиперкоагуляцией (Yoshida Н., 2009) /10/. Воспаление приводит к нарушению равновесия между про- и антикоагуляционными реакциями. Активация и связывание тромбоцитов с клетками эндотелия и лейкоцитами в зоне воспаления способствует прокоагулянтному состоянию, так как активирует факторы свертывания крови и усиливает образование тромбина (Levi М. et al., 2005) /11/.
К генетическим факторам, ассоциированным с повышенным риском развития тромбозов, относятся и гены фолатного цикла (метилентетрагидрофолат-редуктазы (MTHFR), метионин-синтазы редуктазы (MTRR), метионин-синтазы (MTR)). В клетках человека фолаты необходимы для синтеза нуклеотидов, метаболизма аминокислот, метилирования нуклеиновых кислот и белков. Дефицит фолатов, вне зависимости от факторов его вызывающих, приводит к гипергомоцистеинемии, которая может стать причиной развития целого ряда патологических состояний за счет повышения уровня экспрессии генов провоспалительных цитокинов, индукции окислительного стресса, активации апоптоза и нарушения процессов метилирования (Jacques P. et al., 2001) /12/. Показано, что высокая концентрация гомоцистеина может индуцировать экспрессию IL-6 моноцитами (Su S. et al., 2005) /13/. Повышенный уровень гомоцистеина при беременности может приводить к нарушению кровообращения в плаценте, дефектам имплантации, снижению глубины инвазии трофобласта, нарушению нормального развития фетоплацентарного кровообращения.
Причины нарушения метаболизма фолатов могут быть обусловлены наличием полиморфных вариантов генов. Показана связь однонуклеотидных замен в генах ферментов фолатного цикла с развитием патологии беременности (Wu X. et al., 2012) /14/. По данным литературы известно, что гипергомоцистеинемия создает условия для интенсификации свободно-радикальных реакций, а также реакций воспалительного ответа (Lazzerini Р. еt al., 2007) /15/.
Генетические исследования репродуктивной патологии имеют несколько составляющих. В том числе и идентификацию ДНК/РНК-маркеров, имеющих прогностическую ценность для оценки риска невынашивания беременности. Проведение генотипирования по одному полиморфизму не позволяет получить результат с высокой прогностической значимостью. Прогностическая значимость исследования повышается при включении аллельных вариантов нескольких функциональных групп генов, контролирующих ключевые процессы раннего эмбрионального развития. Полиморфизмы таких генов образуют различные комбинации, усиливающие или ослабляющие эффект какого-либо отдельного генетического полиморфизма. Включение полиморфизмов генов IL-1β, IL-6, MTHFR, MTRR в программу генетического тестирования женщин позволит повысить достоверность прогнозирования высокого риска репродуктивных потерь в первом триместре беременности.
Как следует из таблицы две комбинации генетических вариантов
-31СТ IL-1β / -174GG IL-6 / 677СТ MTHFR / 66GG MTRR и
-31СТ IL-1β / -174СС IL-6 / CC677 MTHFR / 66AG MTRR встречаются с одинаковой частотой (по 6,4%) среди женщин с репродуктивными потерями в первом триместре беременности, тогда как в контрольной группе два данных генотипа не обнаружены. Эти комбинации аллельных вариантов генов цитокинов и фолатного цикла являются факторами риска репродуктивных потерь первого триместра, так как показатель отношения шансов по двум данным генотипам составил 17,3 (CI: 1,0-300,3, р=0,01).
Комбинация генетических вариантов (-31СС IL-1β / -174СС IL-6 / СС677 MTHFR / 66AG MTRR) встречается у 7,8% женщин с репродуктивными потерями в первом триместре беременности, в то время как в контрольной группе данный генотип не выявлен. Эта комбинация аллельных вариантов генов цитокинов и фолатного цикла является фактором риска репродуктивных потерь первого триместра беременности, так как показатель отношения шансов для данного генотипа составил 21,2 (CI: 1,2-364,5, р=0,005).
Комбинация генетических вариантов (-31СС IL-1β / -174GC IL-6 / СТ677 MTHFR / 66AG MTRR) встречается у 9,9% женщин с репродуктивными потерями в первом триместре беременности, что в 3,9 раза выше аналогичного показателя контрольной группы. Эта комбинация аллельных вариантов генов цитокинов и фолатного цикла является фактором риска репродуктивных потерь первого триместра беременности, так как показатель отношения шансов для данного генотипа составил 4,3 (CI: 1,2-15,3, р=0,03).
Из результатов статистической обработки полученных данных следует, что генетические полиморфизмы -31С-Т (rs1143627) IL-1β, -174G-C (rs1800795) IL-6, C677T (rs1801133) MTHFR, A66G (rs1801394) MTRR играют значимую роль в формировании генетической предрасположенности к высокому риску репродуктивных потерь в первом триместре беременности. При этом сочетание полиморфных вариантов:
-31СТ IL-1β / -174GG IL-6 / 677СТ MTHFR/ 66GG MTRR;
-31CT IL-1β / -174CC IL-6 / 677CC MTHFR / 66AG MTRR;
-31CC IL-1β / -174CC IL-6 / 677CC MTHFR/ 66AG MTRR;
-31CC IL-1β / -174GC IL-6 / 677CT MTHFR / 66AG MTRR
ассоциированы с высоким риском репродуктивных потерь в первом триместре беременности.
Наличие одного из указанных генотипов подтверждает высокую вероятность репродуктивных потерь в первом триместре беременности следующими примерами.
Пример 1.
Пациентка А., русская, 1981 года рождения. На момент проведения исследования у женщины диагностирована первая беременность, которая на сроке 6 недель остановилась в развитии. У пациентки была взята венозная кровь; при генотипировании ДНК-маркеров было выявлено сочетание исследуемых полиморфизмов генов цитокинов и ферментов фолатного цикла: -31СТ IL-1β / -174GG IL-6 / 677СТ MTHFR / 66GG MTRR, что подтверждает высокую вероятность репродуктивных потерь в первом триместре.
Пример 2.
Пациентка С., русская, 1992 года рождения. В анамнезе имеет 1 роды, закончившиеся рождением живого ребенка. На момент проведения исследования у женщины произошел спонтанный аборт на сроке 7 недели беременности. У пациентки была взята венозная кровь; при генотипировании ДНК-маркеров было выявлено сочетание исследуемых полиморфизмов генов цитокинов и ферментов фолатного цикла: -31СТ IL-1β / -174GG IL-6 / 677СТ MTHFR / 66GG MTRR, что подтверждает высокую вероятность ранних репродуктивных потерь.
Пример 3.
Пациентка У., русская, 1983 года рождения. В анамнезе имеет 1 роды, закончившиеся рождением живого ребенка. На момент проведения исследования у женщины произошел спонтанный аборт на сроке 7 недели беременности. У пациентки была взята венозная кровь; при генотипировании ДНК-маркеров было выявлено сочетание исследуемых полиморфизмов генов цитокинов и ферментов фолатного цикла: -31СТ IL-1β / -174СС IL-6 / 677СС MTHFR / 66AG MTRR, что подтверждает высокую вероятность репродуктивных потерь в первом триместре.
Пример 4.
Пациентка Б., русская, 1987 года рождения. На момент проведения исследования у женщины диагностирована первая беременность, которая на сроке 7 недель остановилась в развитии. У пациентки была взята венозная кровь; при генотипировании ДНК-маркеров было выявлено сочетание исследуемых полиморфизмов генов цитокинов и ферментов фолатного цикла: -31СС IL-1β / -174СС IL-6 / 677СС MTHFR / 66AG MTRR. Таким образом, выявлен генотип повышенного риска ранних репродуктивных потерь.
Пример 5.
Пациентка И., русская, 1984 года рождения. В анамнезе женщины роды отсутствуют. На момент проведения исследования у женщины диагностирована вторая беременность, которая на сроке 10 недель остановилась в развитии. У пациентки была взята венозная кровь; при генотипировании ДНК-маркеров было выявлено сочетание исследуемых полиморфизмов генов цитокинов и ферментов фолатного цикла: -31СС IL-1β / -174СС IL-6 / 677СС MTHFR / 66AG MTRR. Таким образом, выявлен генотип повышенного риска репродуктивных потерь в первом триместре.
Пример 6.
Пациентка М., русская, 1989 года рождения. В анамнезе имеет 1 роды, закончившиеся рождением живого ребенка. На момент проведения исследования у женщины произошел спонтанный аборт на сроке 6 недель беременности. У пациентки была взята венозная кровь; при генотипировании ДНК-маркеров было выявлено сочетание исследуемых полиморфизмов генов цитокинов и ферментов фолатного цикла: -31 СС IL-1β / -174GC IL-6 / 677СТ MTHFR / 66AG MTRR, что подтверждает высокую вероятность ранних репродуктивных потерь.
Пример 7.
Пациентка О., русская, 1978 года рождения. В анамнезе имеет 1 роды, закончившиеся рождением живого ребенка. На момент проведения исследования у женщины диагностирована 4-я беременность, которая спонтанно прервалась на сроке 9 недель. У пациентки была взята венозная кровь; при генотипировании ДНК-маркеров было выявлено сочетание исследуемых полиморфизмов генов цитокинов и ферментов фолатного цикла: -31СС IL-1β / -174GC IL-6 / 677СТ MTHFR / 66AG MTRR, что подтверждает высокую вероятность репродуктивных потерь в первом триместре.
Применение заявленного способа позволит формировать среди женщин на этапе прегравидарной подготовки группы риска и своевременно реализовывать в этих группах необходимые лечебно-профилактические мероприятии.
Источники информации
1. RU 2494400, МПК G01N 33/50, опубл. 27.09.2013.
2. RU2330071 C1 МПК C12Q 1/68, опубл. 27.07.2008.
3. RU 2568892 С1, МПК G01N 33/52, C12Q 1/68, опубл. 20.11.2015.
4. RU 2532367С2, МПК G01N 33/68, опубл. 10.11.2014.
5. RU 2566729 C1, МПК G01N 33/68, опубл. 27.10.2015.
6. Керчелаева С.Б. Значение антител к фосфолипидам и фосфолипидсвязывающим белкам при неразвивающейся беременности // Российский вестник акушера-гинеколога. 2003. - Т. 4. - С. 11-16.
7. Амчиславский Е.И., Соколов Д.И., Старикова Э.А. Цитокиновый контроль процесса ангиогенеза. Медицинская Иммунология 2003, Т. 5, №5-6, С. 493-506.
8. Dimitriadis Е., White С., Jones R. Cytokines, chemokines and growth factors in endometrium related to implantation // Human Reproduction Update. - 2005. - V. 24. - P. 612-628.
9. Daher S., Mattar R., Gueuvoghlanian-Silva BY. Genetic polymorphisms and recurrent spontaneous abortions: an overview of current knowledge // Am J Reprod Immunol. - 2012. - V. 67. - P. 341-347.
10. Yoshida H., Granger D.N. Inflammatory bowel disease: a paradigm for the link between coagulation and inflammation // Inflamm Bowel Dis. - 2009. - V. 15. - P. 1245-1255.
11. Levi M., Van der Poll T. Two-way interactions between inflammation and coagulation // Trends Cardiovasc Med. - 2005. - V. 15. - P. 254-259.
12. Jacques P., Bostom A., Wilson P. Determinants of plasma total homocysteine concentration in the Framingham Offspring cohort // Am J Clin Nutr. - 2001. - V. 73. - P. 613-621.
13. Su S.J., Huang L.W., Pai L.S., Liu H.W. Homocysteine at pathophysiologic concentrations activates human monocyte and induces cytokine expression and inhibits macrophage migration inhibitory factor expression // Nutrition. - 2005. - V. 21. - P. 994-1002.
14. Wu X., Zhao L., Zhu H. Association between the MTHFR C677T polymorphism and recurrent pregnancy loss: A Meta-analysis // Genet Test Mol Biomarkers. - 2012. - V. 7. - P. 806-811.
15. Lazzerini P.E. Hyperhomocysteinemia, inflammation and autoimmunity // Autoimmun Rev. - 2007. - V. 6 (7). - P. 503-509.
Способ прогнозирования высокого риска репродуктивных потерь в первом триместре беременности, включающий выделение ДНК из периферической венозной крови женщин с последующей амплификацией полиморфного варианта A66G гена метионинсинтазы редуктазы MTRR, отличающийся тем, что проводят амплификацию аллельных вариантов генов провоспалительных цитокинов -31С-Т (rs1143627) IL-1β, -174G-C (rs1800795) IL-6 и ферментов фолатного цикла С677Т (rs1801133) MTHFR и при выявлении одного из четырех генотипов:
-31СТ IL-1β / -174GG IL-6 / 677СТ MTHFR / 66GG MTRR;
-31СТ IL-1β / -174СС IL-6 / 677СС MTHFR / 66AG MTRR;
-31CC IL-1β / -174CC IL-6 / 677CC MTHFR/ 66AG MTRR;
-31CC IL-1β / -174GC IL-6 / 677CT MTHFR/ 66AG MTRR
прогнозируют высокий риск репродуктивных потерь в первом триместре беременности.