Способы рецеллюляризации ткани или органа для улучшения приживления трансплантата
Иллюстрации
Показать всеИзобретение относится к медицине. Описан способ рецеллюляризации ex vivo матрикса ткани или органа, включающий: a) предоставление децеллюляризованного матрикса органа млекопитающего или васкуляризованной ткани, где матрикс включает интактную капсулу органа, содержит сосудистую систему и где, когда жидкость вводят в одной точке входа указанной сосудистой системы указанного децеллюляризованного матрикса, указанная жидкость выходит другим путем; и b) реэндотелизацию матрикса указанных ткани или органа путем перфузирования, в антеградном и ретроградном направлениях, указанной децеллюляризованной сосудистой системы указанного матрикса ткани или органа композицией, включающей чистую популяцию эндотелиальных клеток или эндотелиальных клеток-предшественников. При трансплантации реципиенту ткани или матрикса органа выявляется очень малая тромбогенность. 13 з.п. ф-лы, 7 ил., 1 табл., 14 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка претендует на приоритет от Предварительной Заявки № 61/379073, поданной 1 Сентября 2010, которая включена здесь посредством ссылки.
ФИНАНСИРУЕМОЕ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЕ ИЛИ ПРОЦЕСС
Это изобретение создавалось при поддержке государства при помощи Гранта № HL 063346 и HL 100407-01, врученного Национальными Институтами Здоровья. Государство имеет определенные права на изобретение.
ОБЛАСТЬ ТЕХНИКИ
Раскрытие в целом относится к способам рецеллюляризации децеллюляризованной ткани или органа.
УРОВЕНЬ ТЕХНИКИ
Когда повреждается кровеносный сосуд или обнажается внеклеточный матрикс, тромбоциты и фибрин формируют кровяной сгусток для предотвращения потери крови вследствие повреждения. Тромбоз представляет собой формирование кровяного сгустка, называемого тромбом, в кровеносном сосуде. Кровеносный сосуд может представлять собой вену, артерию или капилляр. Тромб обычно перекрывает в различной степени кровоток в системе циркуляции. В живом организме (in vivo) антитромботические и антикоагулянтные средства применяют для снижения реакции свертывания, но они не являются достоверно полезными для снижения или элиминации тромбоза, наблюдаемого во время трансплантации децеллюляризованного органа, ткани или каркаса.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
С одной стороны, предоставлен способ рецеллюляризации ткани или матрикса органа. Этот способ обычно включает перфузию ткани или матрикса органа, например, перфузию децеллюляризованной ткани или матрикса органа, физиологическим буфером под давлением; и реэндотелизацию ткани или матрикса органа путем перфузии ткани или матрикса органа физиологической композицией, включающей популяцию эндотелиальных клеток или эндотелиальных клеток-предшественников. Типичную популяцию дифференцированных эндотелиальных клеток или гладкомышечных клеток можно определить при помощи иммуноцитохимических методов, известных специалистам в данной области техники, включающих, например, двухметочно иммунофлуоресцентный и иммунопероксидазный способы, в которых применяют антибиотики, которые определяют клеточные протеины для распознавания клеточных характеристик или фенотипических свойств эндотелиальных клеток или гладкомышечных клеток. Клеточные маркеры для эндотелиальных клеток включают, например, VE-кадгерин, CD144, CD141, CD 106 или CD142, в то время как клеточные маркеры для гладкомышечных клеток включают Flk. Иммуноцитохимию также можно применять для определения эндотелиальных клеток путем определения экспрессии генов эндотелиальной клетки, таких как CD31 и e-NOS. Популяции зрелых эндотелиальных клеток должны быть относительно свободны от гемопоэтических клеток, таких как популяции CD45+. На месте (in situ) также можно проводить гибридизационную гистохимию с применением кДНК или РНК проб, специфичных для эндотелиального гена мРНК. Эти методы можно комбинировать с иммуноцитохимическими способами для усиления идентификации конкретных фенотипов. Антитела и молекулярные пробы, описанные выше, можно применять к процедурам Вестерн- и Нозерн-блоттинга соответственно для помощи в клеточной идентификации. В одном варианте осуществления практически чистая популяция представляет собой по меньшей мере 50%, 60%, 70% или более, как, например, 80%, 85%, 90%, 95%, 99% или 100% эндотелиальных клеток или эндотелиальных клеток-предшественников. Перфузионная децеллюляризация является ex vivo способом децеллюляризации органа, части (порции) органа или васкуляризованной ткани млекопитающих, где раствор для децеллюляризации пропускают через орган, часть органа или васкуляризованной ткани для облегчения децеллюляризации при сохранении сосудистого русла. Конечный децеллюляризованный орган, матрикс, каркас тканей или трансплантат сохраняет сосудистую систему, включающую артериальное кровоснабжение, интерстициальное пространство, где располагаются ложа капилляров и венозный отток, так что жидкость или клетки могут быть представлены одной или более входными точками, например одним или более сосудами, и выходом из органа, матрикса, ткани или трансплантата по другому пути. Целые органы с первичным артериальным притоком имеют полный венозный возврат жидкости. Изолированные порции органов или тканей сочетают венозный возврат и выход жидкости через обнаженный интерстициальный матрикс, где ткань или порция органа выделены. При наличии капсула органа остается интактной, например, не облегчает передвижение водосодержащей жидкости через капсулу в противоположность органам, подвергнутым иммерсионной децеллюляризации.
Типичные эндотелиальные клетки включают без ограничений эндотелиальные клетки крови, эндотелиальные клетки костного мозга, циркулирующие эндотелиальные клетки, эндотелиальные клетки аорты человека, эндотелиальные клетки капилляров головного мозга человека, эндотелиальные клетки капилляров кожи человека, эндотелиальные клетки капилляров кишечника человека, эндотелиальные клетки капилляров легкого человека, эндотелиальные клетки капилляров человека, эндотелиальные клетки печеночных синусов, эндотелиальные клетки подкожной вены, эндотелиальные клетки пупочной вены человека, лимфатические эндотелиальные клетки, эндотелиальные клетки микрососудов, эндотелиальные клетки капилляров, эндотелиальные клетки легочной артерии, эндотелиальные клетки капилляров сетчатки, эндотелиальные клетки микрососудов сетчатки, эндотелиальные клетки сосудов, эндотелиальные клетки пуповины, эндотелиальные клетки синусов печени, колониеобразующие единицы эндотелиальных клеток (КОЕ-ЭК, CFU-EC), циркулирующие ангиогенные клетки (CAC), циркулирующие эндотелиальные прекурсоры (CEP), эндотелиальные колониеобразующие клетки (ECFC), ECFC с низким пролиферативным потенциалом (LPP-ECFC), ECFC с высоким пролиферативным потенциалом (HPP-ECFC) или комбинации вышеперечисленных веществ. В некоторых вариантах осуществления эндотелиальные клетки или эндотелиальные клетки-предшественники получают из эмбриональных стволовых клеток (ESC), взрослых стволовых клеток, клеток-предшественников или индуцированных плюрипотентных стволовых клеток (iPSC).
В конкретных вариантах осуществления ткань или матрикс органа являются биологической тканью или матриксом органа. В конкретных вариантах осуществления биологическая ткань или матрикс органа происходят из органа, выбираемого из группы, состоящей из сердца, почки, печени, легкого, поджелудочной железы, кишечника, мышцы, кожи, молочной железы, пищевода, трахеи или сальника. В конкретных вариантах осуществления биологическая ткань или матрикс органа представляют собой перфузионно- децеллюляризованную ткань или матрикс органа.
В некоторых случаях биологическая ткань или матрикс органа, а также эндотелиальные клетки или эндотелиальные клетки-предшественники являются ксеногенными. В некоторых случаях биологическая ткань или матрикс органа, а также эндотелиальные клетки или эндотелиальные клетки-предшественники являются аллогенными.
В некоторых вариантах осуществления такой способ дополнительно включает введение клеток, отличных от эндотелиальных или клеток-предшественников эндотелиальных клеток, в или на ткань или матрикс органа перед стадией реэндотелизации. В некоторых вариантах осуществления такой способ дополнительно включает введение клеток, отличных от эндотелиальных или клеток-предшественников эндотелиальных клеток, в или на ткань или матрикс органа после стадии реэндотелизации.
С другой стороны, предоставлен способ снижения тромбообразования и иммуногенности в рецеллюляризованной ткани или органа после трансплантации реципиенту. Этот способ обычно включает перфузирование ткани или матрикса органа физиологическим буфером под давлением; реэндотелизацию ткани или матрикса органа путем перфузии ткани или матрикса органа физиологической композицией, включающей популяцию эндотелиальных клеток или эндотелиальных клеток-предшественников; и трансплантацию реэндотелизованной ткани или матрикса органа реципиенту. Тромбогенность в реэндотелизованных тканях или органах можно определять при помощи стандартных тестов гемосовместимости и анализов, включающих, но не ограничивающихся активацией тромбоцитов, оксидантной реакцией, гемолизом, фибринолизом, образованием фибрина, выработкой тромбина, контактной активацией, анализом тромбомодулина и/или активацией комплемента. В одном варианте осуществления реэндотелизованная ткань или матрикс органа являются подходящими для трансплантации и остаются доступными для трансплантации.
Типичные эндотелиальные клетки включают без ограничений эндотелиальные клетки крови, эндотелиальные клетки костного мозга, циркулирующие эндотелиальные клетки, эндотелиальные клетки аорты человека, эндотелиальные клетки капилляров головного мозга человека, эндотелиальные клетки капилляров кожи человека, эндотелиальные клетки капилляров кишечника человека, эндотелиальные клетки капилляров легкого человека, эндотелиальные клетки капилляров человека, эндотелиальные клетки печеночных синусов, эндотелиальные клетки подкожной вены, эндотелиальные клетки пупочной вены человека, лимфатические эндотелиальные клетки, эндотелиальные клетки микрососудов, эндотелиальные клетки капилляров, эндотелиальные клетки легочной артерии, эндотелиальные клетки капилляров сетчатки, эндотелиальные клетки капилляров сетчатки, эндотелиальные клетки сосудов, эндотелиальные клетки пуповины, эндотелиальные клетки синусов печени, колониеобразующие единицы эндотелиальных клеток (КОЕ-ЭК), циркулирующие ангиогенные клетки (CAC), циркулирующие эндотелиальные прекурсоры (CEP), эндотелиальные колониеобразующие клетки (ECFC), ECFC с низким пролиферативным потенциалом (LPP-ECFC), ECFC с высоким пролиферативным потенциалом (HPP-ECFC) или комбинации вышеперечисленных веществ. В некоторых вариантах осуществления эндотелиальные клетки или эндотелиальные клетки-предшественники получают из эмбриональных стволовых клеток (ESC), взрослых стволовых клеток, клеток-предшественников или индуцированных плюрипотентных стволовых клеток (iPSC).
В конкретных вариантах осуществления ткань или матрикс органа представляют собой биологическую ткань или матрикс органа. В конкретных вариантах осуществления биологическая ткань или матрикс органа происходят из органа, выбираемого из группы, состоящей из сердца, почки, печени, легкого, поджелудочной железы, кишечника, мышцы, кожи, молочной железы, пищевода, трахеи или сальника. В конкретных вариантах осуществления биологическая ткань или матрикс органа представляют собой перфузионно-децеллюляризованную ткань или матрикс органа.
В некоторых вариантах осуществления биологическая ткань или матрикс органа, а также эндотелиальные клетки или эндотелиальные клетки-предшественники являются ксеногенными. В некоторых случаях биологическая ткань или матрикс органа, а также эндотелиальные клетки или эндотелиальные клетки-предшественники являются аллогенными. В некоторых вариантах осуществления биологическая ткань или матрикс органа являются ксеногенными для реципиента, и там эндотелиальные клетки или эндотелиальные клетки-предшественними являются аллогенными для реципиента.
В конкретных вариантах осуществления такой способ дополнительно включает введение клеток, отличных от эндотелиальных или эндотелиальных клеток-предшественников, в или на ткань или матрикс органа перед стадией реэндотелизации. В конкретных вариантах осуществления этот способ дополнительно включает введение клеток, отличных от эндотелиальных или эндотелиальных клеток-предшественников, в или на ткань или матрикс органа после стадии реэндотелизации. В конкретных вариантах осуществления этот способ дополнительно включает введение клеток, отличных от эндотелиальных или эндотелиальных клеток-предшественников, в или на ткань или матрикс органа после стадии трансплантации. Физиологическую композицию, включающую клетки, отличные от эндотелиальных, полученные из эндотелия, или незрелые эндотелиальные клетки или эндотелиальные клетки-предшественники, можно ввести в ткань или матрикс органа путем, например, перфузии, прямой инъекции, топического нанесения или при помощи комбинации вышеперечисленных способов.
Если не указано иного, все технические и научные термины, используемые здесь, имеют то же значение, как обычно понимают средние специалисты в данной области техники, к которой относятся способы и композиции. Хотя способы и материалы, сходные или эквивалентные тем, которые описаны здесь, можно применять на практике или для тестирования способов и композиций, подходящие способы и материалы описаны ниже. В дополнение, материалы, способы и примеры являются только демонстрационными и не склонны к ограничению. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые здесь, включены во всей полноте посредством ссылки.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
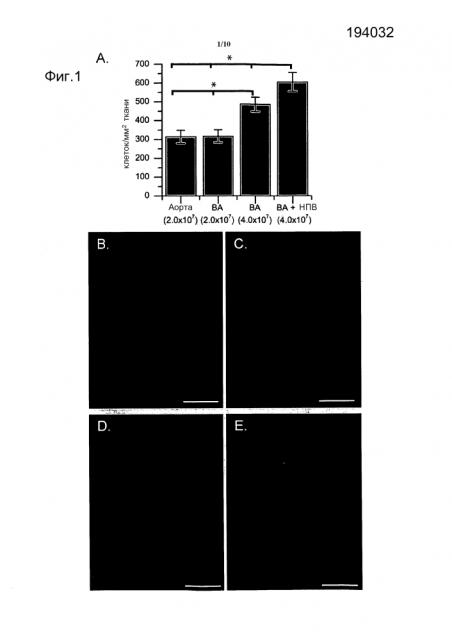
Фигура 1 - Блок А является графиком, показывающим наличие клеток на протяжении структур рецеллюляризованного сердца, которое измеряют путем измерения количества DAPI позитивных ядер в областях четырех различных коротких осей, распределенных от основания до верхушки (N=3 сердца на способ). Эндотелиальные клетки аорты крысы (RAEC) доставляют либо в единичной дозе, либо в двойной дозе. Общее число доставленных клеток показано в скобках для каждого способа. Доставки единичных доз клеток касаются как перфузии RAEC в аорту дистальнее третьей ветви (Аорта), так и через плечеголовной ствол (BA). При доставках двойных доз половину клеток доставляли через НПВ (IVC), вслед за этим следовала доставка половины через BA (BA+IVC). Распределение RAEC по всему сердечному матриксу визуализируют при помощи введения меток DiI (КРАСНЫЙ) и DiO (ЗЕЛЕНЫЙ) в клетки перед доставкой. 40 миллионов меченных DiI RAEC доставлены через BA в Блоках В и С, в то время как 20 миллионов меченных DiO клеток доставлены через НПВ, вслед за чем дополнительно 20 миллионов DiI меченных клеток доставлены через BA в Блоках D и Е. Планки погрешностей представляют собой стандартную ошибку средней, и графический масштаб составляет 5 мм. * определяет р>0,05.
Фигура 2 представляет собой фотографии, на которых 20 миллионов меченных DiO (ЗЕЛЕНЫЙ) RAEC доставлены через НПВ и 20 миллионов меченных DiI (КРАСНЫЙ) RAEC доставлены через BA и визуализированы спустя 7 дней после посева в децеллюляризованные каркасы (Блоки А-Е). Меченые RAEC видны в различных распределениях в стенках желудочка (Блоки А-С) и на поверхности эндокарда (Блоки D-Е). DAPI-позитивные ядра показаны СИНИМ (Блоки А-Е). Графический масштаб для Блоков А-Е составляет 50 микрон.
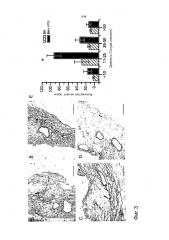
Фигура 3 - Блоки A-D представляют собой фотографии, показывающие гистологическое состояние децеллюляризованного внеклеточного матрикса сердца крысы (ECM), с пересеянными RAEC через BA (40 миллионов клеток, Блоки А-В) или через BA и НПВ (20 миллионов каждая инъекция, Панели C-D). Блоки А и С являются гематоксилин- и эозин-окрашенными секциями, в то время как Блоки B и D являются окрашенными по Вирхову-ван Гисону. Диаметр сосуда измеряют и группируют в соответствии с размерами для стенки левого желудочка (LV) и правого желудочка (RV), данные о которых показаны в Блоке Е (N=3 на группу данных). Графический масштаб составляет 250 микрон. Планки погрешностей представляют собой стандартную ошибку средней. * определяет статистически значимую разницу между способами доставки (p<0,001) для данного диаметра сосуда.
Фигура 4 представляет собой фотографии децеллюляризованной структуры сердца крысы, посеянной на день 0 при помощи 40 миллионов RAEC путем инфузии через BA (Блок А) или 30 миллионов RAEC через НПВ (Блоки B и С). На седьмой день в структуры сердца вводят путем перфузии витальный краситель, CMFDA, через аорту во флуоресцентно меченые живые клетки (ЗЕЛЕНЫЙ). CMFDA-позитивные REAC видны в стенках желудочка (Блоки А и В) и на поверхности эндокарда структуры сердца (Блок С) независимо от пути доставки. Клеточную смерть из-за апоптоза исследовали при помощи окраски по TUNEL (Блоки D-I). Блоки D-F представляют левый желудочек, перегородку и изображения короткой оси правого желудочка для доставленных через ВА клеточных структур. Блоки G-I представляют левый желудочек, перегородку и правый желудочек, изображения TUNEL для клеточных структур, посеянных через ВА и НПВ. Ядра клеток окрашены при помощи DAPI (СИНИЙ), TUNEL-позитивное окрашивание является КРАСНЫМ. Для дополнительного подсчета изменений в жизнеспособности клетки с течением времени образцы среды брали ежедневно и измеряли активность G6PDH(Блок J) (N=6). Планки погрешностей представляют собой стандартную ошибку средней. Графический масштаб составляет 100 микрон в Блоках А-С, в то время как в Блоках D-I графический масштаб составляет 250 микрон. # обозначает TUNEL-позитивное окрашивание. В блоке J графически представлены все данные.
Фигура 5 представляет собой фотографии гистохимически окрашенных RAEC через семь дней на децеллюляризованных структурных каркасах сердца, которые показывают, что клетки по прежнему жизнеспособны, пролиферируют (Блок А, ЗЕЛЕНЫЙ - CMFDA и КРАСНЫЙ - PCNA), а также экспресс-маркеры функционально активных EC (Блок В, КРАСНЫЙ - eNOS, ЗЕЛЕНЫЙ - CMFDA, СИНИЙ - DAPI; Блок С, КРАСНЫЙ - vWF, ЗЕЛЕНЫЙ - CMFDA и СИНИЙ - DAPI). Реэндотелизованные матриксы по-прежнему способны снижать тромбообразование каркасов путем блокирования тромбомодулина (Блок D, N=6 для ацеллюлярных контролей, N=8 для BA и ВА+НПВ). Общее число RAEC, доставленных в каждом способе, показано в скобках. * определяет р>0,05 в сравнении с ацеллюлярными контролями. Планки погрешностей представляют собой стандартную ошибку средней. Графический масштаб составляет 100 микрон.
Фигура 6 представляет собой фотографии, показывающие сравнение между эксплантатами ацеллюлярных каркасов (Блоки А-D) и эксплантатами реэндотелизованных структур (Блоки Е-Н) через семь дней после гетеротипической трансплантации. Макроскопическое исследование ацеллюлярных каркасов аорты и левого желудочка (Блоки А и В, соответственно) и реэндотелизованных структур (Блоки Е и F, соответственно) выявило снижение образования тромбов. Окраска по гематоксилину и эозину ацеллюлярных каркасов (Блоки С-D) и реэндотелизованных структур (Блоки G-H) выявила более жидкую кровь в ацеллюлярных каркасах и сравнимые количества заполненных клеток как в эксплантатах ацеллюлярного каркаса, так и реэндотелизованных каркасах. * обозначает действующие сосуды в каркасах. Графический масштаб составляет: 1мм в Блоках А, В, Е и F, 250 микрон в Блоках С и G, 50 микрон в Блоке D и 100 микрон в Блоке Н.
Фигура 7 представляет собой фотографии VEGF-R2 (КРАСНЫЙ) окрашивания ацеллюлярного каркаса (Блок А) или реэндотелизованных структур (Блок В) через семь дней после трансплантации. PECAM (Красный) окрашивание ацеллюлярного каркаса (Блок С) и реэндотелизованной структуры (Блок D) через 7 дней после трансплантации. DAPI-позитивные ядра являются СИНИМИ. Графический масштаб составляет 100 микрон. * обозначает аутофлуоресценцию крови.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Тромбоз рецеллюляризованной ткани или матрикса органа является феноменом, который происходит после трансплантации и реперфузии кровью тканей или органов. В дополнение, трансплантированные ткани или органы часто являются иммуногенными, и реципиент часто страдает от воспалительной реакции на трансплантированную ткань или орган. Способы рецеллюляризации ткани или матрикса органа, описанные здесь, приводят к снижению тромбогенности при последовательной трансплантации ткани или матрикса органа хозяину и реперфузии кровью. Способы рецеллюляризации, описанные здесь, также приводят к тому, что ткани и органы при трансплантации и реперфузии кровью демонстрируют ограниченное воспаление.
Способы рецеллюляризации ткани или матрикса органа, как описано здесь, можно применять для биологической ткани или матрикса органа. Типичные биологические ткани или матриксы органов включают, например, сердце, печень, почку, легкое, поджелудочную железу, селезенку, матку, мочевой пузырь, пищевод, трахею, спинной мозг, суставы (например, коленные, плечевые или тазобедренные), кожу, молочные железы, мышцы, кишечник, сальник и жировую ткань. Биологический матрикс также может включать, например, коллагеновый матрикс, который секретируют или ремоделируют клетки. Рецеллюризация биологического матрикса, как описано здесь, обычно требует от матрикса быть свободным или практически свободным от живых клеток.
Биологические ткани и органы можно децеллюляризовать при помощи любого количества известных способов. Например, биологическую ткань или орган можно децеллюляризовать при помощи способов перфузии. Смотрите, например, WO 2007/025233 и Ott с соавт. (2008, Nat. Med., 14:213-21) для описаний децеллюляризационных способов, основанных на перфузии. Показано, что перфузионные способы децеллюляризации дают очень хороший матрикс для рецеллюляризации. Смотрите, например, WO 2007/025233; Ott с соавт. (2008, Nat. Med., 14:213-21); Uygun с соавт., 2010, Nat. Med., 16(7):814-20; Petersen с соавт., 2010, Science, e-pub Июнь; и Ott с соавт., 2010, Nat. Med., e-pub Июль.
Альтернативой децеллюляризации биологических тканей и органов, основанной на перфузии, может быть децеллюляризация путем погружения в децеллюляризационный раствор, который удаляет клетки. Смотрите, например U.S. Патент № 6376244 и 6753181. В дополнение, как альтернативу использованию биологических тканей и матриксов органов, способы рецеллюляризации, описанные здесь, можно использовать в отношении синтетических тканей или матриксов органов, таким образом, такие синтетические матриксы приобретают структуру сосудистого ложа. Типичные синтетические ткани и матриксы органов включают, например, гидрогели, полимеры (например, биодеградируемый PLGA, PLA или стойкие полимеры, такие как полиуретан), коллагеновые каркасы, каркасы внеклеточного матрикса (ECM), включая коллаген фибронектин, ламинин и комбинации вышеперечисленных веществ.
Способы рецеллюляризации ткани или матрикса органа, как описано здесь, включают перфузирование ткани или матрикса органа физиологическим буфером под давлением. Это перфузирование ткани или матрикса органа под давлением производят перед введением любых клеток в матрикс и, сходным образом с перфузией, применяемой для децеллюляризационного процесса, описанного в WO 2007/025233, через сосудистое русло или другую полость или систему трубок (например, через трахею в легкие, через желчные пути в печень, через уретру в почку и т. д.) органа или матрикса ткани, и в целом ее начинают с катетеризации сосудистого русла (например, артерий, вен, артериол, венул и капилляров) и/или других полостей и/или трубок (здесь и далее называемых структурами «типа сосудистого русла») органа или матрикса ткани (приблизительно 1 на приблизительно 300 Hg). Катетеризация, таким образом, включает введение канюли в трубку тела, полость или сосуд, например в трахею, мочевой пузырь или кровеносный сосуд, для введения или удаления жидкости, вещества или шлаков. Как применяют здесь, перфузирование органа или матрикса ткани под давлением относится к доставке жидкой композиции (например, физиологического буфера) под достаточным давлением, так что сосудистое русло и структуры типа сосудистого русла в тканях или матриксе органа остаются открытыми и расширенными, но не на таком высоком, чтобы вызывать повреждение или перерастяжение сосудистого русла и структур типа сосудистого русла в тканях или матриксе органа. Физиологический буфер, подходящий для прецеллюлярной перфузии ткани или матрикса органа под давлением, может представлять собой любой буфер, который совместим с тканью или матриксом органа. Например, физиологические буферы могут включать нутриенты, такие как сахара и углеводы, а также могут включать проэндотелиальные факторы (например, соединения, которые оказывают положительный эффект на эндотелиальные клетки и эндотелий), такие как, например, соединения, которые усиливают ангиогенез (например, VEGF, FGF-1 и/или bFGF). Физиологический буфер имеет в целом физиологический pH.
В одном варианте осуществления физиологический буфер, подходящий для прецеллюлярной перфузии, включает, но не ограничивается физиологическим раствором фосфатного буфера (PBS) или раствором культуральной среды, подходящим для эндотелиальной клеточной культуры, включая без ограничений EGM-2, EGM-2MV, DMEM, PromoCell Endothelial Cell Medium, Medium 200, DMEMF/12, буферы с питательной поддержкой, например, глюкозой, которые можно применять для перфузии органа и/или консервирования, включая трансплантацию. Они включают, например, для сердечной ткани, приготовленный из следующих композиций Модифицированный буфер Krebs-Henseleit (в ммоль): 118 NaCl, 4,7 KCl, 1,2 MgSO4, 1,2 KH2PO4, 25 NaHCO3, 11 глюкозы, 1,75 CaCl2 и 2,0 пирувата и 5 ед/л инсулина, или буфер Krebs, содержащий (в ммоль): 118 NaCl, 4,7 KCl, 25 NaHCO3, 1,2 MgSO4, 1,2 KH2PO4, 2 CaCl2, насыщенный 95% O2, 5% CO2; или глюкозу (например, 11 ммоль) или глюкозу в комбинации с 1 или 1,2 ммоль пальмитата. Для тканей почек типичным средством является KPS-1 Почечный Перфузионный Раствор. Для тканей печени типичным средством является буфер Krebs-Henseleit, содержащий 118 ммоль NaCl, 4,7 ммоль KCl, 1,2 ммоль MgSO4, 1,2 ммоль KH2PO4, 26 ммоль NaHCO3, 8 ммоль глюкозы и 1,25 ммоль CaCl2, дополненный 2% бычьим сывороточным альбумином (BSA).
Хотя отсутствует привязка к какому-либо механизму, считается, что эта прецеллюлярная перфузия под давлением открывает и промывает матрикс и, в особенности, сосудистое русло ткани или матрикса органа, таким образом, обнажая больше матрикса для клеток во время реэндотелизации и позволяя жизнеспособному эндотелию утвердиться по всему сосудистому руслу ткани или матрикса органа. Специалистам в данной области техники следует понимать, что различные ткани и матриксы органов (например, из разных источников, например, сердце, печень, легкое, почка, поджелудочная железа и т.д.) могут выдержать различную величину давления. Величина давления, которое может выдержать конкретную ткань или матрикс органа, связана по меньшей мере частично с сосудистым руслом конкретной ткани или матрикса органа.
Способы рецеллюляризации ткани или матрикса органа, как описано здесь, включают реэндотелизацию ткани или матрикса органа эндотелиальными клетками, полученными из эндотелия, незрелыми эндотелиальными клетками или эндотелиальными клетками-предшественниками. Источники эндотелиальных клеток включают полученные аутогенно, например, при помощи биопсии. Аутогенные эндотелиальные клетки можно получить от пациента путем биопсии артерии, вены или специфической ткани и поместить в клеточную культуру для нормального роста популяции. Выделения эндотелиальных клеток достигают как при помощи условий культивирования, где VEGF или bFGF подавляют загрязняющие клеточные популяции, включая гладкомышечные клетки, или при помощи прямого FACS выделения или других доступных ex vivo способов выделения, таких как применение магнитных микроносителей, микрогидродинамики, лаборатории на чипе, колонки для аффинной хроматографии или комбинированного прибора для популяции для выделения чистой популяции эндотелиальных клеток, основанных на любых их следующих утвержденных маркерах поверхности клетки, включающих, но не ограничивающихся CD31, VEGFR-1, VEGFR-2, CD105, CD144, TEM7, CD146 и/или D2-40.
Эндотелиальные клетки-предшественники (EPC) являются незрелыми эндотелиальными клетками, которые обладают способностью к пролиферации, миграции и дифференцировке в эндотелиальные клетки, но пока еще не приобрели свойств зрелых эндотелиальных клеток. EPC могут мобилизоваться из костного мозга в периферическую кровь (циркулирующие EPC) в ответ на конкретный физиологический стимул, например, повреждение тканей. Циркулирующие EPC идентифицируют в крови взрослого человека (Asahara с соавт. (1997) Science 275:964-967), и последующие изучения предполагают роль EPC в поддержании эндотелиальной сохранности и функционирования, так же как и в постнатальной неоваскуляризации. EPC можно выделять из крови, костного мозга или пуповинной крови, и их определяют в CD34+ клеточной фракции в периферических мононуклеарных клетках взрослого человека. Они могут быть выделены при помощи только CD34+ клеток или CD133+ клеток или при помощи комбинации с KDR+, как EPC-богатая клеточная фракция в периферической крови при помощи прямого FACS выделения или других доступных ex vivo способов выделения, таких как применение магнитных микроносителей, микрогидродинамики, лаборатории на чипе, колонки для аффинной хроматографии или комбинированного прибора. EPC можно вводить прямо в матрикс и культивировать в подходящих условиях для достижения пролиферации и дифференцировки, или культивировать in vitro для увеличения общего числа клеток в EPC сохраняющейся культурной среде, например, культивировать в течение семи дней в бессывороточной среде StemSpan® (StemCell Technologies, Ванкувер, Канада) в течение начального периода расширения и при поддержке 1% пенициллина-стрептомицина (Sigma-Aldrich, Сент Луис, США) и рекомбинантного человеческого (rh) Flt-3 лиганда (100 нг/мл), rh фактора роста стволовых клеток (100 нг/мл), rh ИЛ-3 (20 нг/мл), rh ИЛ-6 (20 нг/мл). Далее эти клетки можно вводить в матрикс как EPC, или предифференцировать в EC и вводить их в матрикс. Дифференцировки EPC можно достичь при помощи таких способов, как культивирование от приблизительно 3×105 до приблизительно 1×106/1,5 мл/9,6 см2 в ростовой среде для эндотелиальных клеток-2 (EGM-2), содержащей FBS (2%), гидрокортизон, hFGF, VEGF, R3-IGF-1, аскорбиновую кислоту, hEGF, гентамицин, амфотерицин-В и гепарин (Lonza, Базель, Швейцария). Через три дня культивирования клетки можно собрать и перенести на тарелочки, покрытые фибронектином (10 мкг/мл) (Sigma-Aldrich, Сент Луис, США), при плотности приблизительно равной 1×106клеток/1,5 мл/9,6 см2, и культивировать в течение дополнительных трех дней в свежей EGM-2 среде.
Популяцию аллогенных эндотелиальных клеток или эндотелиальных клеток-предшественников можно применять и изготавливать из ткани, которая является аллогенной реципиенту, и тестируют для применения хорошо известными способами типирования тканей для наиболее близкого совпадения типа гистосовместимости реципиента. Они включают, но не ограничиваются эндотелиальными клетками пупочной вены человека (HUVEC), генетически модифицированными эндотелиальными клетками для уменьшения иммуногенности, HLA подходящими эндотелиальными клетками, полученными из пуповины эндотелиальными клетками, EC, полученными из EPC, предшественников, iPS или эмбриональными стволовыми клетками. Наиболее аллогенные доступы потребуют применение иммуносупрессирующих средств после трансплантации. Недавние исследования продемонстрировали привилегированное с точки зрения иммунологии положение EC, полученных из EPC (Cardiovasc Res. 2010 Окт 1;88(1):121-9. Epub 2010 Апр 13), где иммунной супрессии после трансплантации не потребуется. Примеры способов EPC дифференцировки включают: выделение EPC из крови путем центрифугирования по градиенту плотности при помощи Pancoll крысы (PAN-Biotech) и проведения CD45-элиминации при помощи CD45 моноклональных антител. Фракцию CD45 (-) культивируют в эндотелиальной дифференцировочной среде [EBM, поддерживаемая 5% FCS, 50 мг/мл гентамицина, 10 нг/мл крысиного VEGF, 1 нг/мл бычьего bFGF, 1- нг/мл мышиного IGF-1 (оба R&D Systems), 10 нг/мл мышиного EGF и 1 мг/мл гидрокортизона] в покрытой 20 мг/мл фибронектина посуде. Не прилипающие клетки удаляют при смене среды каждые 4 дня. Разрастающиеся кластеры клеток появляются спустя приблизительно от 15 до 22 дней культивирования и собираются путем трипсинизации внутри клонзапирающих колец. PECAM-1(+) клетки выбирают при помощи MACS разделения при помощи PECAM-1 антител и IgG1 Микрогранул. PECAM-1(+) фракцию можно дополнительно культивировать до пересева 25 и вводить на множество матриксов.
В дополнение, альтернативой применению иммуносупрессивных технологий, имеются способы замещения гена или нокаута при помощи гомологичной рекомбинации в стволовых клетках, преподаваемые Smithies с соавт., 317 Nature 230-234 (1985) и продолженной в замещении гена или нокауте в линиях клеток (Zheng с соавт., 88 Proc. Natl. Acad. Sci. 8067-8071 (1991)), можно применять в отношении эндотелиальных и полученных из эндотелиальных клеток для абляции генов главного комплекса гистосовместимости (MHC). Клетки, лишенные экспрессии MHC, доступны для трансплантации обогащенных популяций эндотелиальных клеток через аллогенный и, возможно, даже ксеногенный барьер гистосовместимости без необходимости в иммуносупрессии реципиента. Общие обзоры и ссылки по применению рекомбинантных методов для снижения антигенности донорских клеток также раскрыл Gruber, 54 Трансплантация 1-11 (1992). Типичные доступы для снижения иммуногенности трансплантатов путем модифицирования поверхности раскрыты PCT Международной патентной заявкой WO 92/04033 и PCT/US99/24630. Альтернативно, иммуногенность трансплантата можно снизить путем подготовки клеток от трансгенных животных, которая меняет или стирает MHC антигены.
Эндотелиальные клетки-предшественники включают, но не ограничиваются колониеобразующими единицами эндотелиальных клеток (CFU-EC), циркулирующими ангиогенными клетками (CAC), циркулирующими эндотелиальными предшественниками (CEP), эндотелиальными колониеобразующими клетками (ECFC), ECFC с низким пролиферативным потенциалом (LPP-ECFC), ECFC с высоким пролиферативным потенциалом (HPP-ECFC).
В одном варианте осуществления эндотелиальные клетки и эндотелиальные клетки-предшественники получают путем культивирования эмбриональных стволовых клеток (ESC) или индуцированных плюрипотентных стволовых клеток (iPSC) в подходящих условиях, чтобы направить стволовые клетки по эндотелиальной линии дифференцировки. Эндотелиальные клетки-предшественники являются клетками, которые начали дифференцироваться в эндотелиальные клетки (например, например, линейно-специфически; например, клетки, которым суждено стать эндотелиальными клетками), но не считаются полностью дифференцированными эндотелиальными клетками. Например, эндотелиальные клетки-предшественники могут экспрессировать маркер предшественника, такой как CD133, а также могут экспрессировать маркер эндотелиальной клетки, например без ограничений тромбоцитарную эндотелиальноклеточную адгезивную молекулу-1 (PECAM1; также называемый CD31), VEGFR-1 (также называемый Flt-1), VEGFR-2 (также называемый Flk-1), гуанилатсвязывающий протеин-1 (GBP-1), тромбомодулин (также называемый CD141), VE-кадгерин (также называемый CD144), фактор Виллебранда (vWF) и интрацеллюларную адгезивную молекулу (ICAM-2). В целом, эндотелиальные клетки-предшественники также могут абсорбировать ацетилированный LDL и, дополнительно, могут мигрировать по направлению к VEGF и/или формировать трубочки на Матригеле.
ESC или iPSC, такие как человеческие ESC и человеческие iPSC, можно дополнительно культивировать в условиях, которые приведут к полностью дифференцированным эндотелиальным клеткам, например, VEGF и bFGF. Дополнительно или альтернативно эндотелиальные клетки можно получить из любого числа источников, таких как костный мозг, кровь, кожа, печень, сердце, легкое, сетчатка, и любой другой ткани или органа, который содержит эндотелиальные клетки. Например, типичные эндотелиальные клетки включают без ограничений эндотелиальные клетки крови, эндотелиальные клетки костного мозга, циркулирующие эндотелиальные клетки, эндотелиальные клетки аорты человека, эндотелиальные клетки капилляров головного мозга человека, эндотелиальные клетки капилляров кожи человека, эндотелиальные клетки капилляров кишечника человека, эндотелиальные клетки капилляров легкого человека, эндотелиальные клетки капилляров человека, эндотелиальные клетки печеночных синусов, эндотелиальные клетки подкожной вены, эндотелиальные клетки пупочной вены человека, лимфатические эндотелиальные клетки, эндотелиальные клетки микрососудов, эндотелиальные клетки капилляров, эндотелиальные клетки легочной артерии, эндотелиальные клетки капилляров сетчатки, эндотелиальные клетки капилляров сетчатки, эндотелиальные клетки сосудов, эндотелиальные клетки пуповины и их комбинации. Как понимают специалисты в данной области техники, этот список не является исчерпывающим списком эндотелиальных клеток.
EPC можно получить из периферической крови путем выделения мононуклеарных клеток периферической крови (PBMC) путем центрифугирования по градиенту плотности. Суспензии клеток высеивают в любую емкость,