Водорастворимая композиция, обладающая противоопухолевой активностью и способ ее получения
Иллюстрации
Показать всеИзобретение относится к медицине и представляет собой водорастворимую композицию, которая обладает противоопухолевой активностью. Композиция содержит в масс. %: солоксолон метил 4,0-40,0; ПЭГ с молекулярной массой 4000 Да - 40,0-57,4; β-глицин - 10,0-56,0. Изобретение касается также способа получения композиции, способ включает растворение в трет-бутиловом спирте солоксолон метила и ПЭГ при ультразвуковом воздействии и одновременном нагревании смеси до 45-50°С в течение 5-30 минут до полного растворения компонентов, затем добавление β-глицина и повторное воздействие на смесь ультразвука в течение 7-10 мин, замораживание и выдерживание полученной суспензии в течение 4-х часов при температуре -20°С, а затем лиофильную сушку сначала при температуре -20°С до падения давления в камере менее 17 мТорр, а затем при температуре +30°С в течение 2 часов. Технический результат заключается в повышении водорастворимости и противоопухолевой активности композиции. 2 н.п. ф-лы, 3 ил., 2 табл., 7 пр.
Реферат
Группа изобретений относится к области химии и медицины, в частности, к водорастворимой композиции с повышенной фармакологической активностью, состоящей из малорастворимого в воде лекарственного средства солоксолон метила и водорастворимого наполнителя.
В последние годы все внимание химиков-синтетиков уделяется тритерпеновым соединениям, таким как бетулин, бетулоновая, олеаноловая, урсоловая и глицирретовая кислоты. Широкий спектр нативной биологической активности (противовоспалительная, противовирусная, противоопухолевая, иммуностимулирующая и т.д.), высокая энантиомерная чистота и ряд функциональных групп, определяющие направление синтетических превращений, делает данные соединения привлекательным стартовым материалом для получения новых биоактивных соединений, перспективных с точки зрения дальнейшего внедрения в медицинскую практику. Основной проблемой, которая ограничивает применение данных соединений в медицине, пищевой промышленности и сельском хозяйстве, является их низкая растворимость в воде и физиологических средах.
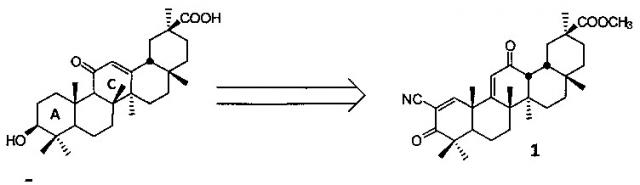
Известно малорастворимое средство тритерпеновой природы «солоксолон метил», представляющее собой метиловый эфир 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты формулы (1), полученное направленной комбинированной модификацией колец А и С природного тритерпенового остова доступного растительного метаболита 18βН-глицирретовой кислоты [Патент RU 2401273 C1, оп. 10.10.2010].
Солоксолон метил (1) показал высокую противоопухолевую активность in vitro по отношению к широкому спектру опухолевых культур, включая карциномную линию клеток, обладающую фенотипом множественной лекарственной устойчивости.
Благодаря вышеперечисленным свойствам солоксолон метил является перспективным лекарственным агентом и может быть использован в разработке лекарственных средств для терапии онкозаболеваний.
Основной проблемой, которая препятствует дальнейшему продвижению солоксолон метила на рынок медицинских агентов, является ограниченная растворимость данного соединения в воде и физиологических средах. В связи с предполагаемым широким использованием солоксолон метила в медицинской практике задача получения водорастворимой формы солоксолон метила с высокой фармакологической активностью и разработка способов получения его водорастворимой формы остается актуальной.
Одним из способов создания водорастворимых форм лекарственных препаратов является получение композиций, состоящих из малорастворимых лекарственных агентов и водорастворимых компонентов природного или синтетического происхождения, например олиго- и полисахаридов, гликолей и др.
В литературе известны водорастворимые композиции лекарственных агентов с циклическими олигомерами глюкозы - циклодекстринами, преимущественно бета-циклодекстрином. В качестве малорастворимого лекарственного вещества композиции содержат нестероидное противовоспалительное средство (парацетамол, ибупрофен, кетопрофен, флуфенамовая и мефенамовая кислоты и др.), стероид, простагландин, простациклин, барбитурат, сульфонамид, сердечный гликозид. [J. Szejtli, Industrial Applications of cyclodextrins. - In Inclusion Compounds, v. 3. ed. Atwood J.L., Davies J.E., Mcnicob D.D., Academic Press, N-Y., 1984, p. 331-390].
Известна водорастворимая композиция, обладающая противовоспалительной и ангиопротекторной активностью, содержащая малорастворимый тритерпеновый препарат дигидрокверцетин и арабиногалактан в соотношении 1:(3,3-96,8) по весу соответственно, а также воду. Способ получения композиции на основе дигидрокверцетина включает смешивание арабиногалактана с водой до полного растворения, затем добавление дигидрокверцетина в соотношении дигидрокверцетин : арабиногалактан, равном 1:(3-100), преимущественно 1:(50-100) по весу соответственно, нагревание раствора до 40-45°С, перемешивание в течение 0,5-1 часа с последующей сушкой полученного раствора методом распыления. Вышеописанная водорастворимая композиция обладает повышенной растворимостью в воде дигидрокверцетина [патент RU 2533231 С1, оп. 20.11.2014].
Известна водорастворимая композиция, обладающая противовоспалительными свойствами, содержащая малорастворимый пентациклический тритерпеноид - урсоловую кислоту и полиэтиленгликоль с мол. массой 6000 Да (ПЭГ-6000) или сополимер этиленгликоля и пропиленгликоля (Poloxamer 407) в соотношении 1:10 по весу соответственно. Способ получения композиции заключается в растворении урсоловой кислоты и соответствующего носителя (ПЭГ-6000 или Poloxamer 407) в метаноле и последующем удалении растворителя на ротационном испарителе. Полученный осадок оставляли стоять при температуре 20°С в течение 24 часов для полного удаления растворителя и затем измельчали при помощи пестика и ступки. Композиция значительно увеличивала концентрацию урсоловой кислоты в водных растворах: так, если концентрация урсоловой кислоты в водных растворах составляла менее 1 мкг/мл, то в случае композиции с ПЭГ-6000 концентрация составляла 8.21 мкг/мл [Eloy J.O., Marchetti J.M. Powder Technology 2014, V. 253, P. 98-106].
Недостатками известной водорастворимой композиции и способа ее получения являются:
1) использование токсичного растворителя (метанол), что накладывает жесткие требования к его остаточному содержанию в композиции;
2) большая продолжительность процесса получения композиции, обусловленная необходимостью длительного выдерживания последней в сушильном шкафу для окончательного удаления метанола, поскольку присутствие даже сравнительно небольших количеств органического растворителя в композиции может существенно влиять на результаты экспериментов по определению растворимости.
Наиболее близкой к заявляемой композиции и способу ее получения (прототипом) является водорастворимая композиция, содержащая 0,1-15% таксифолина (дигидрокверцетин из коры лиственицы); 40-95% полимера, выбираемого из группы: арабиногалактан, полиэтиленгликоли, поливинилпирролидоны, или поливинолы различных молекулярных масс; 0-56% водорастворимого компонента, выбираемого из ряда возможных наполнителей: kollidon VA64 (сополимер винилпирролидона и винилацетата), kollidon 90F (высокомолекулярный поливинилпирролидон с м.м. 1000000-1500000), ludipress (гранулят для прямого прессования, состоящий из лактозы и коллидонов 30 и CL), сахарная пудра, изомальтоза; 0-6% гидрофобного или инертного полимера с целью достижения контролируемого высвобождения лекарственного вещества, где в качестве гидрофобного компонента композиция содержит compritol 888 АТО (композиция моно-, ди- и триглицеридов бегеновой кислоты), в качестве инертного - kollidon SR (смесь полимеров поливинилпирролидона и поливинилацетата).
Способ получения композиции, содержащей таксифолин и полиэтиленгликоль с мол. массой 6000 Да (ПЭГ) в весовом соотношении 1:(7-10), включает следующие стадии: отдельно готовят раствор таксифолина путем растворения последнего (1 г) в 10 мл воды при перемешивании и при нагревании в термостатированном сосуде до полного растворения таксифолина; в сосуд с раствором ПЭГ при перемешивании и термостатировании добавляют раствор таксифолина до получения гомогенной среды с последующими заморозкой и лиофильной сушкой целевого продукта [Патент RU 2351352 С2, оп. 10.04.2009].
Недостатками известной водорастворимой композиции являются сложность состава композиции, использование большого количества импортных труднодоступных компонентов, высокая себестоимость целевого продукта, а также длительность и трудоемкость способа ее получения.
Задачей группы изобретений является создание водорастворимой композиции на основе солоксолон метила с повышенной растворимостью в воде и разработка способа ее получения.
Технический результат: повышение водорастворимости и противоопухолевой активности композиции.
Поставленная задача решается предлагаемой водорастворимой композицией на основе солоксолон метила, включающей следующие компоненты, масс. %:
| солоксолон метил | 4,0-40,0 |
| полиэтиленгликоль-4k | 40,0-57,4 |
| β-глицин | 10,0-56,0 |
Поставленная задача решается также способом получения водорастворимой композиции на основе солоксолон метила, заключающимся в растворении в трет-бутиловом спирте при ультразвуковом воздействии (УЗ-воздействии) последовательно солоксолон метила и полиэтиленгликоля с мол. массой 4000 Да (ПЭГ-4k), затем добавление β-глицина с последующей заморозкой и лиофильной сушкой полученной суспензии.
Для этого в емкость, содержащую трет-бутиловый спирт (1 мл), добавляют солоксолон метил (1,5-5,0 мг) и ПЭГ-4k (6,25-15,0 мг), смесь подвергают воздействию ультразвука при одновременном нагревании до 45-50°С в течение 5-30 минут до полного растворения солоксолон метила и ПЭГ-4k, затем добавляют β-глицин (1,25-21,0 мг) и повторно подвергают смесь воздействию ультразвука в течение 7-10 минут. Полученную суспензию замораживают и выдерживают в течение 4-х часов при температуре -20°С, а затем лиофильно сушат сначала при температуре -20°С до падения давления менее 17 мТорр, а затем при температуре +30°С в течение 2-х часов.
Характеристика используемых реагентов.
В качестве основного носителя для создания композиции используют полиэтиленгликоль с мол. массой 4000 Да (ПЭГ-4k), масс. % 40,0-57,4. При использовании ПЭГ-4k в концентрации ниже 40,0% возможно приготовление композиции только с малым (менее 4,0 масс %) содержанием солоксолон метила, что приводит к существенному увеличению массы композиции, содержащей требуемое количество солоксолон метила и, как следствие, к необходимости существенного увеличения объема раствора для инъекции.
Использование ПЭГ-4k в концентрации выше 57,4% также приводит к существенному увеличению массы композиции, содержащей требуемое количество солоксолон метила, и приводит к необходимости существенного увеличения объема раствора для инъекции.
В качестве второго носителя и инициатора процесса кристаллизации, ответственного за формирование водорастворимой композиции, используют высокодисперсный β-глицин в масс. % 10,0-56,0, не растворимый в выбранном органическом растворителе, который получают способом, описанным в [Патент RU 2425025, опубл. 27.07.2010].
Использование высокодисперсного β-глицина в составе композиции позволяет провести процесс кристаллизации растворителя после замораживания суспензии (отжиг перед сублимационной сушкой) и предотвратить образование высоковязкой метастабильной жидкости при превышении так называемой «температуры стеклования». При отсутствии β-глицина в композиции проведение сублимационной сушки становится практически невозможным вследствие значительно более медленного удаления растворителя из высоковязкого жидкого «раствора». Чтобы избежать этого, необходимо провести процесс кристаллизации растворителя (в некоторых случаях - и растворенного вещества) [Oetjen G.-W., Haseley P. Freeze-Drying. Second Edition. WILEY-VCH, 2004, 395 c.; Milton N., Gopalrathnam G., Craig G.D., Mishra D.S., Roy M.L., Yu L. Correspondence - Vial breakage during freeze-drying: crystallization of sodium chloride in sodium chloride-sucrose frozen aqueous solutions. // J. Pharm. Sci., 2007, 96(7), P. 1848-1853].
Определяющими отличиями предлагаемой водорастворимой композиции и способа ее получения по сравнению с прототипом являются:
1. Заявляемая водорастворимая композиция содержит, масс. %: солоксолон метил 4,0-40,0; ПЭГ-4k 40,0-57,4; β-глицин 10,0-56,0, что позволяет повысить растворимость солоксолон метила в воде в 10-25 раз и увеличить его фармакологическую активность.
2. Для получения композиции на основе солоксолон метила в емкость, содержащую трет-бутиловый спирт, последовательно добавляют солоксолон метил и ПЭГ-4k в соотношении трет-бутиловый спирт : солоксолон метил : ПЭГ-4k, равном 1:(1,5-5,0):(6,25-15,0) по весу соответственно, смесь подвергают воздействию ультразвука при одновременном нагревании до 45-50°С в течение 5-30 минут до полного растворения компонентов, затем добавляют β-глицин в соотношении солоксолон метил : β-глицин, равном 1:(0,25-14,0) по весу и повторно подвергают смесь воздействию ультразвука в течение 7-10 минут с последующим замораживанием и выдерживанием полученной суспензии в течение 4-х часов при температуре -20°С, что позволяет получить суспензию, в которой малорастворимое активное вещество (солоксолон метил) равномерно распределено по всему объему хорошо растворимых наполнителей (ПЭГ-4k и β-глицин), что способствует увеличению скорости растворения композиции.
3. Лиофильную сушку замороженной суспензии осуществляют сначала при температуре -20°С до падения давления менее 17 мТорр, а затем при температуре +30°С в течение 2-х часов, что позволяет получить целевой продукт в виде высокодисперсного легкого пушистого порошка, растворимого в воде.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение водорастворимой композиции (1)
Во флаконе прозрачного боросиликатного стекла к 4 мл трет-бутилового спирта добавляли последовательно 6 мг солоксолон метила и 60 мг ПЭГ-4k, смесь подвергали воздействию ультразвука (в герметично закрытом флаконе) в ультразвуковой ячейке (передающая среда: вода, температура +45°С) на базе прибора УЗДН-2Н в течение 5 минут до полного растворения компонентов, затем добавляли 84 мг высокодисперсного β-глицина и повторно подвергали смесь воздействию ультразвука в течение 7 минут. Полученную суспензию порциями по 1,000 мл (пипетка-дозатор) быстро помещали в предварительно нагретые до +50°С флаконы темного стекла (Sci/Spec, В75592), которые сразу же помещали на охлажденную до -20°С полку установки лиофильной сушки и выдерживали в течение 4 часов при этой температуре. Сушку (первая стадия сушки) проводили при -20°С до падения давления в камере менее 17 мТорр. Затем температуру полки повышали до +30°С с выдерживанием в течение 2 часов (вторая стадия сушки) при этой температуре. После этого давление в камере повышали до 1 атмосферы заполнением камеры сушки сухим азотом, камеру открывали, доставали флаконы и герметично закрывали их крышками с тефлоновым уплотнением.
В результате получили водорастворимую композицию (1) следующего состава, масс. %:
| солоксолон метил | 4,0 |
| ПЭГ-4k | 40,0 |
| β-глицин | 56,0 |
Композицию-контроль (1а) для композиции (1) получали аналогично примеру 1 за исключением того, что к 4 мл трет-бутилового спирта добавляли 66 мг ПЭГ-4k и 84 мг высокодисперсного β-глицина. В результате получили композицию следующего состава, масс. %:
| ПЭГ-4k | 44,0 |
| β-глицин | 56,0 |
Пример 2. Получение водорастворимой композиции (2)
Композицию (2) получали аналогично примеру 1 за исключением того, что к 6,0 мл трет-бутилового спирта добавляли последовательно 24,3 мг солоксолон метила и 42,7 мг ПЭГ-4k, смесь подвергали воздействию ультразвука (в герметично закрытом флаконе) в ультразвуковой ячейке (передающая среда: вода, температура +50°С) на базе прибора УЗДН-2Н в течение 30 минут до полного растворения компонентов, затем добавляли 7,5 мг высокодисперсного β-глицина и повторно подвергали смесь воздействию ультразвука в течение 10 минут.
В результате получили водорастворимую композицию (2) следующего состава, масс. %:
| солоксолон метил | 32,6 |
| ПЭГ-4k | 57,4 |
| β-глицин | 10,0 |
Композицию-контроль (2а) для композиции (2) получали аналогично примеру 2 за исключением того, что к 6,0 мл трет-бутилового спирта добавляли 67,5 мг ПЭГ-4k и 7,5 мг высокодисперсного β-глицина и подвергали воздействию ультразвука. В результате получили композицию следующего состава, масс. %:
| ПЭГ-4k | 90,0 |
| β-глицин | 10,0 |
Пример 3. Получение водорастворимой композиции (3)
Композицию (2) получали аналогично примеру 1 за исключением того, что к 6,0 мл трет-бутилового спирта добавляли последовательно 30 мг солоксолон метила, 37,5 мг ПЭГ-4k, смесь подвергали воздействию ультразвука (в герметично закрытом флаконе) в ультразвуковой ячейке (передающая среда: вода, температура +50°С) на базе прибора УЗДН-2Н в течение 30 минут до полного растворения компонентов, затем добавляли 7,5 мг высокодисперсного β-глицина и повторно подвергали смесь воздействию ультразвука в течение 10 минут. В результате получили композицию (3) следующего состава, масс. %:
| солоксолон метил | 40,0 |
| ПЭГ-4k | 50,0 |
| β-глицин | 10,0 |
Композицию-контроль (3а) для композиции (3) получали аналогично примеру 1 за исключением того, что к 6,0 мл трет-бутилового спирта добавляли 67,5 мг ПЭГ-4k и 7,5 мг высокодисперсного β-глицина и подвергали воздействию ультразвука. В результате получили композицию следующего состава, масс. %:
| ПЭГ-4k | 90,0 |
| β-глицин | 10,0 |
Пример 4. Исследование физико-химических свойств полученных композиций
Водорастворимые композиции, полученные по предлагаемому способу, представляют собой чрезвычайно легкие пушистые порошки. На фиг. 1 проиллюстрировано сравнение насыпных объемов и морфологии порошков высокодисперсной формы солоксолон метила (слева) и высокодисперсной композиции (1) (справа) (массы солоксолон метила в виде высокодисперсного порошка и композиции (1) одинаковы). Объем флакона ~25 мл. На фиг. 1 видно, что в случае чистого солоксолон метила происходит электризация порошка и агломерация образующихся дисперсных частиц, что чрезвычайно затрудняет работу с такими объектами. Гидрофильные компоненты композиции, взятые в экспериментально полученных оптимальных концентрациях, позволяют перевести гидрофобный компонент (солоксолон метил) в водный раствор.
На фиг. 2 представлены электронные микрофотографии (исследовательский сканирующий электронный микроскоп EVO МА10 (Carl Zeiss)) образцов высокодисперсной формы солоксолон метила (А-В) и высокодисперсной композиции (1) (Г-Е), а на фиг. 3 представлены микрофотографии образцов высокодисперсной композиции (3).
Таким образом, по данным сканирующей электронной микроскопии полученные высокодисперсные композиции (1) и (3) состоят из двух типов частиц: перфорированных листов (толщина около 100 нм) с линейными размерами 10-100 мкм (ПЭГ-4k и солоксолон метил) и небольших (1-5 мкм) плоских частиц (частицы β-глицина, полученные воздействием ультразвука).
Дифракционные исследования показали, что как в случаях высокодисперсных композиций (1), (2) и (3), так и в случаях композиций-контролей (1а), (2а) и (3а) происходит аморфизация как полимерного носителя, так и солоксолон метила. Глицин не претерпевает полиморфных превращений в процессе получения и присутствует во всех композициях в виде β-полиморфной модификации.
Анализ ИК-спектров композиций в сравнении с ИК-спектрами исходных компонентов (ИК-фурье спектрометр Digilab Excalibur 3100. Запись спектров неполного внутреннего отражения в диапазоне 600-4000 см-1 с разрешением 2 см-1. Пробоподготовка в виде предварительного растирания в ступке или прессования в таблетки с KBr отсутствовала) показывает, что частота валентных колебаний N-H связи в глицине, а также валентных колебаний С-Н в ПЭГ-4k и солоксолон метиле не изменяет своего положения при образовании указанной композиции, что говорит об отсутствии водородного связывания с участием указанных групп (частота валентных колебаний N-H связи 3179 и 3178 см-1 в композиции и в чистом β-глицине соответственно; валентные колебания С-Н появляются в виде мультиплета при 2884 и 2883 см-1 в композиции (3) и ПЭГ-4k соответственно). Наличие всех трех компонентов в композиции (3) отчетливо видно при рассмотрении области скелетных колебаний (600-1700 см-1). Глицин присутствует в композициях в виде метастабильной β-полиморфной модификации, то есть не претерпевает фазовых переходов в процессе приготовления. В композициях-контролях наблюдается похожая картина: образования водородных связей между ПЭГ-4k и β-глицином не происходит, глицин содержится в виде β-формы. Таким образом, результаты исследований с использованием ИК-спектросокопии демонстрируют отсутствие химического связывания компонентов композиции друг с другом.
Калориметрические измерения, проведенные с образцом композиции (3), также демонстрируют отсутствие химического связывания компонентов композиции друг с другом.
Таким образом, плохо растворимое лекарственное вещество (солоксолон метил) не образует в композиции химических связей с ПЭГ-4k и β-глицином и равномерно распределено по всему объему хорошо растворимых наполнителей: (ПЭГ-4k) и β-глицина, за счет чего достигается высокая скорость высвобождения лекарственного вещества из композиции.
Пример 5. Исследование водорастворимости полученных композиций
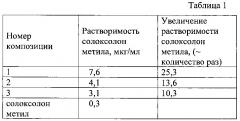
Проведен эксперимент по исследованию растворимости полученных композиций (1-3). Для этого образцы растворяли в 100 мл среды Opti MEM (улучшенная минимальная питательная среда) при температуре 20°С на магнитной мешалке (400 об/мин). Концентрацию солоксолон метила в растворе определяли фотометрическим методом ВЭЖХ. Результаты исследования представлены в таблице 1.
Из таблицы 1 видно, что растворимость солоксолон метила в воде увеличилась в 10-25 раз в зависимости от содержания последнего в композиции.
Пример 6. Исследование цитотоксической активности композиций в отношении опухолевых клеток человека in vitro
Цитотоксичность композиций (1), (2) и (3) в отношении опухолевых клеток человека in vitro оценивали по снижению жизнеспособности клеток эпидермоидной карциномы КВ-3-1 после их инкубации в присутствии исследуемого препарата. С данной целью был проведен МТТ-тест, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в лунке.
Композиции растворяли в среде ДМЕМ (минимальная эссенциальная среда Игла, модифицированная по способу Дульбекко) до концентрации 20 мкМ и использовали данный раствор в качестве стокового. Композиции-контроли (1а), (2а) и (3а) растворяли в том же объеме ДМЕМ, что и композиции (1), (2) и (3). В качестве референсного препарата использовали солоксолон метил, предварительно растворенный в диметилсульфоксиде (ДМСО) до концентрации 0.1 М. Клетки КВ-3-1 высаживали в 96-луночные планшеты для получения монослоя в среде DMEM, содержащей 10%-ную эмбриональную телячью сыворотку, и инкубировали при 37°С, 5% СО2. Через 24 часа в лунках меняли среду на среду DMEM без сыворотки и вносили исследуемые композиции (1), (1а), (2), (2а), (3), (3а) или солоксолон метил в различных концентрациях. Клетки инкубировали в присутствии указанных препаратов в течение суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0,5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность в лунках на многоканальном спектрофотометре MultiscanRC («ThermoLabSystems», Финляндия) на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а А630 - фон клеток. По результатам теста определяли значение IC50 - концентрацию соединения, при которой наблюдается гибель 50% клеток. За 100% принимали интактные клетки. Результаты исследования представлены в табл. 2.
Как видно из таблицы 2, все полученные композиции обладают цитотоксическим действием в отношении клеток КВ-3-1, причем уровень противоопухолевой активности данных композиций оказался выше активности референсного соединения - значение IC50 солоксолон метила составило 0.70 мкМ, в то время как значение IC50 композиций (1), (2), (3) было ниже и составило соответственно 0.55 мкМ, 0,27 и 0,37 мкМ. Композиции-контроли (1а), (2а), (3а), содержащие только ПЭГ-4k и β-глицин, цитотоксического действия на клетки не оказывали.
Пример 7. Исследование токсичности композиции (3) на мышиной модели in vivo
Мыши линии СВА были распределены на 8 групп, содержащих по 3 мыши в каждой. Композицию (3) растворяли в среде Opti-MEM (GIBCO™, LifeTechnologies, США) в концентрации 0.25 мг/мл и вводили мышам в дозе 5 мг/кг. Мыши группы 1 получали инъекции препарата внутривенно, группы 2 - внутрибрюшинно, группы 3 - подкожно, группы 4 - перорально. Группы 6-8 являлись соответствующими контролями для групп 1-4 и получали инъекции композиции, содержащей только ПЭГ и глицин (ПЭГ-4k - 90 масс. %, β-глицин - 10 масс. %). Композицию (3) вводили три раза с перерывом в 1 сутки, ежедневно контролируя вес подопытных животных. На 6 сутки мышей выводили из эксперимента и отбирали пробы крови.
Было показано, что трехкратное введение композиции (3) не оказывает токсического действия на лабораторных животных - в процессе эксперимента вес животных в опытных группах не снижался. Более того, проведенный анализ крови лабораторных животных показал отсутствие какого-либо влияния исследуемой композиции на состав форменных элементов крови.
Таким образом, полученные композиции проявляют высокую активность в отношении ингибирования роста опухолевых клеток, являются низкотоксичными и обладают хорошей растворимостью в воде, пригодны для инъекционного введения в организм. Данные композиции могут быть использованы при разработке водорастворимых лекарственных форм препаратов, полученных из доступного растительного сырья, предназначенных для лечения опухолевых заболеваний.
1. Водорастворимая композиция, обладающая противоопухолевой активностью, включающая активный компонент и физиологически приемлемый наполнитель, отличающаяся тем, что в качестве активного компонента она содержит солоксолон метил, а в качестве наполнителей - полиэтиленгликоль с мол. массой 4000 Да (ПЭГ-4k) и β-глицин при следующем содержании компонентов, масс. %:
| солоксолон метил | 4,0-40,0, |
| ПЭГ-4k | 40,0-57,4 |
| β-глицин | 10,0-56,0 |
2. Способ получения водорастворимой композиции по п. 1, включающий смешивание исходных компонентов с последующей заморозкой и сушкой целевого продукта в камере установки лиофильной сушки, отличающийся тем, что к трет-бутиловому спирту последовательно добавляют солоксолон метил и ПЭГ-4k в соотношении трет-бутиловый спирт: солоксолон метил: ПЭГ-4k, равном 1:(1,5-5,0):(6,25-15,0) по весу, смесь подвергают воздействию ультразвука при одновременном нагревании до 45-50°С в течение 5-30 минут до полного растворения компонентов, затем добавляют β-глицин в соотношении солоксолон метил: β-глицин, равном 1:(0,25-14,0) по весу, и повторно подвергают смесь воздействию ультразвука в течение 7-10 минут, полученную суспензию замораживают и выдерживают в течение 4-х часов при температуре -20°С, а затем лиофильно сушат сначала при температуре -20°С до падения давления в камере менее 17 мТорр, а затем при температуре +30°С в течение 2 часов.