Средство, обладающее сочетанным нормализующим воздействием на иммунную и пищеварительную системы организма
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и медицины и касается средства для перорального введения, обладающего сочетанным нормализующим воздействием на иммунную и пищеварительную системы, которое в качестве активного начала содержит смесь карбоновых кислот С1-С4, аминокислот и их солей при следующем соотношении ингредиентов, мас.%: аланин - 0,1-0,4, аспарагиновая кислота - 0,05-2,0; валин - 0,5-1,5, глицин - 0,05-0,2; глутаминовая кислота - 0,5-2,0; лейцин - 0,1-0,4; лизина гидрохлорид - 0,5-2,0; карбоновые кислоты С1-С4 от 1,5 до 25; вода – остальное, а в качестве карбоновых кислот С1-С4 оно содержит уксусную, молочную, янтарную и муравьиную кислоты, при их концентрации в конечном продукте в интервале, мас.%: уксусная кислота - 1,0-15,0%; молочная кислота - 0,2-5,0%; янтарная кислота - 0,15-3,0%; муравьиная кислота - 0,1-2,0%. Изобретение обеспечивает стимуляцию клеточного иммунного ответа, усиление гуморального иммунного ответа, а также обладает терапевтическим действием при эрозивно-язвенных поражениях желудочно-кишечного тракта. 1 з.п. ф-лы, 9 пр., 11 табл., 3 ил.
Реферат
Изобретение относится к медицине, а именно к препаратам для лечения заболеваний иммунной системы и желудочно-кишечного тракта (ЖКТ) с использованием методов, основанных на нормализации микробиоты хозяина (человека или животных), и может быть использовано в медицине, ветеринарии, пищевой промышленности и прикладной биотехнологии.
В настоящее время препараты на основе пробиотиков (живых микроорганизмов или веществ микробного происхождения) находят широкое применение в практической медицине для лечения заболеваний желудочно-кишечного тракта и ряда других заболеваний (ЕР 0097484, 1984, ЕР 0043962, 1980; US 4289888, 1979, RU 2064269, 1994; SU 1227145, 1983; RU 2080795, 1997). Так, широкое распространение, в частности, получили пробиотик Бактисубтил (фирма "Marion Merrell", Франция) и его аналог Флонивин БС (фирма "Galenika", Сербия), содержащие культуру штамма Bacillus cereus IP 5832 (коллекция Института Пастера (Париж)). Основой Энтерогермина (фирма "Sanofi Winthrop", Италия) является культура Bac.cereus. Известны также биопрепараты Цереобиоген ("Xing Jian", Китай), действующим началом которого является штамм Bac.cereus DM-423 (В.В. Смирнов, С.Р. Резник, И.Б. Сорокулова, В.А. Вьюницкая. Дискуссионные вопросы создания и применения бактериальных препаратов для коррекции микрофлоры теплокровных // Микробиол. журн., 1992, т. 54, №6, с. 82-93), лечебно-профилактический биопрепарат Бактиспорин для лечения широкого круга заболеваний, содержащий лиофильно высушенную биомассу штамма Bacillus subtilis ЗН и защитную среду на основе сахарозо-желатиновой смеси или лактозы (RU 2130316, 1999), препарат Биоспорин для профилактики и лечения желудочно-кишечных заболеваний человека, содержащий живые клетки штаммов Bacillus subtilis 3 (ВКПМ № В-2335) и Bacillus licheniformis 31 (ВКПМ № В-2336), а также наполнитель (RU 1722502, 1992). Противовоспалительный эффект отмечался (RU 2468808, 2012) при использовании пищевой композиции, содержащей инактивированную Lactobacillus rhamnosus GG, иммунонормализующее действие при иммунокоррекции онкологических больных отмечалось (RU 2477751, 2013; RU 2230113, 2006; RU 2127119, 2001) при использовании пробиотика на основе Corynebacteriae diphtheriae; для коррекции иммунной недостаточности и профилактики желудочно-кишечных болезней новорожденных телят предлагается использовать пробиотик на основе настоя, ферментированного микроорганизмами «ЭМ-Курунги» (RU 2535014, 2014).
Общим недостатком препаратов на основе пробиотиков является их относительно невысокая биологическая активность, связанная с процессом дезактивации живых микроорганизмов при их прохождении через верхние отделы ЖКТ (желудок, двенадцатиперстная кишка), отсутствие стабильности их биологических свойств при длительном хранении, что ведет к снижению эффективности лечебно-профилактических процедур, а также использование в его составе живых микроорганизмов, что затрудняет или исключает его использование в комплексной терапии со многими антибиотиками, а также наличие негативного влияния на нормальную микрофлору ЖКТ.
1. В настоящее время наряду с пробиотиками, находящими широкое применение в медицине, все большее внимание уделяется применению для лечения различных заболеваний бактериальных метаболитов, выделяемых ими в среду обитания в различных, в том числе и неблагоприятных условиях. В частности, метаболиты бактерий нормофлоры являются важным фактором функциональной и иммунологической активности микробиоценоза человека, способствуют подавлению развития патогенной микрофлоры и оказывают непосредственное позитивное влияние на организм хозяина, в том числе и на его иммунологический статус (Вахитов Т.Я., Петров Л.Н., Бондаренко В.М. Концепция пробиотического препарата, содержащего оригинальные микробные метаболиты // Журн. микробиол. - 2005 - №5 - С. 108-114; Вахитов Т.Я., Петров Л.Н. Регуляторные функции экзометаболитов бактерий // Микробиология - 2006. - Т. 75. - №4 - С. 483-488; Вахитов Т.Я., Петров Л.Н., Бондаренко В.М., Воробьев А.А. Перспективы создания пробиотических препаратов на основе чувства кворума у бактерий // Журн. микробиол. - 2006. - №3. - C. 105-113).
В этой связи авторами было высказано предположение, что применение препаратов на основе бактериальных экзометаболитов позволит повысить эффективность лечения и профилактики заболеваний, расширить сферу использования пробиотических препаратов, в частности, они могли бы быть рекомендованы для повышения эффективности терапии заболеваний, при которых наблюдаются нарушения микроэкологического статуса и иммунодефицитные состояния (острые кишечные инфекции и острые респираторные заболевания, вызванные условно-патогенными микроорганизмами, лучевая болезнь и т.д.).
В настоящее время метаболиты бактериальных клеток являются перспективным направлением для лечения ряда заболеваний, как правило, входя в качестве составной части в лекарственные препараты. В частности, было показано, что метаболиты бактериальных клеток Bacillus subtilis штамм 3/28 (59Т) в сочетании с клетками бактерий оказывают гепатопротекторное действие (RU 2429869, 2009); комплекс метаболитов бифидобактерий как активное начало оказывает в сочетании с растительными экстрактами и эфирными маслами оздоравливающее воздействие на кожные покровы (RU 2241441, 2004) и т.д.
Наиболее близким по достигаемому эффекту к заявляемому изобретению является препарат «Бактистатин» (RU 2287335, 2006), который проявил себя как средство с многогранной клинической эффективностью при лечении больных с дисбактериозом кишечника различного генеза, в качестве средства, оказывающего иммуномодулирующее действие, а также препарата, положительно влияющего на психологический статус больных и способствующего повышению их качества жизни. Препарат представляет собой стерилизованную культуральную жидкость, содержащую метаболиты Bacillus subtilis, смешанную с цеолитом, гидролизатом соевой муки и вспомогательными добавками.
Недостатком Бактистатина является нестабильный состав и невысокая эффективность в качестве иммуномодулятора.
Техническая задача, решаемая авторами, состояла в создании средства, имеющего стабильный стандартизированный состав и проявляющего повышенную эффективность при воздействии на иммунную и иные системы организма.
В ходе работ, проведенных авторами в области исследования состава бактериальных метаболитов, удалось установить перечень ингредиентов, оказывающих наиболее активное воздействие на клетки организма и разработать на их основе рецептуру средства, обладающего сочетанным нормализующим воздействием на иммунный статус и пищеварительную систему человека.
Технический результат был достигнут в результате создания средства, содержащего в качестве активного начала смесь карбоновых кислот С1-С4, аминокислот и их солей при следующем соотношении ингредиентов, % масс.:
аланин - 0,1-0,4,
аспарагиновая кислота - 0,05-2,0;
валин - 0,5-1,5;
глицин - 0,05-0,2;
глутаминовая кислота - 0,5-2,0;
лейцин - 0,1-0,4;
лизина гидрохлорид - 0,5-2,0;
карбоновые кислоты С1-С4 от 1,5 до 25;
вода - остальное.
В качестве карбоновых кислот С1-С4 средство, как правило, содержит уксусную, молочную, янтарную и муравьиную кислоты. При этом оптимальные результаты достигаются при их концентрации в конечном продукте в интервале, % масс:
уксусная кислота - 1,0-15,0;
молочная кислота - 0,2-5,0;
янтарная кислота - 0,15-3,0;
муравьиная кислота - 0,1-2,0.
Особенностью заявляемого средства является оптимальное соотношение между аминокислотами и карбоновыми кислотами, что обеспечивает их комплексное воздействие на микробиоту и ее хозяина. Заявляемый диапазон концентраций оптимален при воздействии на клетки. Снижение концентрации ингредиентов ниже заявляемого диапазона снижает эффективность композиции, введение ингредиентов в концентрации, превышающей заявляемый диапазон, возможно, но не дает существенного повышения эффективности, т.е. экономически нецелесообразно.
Так как вышеуказанные кислоты находятся в растворе в диссоциированном состоянии, а эффективность их действия определяется сочетанием анионов, то вместо кислот в смесь могут вводиться соответствующие количества их водорастворимых солей. Оптимально для нейтрализации кислот в смесь вводить едкий натр или иные щелочные агенты до достижения рН 4,5-7,5.
В качестве вспомогательных веществ заявляемое средство может дополнительно содержать метионин в концентрации 0,1-1,0% масс., рибофлавин в концентрации 0,001-0,005% масс. и/или фолиевую кислоту в концентрации 0,001-0,02% масс.
Как показали проведенные эксперименты, наиболее благоприятное воздействие на организм достигается при использовании средства, имеющего следующий состав, % масс.: аланин - 0,2, аспарагиновая кислота - 0,1; валин - 0,7, глицин - 0,12; глутаминовая кислота - 0,67; лейцин - 0,15; лизина гидрохлорид - 0,8; натрия ацетат - 11,6; молочная кислота - 2,5; янтарная кислота - 1,6; муравьиная кислота - 1,1; метионин - 0,34; рибофлавин - 0,0025; фолиевая кислота - 0,005; едкий натр - до рН 4,6-6,5; вода - остальное.
Средство получают путем смешивания ингредиентов, растворения смеси в воде и, при необходимости, введения едкого натра до заданной величины рН.
В соответствующих экспериментах было показано, что данное средство, получившее условное название АС, стимулирует рост представителей нормофлоры человека приблизительно в 8-15 раз эффективнее, чем его известные аналоги микробного происхождения. Объясняется это отсутствием в нем других (балластных) веществ и метаболитов, соответствующим выбором компонентов и более оптимальным их соотношением. Было показано, что оно стимулирует клеточный иммунный ответ, усиливая митоген-индуцированную и антиген-специфическую пролиферацию клеток селезенки и продукцию ими ИЛ-2; значительно усиливает гуморальный иммунный ответ, повышая содержание в сыворотке крови антиген-специфических антител класса IgG, и снижает количество антител класса IgE; при внутрижелудочном введении АС усиливает местный иммунный ответ лимфоидной ткани, ассоциированной со слизистой кишечника, увеличивая синтез антиген-специфических антител класса IgA; при иммунизации корпускулярным антигеном (эритроциты барана) его использование вызывает увеличение количества антителообразующих клеток в селезенке.
АС получается путем смешения высококачественных коммерческих продуктов - карбоновых кислот и протеиногенных (кодируемых) аминокислот. Оно не содержит белков, пептидов и других высокомолекулярных соединений, способных вызывать аллергию и, в отличие от обладающих сходным (пробиотическим) действием бактериальных препаратов, не может способствовать развитию аллергических реакций. В состав препарата входят только те соединения, которые в норме продуцируются микрофлорой и клетками самого организма, содержатся в его тканях и органах, поступают в кровоток и циркулируют в нем, удовлетворяя потребности организма в низкомолекулярных продуктах обмена веществ. При этом все эти соединения в заявляемых концентрациях нетоксичны и не могут представлять потенциальной опасности для организма.
Проведенные доклинические испытания показали, что в остром эксперименте ЛД50 при внутрижелудочном введении находится в пределах от 10840 до 12300 мг/кг, что позволяет отнести его к практически нетоксичным лекарственным веществам. Результаты токсикометрии и некропсии позволяют отнести препарат АС к V классу практически нетоксичных лекарственных веществ, а состояние перенесших острую интоксикацию животных свидетельствует о хорошей переносимости препарата. Изучение возможных аллергенных, иммунотоксических, мутагенных, эмбриотоксических и тератогенных свойств препарата подтвердило отсутствие у него специфической токсичности.
Применение препарата в дозе 5000 мг/кг в/ж показало, что общее состояние и поведение экспериментальных животных (мыши, крысы, собаки) носили нормальный характер и не отличались от таковых у животных из контрольных групп. По данным некропсии препарат при однократном введении не вызывает патологических изменений головного мозга, внутренних и эндокринных органов.
При изучении подострой и хронической токсичности было показано, что ежедневное пероральное введение препарата АС в течение 90 дней в дозах 50 и 1000 мг/кг крысам и собакам обоего пола не приводит к развитию патологических сдвигов со стороны общего состояния и поведения животных, не оказывает токсического воздействия на сердечно-сосудистую деятельность, морфологический состав, биохимические и другие показатели периферической крови и костного мозга, на функциональное состояние печени и почек, белковый, углеводный, жировой и электролитный виды обмена веществ, не вызывает дистрофических, деструктивных, очаговых склеротических изменений в паренхиматозных клетках и строме внутренних органов, а также не сопровождается местно-раздражающим действием.
Изучение возможных аллергенных, иммунотоксических, мутагенных, эмбриотоксических и тератогенных свойств препарата подтвердило отсутствие у него специфической токсичности.
АС представляет собой прозрачный раствор желтого цвета (в случае наличия рибофлавина и фолиевой кислоты) или прозрачный бесцветный раствор с характерным запахом низших карбоновых кислот (муравьиная и уксусная) и меркаптанов (метионина).
Свойства препарата иллюстрируются следующими графическими материалами:
На фиг. 1 показано влияние АС-1 на пролиферацию клеток линии СаСо-2 (прямой подсчет клеток). По оси абсцисс концентрация препарата АС.
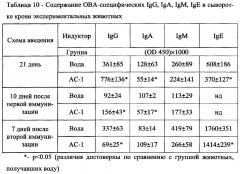
На фиг. 2 показано содержание ОВА-специфических секреторных IgA в экстракте фекалий экспериментальных животных в зависимости от получаемой дозы АС. По оси абсцисс - доза АС в мг/кг. *-р<0.05 (различия достоверны по сравнению с группой животных, получавших воду)
На фиг. 3 показано влияние препарата АС при различных схемах его введения на количество антителообразующих клеток в селезенке мышей. *-р<0.05 (различия достоверны по сравнению с группой животных, получавших воду).
Практическая применимость средства иллюстрируется следующими примерами.
Пример 1. Получение препаратов АС
Путем смешения ингредиентов и последующим растворением их в воде были получены композиции следующего состава:
АС-1 (опт) аланин - 0,2%, аспарагиновая кислота - 0,1%; валин - 0,7%, глицин - 0,12%; глутаминовая кислота - 0,67%; лейцин - 0,15%; лизина гидрохлорид - 0,8%; натрия ацетат - 11,6%; молочная кислота - 2,5%; янтарная кислота - 1,6%; муравьиная кислота - 1,1%; метионин - 0,34%; рибофлавин - 0,0025%; фолиевая кислота - 0,005%; NaOH - 0,9% до рН 4,7.
АС-2 (без вспомогательных веществ): аланин - 0,2%, аспарагиновая кислота - 0,1%; валин - 0,7%, глицин - 0,12%; глутаминовая кислота - 0,67%; лейцин - 0,15%; лизина гидрохлорид - 0,8%; уксусная кислота - 8,5%; молочная кислота - 2,5%; янтарная кислота - 1,6%; муравьиная кислота - 1,1%; NaOH - 0,9% до рН 4,7 (кислоты C1-C4 - 16,8%).
АС-3: аланин - 0,1%, аспарагиновая кислота - 2,0%; валин - 0,5%, глицин - 0,2%; глутаминовая кислота - 0,5%; лейцин - 0,4%; лизина гидрохлорид - 0,5%; натрия ацетат - 1,0%; молочная кислота - 0,2%; янтарная кислота - 0,19%; муравьиная кислота - 0,1%; метионин - 0,1%; рибофлавин - 0,005%; фолиевая кислота - 0,001%; NaOH - до рН 7,5; вода - остальное.
АС-4: аланин - 0,4%, аспарагиновая кислота - 0,05%; валин - 1,5%, глицин - 0,05%; глутаминовая кислота - 0,5%; лейцин - 0,4%; лизина гидрохлорид - 0,5%; натрия ацетат - 15,0%; молочная кислота - 5,0%; янтарная кислота - 3,0%; муравьиная кислота - 2,0%; метионин - 1,0%; рибофлавин - 0,001%; фолиевая кислота - 0,02%; вода - остальное. рН 4,5.
КК: уксусная кислота 11,6%; молочная кислота - 2,5%; янтарная кислота - 1,6%; муравьиная кислота - 1,1%.
АК: аланин - 0,2%, аспарагиновая кислота - 0,1%; валин - 0,7%, глицин - 0,12%; глутаминовая кислота - 0,67%; лейцин - 0,15%; лизина гидрохлорид - 0,8%.
Пример 2. Воздействие состава АС на гомеостаз клеток и продукцию ими медиаторов иммунного ответа
Влияние состава АС и его компонентов на пролиферативную активность клеток иммунной системы изучали в экспериментах с диссоциированными культурами ткани селезенки лабораторных животных (мышей).
Определение пролиферативной активности клеток диссоциированной культуры ткани селезенки (полностью дифференцированные Т- и В-лимфоциты или спленоциты) проводили по включению Н3-меченого тимидина в ДНК клеток.
Для получения культуры спленоцитов асептически забирали селезенки лабораторных животных (мыши гибриды F1 (СВА×С57В1), и измельчали ножницами, затем добавляли 5 мл забуференного физиологического раствора (PBS) и суспендировали с помощью шприца. Клеточную суспензию фильтровали через двойной слой марли и центрифугировали. Затем лизировали эритроциты 0,86% раствором NH4Cl, дважды отмывали клетки в PBS, ресуспендировали в среде RPMI-1640 (Sigma) с 2,0 мМ L-глутамина, 50 мкМ 2-меркаптоэтанола и 10 мкг/мл гентамицина (полная среда) и считали количество клеток в камере Горяева. Затем клетки селезенки (спленоциты) вносили в 96-луночные плоскодонные культуральные платы (Costar) (5×105 клеток на лунку), добавляли полную питательную среду с 10% FBS. Препараты с различным содержанием карбоновых и аминокислот и/или их солей вносили в объеме 50 мкл, так, чтобы конечная концентрация препарата составляла 10 мкг/л. Общий объем суспензии в лунках составлял 200 мкл. Платы помещали на 24, 48 и 72 часа в СО2 инкубатор при температуре 37°C, в атмосфере 5% СО2 в условиях абсолютной (100%) влажности. За 20 часов до окончания инкубации во все лунки планшета вносили по 40 μБк рабочего раствора Н3-тимидина («Изотоп», С-Петербург) в объеме 20 мкл.
По окончании инкубации клетки переносили на стекловолоконные фильтры с помощью харвестера (Filter Mate Harvester 96 «Perkin Elmer»), которые затем промывали дистиллированной водой. Фильтры сушили в сушильном шкафу, затем пропитывали сцинтиллятором Betaplate Scint («Perkin Elmer») и определяли интенсивность включения тимидина на планшетном b-счетчике MicroBeta TriLux 1450 («Perkin Elmer»). Результаты выражали в количестве импульсов в минуту (имп/мин). Полученные значения сравнивались с контрольными. Достоверность различий определялась по t-критерию Стьюдента. Статистическая обработка производилась с использованием пакета программ «Microsoft Excel». Полученные результаты приведены в таблице 1.
Анализ полученных результатов показывает, что наиболее высокую активность проявляют композиции АС-1 и АС-2.
Пример 3. Влияние состава препарата АС на дисбактериоз, вызванный хронической свинцовой интоксикацией
В качестве модели дисбактериоза при хронической свинцовой интоксикации использовали внутрижелудочное введение белым крысам ацетата свинца в дозе 0,3 мг/кг в пересчете на чистый свинец на протяжении 2 месяцев. С лечебно-профилактической целью за 10 дней до окончания введения свинца крысам также внутрижелудочно вводили АС в дозе 50 мг/кг. По завершении затравки у животных исследовали микрофлору кала, навески которого разводили физиологическим раствором от 10-2 до 10-9 при использовании десятичного шага разведения. По 0,1 мл каждого разведения наносили на чашки Петри с твердой питательной средой и растирали шпателем по ее поверхности. Для выделения кишечных палочек использовали среду Левина, для энтерококков - среду Калина, для дрожжей - среду Сабуро. Посевы выдерживали в термостате при 37°C в течение 1-2 дней, после чего подсчитывали число выросших колоний. Результаты представлены в таблице 2.
Как видно из таблицы, введение свинца приводило к снижению содержания микроорганизмов в кишечнике, т.е. развивался дисбактериоз. Препараты АС оказывали нормализующее влияние на микробиоту толстой кишки. Оптимальные результаты достигались при использовании АС-1 и АС-4.
Пример 4. Влияние состава АС при экспериментальном язвенном поражении желудочно-кишечного тракта
Для получения экспериментального язвенного поражения вводили резерпин в дозе 2 мкг/кг внутрибрюшинно один раз в день в течение 3-х дней, при этом у животных образовались эрозивно-язвенные поражения желудка и кишечника, которые самостоятельно восстанавливались через 20 дней после последнего введения препарата.
Препарат АС вводили внутрижелудочно (в/ж) в дозе 50 мг/кг в виде свежеприготовленной взвеси содержимого капсул в дистиллированной воде. В процессе эксперимента сопоставляли динамику массы тела животных, картину клинического течения, подсчет среднего числа деструктивных участков желудочно-кишечного тракта, морфологические данные.
Эксперименты проводись на крысах-самцах средним весом 220 г. Всего в эксперименте было использовано 100 животных, разделенных на 5 групп:
1 группа - интактные - 20.
2 группа - резерпиновая язва без лечения - 20.
3 группа - язва + лечение АС-1 - 20.
4 группа - язва + лечение АС-3 - 20.
5 группа - язва + лечение АС-4 - 20.
Результаты исследований представлены в таблице 3.
По проведенным наблюдениям животные, у которых резерпином был вызван язвенный процесс, становились вялыми, малоподвижными, отказывались от пищи. Масса их тела прогрессивно падала и к 7-м суткам опыта составляла лишь 65% от массы тела интактных животных.
При макроскопическом исследовании слизистой оболочки желудочно-кишечного тракта на 3 сутки опыта отмечались гиперемия, иногда синюшность, отек и нарушение нормального расположения желудочных складок и кишечных крипт. Язвенные дефекты круглой и овальной формы располагались в железистой части по верхушкам складок или бороздах между ними. Поверхность их покрыта серовато-желтым налетом или свернувшейся кровью, отчего они имели вид черных точек различной величины. Число деструктивных участков, приходящихся на одно животное, равнялось на 3 сутки 26±2.
Наиболее значительные нарушения слизистой оболочки наблюдались на 7-й день: слизистая была гиперемирована, покрыта сгустками крови, складки ее сглажены; на железистой части - язвенные дефекты диаметром от 2 до 5 мм, число которых в среднем равнялось 37±3. Гистологическое исследование желудочной стенки трех погибших крыс выявило глубокие дефекты и обширный некроз слизистой.
К 20 суткам у трети крыс отмечалось полное восстановление дефектов; у остальных же слизистая оболочка все еще была гиперемирована, иногда отечна, покрыта эрозиями и язвами диаметром 1 мм. Среднее число деструктивных участков составляло 10±2.
При лечении резерпиновых язв препаратами АС средняя масса крыс составляла 155-165 г на 7 сутки лечения. Через 20 дней прибавка массы была примерно на 20% выше, чем у животных с резерпиновыми язвами без лечения.
Макроскопическое исследование выявило, что язвенно-деструктивные поражения слизистой локализовались в железистой части желудка и по ходу кишечника. По характеру они были одинаковы, но отличались по степени выраженности поражений. На 20 сутки у трети животных слизистая оставалась несколько гиперемированной и на ней имелось по 1-2 изъязвления.
Таким образом, АС оказался эффективным препаратом при лечении язвенных поражений желудочно-кишечного тракта. Влияние состава композиции в заявленном диапазоне концентраций на эффективность лечения воздействует незначительно.
Пример 5. Воздействие АС на гомеостаз культур клеток и продукцию ими медиаторов иммунного ответа
Изучение влияния состава пребиотического препарата АС на гомеостаз клеток кишечного эпителия и продукцию ими медиаторов иммунного ответа проводили в экспериментах in vitro с использованием клеточной линии Сасо-2, полученной из колоректальной аденокарциномы. Ввиду того, что данная клеточная линия, согласно данным литературы, секретирует очень ограниченный спектр медиаторов воспаления, в качестве еще одного объекта была избрана линия клеток печеночного происхождения Hep G2 (гепатокарцинома), способная при различных стимулах производить разнообразные цитокины так же, как это свойственно клеткам печени in vivo.
В качестве интегративного показателя гомеостаза клеточных линий использовали интенсивность пролиферации клеток, определяемую по включению меченого тимидина или путем микроскопического подсчета клеток.
Клеточные линии были получены из коллекции клеточных культур НИИ цитологии (С-Петербург). Клетки культивировались в среде DMEM/F-12 (Sigma) с 10 мкг/мл гентамицина с 10% фетальной телячьей сыворотки (FCS) в полистироловых флаконах для культур клеток (Costar) в исходной плотности 2,0-4,0×104 кл/см2. Через 3-4 дня клетки снимали с поверхности пластика раствором Версена (ООО «Биолот», С-Петербург) с 50 мкг/мл химопсина, отбирали 1/3 часть клеток, переносили в новый флакон и добавляли среду до исходного объема.
Культивирование клеточной линии Сасо-2. Клетки Сасо-2 в количестве 0,5×104 кл/лунку или 1×104 кл/лунку вносили в 96-луночные плоскодонные культуральные платы (Costar) и культивировали в течение 48 часов в среде DMEM/F-12 с гентамицином с 10% FCS в CO2-инкубаторе при t=37°C, в атмосфере абсолютной влажности с 5% СО2. Затем культуральную среду из лунок удаляли и добавляли свежую среду DMEM/F-12 без сыворотки. В среде без FCS клетки культивировали 24 часа, после чего заменяли старую среду на новую, содержащую 0% или 5% FCS, и вносили препарат АС в конечной концентрации 0,01-10000 нг/мл. В качестве положительного контроля использовали рекомбинантный интерлейкин-1β человека (IL-1β) (ФГУП «Гос.НИИ ОЧБ» ФМБА России, С-Петербург) в конечной концентрации 100 нг/мл. Далее платы помещали на 72 часа в СО2-инкубатор. За 12 часов до окончания инкубации во все лунки планшета вносили 3Н-тимидин («Изотоп», С-Петербург) в конечной концентрации 0,5 μКю/мл.
В отдельном эксперименте клетки вносили в культуральные платы в исходной плотности 0,5×104 кл/лунку и культивировали, заменяя среду с периодичностью 1 раз в 3 дня. Исследуемые вещества (препараты АС, карбоновые кислоты или соли карбоновых кислот в конечных концентрациях 0,01-10000 нг/мл) добавляли к клеткам на 4, 7, 8, 14 или 21 день от начала эксперимента. Перед внесением препаратов клетки так же культивировались в среде без FCS в течение 24 часов. После внесения исследуемых веществ клетки культивировались так же в среде без FCS в течение 65 часов до внесения 3Н-тимидина.
Культивирование клеточной линии Hep G2. Клетки линии Hep G2 в количестве 5×105 кл/мл вносили в объеме 200 мкл в 96-луночные плоскодонные культуральные платы и культивировали в течение 24 часов в среде DMEM/F-12 с гентамицином с 10% FCS в CO2-инкубаторе. Затем меняли среду на бессывороточную и культивировали клетки еще 24 часа, после чего вносили препарат АС, карбоновые кислоты или соли карбоновых кислот в конечных концентрациях 1-1000 мкг/мл. Платы помещали в CO2-инкубатор. Через 1, 2 или 3 дня после внесения препаратов вносили 3Н-тимидин за 4 часа до окончания инкубации.
После окончания культивирования удаляли среду, промывали лунки забуференным физиологическим раствором (PBS) и добавляли раствор Версена с химопсином. Платы помещали на шейкер при t=37°C до полного отлипания клеток от дна плат. Далее клетки переносили на стекловолоконные фильтры с помощью харвестера (FilterMate Harvester 96, «Perkin Elmer»). Фильтры сушили в сушильном шкафу, после чего запаивали в полиэтиленовые ракеты, заполняя их сцинтиллятором Betaplate Stint («Perkin Elmer»), и определяли интенсивность включения 3Н-тимидина на планшетном β-счетчике MicroBeta TriLux 1450 («Perkin Elmer»). Результаты выражали в количестве импульсов в минуту (имп/мин).
Клетки линии Сасо-2 в количестве 7×104 кл/лунку вносили в 24-луночные плоскодонные культуральные платы («Costar»), добавляли по 1 мл среды DMEM/F-12 с 10% FCS. Далее клетки культивировались так же, как описано выше. После окончания культивирования удаляли среду, промывали лунки раствором PBS, добавляли раствор Версена с химопсином и помещали платы в термостат до полного отлипания клеток от дна плат. Суспензию клеток тщательно перемешивали, окрашивали трипановым синим и считали количество клеток в камере Горяева.
Клетки Сасо-2 засевали в плоскодонные 24-луночные платы (Costar) в среде DMEM/F-12 с гентамицином и 10% FCS в плотности 4×105 кл/лунку в 1 мл среды и культивировали в течение 14 дней с заменой среды 2 раза в неделю, как описано выше. Затем лунки промывали средой без сыворотки и вносили исследуемый препарат в различных концентрациях в среде с 5% фетальной сыворотки или без нее. В отдельные лунки препарата вносили на фоне 10 нг/мл рекомбинантный интерлейкин-1β человека (IL-1β). Далее платы инкубировали в течение 48 часов, отбирали супернатанты, замораживали и хранили при -20°C до определения уровней цитокинов.
Клетки Hep G2 засевали в плоскодонные 24-луночные платы в плотности 5×105 клеток на лунку и одновременно вносили препарат АС в различных концентрациях на фоне 1 нг/мл IL-1β или без него. Сбор супернатантов проводили через 48 и 72 часа после начала культивирования.
Анализ содержания цитокинов IL-1β, IL-8 и рецепторного антагониста IL-1 проводили с помощью наборов на основе твердофазного иммуноферментного анализа производства ООО «Цитокин» (С-Петербург) по инструкции изготовителя. Каждый супернатант анализировали в двух параллелях, полученные значения усредняли.
Полученные значения пролиферации клеток в присутствии исследуемых веществ сравнивались с контрольными (определялся процент увеличения пролиферативной активности относительно контроля). Достоверность различий определялась по t-критерию Стьюдента. Статистическая обработка производилась с использованием пакета программ ((Microsoft Excel». Результаты анализа продукции цитокинов приведены в таблицах в виде среднего значения от двух параллельных экспериментов.
Все результаты изучения пролиферации в таблицах представлены как
X ср.±ΔХ,
где X ср. - среднее арифметическое показателя изменения пролиферативной активности относительно контроля;
ΔХ - относительная ошибка показателя изменения пролиферативной активности относительно контроля.
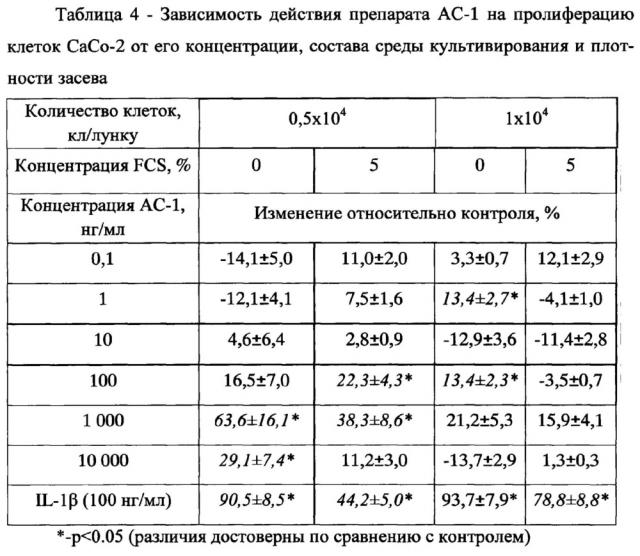
Для оценки влияния препарата АС на пролиферацию клеток линии Сасо-2 клетки культивировали в средах с фетальной сывороткой и без нее при двух различных плотностях засева в средах содержащих и не содержащих фетальную сыворотку. Полученные результаты представлены в таблице 4.
Как видно из таблицы, максимальное увеличение пролиферации клеток относительно контроля в большинстве случаев наблюдалось при культивировании в среде без FCS при исходной концентрации клеток 0,5×104 кл/лунку. Поэтому последующие эксперименты проводились именно в этих условиях. Максимальная стимуляция пролиферации клеток наблюдалась при добавлении АС-1 в концентрации 1000 нг/мл.
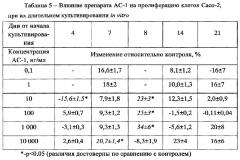
Известно, что клетки линии Сасо-2 при длительной культивации in vitro без пересева способны спонтанно дифференцироваться. В связи с этим в последующих экспериментах было оценено влияние препарата АС-1 на пролиферацию клеток, находящихся на различной стадии дифференцировки. Для этого препарат вносили на 4, 7, 8, 14 или 21 сутки от начала культивирования клеток. Препарат вносили как отдельно (таблица 5), так и на фоне IL-1β (10 нг/мл) (таблица 6).
Из представленных результатов видно, что АС-1 максимально стимулирует пролиферацию клеток линии Сасо-2 при внесении на 8 сутки культивирования в концентрациях 10-1000 нг/мл и при внесении на 7 сутки в концентрации 10000 нг/мл (таблица 5).
При этом АС-1 на фоне IL-1β достоверно угнетает пролиферацию клеток при непродолжительной дифференцировке in vitro в концентрации 1000-10000 нг/мл (без IL-1β значения от контроля достоверно не отличались), достоверно стимулирует при внесении на 7 сутки дифференцировки только в низкой концентрации (0,1 нг/мл) (без IL-1β стимулировал только в концентрации 10000 нг/мл) (таблица 5). При добавлении АС-1 к культурам клеток, предварительно культивировавшихся без пересева в течение 3 недель, их пролиферация увеличивается относительно контроля, но достоверность отличий наблюдается только в минимальной (0,1 нг/мл) и максимальных концентрациях (1000-10000 нг/мл).
Для изучения влияния препарата АС на пролиферацию клеток линии Сасо-2 использовали также метод прямого подсчета клеток, так как включение тимидина является непрямым методом определения пролиферации клеточной культуры. Так, уменьшение включения тимидина относительно контроля может быть связано не с уменьшением пролиферативной активности, а быть следствием, например, гибели клеток. К тому же, по включению тимидина возможно определить пролиферацию только за время присутствия изотопа в растворе, в то время как методом прямого подсчета можно определить пролиферацию клеток за весь период культивирования.
Клетки в этом эксперименте инкубировали в среде, содержащей исследуемый препарат, или без него. В качестве положительного контроля использовали IL-1β в концентрации 100 нг/мл. Полученные результаты представлены на фиг 1.
Из анализа результатов фиг. 1 следует, что достоверная стимуляция пролиферативной активности наблюдалась при добавлении в культуральную среду препарата АС-1 в концентрации 10 нг/мл, а не 1000 нг/мл, как было выявлено по включению меченого тимидина. Количество клеток при этом увеличивалось на 50±7%. Добавление в культуральную среду IL-1 в концентрации 100 нг/мл вызывало усиление пролиферации клеток на 42±7% относительно контроля.
Пример 6. Воздействие АС на клеточный иммунитет.
В экспериментах использовались беспатогенные (SPF) мыши линии Balb/C (Питомник лабораторных животных «Пущино») весом 18-20 грамм. Мыши содержались в условиях SPF-вивария при 12-часовом цикле день-ночь, получали стандартную диету и воду ad libitum. Каждая группа включала 6 мышей. Иммунизацию животных овальбумином осуществляли в дозе 20 мкг/мышь, внутрибрюшинно дважды на 0-й и 14-й день эксперимента. В качестве адъюванта использовали Imject Alum (Pierce).
Препарат АС-1 вводили через пищевод с помощью атравматического зонда в виде раствора в дистиллированной воде в объеме 0,2 мл и дозе 0,2 мг/кг. Животные контрольной группы получали дистиллированную воду в объеме 0,2 мл.
Были использованы три схемы введения препаратов:
1. Ежедневно в течение всего эксперимента (21 день).
2. Ежедневно в течение 10 дней после начала эксперимента.
3. Ежедневно после второй иммунизации до окончания эксперимента (7 дней).
На 22-й день эксперимента мышей умерщвляли методом цервикальной дислокации и асептически забирали для исследования периферическую кровь и селезенку.
Селезенку гомогенизировали в среде RPMI-1640 (Sigma) и фильтровали через два слоя стерильной марли. Полученный гомогенат центрифугировали и затем лизировали эритроциты, используя 0,83% раствор хлористого аммония. Спленоциты дважды отмывали средой RPMI-1640. Количество клеток подсчитывали в камере Горяева. Спленоциты инкубировали в среде RPMI-1640 (Sigma) с 2 мМ L-глутамина (Sigma), 80 мкг/мл гентамицина (полная среда) и 10% сыворотки плодов коровы (СПК) (Sigma), инактивированной прогреванием при 56°C в течение 40 минут, в присутствии митогенов или антигена - конканавалина A (Sigma) (КонА), липополисахарида (Sigma), овальбумина (Sigma) в плоскодонных 96-луночных планшетах для культивирования (Costar). Планшеты инкубировали при 37°C в атмосфере, содержащей 5% CO2. Продолжительность инкубации при стимуляции спленоцитов митогенами и овальбумином соответственно составляла 72 и 96 часов. За 16 часов до окончания культивирования в лунки планшетов вносили 3Н-тимидин («Изотоп», Санкт-Петербург) в конечной концентрации 5 μCi/мл. По окончании культивирования культуры клеток переносили на стекловолоконные фильтры. Интенсивность включения 3Н-тимидина измеряли с помощью жидкостного сцинтилляционного счетчика (Rackbeta 1217). Результаты выражали в количестве импульсов в минуту (имп/мин).
Для индукции синтеза интерлейкина (ИЛ)-2 спленоциты в полной среде с 5% СПК стимулировали КонА или овальбумином. Культивирование проводили в течение 48 часов при 37°C в атмосфере с 5% CO2. По окончании культивирования из всех лунок планшета отбирали по 150 мкл супернатата. Супернатанты хранили до исследования при температуре - 70°C.
Определение уровня интерлейкина-2 в супернатантах культур спленоцитов проводили с использованием интерлейкин-2-зависимой линии CTLL-2 (Gillis S. et al., 1982). В качестве стандарта использовали рекомбинантный ИЛ-2 человека (Sigma).
В конце эксперимента у каждой мыши индивидуально собирали образцы фекалий, которые после взвешивания гомогенизировали в PBS в соотношении 1:10. Гомогенаты инкубировали 60 минут при комнатной температуре и центрифугировали. Надосадок отбирали и использовали для определения антиген-специфичес