Способ совместного кондиционирования и хемоселекции за один цикл
Иллюстрации
Показать всеИзобретение раскрывает способ трансплантации гемопоэтических стволовых клеток (HSC) без облучения, включающий: (a) введение млекопитающему субъекту одной или двух доз от 2 до 10 мг/кг массы тела аналога пуринового основания, выбранного из 6-тиогуанина (6TG), 6-меркаптопурина (6-МР) или азатиопурина (AZA) в качестве этапа предварительного кондиционирования; (b) пересадку субъекту HSC доноров с нехваткой гипоксантин-гуанин фосфорибозилтрансферазы (HPRT) через 48-72 часов после этапа предварительного кондиционирования и (c) немедленное введение субъекту приблизительно от 1 до 5 мг/кг аналога пуринового основания и продолжающееся введение субъекту приблизительно от 1 до 5 мг/кг аналога пуринового основания каждые 2-4 дня в течение 2-8 недель без предусмотренного периода восстановления; где способ осуществляют в отсутствие предварительного кондиционирования путем облучения. Способ согласно изобретению осуществляют в отсутствие предварительного кондиционирования путем облучения, поэтому нуждающийся субъект избавлен от токсичности, индуцированной миелоаблативным облучением. 17 з.п. ф-лы, 6 ил., 5 табл., 2 пр.
Реферат
Данная заявка испрашивает приоритет предварительной заявки США на патент №61/477.440, поданной 20 апреля 2011 г., полное содержание каждой из которых включено в данный документ посредством ссылки. В данной заявке даются ссылки на различные публикации. Раскрытие этих публикаций во всей их полноте включено в данную заявку посредством ссылки для более полного описания уровня техники, к которому относится настоящее изобретение.
ЗАЯВЛЕНИЕ ОТНОСИТЕЛЬНО ФИНАНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЙ
Настоящее изобретение было сделано при поддержке правительства в виде гранта № AI 67769, выданного Национальными институтами здоровья. Правительство имеет определенные права на настоящее изобретение.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Трансплантация гемопоэтических стволовых клеток (HSCT) является основой лечения многих наследственных заболеваний и лимфогемопоэтических злокачественных новообразований (1). Кроме того, гемопоэтические стволовые клетки (HSC) в целом представляют собой важную цель для генной терапии ex vivo. Перенос генов в HSC предоставляет потенциальную стратегию коррекции моногенных дефектов и изменения чувствительности нормального ВМ к цитотоксическим препаратам. Эти применения имеют значительный терапевтический потенциал, но были ограничены низким уровнем переноса генов в HSC. Последние достижения, такие как улучшенные цитокины для минимизации коммитирования в ходе процедуры ex vivo, перенос генов с помощью фибронектина и обогащение HSC перед переносом генов, улучшили эффективность переноса генов в клетки человека и усовершенствовали испытания генной терапии человека (2). Тем не менее, эффективность переноса генов в HSC и пересадка большого числа трансдуцированных клеток остается серьезной проблемой для расширения применения этой технологии для успешного лечения рака и моногенетических заболеваний.
Для улучшения пересадки генномодифицированных HSC и уменьшения времени, необходимого для лимфогемопоэтического восстановления после HSCT, исследовали стратегии селекции in vivo, использующие гены лекарственной устойчивости, такие как дигидрофолатредуктаза (DHFR) (3) или ген множественной лекарственной устойчивости 1 (MDR1) (4, US 1996/017660), но, как правило, они потерпели неудачу из-за неприемлемой токсичности (5) или недостаточной эффективности селекции (6). В настоящее время мутантные формы О-6-метилгуанин-ДНК-метилтрансферазы (MGMT) исследуют на их способность придавать хемопротекцию против BCNU или темозоломида в сочетании с О-6-бензилгуанином (2,7, US 1997/004917), но эти средства представляют значительный риск токсичности, а последние наблюдения показывают, что мутантный MGMT может придавать селективный недостаток при высоком уровне экспрессии (8). В US 2003032003 AA описана стратегия селекции HPRT-дефицитных клеток in vivo с помощью 6TG. Однако в этой заявке на патент для предварительного кондиционирования перед селекцией in vivo по-прежнему используется облучение, или селекцию in vivo совершают циклами с периодами восстановления между введением 6TG.
Кроме того, предложенная доза 6TG является высокой и вводится в течение длительного периода времени (200 мг/кг общей дозы в течение 55 дней). Кроме того, Porter и DiGregori описали подход к инактивации экспрессии HPRT в ВМ и последующей селекции донорских клеток с 6TG in vivo как «опосредованную интерферирующей РНК резистентность к аналогам пурина» («iPAR»). Этот отчет показал возможность инактивации HPRT в HSC с помощью лентивирусного вектора, экспрессирующего shRNA, которая воздействует на HPRT, и обогащение этих измененных гемопоэтических клеток 6TG у мышей in vivo. Тем не менее, в данном отчете, предварительную подготовку осуществляли все еще путем облучения всего тела, а хемоселекцию in vivo не начинали до, по меньшей мере, 4 недель после трансплантации. Кроме того, 6TG вводили в виде короткого импульса или при дозировках, которые выбрали только для умеренной миелосупрессии, и не ясно, были ли достигнуты достаточные уровни трансдукции HSC лентивирусными векторами второго поколения, которые использовали в их исследовании. В целом, описанные уровни пересадки были переменными и относительно незначительными.
Остается необходимость более эффективных способов HSCT, чтобы избежать токсичности во время восстановления клеток костного мозга.
Литература:
(1) Bhattacharya D, Ehrlich LI, Weissman IL. Eur J Immunol. 2008; 38:2060-2067.
(2) Milsom MD, Williams DA. DNA Repair (Amst). 2007; 6:1210-1221.
(3) Williams DA, Hsieh K, DeSilva A, Mulligan RC. J Exp Med. 1987; 166:210-218.
(4) Sorrentino BP, Brandt SJ, Bodine D, et al. Science. 1992; 257:99-103.
(5) Zaboikin M, Srinivasakumar N, Schuening F. Cancer Gene Ther. 2006; 13:335-345.
(6) Southgate T, Fairbairn LJ. Expert Rev Mol Med. 2004; 6:1-24.
(7) Neff T, Beard ВС, Kiem HP. Blood. 2006; 107:1751-1760.
(8) Schambach A, Baum C. DNA Repair (Amst). 2007; 6:1187-1196.
(9) Porter CC, DeGregori J. Blood. 2008; 112:4466-4474.
Селекция in vivo примитивных гемопоэтических клеток (публикация патента WO/1998/019540) US 1996/017660
Использование мутантных алкилтрансфераз для генной терапии для защиты от токсичности терапевтических алкилирующих средств (публикация патента WO/1997/035477) US 1997/004917
Селекция in vivo (публикация патента WO/1997/043900) US 2003032003 AA
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает способ трансплантации гемопоэтических стволовых клеток (HSC) без облучения. Как правило, способ включает введение млекопитающему субъекту одной или двух доз от 2 до 10 мг/кг массы тела аналога пуринового основания в качестве стадии предварительного кондиционирования. Способ дополнительно включает пересадку субъекту гипоксантин-гуанин-фосфорибозилтрансфераз (НРКТ)-дефицитных HSC донора в течение от 48 до 72 часов стадии предварительного кондиционирования и введение субъекту приблизительно от 1 до 5 мг/кг аналога пуриновых оснований каждые 2-4 дня в течение 2-8 недель после стадии пересадки. Способ осуществляют в отсутствие предварительного кондиционирования путем облучения. Поэтому при подготовке к трансплантации субъекта не подвергают миелоаблативному облучению, и, таким образом, субъект лишен токсичности, индуцированной миелоаблативным облучением.
Характерные примеры аналогов пуриновых оснований включают 6-тиогуанин (6TG), 6-меркаптопурин (6-МР) и азатиопурин (AZA). В одном варианте осуществления аналогом пуриновых оснований является 6TG. В некоторых вариантах осуществления общая доза 6TG, которую вводят субъекту, не превышает 105 мг; обычно, общая доза 6TG, которую вводят субъекту, не превышает 75 мг. В одном варианте осуществления введение аналога пуринового основания осуществляют каждые 3 дня и на протяжении не более четырех недель после этапа пересадки.
У субъектов, которых лечили в соответствии с данным способом, будет наблюдаться более 75% генетически модифицированных гемопоэтических клеток. В некоторых вариантах осуществления у субъекта наблюдается более 95% генетически модифицированных гемопоэтических клеток.
HPRT-дефицитные HSC для трансплантации могут быть превращены в HPRT-дефицитные с применением традиционных способов, известных специалистам в данной области техники. Характерные способы включают, без ограничения, введение последовательностей, кодирующих нуклеазы "цинковые пальцы" (ZFN), эффекторные нуклеазы, подобные активаторам транскрипции (TALEN), матричные цепи небольшого фрагмента гомологичной рекомбинации (SFHR), ингибирующие РНК (siRNA) или микроРНК (miRNA), антисмысловые РНК, транс-сплайсинговые РНК, рибозимы, внутриклеточные антитела или доминантно-негативные, или конкурентные белки-ингибиторы. Трансплантированные HSC могут быть аутологичными, изогенными или аллогенными.
В некоторых вариантах осуществления HPRT-дефицитные HSC для трансплантации были генетически модифицированы. Субъект может иметь наследственное или генетическое заболевание, приобретенное заболевание, поражающее лимфогемопоэтические клетки, такое как инфекция, вызванная вирусом иммунодефицита человека (ВИЧ), или синдром приобретенного иммунодефицита (СПИД) или лимфогемопоэтические злокачественные новообразования. Генетическая модификация донорских HSC может выходить за пределы превращения клеток в HPRT-дефицитные, а также служить для лечения или исправления состояния.
КРАТКОЕ ОПИСАНИЕ ФИГУР
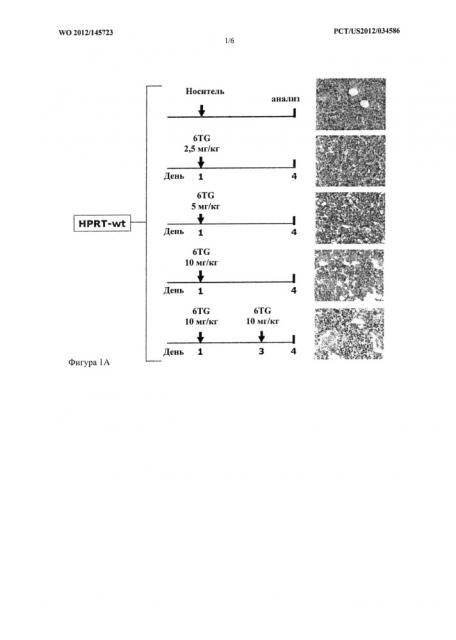
Фигура 1A-1B. Оптимизация режима кондиционирования 6TG (Фиг.1A). В качестве исследования подбора дозы мышам HPRT-wt интраперитонеально инъецировали носитель или изменяющиеся дозы 6TG от 2,5 до 10 мг/кг, как указано, в день 1 (n=3 на группу) или две дозы 10 мг/кг в день 1 и день 3 (n=3), соответственно. В день 4 после первой дозы 6TG фиксированные параформальдегидом срезы кости окрасили Н&Е и исследовали гистологию ВМ. Характерные микрофотографии (40-кратное увеличение) показаны для каждого режима кондиционирования 6TG (Фиг.1B). Характерные микрофотографии показывают при низких (10x) и высоких (100x) увеличениях общую и детальную гистологию ВМ мышей HPRT-wt, которые получили носитель, или с оптимизированным режимом кондиционирования, состоящим из двух доз 10 мг/кг 6TG в день 1 и день 3. Гистологические анализы провели в день 4, как указано выше.
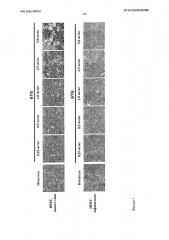
Фигура 2A-2B. Отсутствие прогрессивной миелотоксичности после инъекции кондиционирующих доз 6TG HPRT-дефицитным мышам и низкий уровень пересадки только с кондиционированием 6TG (Фиг.2A). HPRT-wt и HPRT-дефицитным мышам интраперитонеально инъецировали 10 мг/кг 6TG в дни 1 и 3. В день 7 после первой дозы 6TG фиксированные параформальдегидом срезы кости окрашивали Н&Е и исследовали гистологию ВМ. Показаны характерные микрофотографии (40-кратное увеличение) (Фиг.2В). График лечения: самки мышей-реципиентов HPRT-wt (n=4) получили первую кондиционирующую дозу 6TG (10 мг/кг, интраперитонеально) в день - 2, затем им пересадили ВМ HPRT-дефицитных самцов, а после этого - вторую кондиционирующую дозу 6TG (10 мг/кг, интраперитонеально) в день 0. ВМ проанализировали в день 7 после первой дозы 6TG. Показаны фиксированные параформальдегидом срезы кости, окрашенные Н&Е (40-кратное увеличение).
Фигура 3. Эффект дозы и период действия хронической миелотоксичности низких доз 6TG у HPRT-wt по сравнению с HPRT-дефицитными мышами. HPRT-мыши дикого типа и HPRT-дефицитные мыши получали каждые 3 дня различные дозировки 6TG или носитель (n=3 на группу), как показано над каждой панелью. Для мышей HPRT дикого типа гистологию исследовали в следующие временные точки вплоть до 60 дней после начала лечения: носитель (день 60), 6TG 0,25 мг/кг (день 60), 6TG 0,5 мг/кг (день 60), 6TG 1,0 мг/кг (день 38), 6TG 2,5 мг/кг (день 28), 6TG 5,0 мг/кг (день 22). Для HPRT-дефицитных мышей гистологию исследовали в день 60 для всех животных. Показаны характерные микрофотографии фиксированных параформальдегидом срезов кости, окрашенных Н&Е (40-кратное исходное увеличение).
Фигура 4A-4B. Оптимизация совместного кондиционирования 6TG и стратегии хемоселекции in vivo. График лечения: самки мышей-реципиентов HPRT-wt получили первую кондиционирующую дозу 6TG (10 мг/кг, интраперитонеально) в день - 2, затем им пересадили ВМ HPRT-дефицитных самцов вместе со второй кондиционирующей дозой 6TG (10 мг/кг, интраперитонеально) в день 0. Затем провели хемоселекцию in vivo с помощью многократных инъекций 2,5 мг/кг или 5,0 мг/кг 6TG каждые 3 дня в течение 2 недель (фиг.4A) или 4 недель (фиг.4B), как указано. Показаны характерные микрофотографии костного мозга из фиксированных параформальдегидом срезов, окрашенных Н&Е (40-кратное исходное увеличение).
Фигура 5. Долгосрочное гемопоэтическое восстановление после трансплантации реципиентам HPRT-wt ВМ, полученного из HPRT-дефицитных доноров с помощью совместного кондиционирования 6TG и хемоселекции. Гистограммы показывают процентное отношение клеток костного мозга (ВМ), полученных от донора, и лейкоцитов периферической крови (PBL), определенное с помощью FISH анализа XY хромосом через 4 недели (т.е. сразу после окончания периода хемоселекции) и через 4 месяца, 7 месяцев и 12 месяцев после трансплантации, как указано.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение предлагает новую стратегию хемоселекции in vivo, которая применяет ключевую роль опосредованного гипоксантин-гуанин фосфорибозилтрансферазой (HPRT) преобразования 6-тиогуанина (6TG) в нуклеотид тиогуанина с миелотоксичностью 6TG. Поскольку дефицит HPRT сам по себе не ухудшает развитие или функцию гемопоэтических клеток, его можно удалить из гемопоэтических клеток, применяемых для трансплантации. Стратегия хемоселекции in vivo включает HSCT, которую осуществляют с применением HSC HPRT-дефицитных доноров, используя 6TG как для миелоаблативного кондиционирования реципиентов HPRT-дикого типа, так и процесса хемоселекции in vivo донорских клеток в один цикл. Настоящее изобретение основано на разработке и выявлении режима дозирования, при котором 6TG вызывает селективную миелоаблацию без каких-либо негативных последствий для экстрагемопоэтических тканей, в то время как пересаженные HSC с недостаточной HPRT активностью обладают высокой устойчивостью к цитотоксическим эффектам 6TG. С помощью этой стратегии совместного кондиционирования 6TG и хемоселекции можно достигнуть эффективной и высокой пересадки HSC HPRT-дефицитных доноров с низкой общей токсичностью. 6TG в хемоселекции in vivo обеспечивает долгосрочное восстановление иммунофенотипически нормального костного мозга (ВМ), увеличивая популяцию самообновляющихся плюрипотентных HSC из ВМ HPRT-дефицитного донора или пересаженного ВМ.
Описанный в данном документе способ высокоэффективного и полностью нетоксичного кондиционирования, и хемоселекции in vivo в одном цикле, в общем применим в качестве стратегии улучшения эффективности пересадки HSCT и исхода трансплантации, и придать селективное преимущество генетически модифицированным клеткам после генной терапии ex vivo. В стратегии хемоселекции in vivo используется исключительно 6TG или другой аналог пуриновых оснований как для предварительного кондиционирования, так и хемоселекции HSC HPRT-дефицитных доноров в одном цикле, и она способна обеспечить высокоэффективную пересадку и долгосрочное восстановление с заменой >95% ВМ реципиента. Данная стратегия применима для улучшения пересадки большого числа HSC, манипулированных ex vivo, чтобы расширить применение генной терапии в целом.
Определения
Все научные и технические термины, используемые в данной заявке, имеют общеупотребимые в данной области техники значения, если не указано иное. Следующие слова или фразы, используемые в данной заявке, имеют указанные значения.
Используемый в данном документе термин "трансплантация гемопоэтических стволовых клеток (HSC) без облучения" означает, что реципиент не подвергается миелоаблативному кондиционированию путем облучения. Вместо этого, кондиционирование осуществляют за счет введения 6TG, который обычно вводят в течение 48 часов до (и включая день) пересадки донорских HSC.
Используемый в данном документе термин "HPRT-дефицитные" включает как клетки, которые HPRT-дефицитные от природы, так и те, которые сделали HPRT-дефицитными путем генетической модификации.
Используемый в данном документе термин "донорские HSC" или "донорские клетки" относится к клеткам, которые будут пересажены, независимо от того, получены ли HSC от реципиента трансплантата или от другого субъекта. Таким образом, клетки, полученные из субъекта, могут быть модифицированы и пересажены обратно тому же субъекту, став "донорскими клетками". Они могут упоминаться в данном документе как "донорские клетки", "пересаженные клетки" или "трансплантированные клетки".
Используемые в данном документе артикли "a" или "an" означают, по меньшей мере, один, если явно не указано иное.
Совместное кондиционирование и хемоселекция для гемопоэтической трансплантации
Настоящее изобретение предоставляет способ трансплантации гемопоэтических стволовых клеток (HSC) без облучения. Как правило, способ включает введение млекопитающему субъекту одной или двух доз от 2 до 10 мг/кг массы тела аналога пуринового основания в качестве стадии предварительного кондиционирования. Способ дополнительно содержит пересадку субъекту доноров HSC с нехваткой гипоксантин-гуанин-фосфорибозилтрансферазы (HPRT) в пределах от 48 до 72 часов стадии предварительного кондиционирования и введение субъекту приблизительно от 1 до 5 мг/кг аналога пуриновых оснований каждые 2-4 дня в течение 2-8 недель после стадии пересадки.
Способ осуществляют в отсутствие предварительного кондиционирования путем облучения. Следовательно, субъект не подвергают миелоаблативному облучению при подготовке к трансплантации, и, таким образом, субъект не подвергается индуцированной миелоаблативным облучением токсичности. Способ рассматривается для применения с различными субъектами, в том числе с субъектами, которые никогда не подвергались лучевой терапии любого рода, субъектами, которые никогда не подвергались миелоаблативной лучевой терапии, а также субъектами, которых подвергали миелоаблативному лечению в прошлом, но не в сроки и/или с дозой, которая была бы предварительно кондиционирующей для способа, описанного в данном документе. Например, как правило, субъект не был бы подвержен миелоаблативному облучению в течение 2 недель, или даже в течение 8 недель, способа совместного кондиционирования и хемоселекции, описанного в данном документе.
Характерные примеры аналогов пуриновых оснований включают: 6-тиогуанин (6TG), 6-меркаптопурин (6-МР) и азатиопурин (AZA). В одном варианте осуществления аналогом пуриновых оснований является 6TG. В некоторых вариантах осуществления общая доза 6TG, которую вводят субъекту, не превышает 105 мг; обычно, общая доза 6TG, которую вводят субъекту, не превышает 75 мг. В одном варианте осуществления аналог иуринового основания вводят каждые 3 дня и на протяжении не более чем четырех недель после этапа пересадки.
Когда в качестве аналога пуринового основания применяют альтернативу 6TG, для инструктирования квалифицированного клинициста в определении подходящей дозы для применения в способе настоящего изобретения доступны известные онлайн (например, rxlist.com) и другие ресурсы. Например, обычная пероральная доза для однокомпонентной химиотерапии 6TG у детей и взрослых составляет 2 мг/кг массы тела в день; если после 4 недель эффект лечения не наблюдается, дозу можно увеличить до 3 мг/кг. В одной пероральной дозе давали вплоть до 35 мг/кг, наблюдая реверсивную миелосуппрессию.
В случае острой лимфатической лейкемии обычная начальная доза для пациентов педиатрического профиля и взрослых составляет 2,5 мг/кг массы тела 6-МР в день (от 100 до 200 мг для среднестатистического взрослого и 50 мг для среднестатистического 5-летнего ребенка). Пациенты педиатрического профиля с острой лейкемией в большинстве случаев легко переносили эту дозу; некоторым пациентам ее можно продолжать каждый день в течение нескольких недель или более. Если после 4 недель при такой дозировке нет клинического улучшения и точных признаков подавления лейкоцитов или тромбоцитов, дозу можно увеличить до 5 мг/кг в день. Дозировка 2,5 мг/кг/день может привести к быстрому падению количества лейкоцитов в течение от 1 до 2 недель у некоторых взрослых с острой лимфатической лейкемией и высоким общим количеством лейкоцитов. После достижения полной гематологической ремиссии считается необходимой поддерживающая терапия. Поддерживающие дозы будет изменяться от пациента к пациенту. Обычная суточная поддерживающая доза 6-МР составляет от 1,5 до 2,5 мг/кг/день в виде разовой дозы.
Дозировка для 6-TG и 6-МР в некоторой степени сопоставима, в то время как дозировку для AZA более трудно сравнивать, потому что его нужно сначала биоактивировать до 6-МР, и его, как правило, не применяют для лечения лейкемии. Для пациентов, которые получают трансплантацию твердого органа, доза AZA, которая требуется для предотвращения отторжения и минимизации токсичности, будет изменяться у отдельных пациентов, что требует тщательного управления. Начальная доза составляет обычно от 3 до 5 мг/кг ежедневно, начиная с момента трансплантации. AZA обычно дают в виде разовой ежедневной дозы в день, а в редких случаях от 1 до 3 дней до трансплантации. Снижение дозы до поддерживающих уровней от 1 до 3 мг/кг ежедневно обычно является возможным. Дозу AZA нельзя увеличить до токсичных уровней из-за угрозы отторжения.
HPRT-дефицитные доноры HSC могут быть HPRT-дефицитными от природы или их можно сделать HPRT-дефицитными путем генетической модификации. В этом контексте "донорские HSC" обозначает клетки, которые будут пересажены, независимо от того, получены HSC из реципиента трансплантата или другого субъекта. Трансплантированные HSC могут быть аутологичными, сингенными или аллогенными.
Генетическую модификацию можно осуществить с помощью любого из различных средств, известных специалистам в данной области техники. Примеры подходящих средств генетической модификации включают, без ограничения, введение последовательностей, кодирующих нуклеазы "цинковые пальцы" (ZFN), эффекторные нуклеазы, подобные активаторам транскрипции (TALEN), матричные цепи небольшого фрагмента гомологичной рекомбинации (SFHR), ингибирующие РНК (siRNA) или микроРНК (miRNA), антисмысловые РНК, транс-сплайсинговые РНК, рибозимы, внутриклеточные антитела или доминантно-негативные или конкурентные белки-ингибиторы. Модификация может быть применена непосредственно с донорскими HSC или клетками-предшественниками. Данные технологии могут быть применены для генетической модификации различных типов клеток, включая, без ограничения, гемопоэтических клеток-предшественников или непосредственно гемопоэтических стволовых клеток, а также других типов зрелых или эмбриональных стволовых клеток или индуцированных плюрипотентных стволовых клеток, которые могут быть дифференцированы или транс-дифференцированы в гемопоэтические клетки-предшественники или гемопоэтические стволовые клетки.
В некоторых вариантах осуществления HPRT-дефицитные HSC для трансплантации были генетически модифицированы для соответствия определенной терапевтической цели. Например, донорские HSC могут быть модифицированы для того, чтобы исправить наследственный генетический дефект для изменения чувствительности нормального костного мозга к цитотоксическим лекарственным средствам, чтобы придать устойчивость к инфекционным микроорганизмам, которые поражают лимфогематопоэтические клетки, чтобы заменить или возвратить в исходное состояние эндогенную иммунную систему, или для борьбы с лимфогематопоэтическими злокачественными новообразованиями путем замены эндогенного костного мозга и индукции эффекта трансплантат против лейкемии/лимфомы.
Более конкретно, наследственные генетические дефекты могут включать, без ограничения, расстройства гемопоэза, в том числе гемоглобинопатии, такие как серповидно-клеточная анемия, талассемия, наследственный сфероцитоз, нехватка G6PD и т.д., нарушения иммунологической или антимикробной функции, такие как тяжелый комбинированный иммунодефицит (SCID), хронический гранулематоз (CGD), расстройства тромбоиоэза, ведущие к дефектам коагуляции, таким как синдром Вискотта-Олдрича (WAS), а также другие генетические структурные или метаболические расстройства, которые можно облегчить с помощью генной инженерии гемопоэтических клеток, которые передвигаются в места повреждения тканей, такие как различные формы буллезного эпидермолиза (ЕВ) и мукополисахаридоза.
Заболевания, при которых модификация чувствительности костного мозга к хемотоксическим лекарственным препаратам была бы полезной, включают, без ограничения, злокачественные заболевания, которые лечат химиотерапевтическими средствами, максимально переносимая доза которых ограничена миелотоксичностью. К ним относятся рак легких, рак толстой и прямой кишок, рак молочной железы, рак простаты, рак поджелудочной железы, рак желудка, рак печени, рак головы и шеи, почечно-клеточный рак, рак мочевого пузыря, рак шейки матки, рак яичников, рак кожи, саркомы и глиома.
Заболевания, при которых используют трансплантацию костного мозга или гемопоэтических стволовых клеток для замены или возвращения в исходное состояние эндогенной иммунной системы, включают, без ограничения, воспалительное заболевание кишечника, склеродермию и красную волчанку.
Заболевания, при которых было бы полезным придание устойчивости к инфекционным микроорганизмам, включают, без ограничения, ВИЧ-инфекцию и СПИД, HTLV-инфекцию и парвовирусную В19 инфекцию.
Злокачественные или предопухолевые заболевания лимфогеиопоэза, которые лечат трансплантацией костного мозга или гемопоэтических стволовых клеток, включают, без ограничения, острую миелоцитарную лейкемию, острый лимфоцитарный лейкоз, лимфому и миелодиспластические синдромы.
Другой пример терапевтического применения этой технологии будет заключаться в улучшении результата трансплантации костного мозга или гемопоэтических стволовых клеток после приобретенного нарушения эндогенного лимфогемопоэза, вызванного лучевым поражением и хемотоксинами.
Нетерапевтическим, но коммерчески полезным применением этой технологии будет его применение для создания гуманизированных животных моделей, в которых их эндогенный лимфогемопоэз почти полностью заменен клетками из человека-донора. После продуцирования, такие животные могут быть применены, например, для проверки новых лекарственных препаратов на миелотоксичность, которые рассматривают для применения к заболеваниям человека. Это является полезным, потому что чувствительность гемопоэза к различным лекарственным средствам может различаться в зависимости от вида животного, поэтому наиболее желательным является исследование таких препаратов на гуманизированной животной модели.
Как правило, субъектом является млекопитающее. Млекопитающий субъект может быть мышью, собакой, кошкой, крупным рогатым скотом, лошадью, овцой, приматом или человеком. В одном варианте осуществления субъектом является человек.
Введение и дозировка
Композиции вводят любым подходящим способом, часто с фармацевтически приемлемыми носителями. В контексте настоящего изобретения доступны подходящие способы введения лекарственного средства субъекту, и, хотя для введения конкретной композиции можно использовать более чем один путь, конкретный путь может часто обеспечить более быструю и более эффективную реакцию, чем другой путь.
Доза, которую вводят пациенту, в контексте настоящего изобретения должна быть достаточной, чтобы обеспечить благоприятный терапевтический ответ у пациента с течением времени или чтобы ингибировать развитие заболевания. Таким образом, композицию вводят субъекту в количестве, достаточном, чтобы вызвать эффективный ответ и/или облегчить, уменьшить, вылечить или, по меньшей мере, частично остановить симптомы и/или осложнения болезни. Количество, необходимое для достижения этой цели, определяется как "терапевтически эффективная доза".
Пути и частота введения терапевтических композиций, раскрытых в данном документе, а также дозировка, будут изменяться от индивидуума к индивидууму, а также в зависимости от выбранного лекарственного средства, и могут быть легко установлены с помощью стандартных методов. В общем, фармацевтические композиции можно вводить путем инъекции (например, внутрикожной, внутриопухолевой, внутримышечной, внутривенной или подкожной), интраназально (например, путем аспирации) или перорально. Для отдельных пациентов могут быть подходящими альтернативные протоколы.
Как понятно специалистам в данной области техники, дозы могут быть преобразованы из мг/кг массы тела в мг/площадь поверхности тела, причем последнее подходит для применения с более крупными млекопитающими субъектами, включая человека. Калькуляторы для аллометрического вычисления известны в данной области техники и широко доступны в Интернете. Как правило, при аллометрическом вычислении используют экспоненту 0,75-0,80. Для получения дополнительной информации см. West & Brown, J Exp Bio 208, 1575-1592, 2005. Кроме того, Управление США по контролю пищевых продуктов и лекарственных средств публикует "Guidance for Industry: Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers", которое доступно от: Управления обучения и коммуникаций Отдела информации по лекарственным препаратам, HFD-240 Центр по оценке лекарственных препаратов и исследованиям пищевых продуктов и лекарственных препаратов, переулок Фишере, 5600, Роквилл, Мэриленд 20857.
Например, 5 мг/кг 6TG соответствует дозе 15,08 мг/м2 для мыши массой 20 г. Это соответствует 0,4 мг/кг для человека массой 65 кг. Абсорбция после перорального введения 6TG оценивается в 30%, поэтому эта интраперитонеальная доза у мышей соответствует абсорбированной дозе после перорального введения приблизительно 1,3 мг/кг у человека. Обычная пероральная доза для монокомпонентной химиотерапии 6TG у пациентов педиатрического профиля и взрослых составляет 2 мг/кг массы тела в день; если эффекта лечения не наблюдают после 4 недель, дозу можно увеличить до 3 мг/кг.
Способ настоящего изобретения предлагает неожиданное преимущество предотвращения токсичности, являющейся результатом или чрезмерного облучения субъекта, или чрезмерной дозировки 6TG. К удивлению, эффективное кондиционирование и восстановление костного мозга можно осуществить с помощью менее чем 105 мг общей дозы 6TG в течение курса лечения и в течение от двух до восьми недель. Эффективную пересадку наблюдали с общей дозой 6TG менее 65 мг и в течение всего лишь двух недель. Кроме того, заявленный способ делает возможным мониторинг токсичности у отдельного субъекта и регулировку дозирования для оптимизации эффективной пересадки с минимальной токсичностью для каждого субъекта. В некоторых вариантах осуществления субъекту вводят 1 или 2,5 мг/кг массы тела 6TG в ходе лечения после пересадки.
У субъектов, которых лечили в соответствии с данным способом, будет наблюдаться более 75% генетически модифицированных гемопоэтических клеток. В некоторых вариантах осуществления у субъекта наблюдали более 95% генетически модифицированных гемопоэтических клеток. Успешная пересадка у субъекта может быть подтверждена путем отбора проб периферической крови или костного мозга в различных интервалах после трансплантации и хемоселекции. Мононуклеарные клетки периферической крови могут быть изучены путем мониторинга уровней разрывов гена HPRT, нокдауна или снижения функциональной активности, используя различные стандартные методики, которые обычно известны любому специалисту в данной области техники, включая, без ограничения, полимеразную цепную реакцию (ПЦР), количественную ПЦР в реальном времени (Q-ПЦР), анализ с помощью нуклеазы surveyor (также называемый "анализ Cel-I"), Саузерн-Блоттинг, Вестерн-Блоттинг/иммуноблот-анализ, иммуногистохимию или иммуноцитохимию, анализ проточной цитометрии с внутриклеточным окрашиванием, HPRT анализ ферментативной активности, HPLC, масс-спектрометрию и тому подобное.
ПРИМЕР
Следующий пример представлен для иллюстрации настоящего изобретения и для того, чтобы помочь специалистам при его получении и применении. Эти примеры никоим образом не предназначены для ограничения объема настоящего изобретения.
Пример 1
Совместное предварительное кондиционирование и хемоселекция in vivo только с 6-тиогуанином обеспечивают высокоэффективное восстановление нормального гемопоэза с помощью HPRT-дефицитного костного мозга
Пуриновые аналоги, такие как 6-тиогуанин (6TG), вызывают миелотоксичность при преобразовании в нуклеотиды гипоксантин-гуанин фосфорибозилтрансферазой (HPRT). Этот пример показывает разработку новой и высокоэффективной стратегии, использующей 6TG в качестве монотерапии как для кондиционирования, так и хемоселекции in vivo HPRT-дефицитных HSC. Эффект дозы и период действия миелотоксичности 6TG сначала сравнили в мышах HPRT дикого типа и HPRT-дефицитных трансгенных мышах. Параметры дозировки и режима оптимизировали, чтобы использовать 6TG для миелосупрессивного кондиционирования и сразу следующей за ним хемоселекции in vivo костного мозга (ВМ) HPRT-дефицитных трансгенных доноров, пересаженного сингенным реципиентам HPRT дикого типа.
В соответствующих дозах 6TG индуцировал избирательную миелотоксичность без какого-либо негативного воздействия на экстрагемопоэтические ткани у мышей HPRT дикого типа, в то время как HSC с недостатком HPRT активности были весьма устойчивы к его цитотоксическому воздействию. Совместное кондиционирование 6TG и хемоселекция после трансплантации последовательно позволяли достичь - 95% пересадки ВМ HPRT-дефицитных доноров, с низкой общей токсичностью. Долгосрочное восстановление иммунофенотипически нормального ВМ было достигнуто как у первичных, так и у вторичных реципиентов. Эти результаты предоставляют доказательство правильности концепции того, что монотерапия 6TG может быть применена как для миелосупрессивного кондиционирования, не требующего облучения, так и для хемоселекции in vivo HPRT-дефицитных донорских клеток. Результаты показывают, что путем применения миелосупрессивного воздействия 6TG как до (в качестве кондиционирования), так и после трансплантации (хемоселекция), можно достичь высокоэффективной пересадки HPRT-дефицитных гемопоэтических стволовых клеток.
Клиническая эффективность генной терапии ex vivo с использованием гемопоэтических стволовых клеток остается зависимой от придания селективного преимущества трансплантированным клеткам [1, 2]. В целях повышения пересадки и уменьшения времени, необходимого для лимфогемопоэтического восстановления, проверили стратегии селекции in vivo, использующие гены лекарственной устойчивости, такие как дигидрофолатредуктазу (DHFR) [3] или ген множественной лекарственной устойчивости 1 (MDR1) [4, 5], но, как правило, они потерпели неудачу из-за неприемлемой токсичности [6] или недостаточной эффективности селекции [7]. В настоящее время мутантные формы О-6-метилгуанин-ДНК-метилтрансферазы (MGMT) проходят испытания на их способность придавать хемопротекцию против BCNU или темозоломида в комбинации с О-6-бензилгуанином [8, 9], но эти средства также представляют собой значительный риск токсичности, и последние наблюдения показывают, что мутантная MGMT может придавать селективный недостаток при экспрессии на высоких уровнях [10].
Следует отметить, что эти подходы, как правило, основаны на трансплантации гемопоэтических клеток-предшественников, которые сверхэкспрессируют экзогенный ген лекарственной устойчивости, реципиентам, предварительно кондиционированным миелоаблативным облучением; однако хеморезистентность также можно придать понижением уровня эндогенных ферментов, которые обычно необходимы для активации цитотоксических лекарственных препаратов. В этом контексте мы ранее отметили, что высокие уровни фермента пути реутилизации пуриновых нуклеотидов гипоксантин-гуанин фосфорибозилтрансферазы (HPRT) приводят к повышенной чувствительности к пуриновому аналогу 6-тиогуанину (6TG) [11]. Первый этап метаболического преобразования 6TG катализируется HPRT [12], которая опосредует добавление рибозо-5-фосфата с получением тиогуанозин-монофосфата (TGMP). Таким образом, цитотоксичность 6TG, по существу, основывается на его опосредованном HPRT преобразовании в тио-дГТФ, которые затем включаются в ДНК, вызывая безрезультатное исправление ошибок спаривания и последующий апоптоз.
Чтобы придать миелопротекцию путем уменьшения активности, эндогенный фермент, активирующий лекарственные препараты, как правило, должен высоко экспрессироваться в гемопоэтических клетках-предшественниках, но быть несущественным для нормального гемопоэза. В действительности, гемопоэтические клетки-предшественники обычно экспрессируют высокие уровни HPRT [13-16], что делает их чрезвычайно чувствительными к 6TG. Действительно, на протяжении полувека для лечения лейкемии клинически применяли пуриновые аналоги, такие как 6-меркаптопурин (6МР), азатиопурин (Aza) и 6TG, особенно у пациентов педиатрического профиля [17], а также для иммуносупрессии у пациентов с пересадкой органов, а в последнее время - для аутоиммунных заболеваний. При более высоких дозах, миелотоксичность является наиболее частым и постоянным побочным эффектом при клиническом применении 6TG и при введении в соответствующих концентрациях в течение коротких периодов времени, 6TG является сильно миелосупрессивным с небольшой токсичностью для других тканей животных дикого типа с нормальной HPRT [11].
В отличие от этого, костный мозг (ВМ) HPRT-дефицитных животных обладает высокой устойчивостью к 6TG [11]. Примечательно, однако, что мы [11] и другие [18] обнаружили, что гемопоэз является фенотипически и функционально нормальным у жив