Меченые дендримерные пептиды
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к молекулярной фармакологии, и может быть использовано для получения меченых катионных дендримерных пептидов для внутриклеточной доставки нуклеиновых кислот (НК). Меченые катионные дендримерные пептиды представлены формулой: X-AC(Y)-NH2, где X является дендримерным катионным пептидом с аминокислотным составом, выбранным из группы, состоящей из (K)4(K)2K, (R)8(K)4(K)2K, (RRRKK)2KKK и (K8)(K4)(K2)K, где K представляет собой лизин; R представляет собой аргинин, А представляет собой аланин, С представляет собой цистеин, Y представляет собой присоединенный по меркаптогруппе цистеина флуоресцентный цианиновый краситель Су5. Использование данной конструкции меченых дендримерных пептидов, имеющих связывающий модуль для взаимодействия с НК, и сигнальный модуль, содержащий флуоресцентную метку - цианиновый краситель Су5, позволяет визуализировать распределения препарата по органам и тканям, обеспечивая трансфекционную активность, близкую к трансфекционной активности комплексов нуклеиновой кислоты с немеченым дендримерным пептидом. 6 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к медицине, а именно к фармацевтике, и может быть использовано для анализа фармакокинетики пептидных носителей и их комплексов с нуклеиновыми кислотами.
Генная терапия как метод введения новой генетической информации в клетки человека и животных хотя и нацеливается на лечение генетических заболеваний, однако сфера ее применения намного шире, предполагая лечение большого спектра заболеваний - от генетических до инфекционных, включая онкологические и иммунные заболевания. В связи с тем, что нуклеиновые кислоты сами неспособны транспортироваться через клеточную мембрану, разработка эффективных транспортеров (стимуляторов трансфекции) для доставки генного материала в клетки является весьма актуальной задачей. В настоящее время десятки фармацевтических компаний разрабатывают лекарственные средства, предназначенные для генной терапии онкологических, воспалительных, инфекционных заболеваний, а также заболеваний, связанных с нарушением обмена веществ. В состав таких генно-терапевтических препаратов входят нуклеиновые кислоты (НК), короткие олигонуклеотиды (миРНК) и крупные генетические конструкции, например ДНК-плазмиды, а также молекулы РНК и РНК-кассеты.
Известно, что свободную НК можно доставлять в нужную мишень, клетки и ткани, просто путем инъекции, однако эффективность такой доставки часто близка к нулевой, очевидно ввиду быстрого разрушения НК под действием нуклеаз. Показано, что нативные НК в организме быстро деградируют, например плазмидную ДНК при внутривенном введении удается зарегистрировать только в течение 5-10 минут. Для достижения терапевтического эффекта НК приходится использовать в очень высоких концентрациях (от 5 до 100 mМ), в зависимости от состава и длины олигомеров, а также от типа клеток-мишеней [Mahato R.I., Takakura Y., Hashida M. (1997). J. Drug Targeting. 4, 337-357; Позмогова Г.Е., Кнорре Д., Белковые и пептидные конструкции для доставки в клетку олигонуклеотидов и ДНК. Вопр. мед. химии, 1998, 44 (4), 331-337]. Очевидно, что такой метод невозможно применять в медицине ввиду непредсказуемости результата и особенно при системном введении. Поэтому созданию эффективных систем доставки уделяется огромное внимание. Транспортерами НК могут быть вирусы и вещества разнообразной природы: неорганические комплексы, органические полимеры, биополимеры, в том числе липиды, полисахариды и пептиды.
Вирусы ввиду своего строения и природных функций хорошо выполняют задачу доставки генетического материала в клетки-мишени. Использование вирусов в качестве векторов подразумевает конструирование и сборку рекомбинантных вирионов, несущих необходимый трансген, после чего созданные рекомбинантные вирионы способны трансдуцировать клетки-мишени. Несмотря на высокую эффективность, вирусные средства доставки обладают рядом существенных недостатков: сложность подготовки вектора и его хранения, высокая вероятность нежелательных иммунных реакций у пациентов, опасные мутации вирусного генома вектора, а также инсерционный мутагенез, когда геном вирусного вектора неконтролируемо встраивается в хромосому клетки-мишени, что может привести к активации онкогенов и перерождению клетки в раковую. Медицина уже имеет печальный опыт клинических исследований аденовирусных и ретровирусных векторов, связанных с гибелью волонтеров [Raper S.E. et al. Fatal systemic inflammatory response syndrome in a ornithine transcarbamylase deficient following adeniviral gene transfer, Mol. Gen. Metabol., 2003, 80 (1-2): 148-158] или развитием онкологии как побочных эффектов. В связи с этим, активно ведутся исследования не только по усовершенствованию и увеличению безопасности вирусных векторов, но и по поиску новых невирусньгх средств доставки.
Среди невирусных векторов последнее время активно исследуются катионные полимеры, пептиды, липосомы. К их достоинствам можно отнести биодеградируемость и биосовместимость, простоту и быстроту синтеза, хранения и использования, а также, в отличие от вирусных систем, они не иммуногенны и не приводят к мутациям. Идеальный вектор для доставки НК должен: (i) упаковывать НК в наночастицы; (ii) защищать НК от ферментов, (iii) облегчать проникновение НК в клетки; (iv) инициировать эндосомальный выход; (v) высвобождать НК в цитоплазму и (vi) иметь низкую токсичность.
Липидные системы в настоящее время - это наиболее часто используемые агенты доставки НК как in vitro, так и in vivo. Для этой цели применяются, как правило, катионные липиды, которые формируют комплексы с отрицательно заряженными НК посредством спонтанного электростатического взаимодействия, так называемые липоплексы. Сейчас многие коммерческие средства доставки НК для научных целей имеют липидную природу: OligofectamineTM [Tompkins S.M. et al. Protection against lethal influenza virus challenge by RNA interference in vivo. Proc. Natl. Acad. Sci. USA, 2003, 101 (23): 8682-8686], TransIT-TKO [Bitko A. et al. Inhibition of respiratory viruses by nasally administered siRNA. Nature Med., 2005, 11 (1): 50-55], DharmFECT [Wang J.-C. et al. Arthritis Res. Therapy, 2010, 12 (2): 60] и т.п. Главные проблемы таких систем - токсичность, активация провоспалительных цитокинов и неспецифического интерферонового ответа. Катионные липосомы в форме водных дисперсий обладают также низкой стабильностью и их могут деградировать макрофаги. В частности, было продемонстрировано, что катионные липосомы Lipofectamine и DOTAP проявляют дозозависимую токсичность. Для снижения нежелательных эффектов их часто покрывают полиэтиленгликолем. Рассматривая результаты доклинических исследований липосомальных средств, можно сделать вывод, что разработанные на сегодняшний день варианты, как правило, оказываются достаточно токсичными. Поэтому их клиническое использование разрешено лишь для пациентов с онкологическими заболеваниями и гепатитом С, где снижен коэффициент безопасности, например, для химиотерапии.
Полимерные системы доставки имеют ряд преимуществ в сравнении с липосомами, в частности они легко поддаются модификации и не вызывают воспалительных иммунных ответов. Наибольшее распространение получили полиэтиленимин (PEI), полиамидоамин (РАМАМ) и природные, например полиглюкозамин или хитозан. Полимеры имеют высокую плотность положительного заряда и спонтанно формируют комплексы полимер/НК, которые называют полиплексами. Эффективности и размер полиплекса, как правило, зависит от молекулярной массы полимера, соотношения зарядов, рН и ионной силы раствора. Примечательно, что полимеры эффективны в доставке ДНК-молекул, в то же время малоэффективны при доставке коротких НК молекул, миРНК. Другие недостатки связаны с токсичностью (для PEI), плохой биодеградируемостью (PEI, РАМАМ, хитозан) и воспроизводимостью результатов (хитозан).
Возможности использования пептидов для доставки НК в клетки-мишени появились еще с открытия белка ТАТ из вируса HIV-1 и локализации в нем катионного НК-связывающего домена [Green М. & Loewenstein P.M. Cell, 1988, 55 (6): 1179-1188]. С тех пор было синтезировано большое количество различных пептидов для кандидатов для доставки НК, которые часто называют «проникающие пептиды» (ПП или cell-penetrating peptides=CPPs). Одними из первых были созданы и изучены аналоги и производные ТАТ - пептида, пенетратин, транспортан. Сравнению активности различных ПП посвящен ряд обзоров [Morris М.С. et al. Cell-penetrating peptides: from molecular mechanisms to therapeutics. Biol. Cell, 2008, 100 (4): 201-217; Copolovici D.M. et al. Cell-penetrating peptides: Design, synthesis, and applications. ACS Nano, 2014, 8 (3): 1972-1994; Trabulo S. et al. Cell-penetrating peptides - mechanisms of cellular uptake and generation of delivery systems. Pharmaceuticals, 2010, 3: 961-993].
Катионные пептиды способны образовывать комплексы с отрицательно заряженными НК и конденсировать их в компактные наноструктуры. Комплексование, с одной стороны, обеспечивает защиту НК от действия нуклеаз, а с другой - способствует их транслокации через клеточные мембраны, чаще всего путем эндоцитоза. Степень компактизации НК, т.е. физический размер формируемого комплекса НК/носитель, сильно влияет на эффективность его транслокации через клеточную мембрану. Эффективность также зависит от суммарного заряда комплекса, который, в свою очередь, определяется отношением количества положительных зарядов носителя к количеству отрицательных фосфатных групп НК (величина R). Обычно в составе комплекса катионный носитель находится в избытке, обеспечивая суммарный позитивный заряд всего комплекса, что повышает эффективность его проникновения в клетки, т.к. поверхность клетки обычно несет отрицательный заряд. Кроме того, при взаимодействии носителя с НК происходит увеличение размера комплекса носитель/НК по сравнению с исходными размерами отдельных компонентов до их взаимодействия, при этом оптимальным для эффективного проникновения в клетки размером формируемых наночастиц является не более 300 нм. Среди различных изученных ПП одни представляют собой фрагменты природных белков, другие построены из комбинаций различных участков белка. Следует учесть, что в настоящее время нет общепринятой теории и тем более алгоритма для предсказания эффективного ПП в отношении трансфекции. Дизайн многих ПП основан на чисто умозрительных гипотезах с учетом некоторых структурных соображений, например способности формировать амфипатическую α-спираль, что благоприятно для взаимодействия с липидной мембраной клетки. Однако сам механизм клеточной трансфекции довольно сложный и транслокация комплекса НК с пептидом через мембрану является лишь первым этапом этого процесса.
Принцип доставки может базироваться как на ковалентном конъюгировании, так и на нековалентном связывании с НК. Наиболее значимым недостатком первой стратегии является трудоемкость и низкая эффективность конденсации НК с ПП. По всем соображениям, наиболее перспективными считается стратегия нековалентного комплексообразования. Объектами доставки могут быть любые НК, плазмидные ДНК, РНК, сплайсинг-корректирующие олигонуклеотиды, миРНК. Общим для всех ПП является наличие позитивно заряженных аминокислот при физиологическом значении pH, их длина составляет 8-30 аминокислот. Установлено, что транспорт ПП через клеточную мембрану осуществляется преимущественно путем эндоцитоза.
Преимуществами использования синтетических пептидов над другими системами являются их низкая токсичность, способность к биодеградации в клетке-мишени, и практически неограниченные возможности в дизайне структур, которые могут представлять собой линейные, циклические и дендримерные пептиды с желаемым суммарным зарядом, трехмерной структурой и энантиомерным составом. Устойчивость их при хранении в сухом состоянии, сравнительная дешевизна методов их синтеза и масштабируемость производства (автоматические синтезаторы). По всем этим параметрам пептиды имеют явное конкурентное преимущество по сравнению с липосомами, как средством доставки.
Несмотря на большое количество созданных пептидов, разработкам новых соединений уделяется большое внимание, связанное с тем, что с эффективность трансфекции данного типа клеток-мишеней определенного органа/ткани пептида также сильно зависит от структуры пептида-транспортера. Небольшое изменение структуры пептида способно влиять на фармакокинетику его комплекса с НК. Другие проблемы связаны с тем, что обычные линейные пептиды при попадании в биологическую среду подвергаются быстрой протеолитической деградации, при этом ПП с высоким позитивным зарядом обладают заметной мембрано-деструктивной активностью и могут вызывать лизис клеток (цитотоксичность).
Перспективными конструктивными вариантами ПП являются липопептиды и дендримерные структуры. Добавление липофильных группировок (жирных хвостов) на один из концов пептида (N или С) формирует амфифильный «липопептид», что в водной среде приводит к его агрегации и формированию мицелл или липосом (два жирных хвоста). В отличие от простых линейных катионных пептидов, такая форма облегчает транспорт липопептида и его комплекса с НК через липидные бислойные мембраны. Недостатком липопептидов, особенно коротких, является их низкая растворимость в водной среде и отсюда трудность в их очистке методом ВЭЖХ. Проблему решают путем их перевода в липосомальную форму. Однако многие липопептиды обладают повышенной цитотоксичностью, способствуя дестабилизации клеточных мембран и даже их деструкции.
Другой тип ПП, дендримеры, представляющие собой разветвленные глобулярные структуры с плотным ядром и внешним слоем, состоящим из заряженных группировок одного типа. При высоких степенях ветвления (генерации) стерические ограничения ведут к формированию глобулярных конформаций. Ввиду высокой плотности заряда они способны эффективно связывать НК (дендриплексы). Использование дендримеров в качестве агентов доставки молекул НК в основном ограничивались использованием полимерных полиамидоаминов (РАМАМ). В 1993 г. впервые были опубликованы результаты исследований о том, что молекулы ДНК, содержащие гены люциферазы и β-галактозидазы, могут быть доставлены в клетки с помощью РАМАМ-дендримеров. Было показано, что различные поколения протонированных дендримеров (заряд +) взаимодействуют с отрицательно заряженными плазмидными ДНК, и этот комплекс стабилен при физиологических условиях даже в присутствии додецилсульфата натрия. Результативность трансфекции зависела от типа дендримеров, в некоторых случаях эффективность трансфекции в 10-100 раз превышала эффективность известных коммерческих катионных липидов.
Применение дендриплексов позволило значительно повысить эффективность транспорта генов в цитоплазму и ядро клетки. Одно из основных преимуществ дендримеров в том, что они являются монодисперсными структурами, поскольку их синтез проводится по строго заданной схеме на основе принципов твердофазного синтеза. Функциональные свойства дендримеров во многом зависят от свойств терминальной группировки, при этом их растворы обладают гораздо меньшей вязкостью, чем растворы линейных аналогов с такой же молекулярной массой. Благодаря возможности создавать дендримеры определенного размера, типом ветвления, регулируемым поверхностным зарядом и их топографией, они представляют очень удобные объекты для создания проникающих комплексов с НК. Другим привлекательным свойством является их биосовместимость и устойчивость к биодеградации. Ранее установлено, что пептиды, содержащие аргинин и конъюгированные ковалентно с нуклеиновыми кислотами, хорошо проникают в клетки и обеспечивают их трансфекцию с эффективностью даже лучшей, чем известные проникающие пептиды из природных белков, ТАТ и Пенетратин. Причем дополнительное введение в терминальные ветви дендримера остатков глицина или ε-аминогексановой кислоты и гистидина может повышать трансфецирующую активность конъюгатов, по-видимому, за счет увеличения гибкости пептидных цепей и менее жесткому связыванию нуклеиновых кислот с ДП.
Надо отметить, что в некоторых работах для трансфекции применяют не электростатические комплексы, а ковалентные конъюгаты нуклеиновых кислот с дендримерами, причем ковалентное связывание иногда осуществляют через меркаптогруппу цистеина, который водят в дендример, и способен взаимодействовать с активированной молекулой нуклеиновой кислоты. Такой подход обусловлен тем, при попадании конъюгата внутрь клетки цитоплазматические редуктазы могут расщеплять эту связь, тем самым высвобождать нуклеиновую кислоту. Однако такая система доставки нуклеиновых кислот значительно усложняет практическую реализацию метода трансфекции, поскольку необходима дополнительная непростая химическая модификация целевой НК для введения специальной SH-реактивной группы.
Таким образом, преимущество дендримерных ПП в том, что они монодисперсны, стабильны, обладают сравнительно низкой вязкостью при высоком молекулярном весе, высокой плотностью ионогенных концевых групп, способные эффективно связывать разнообразные НК [Wu J., Huang W., He Z. Dendrimers as Carriers for siRNA Delivery and Gene Silencing: A Review. Sci. World J., 2013, http://dx.doi.org/10.1155/2013/630654].
Пока известно немного патентов на способы изготовления проникающих ДП для доставки НК. Так, известно изобретение, описанное в патенте US 6376248 "Peptide-enhanced transfections», в котором авторы предлагают многочисленные композиции для трансфекции клеток эукариот, включающие комплексы НК с пептидами, где нуклеиновая кислота связана ковалентно с линейным катионным пептидом с аминокислотной последовательностью ТАТ-пептида (из ВИЧ), дендримером или липопептидом. Описанные в патенте дендримеры являются производными коммерческого дендримера РАМАМ (от компании Dendritech Inc.) с высокой молекулярной массой, к концевым группам которого присоединены остатки лизина (LysDmer) или аргинина (ArgDmer).
В заявке №2012153218/10, 14.06.2011 «Получение комплексов нуклеиновых кислот и поперечно-сшитых дисульфидными связями катионных компонентов, предназначенных для трансфекции и стимуляции» авторы предлагают применять композицию, содержащую полимерный носитель и карго-молекулу, в качестве иммуностимулирующего агента или адъюванта. В том числе заявлены олигопептиды и белки с общей формулой (Arg)1; (Lys)m; (His)n; (Orn)o; (Xaa)x, однако авторы не указывают, линейные ли это пептиды или дендримеры.
Патент US 6376248 B1 "Peptide-enhanced transfections» описывает многочисленные композиции для трансфекции клеток эукариот, включающий комплексы нуклеиновых кислот с пептидами, где нуклеиновая кислота связана ковалентно с линейным катионным пептидом, дендримером или липопептидом. Однако дендримерный компонент представляет собой не пептид, а полимер РАМАМ.
Известна публикация (Luo К, Li С, Wang G, Nie Y, Не В, Wu Y, Gu Z. Peptide dendrimers as efficient and biocompatible gene delivery vectors: Synthesis and in vitro characterization. J. Control Release, 2011, 55 (1): 77-87), где описывается введение в терминальные ветви дендримера остатков глицина, ε-аминогексановой кислоты и гистидина. Однако в данном случае осуществляется не электростатические формирование комплекса НК/носитель, а их жесткое ковалентное взаимодействие. Такой принцип формирования комплекса значительно усложняет практическую реализацию изобретения, как указывалось выше, ввиду необходимости дополнительной химической модификации молекул носителя и НК, с последующей очисткой комплекса, что сопряжено с потерями и снижением выхода конечного продукта.
Патент RU 2127125 («Биологически активные и/или целевые дендримерные конъюгаты») описывает плотные звездчатые полимерные конъюгаты, ассоциированные с биологическим модулятором, причем в одном из воплощений плотным звездчатым полимером является дендример, но полученный не на основе разветвленного пептида, а на основе полимеров (РАМАМ, полиэтиленимин и др.).
Сложность изучения фармакокинетики препаратов, содержащих НК и пептиды, обусловлена тем, что в организме млекопитающих присутствует большое количество соединений, сходных по природе, и это создает проблемы селективной детекции именно компонентов самого комплекса пептид/НК. Другая проблема связана с тем, что объемная метка (часто флуоресцентная), вводимая в сравнительно короткий пептид, может существенно изменить его специфичность [Kuil J., Velders А.Н., Van Leeuwen F.W.В. Multimodal tumor-targeting peptides functionalized with both a radio-and a fluorescent-label. Bioconjugate Chem., 2010, 21: 1709?1719; Kuil J. et al. Hybrid Peptide Dendrimers for Imaging of Chemokine Receptor 4 (CXCR4) Expression. Mol. Pharm., 2011, 8 (6): 2444-2453].
Ближайшим аналогом изобретения является использование меченых катионных дендримеров, где этилендиаминовый кор дендримера РАМАМ метилицианиновым красителем Су5 и изучали биораспределение меченого препарата у новорожденных крыс, у здоровых и с церебральным параличом [Lesniak et al. Biodistribution of fluorescently labeled РАМАМ dendrimers in neonatal rabbits: effect of neuroinflammation. Mol. Pharm., 2013, 10 (12): 4560-4571]. В работе отмечено, что применение такой метки сравнимо с радиоактивной и имеет превосходную чувствительность (0.1 нг/г ткани) и позволяет использовать меченый препарат более длительное время по сравнению с радиоактивной.
Однако дендримерный компонент представляет собой не пептид, а полимер РАМАМ. Поэтому одной из проблем в использовании мультимерных пептидов является то, что молекулярный объем метки будет заметно меньше, чем объем пептида. Важно также, что введение метки по возможности не должно затрагивать функциональные группы пептида, необходимые для его активности (связывания с НК). Дендримерные пептиды, по сути, являются мультимерными, их объем возрастает в геометрической прогрессии по мере возрастания номера генерации (точки разветвления). Поскольку именно позитивно заряженные концевые группы молекул ДП выполняют функцию связывания с НК, то введение метки не должно затрагивать эти группы.
Задачей данного изобретения является дизайн конструкции меченых дендримерных пептидов (ДП), нацеленных на использование в медицине для анализа фармакокинетики пептидных носителей и их комплексов с НК, т.е. прослеживание скорости транспорта и распределения по органам, необходимое для оценки его клинической эффективности.
Для решения данной задачи были разработаны меченые катионные дендримерные пептиды для внутриклеточной доставки нуклеиновых кислот, представленные формулой: X-AC(Y)-NH2, где X является дендримерным катионным пептидом с аминокислотным составом, выбранным из группы, состоящей из (К)4(К)2К, (R)8(K)4(K)2K, (RRRKK)2KKK и (К8)(К4)(К2)К,
где К представляет собой лизин;
R - представляет собой аргинин;
А - представляет собой аланин;
С - представляет собой цистеин;
Y - представляет собой присоединенный по меркаптогруппе цистеина флуоресцентный цианиновый краситель Су5.
Технический результат настоящего изобретения состоит в создании модульной конструкции меченых дендримерных пептидов, имеющих связывающий модуль, представляющий собой заряженный кластер из N-концевых катионных аминокислот (аргинин или лизин) для взаимодействия с НК, и сигнальный модуль, содержащий флуоресцентную метку - цианиновый краситель Су5 для визуализации распределения препарата (комплекса с НК) по органам и тканям, обладающей высокой функциональной и биологической активностью, обеспечивающей таким образом трансфекционную активность, близкую к трансфекционной активности комплексов нуклеиновой кислоты с немеченым дендримерным пептидом.
Краткое описание чертежей:
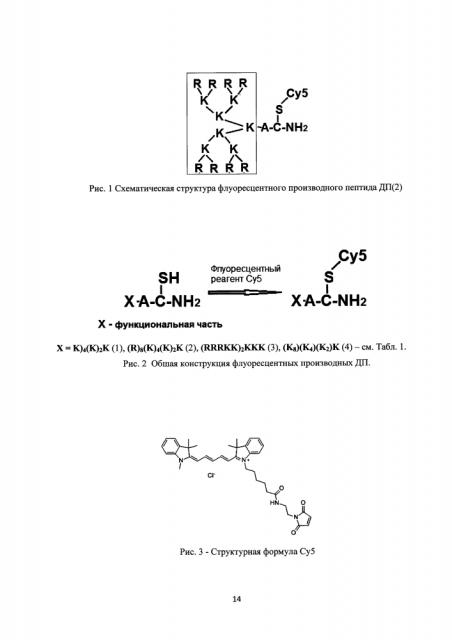
Рис. 1. Схематическая структура флуоресцентного производного пептида ДП(2).
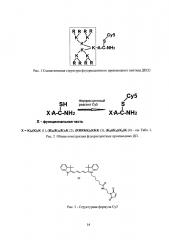
Рис. 2. Общая конструкция флуоресцентных производных ДП.
Рис. 3. Структурная формула Су5.
Рис. 4. Macс-спектр (MALDI-TOF) ДП(2).
Рис. 5. Масс-спектр (MALDI-TOF) ДП(2)-Су5.
Рис. 6. Трансфекционная активность меченого и немеченого ДП(2).
Подробное описание изобретения
В качестве проникающих ДП использованы пептиды, представленные в таблице 1.
Таблица 1. Структура синтезированных дендримерных пептидов, потенциальных транспортеров НК для стимуляции трансфекции.
Все ДП сконструированы так, что содержат остаток цистеина (С) со свободной меркаптогруппой (SH) на карбоксильном конце пептида (рис. 1), а позитивно заряженные остатки аргинина (Arg) находятся на другой стороне пептида. Такая конструкция позволяет разобщить в пространстве функциональный участок (позитивно заряженный кластер, связывающий НК=Х) и флуоресцентную метку (Су5), как изображено на рис. 1.
Основные требования, предъявляемые к флуоресцентной метке и способу ее введения - это низкая токсичность конечного продукта, высокий квантовый выход и стабильность хромофора. В данном изобретении, в качестве хромофорной метки используется цианиновый краситель Су5 (BioDye, кат. 08034, формула изображена на рис. 3), характеризующийся очень высоким коэффициентом экстинкции с длиной волны возбуждения около 650 и максимум флуоресценции при 670 нм (красный диапазон видимого спектра). Данное соединение содержит малеимидную группу, реактивную в отношении меркаптогруппы цистеина, который находится в составе ДП. Связывание ДП с Су5 идет за счет реакции алкилирования, протекающей быстро и однозначно, и практически не дающей побочных продуктов («клик-реакция»). Непрореагировавший Су5 удаляется тщательный экстракцией (этилацетат, диэтиловый эфир), и конъюгат ДП-Су5 дополнительно очищают жидкостной хроматографией на колонке с Sephadex G-25. После лиофилизации выделенной фракции получают порошок синего цвета. Структура конъюгата ДП-Су5 подтверждается масс-спектрометрией (рис. 5).
Изученная биологическая активность меченых ДП (рис. 6) в сравнении с немечеными ДП показала, что они сохраняют высокую функциональную и биологическую активность. Эксперименты по сравнению трансфекционной активности меченого и немеченого ДП(4) для клеток 293Т с использованием ДНК-плазмиды (pGL3), содержащей ген люциферазы, показали, что активность меченых ДП снижается лишь на 17% (рис. 6). По-видимому, прикрепленная метка не мешает взаимодействию такого модифицированного пептида с целевой НК, и формируемый комплекс ДП-Су5/плазмида способен эффективно трансфецировать клетки.
Изобретение иллюстрируется описанием синтеза и рисунками на примере получения меченого дендримерного пептида ДП(2).
Пример 1. Синтез ДП (2)
Синтез катионных дендримерных пептидов проводят твердофазным методом, используя стандартный протокол Fmoc-химии и N-гидроксибензотриазол/диизопропилкарбодиимидный (ГБТ/ДИП) метод активации Fmoc-аминокислот. В качестве полимера-носителя используют смолу Rink Amide МВНА, другие реагенты: Fmoc-Cys(Trt)-OH, Fmoc-Ala-OH, Fmoc-Lys(Boc)-OH, Fmoc-Arg(Pbf)-OH. Стандартный синтетический цикл включет промывку гранул полимера в реакторе диметилформамидом (ДМФА), удаление Fmoc-защиты 20% пиперидином в ДМФА, предварительное активирование Fmoc-аминокислоты реагентами ДИП/ГБТ и конденсацию в среде ДМФА при 2-кратном избытке карбоксильного компонента (~0,5 часа). Контроль над полнотой реакции осуществляют нингидриновым методом и при необходимости реакцию конденсации повторяют. Конечные пептиды отщепляют от полимера трифторуксусной кислотой в присутствии смеси скавенджеров (тиоанизол, этандитиол, фенол, диметилсульфид). Сырой продукт высаждают сухим серным эфиром, экстрагируют водной уксусной кислотой и экстракт лиофилизируют. Очистку пептида проводят методом высокоэффективной жидкостной хроматографии (ВЭЖХ), используя колонку Grace Vydac 218 ТР54. Структуру полученных продуктов подтверждают масс-спектрометрией (рис. 4).
Пример 2. Синтез меченого дендримера
Навеску 10 мг пептида ДП(2) смешивают с навеской красителя Су5 в мольном соотношении 1:1 (2,8 мг) и растворяют в 1 мл диметилсульфоксида (ДМСО). Полученный раствор оставляют без доступа света при 4°C на 4 часа. К полученному застывшему гелю добавляют 10 мл этилацетата и смесь энергично встряхивают (Vortex) 5 мин. После расслоения раствора верхний слой аккуратно декантируют, а к нижнему опять добавляют этилацетат в том же объеме. Операцию экстракции непрореагировавшего Су5 повторяют несколько раз, до тех пор, пока этилацетатный слой не станет бесцветным. Остаток промывают серным эфиром и высушивают в вакууме. Оставшийся синий порошок растворяют в 1 мл дистиллированной воды и вводят в колонку с сефадексом G-25 (1×20 см) и проводят элюирование дистиллированной водой, фракцию, близкую к свободному объему колонки, выделяют и лиофильно высушивают. Полученный меченый пептид, ДП(2)-Су5, представляет собой порошок синего цвета, выход 11,5 мг; масс-спектр содержит молекулярный пик с m/z 2946, соответствующий молекулярному иону целевого соединения (рис. 5).
Пример 3. Оценка трансфекционной активности меченого ДП
Культуру клеток 293Т засевали в 48-луночный планшет в полной среде ДМЕМ, которая содержит 10% эмбриональной телячий сыворотки (ЭТС), 300 мг/л глутамина-L и 60 мг/мл гентамицина в количестве 50-75 тыс. клеток на лунку в объеме 300 мкл полной среды ДМЕМ и культивировали при 37°C в 5% атмосфере CO2 до образования монослоя 75% конфлюентности (1 сутки). Затем готовили трансфекционную смесь, состоящую из плазмиды pGL3, которая несет репортерный ген люциферазы светлячка (Juc) и ДП(2). Трансфекционную смесь готовили в среде optiMEM (Gibco), не содержащей ЭТС и антибиотиков. Для этого 2 мкг ДП(2) или ДП(2)-Су5 смешивали с 40 мкл optiMEM в отдельной пробирке, а 0,2 мкг pGL3 также смешивали с 40 мкл optiMEM в отдельной пробирке. Затем содержимое пробирки с pGL3 смешивали с содержимым пробирки с ДП(2) или ДП(2)-Су5, таким образом, суммарный объем комплекса составил 80 мкл. Для достижения равновесного состояния комплекса смесь инкубировали при комнатной температуре в течение 25-30 минут, избегая попадания прямых солнечных лучей или других источников ультрафиолетового излучения. Подготовленный и сформированный комплекс ДП(2)/pGL3 или ДП(2)-Су5/pGL3 в объеме 80 мкл optiMEM вносили к клеткам в лунки 48-луночного плейта по каплям и инкубировали при 37С в 5% атмосфере CO2 в течение 2 суток. В качестве отрицательного контроля использовали плазмиду pGL3 без смешивания с каким-либо трансфекционным реагентом. После инкубации клеток с комплексом надосадочную среду удаляли из лунок планшета, а монослой клеток лизировали в 60 мкл специального буфера (Luciferase Cell Culture Lysis Reagent (Promega)). Лизат клеток переносили в отдельные пробирки на 1,5 мл и центрифугировали и осуществляли цикл замораживания оттаивания для лучшего лизиса клеток; замораживание проводили в течение ночи при -70°C, а оттаивание в течение 10-15 мин при 37°С в твердотельном термостате. Далее лизаты клеток интенсивно встряхивали (Vortex) и центрифугировали при 10000 об/мин при 4°С в течение 2 минут для удаления клеточных стенок. Надосадочный раствор переносили в отдельные пробирки на 1,5 мл. После чего проводили измерение люциферазной активности каждого образца путем смешивания 50 мкл лизата с 50 мкл люциферина - субстрата для люфиферазы. При наличии в образце фермента - люциферазы происходит излучение света, интенсивность которого детектировалось люминометром (Promega) в относительный световых единицах (RLU). Результаты отображены на рис. 6. Полученные данные свидетельствуют, что «голая» плазмида не проникает в клетки и соответственно сигнал присутствует лишь на фоновом уровне, порядка 200 RLU. В то же время трансфекционные активности как меченого ДП(2)-Су5, так и исходного ДП(2) находятся на высоком уровне, около 4000000 RLU. Изученная биологическая активность меченых ДП (рис. 6) в сравнении с немечеными ДП показала, что они сохраняют высокую функциональную и биологическую активность. Эксперименты по сравнению трансфекционной активности меченого и немеченого ДП(4) для клеток 293Т с использованием ДНК-плазмиды (pGL3), содержащей ген люциферазы, показали, что активность меченых ДП снижается лишь на 17% (рис. 6). По-видимому, прикрепленная метка не мешает взаимодействию такого модифицированного пептида с целевой НК, и формируемый комплекс ДП-Су5/плазмида способен эффективно трансфецировать клетки. Таким образом, меченые катионные дендримерные пептиды в комплексе с нуклеиновой кислотой обладают трансфекционной активностью, близкой к трансфекционной активности комплексов нуклеиновой кислоты с немеченым дендримерным пептидом.
Меченые катионные дендримерные пептиды для внутриклеточной доставки нуклеиновых кислот, представленные формулой: X-AC(Y)-NH2, где X является дендримерным катионным пептидом с аминокислотным составом, выбранным из группы, состоящей из (K)4(K)2K, (R)8(K)4(K)2K, (RRRKK)2KKK и (K8)(K4)(K2)K,
где K представляет собой лизин;
R - представляет собой аргинин;
А - представляет собой аланин;
С - представляет собой цистеин;
Y - представляет собой присоединенный по меркаптогруппе цистеина флуоресцентный цианиновый краситель Су5.