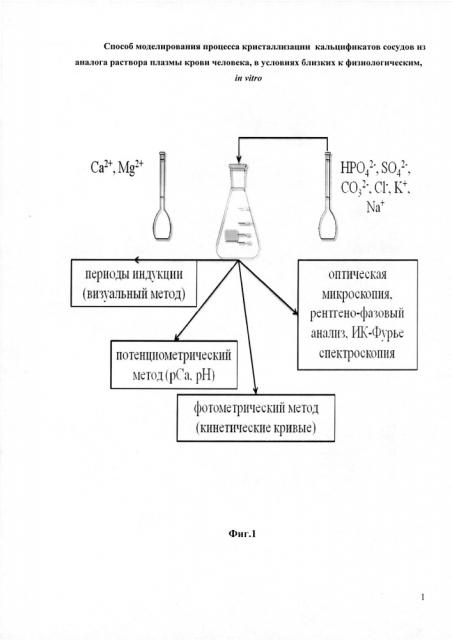
Способ моделирования процесса кристаллизации кальцификатов сосудов из аналога раствора плазмы крови человека в условиях, близких к физиологическим, in vitro
Иллюстрации
Показать всеИзобретение касается способа моделирования патологических процессов образования минеральных фаз при патогенной кальцификации коллагеновых и мышечных тканей. Сущность способа заключается в том, что получают минеральные фазы, составляющие основу неорганической компоненты кальцификатов сердечных клапанов человека, в искусственно созданной, приближенной к физиологической среде модельной системе. При этом создают модельные среды, близкие по неорганическому составу, рН, ионной силе к плазме крови человека, следующего состава: объем раствора 250 мл, массы (г) солей: CaCl2*2H2O - 0,1446; K2HPO4 - 0,1288; (NH4)2HPO4 - 0,6600*10-3; MgCl2*6H2O - 0,0482; NaHCO3 – 0,5460; Na2SO4 - 0,0639; NaCl – 5,7330 г, при рН 7,40±0,05. Наблюдение проводят в течение 7 суток, полученный осадок отфильтровывают, высушивают при t=80±5°C в течение 5 часов. В составе осадка идентифицируют карбонатгидроксилапатит с примесью витлокита, близкого по составу к кальцификатам коллагеновых и мышечных тканей человека. Использование способа позволяет выявить параметры, которые приводят к патогенной кальцификации коллагеновых и мышечных тканей человека. 3 ил., 5 табл.
Реферат
Изобретение относится к области экспериментальной медицины, в частности к области моделирования патологических процессов образования минеральных фаз при патогенной кальцификации коллагеновых и мышечных тканей.
Долгое время с помощью минералогических оптическо-поляризационных методов исследуются патогенные биоминеральные объекты человеческого организма, как уролиты, холелиты, зубные, слюнные и прочие крупные полиминеральные образования, легко извлекаемые из организма, по причине отсутствия тесной связи с тканью. Минерализация тканей изучена значительно хуже. Главной неорганической фазой патогенной кальцификации коллагеновых и мышечных тканей, так же как в костной и зубной тканях, является фосфат кальция, который с определенной степенью приближения и идеализации относят к карбонатсодержащему гидроксилапатиту, как правило, слабо окристаллизованному и нестехиометрическому из-за присутствия значительных количеств посторонних ионов. Некоторые из этих ионов входят в кристаллическую решетку апатита, другие же только адсорбируются на поверхности апатита. Этот апатит является типичным биогенным минералом, тесно связанным пространственно, генетически структурно и морфологически с протеинами, липидами и полисахаридами тканей организма.
Патогенный апатит не имеет такой тесной связи с обменными процессами в организме, как физиогенный. Степень дефектности его всегда высока и зависит в большей степени от локальных процессов, чем от состояния организма в целом. Соотношение Са/Р в кальцинатах, по многочисленным литературным данным, варьирует в значительных пределах.
В России первые работы по минералогии кальцифицированных тканей сердечнососудистой системы появились в Новосибирске. В ИГГМ в этом направлении работали две независимые группы: группа А.Т. Титова и группа Л.И. Гилинской. Обеими группами биоапатит рассматривается как обычный апатит из геологических объектов: однородный и неизменный в пространстве и времени, вследствие чего исключительно важная в биоминералогии область взаимодействия минерал - ткань исключается из сферы исследования. Группа А.Т. Титова прокаливала образцы 600°C, при этом исчезают не только минералообразующие структуры, но и сам апатит теряет кристаллизационную воду. Кроме того, может выделиться CO2, а значит, изменяются и параметры элементарной ячейки.
Группа Л.Г. Гилинской использует более щадящую методику: кальцинат не прокаливают, но после высушивания на воздухе полностью отделяют от тканевого материала. При этом нарушается и полностью уничтожается самая важная для патогенного минералообразования зона контакта: органоминеральный агрегат-ткань.
Кроме того, исследованием сосудистых отложений занималась группа в СпбГУ под руководством О.В. Франк-Каменецкой. Авторами были изучены кальцификаты сердечных клапанов восходящей сердечной аорты и перикарда. Результаты исследований показали, что кардиолиты представляют собой апатит-органические композиты.
Исследования показали, что изучаемый апатит содержит воду и существенное количество карбонат ионов, которые замещают фосфат ионы, т.е. является водо-содержащим карбонатапатитом. Апатит кардиолитов отличается по параметрам элементарной ячейки от других физиогенных и патогенных апатитов, образующихся в организме человека. Большие значения параметра с авторы объясняют существенным количеством карбонатионов и практическим отсутствием вакансий в позициях кальция.
Состав и свойства кальцинатов изучала группа под руководством Ламановой Л.М. (ТГУ). Автором исследована коллекция более чем из 500 кальцинатов, содержащихся в стенках сосудов, в сердечных клапанах, склеротических бляшках, миокарде и перикарде.
В процессе изучения кальцинатов автором выявлены общие закономерности патологического отложения минерального вещества в кровеносной системе человека. Несмотря на некоторые отличия в структурах отложения минерального вещества автор приходит к выводу, что абсолютно все так называемые «кальцинаты» кровеносной системы характеризуются сходным минеральным составом (до 90% апатита) и рядом общих, сопутствующих и способствующих минерализации условий.
Сложность большинства реальных физико-химических процессов не позволяет решить описанные проблемы в in vivo. Их изучение становится возможным в искусственно созданной модельной системе, приближенной к физиологической среде.
Известен способ моделирования процесса образования зубного камня, образующегося в результате преципитации из слюны фосфатов и карбонатов кальция и магния в органическую матрицу зубного камня, являющуюся ядром образования. Сущность его заключается в выращивании зубного камня путем помещения здорового зуба в искусственно созданной модельной среде, близкой по составу к ротовой жидкости людей, имеющих зубные отложения (патент РФ №2342713). К преимуществам данного способа относится возможность изучения патологических процессов, протекающих в полости рта человека. Это позволяет выявить причины развития и течения заболевания, следовательно, разработать эффективные методы его лечения.
Основными недостатками этой модели является то, что она позволяет исследовать лишь патологические процессы, протекающие в полости рта человека, в частности, при образовании зубного налета и росте зубного камня. Указанные недостатки связаны с тем, что минералообразующей средой в данном случае выступает смешанная слюна, отличающаяся от плазмы крови более широким диапазоном значении рН (5,6-7,6), содержанием всех неорганических ионов.
Технической задачей заявляемого решения является разработка способа экспериментального моделирования процесса патогенной кальцификации коллагеновых и мышечных тканей и выявление условий, способствующих осаждению минеральных фаз с целью выработки рациональных профилактических, диагностических и лечебно-восстановительных мер по предотвращению и развитию данного заболевания.
Указанный технический результат достигается тем, что предложен способ моделирования процесса кристаллизации кальцификатов сосудов из аналога раствора плазмы крови человека в условиях, близких к физиологическим, in vitro, включающий получение минеральных фаз, составляющих основу неорганической компоненты кальцификатов сердечных клапанов человека, в искусственно созданной приближенной к физиологической среде модельной системе, отличающийся тем, что создают модельные среды, близкие по неорганическому составу, рН, ионной силе к плазмы крови человека следующего состава: объем раствора 250 мл, массы (г) солей: CaCl2*2H2O - 0,1446; K2HPO4 - 0,1288; (NH4)2HPO4 - 0,6600*10-3; MgCl2*6H2O - 0,0482; NaHCO3 – 0,5460; Na2SO4 - 0,0639; NaCl – 5,7330 г, при рН 7,40±0.05, проводят наблюдение в течение 7 суток, полученный осадок отфильтровывают, высушивают при t=80±5°C в течение 5 часов. В составе осадка идентифицируют карбонатгидроксилапатит с примесью витлокита близкого по составу к кальцификатам коллагеновых и мышечных тканей.
Для расчета состава систем использовали значения средней концентрации неорганических веществ, входящих в плазму крови человека, полученные из литературных данных [Березов Т.Т., Коровин М.А. Биологическая химия. М: Медицина. 2002. 704 с.]. Состав плазмы крови человека представлен в таблице 1.
1. Рассчитали ионную силу растворов:
Учли, что мольные доли карбонатов и фосфатов зависят от рН. Молярные доли ионов в растворе при различных значениях рН рассчитали и свели в таблицу 2.
Подставили значения концентраций из табл. 1, мольные доли из табл. 2 и получили значения ионной силы моделируемых растворов для разных рН, свели в таблицу 3.
2. Следующий шаг - расчет коэффициентов активности ионов, входящих в состав осадков:
где А - коэффициент, зависящий от температуры, диэлектрической проницаемости растворителя (для водных растворов изменяется в диапазоне 0,51-0,52); а - константа, учитывающая минимальное расстояние, на которое сближаются ионы - средний эффективный диаметр ионов, принимается равным 3÷4 ; В - теоретический коэффициент, равный для водных растворов при 298 К (0,32÷0,33)⋅108 Коэффициенты активности осадкообразующих ионов для раствора, моделирующего состав плазмы крови приведены в таблице 4.
Рассчитываем состав раствора плазмы крови для среднего значения концентраций при рН=7,4
Пусть [Са2+]=х,
для средних концентраций плазмы крови , тогда
0,578⋅x⋅x=8,95⋅10-6
Таким образом
[Са2+]=3,94⋅10-3 моль/л на концентрацию гидрофосфат-ионов создаем с использованием двух солей, поэтому смотрим на концентрации других ионов: (табл. 1), поэтому с помощью (NH4)2HPO4 мы можем ввести только , остальное - с помощью K2HPO4, т.е.
Из табл. 1 [Mg2+]=0,95⋅10-3 моль/л,
тогда m (MgCl2⋅6H2O)=0,95⋅10-3⋅0,25⋅203=4,82⋅10-2 г
Из табл. 1
Хлорид-ионы вводим с солями кальция и магния: [Cl-]=2⋅[CaCl2⋅2H2O]+2⋅[MgCl2⋅6H2O]=2⋅(3,94⋅10-3+0,95⋅10-3)=4,89⋅10-3 моль/л
Ионы калия: [K+]=2⋅2,26⋅10-3=4,52⋅10-3 моль/л
Ионы натрия: [Na+]=2,6⋅10-2 моль/л
Данные для приготовления модельного раствора приведены в таблице 5.
Как видно из табл. 5, модельный раствор отличается от средних значений по содержанию натрия, хлорид-ионов и сульфатов, поэтому добавляем хлорид натрия в количестве 98 ммоль/л, тем самым закрываем потребность в хлорид-ионах и частично в ионах натрия. Добавляем сульфат натрия в количестве 0,45 ммоль/л, тогда полностью покрываем потребность в сульфатах. Остается ввести 117-98-1=18 ммоль/л натрия, можно использовать NaOH для создания необходимого значения рН.
Выбор исходных реагентов и их соотношение в растворе определялись таким образом, чтобы концентрации ионов и ионная сила раствора были максимально приближены к данным параметрам моделируемой системы.
В качестве исходных реагентов использовали соли марки ч.д.а. и х.ч. и дистиллированную воду. Для каждой серии экспериментов были приготовлены растворы, содержащие катионы и анионы, при совместном присутствии которых в данных условиях не образуются малорастворимые соединения. В каждом производили корректировку значений рН до физиологического значения (7.4±0.01) путем добавления 30%-ого раствора NaOH или HCl (конц.). После смешения эквивалентных объемов растворов получаем раствор с заданным пересыщением и рассчитанной концентрацией компонентов.
Все опыты проводили в термостатируемых условиях при температуре 25°C в отсутствии перемешивания. На Фиг. 1 представлена схема модельного эксперимента.
Рентгенофазовый анализ синтезированных твердых фаз (рис. 2) показал, что в составе осадка присутствует основная фаза карбонатгидроксилапатит (Са10-х/2(PO4)6-х(СО3)х(ОН)2) и незначительная примесь витлокита (Ca9Mg9(PO4)6(РО3ОН)).
На Фиг. 2 представлена дифрактограмма образца (* - пик витлокита, ** - пик карбонатгидроксилапатита)
Малая интенсивность и полуширина дифракционных отражений указывает на низкую кристалличность полученных порошков.
По параметрам наиболее разрешенных пиков был оценен размер кристаллитов, он составил 8,2 нм, что согласуется с литературными данными [Brown Ch. М., Ackermanu D.К., Purich D.L., Finloyson В. Nucleation of calcium oxalate monohydrate: use of turbidity measurements and computer-assisted simulation in characterizing of early events in crystal formation. //J. Crystal. Growth. 1991. V. 108. P. 455].
Исследование образцов методом ИК-спектроскопии позволяет внести уточнения в состав и структуру полученных образцов. Интерпретация данных проводилась путем качественной идентификации полос поглощения колебаний группировок на ИК-спектрах образцов.
На Фиг. 3 представлены ИК-спектры образцов 1 и 2. Из ИК-спектров образцов видно, что интенсивность характерных для гидроксилапатита полос колебаний ОН- в области 3500 см-1 очень мала. Колебания при 880-870 см-1 относятся к карбонатной группе, которая замещает гидроксильную группу, отсюда можно сделать вывод, что осадок содержит карбонатгидроксилапатит. А полосы в области 1090 и 1039 см-1 отвечают колебаниям группы РО4.
Таким образом, в составе полученных твердых фаз обнаружена смесь витлокита и карбонатгидроксилапатита. Известно, что витлокит - фаза-предшественник гидроксилапатита.
Заявляемый способ позволяет в модельных условиях выявить параметры, которые приводят к патогенной кальцификации коллагеновых и мышечных тканей человека с участием плазмы крови человека, и создать модельную систему, с помощью которой можно изучать эффективность воздействия лекарственных препаратов для профилактики и лечения патогенной кальцификации.
Способ моделирования процесса кристаллизации кальцификатов сосудов из аналога раствора плазмы крови человека в условиях близких, к физиологическим, in vitro, включающий получение минеральных фаз, составляющих основу неорганической компоненты кальцификатов сердечных клапанов человека, в искусственно созданной, приближенной к физиологической среде модельной системе, отличающийся тем, что создают модельные среды, близкие по неорганическому составу, pH, ионной силе к плазме крови человека, следующего состава: объем раствора 250 мл, массы (г) солей: CaCl2*2H2O - 0,1446; K2HPO4 - 0,1288; (NH4)2HPO4 - 0,6600*10-3; MgCl2*6H2O - 0,0482; NaHCO3 – 0,5460; Na2SO4 - 0,0639; NaCl – 5,7330 г, при pH 7,40±0,05, проводят наблюдение в течение 7 суток, полученный осадок отфильтровывают, высушивают при t=80±5°C в течение 5 часов, в составе осадка идентифицируют карбонатгидроксилапатит с примесью витлокита, близкого по составу к кальцификатам коллагеновых и мышечных тканей человека.