Композиция для визуализации и повреждения клеток-мишеней
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к композиции для визуализации и повреждения опухолевых клеток-мишеней, содержащей неорганические наночастицы размером 10-100 нм и размерной дисперсностью до 6% состава NaYF4, солегированные ионами иттербия (Yb) и эрбия (Er) или иттербия (Yb) и тулия (Tm), и включающей цитотоксический компонент, представленный бета-изотопом, которым является изотоп иттрия-90 (90Y), при этом наночастицы переведены в гидрофильную форму путем использования покрытия, представленного по крайней мере одним из соединений, выбранных из полималеинового ангидрида октадецена, полиэтиленимина, поли(D,L-лактида), поли(лактид-гликолида), диоксида кремния, тетраметиламмония гидроксида, при этом наночастицы связаны с гуманизированным мини-антителом scFv 4D5 или высокоаффинным пептидом неиммуноглобулиновой природы DARPin-29, которые специфичны к раковоассоциированному антигену HER-2/new. Изобретение обеспечивает возможность осуществления локального направленного терапевтического воздействия за счет повреждающего действия бета-излучения одновременно с возможностью оптической визуализации патологического очага при снижении риска отравления близлежащих тканей. 6 ил.
Реферат
Изобретение относится к области медицины и экспериментальной биологии, касается композиции для визуализации и повреждения опухолевых клеток-мишеней и может быть использовано для получения противоопухолевых препаратов на основе наноразмерных частиц, содержащих радиоактивные вещества, в том числе бета-активные изотопы, предназначенных для таргетной терапии и визуализации патологических очагов, в том числе рецепторно-зависимых. Потенциально перспективы использования изобретения могут быть реализованы не только в онкологии, но и в лечении таких тяжелых аутоиммунных заболеваний, как ревматоидный артрит, осложненный системными проявлениями.
Одним из важных результатов многолетней клинической и исследовательской работы международного онкологического сообщества является признание того, что таргетная терапия с применением иммунотоксинов должна дополняться химио- или лучевой терапией. Общим недостатком широко использующихся в настоящее время методов лучевой терапии является неадекватная точность воздействия. В основе лучевой терапии опухолевых заболеваний лежит известная в радиобиологии гиперчувствительность опухолевых тканей к ионизирующему излучению, в силу чего опухоли повреждаются сильнее, чем окружающие их здоровые ткани, подвергшиеся облучению. Радионуклиды, претерпевающие бета-распад (например, 32Р, 114Се, 90Y), среди которых предпочтение отдают радионуклидам с высокой энергией и относительно коротким периодом полураспада - от 2 дней до 2 недель, характеризуются оптимальной для биомедицинских применений длиной пробега в биологических тканях, измеряемой в сантиметрах. Использование таких радионуклидов значительно снижает побочное воздействие на здоровые ткани, однако требует их адресной доставки.
Известна цитотоксическая композиция для повреждения клеток мишеней (RU 2218938 С1, кл. A6K 51/00, A61K 1/08, C07K 1900, C12N 15/62, опубл. 20.12.2003 г.), состоящая из цитотоксического агента, компонента для узнавания клеток-мишеней и транспорта цитотоксического агента внутрь клетки-мишени, компонента для специфического направленного транспорта цитотоксического агента в клеточное ядро и компонента-носителя, в которой в качестве цитотоксического агента используется излучатель альфа-частиц - астат-211, в качестве компонента специфического направленного транспорта излучателя альфа-частиц в клеточное ядро используется модифицированная последовательность большого Т-антигена вируса SV-40: Ser-Ser-Asp-Asp-Glu-Ala-Thr-Ala-Asp-Ala-Gln-His-Ala-Ala-Pro-Pro-Lys-Lys-Lys-Arg-Lys-Val-Glu-Asp-Pro, в качестве компонента-носителя - бактериальная бета-галактозидаза, в качестве компонента для узнавания клеток-мишеней и транспорта излучателя альфа-частиц внутрь клетки-мишени путем специфического рецептор-опосредуемого эндоцитоза - эндоцитируемый лиганд. При этом компонент для специфического направленного транспорта излучателя альфа-частиц в клеточное ядро и компонент-носитель представлены химерным белком, эндоцитируемый лиганд представлен инсулином. Композиция обеспечивает адресную доставку радиоактивных изотопов путем присоединения низкомолекулярных носителей к направляющему модулю либо включения их в состав нанокапсулы, также, в свою очередь, снабженной направляющим модулем. Изобретение обеспечивает возможность повреждения определенного типа клеток, например опухолевых, при относительно низких концентрациях радионуклида и минимальном воздействии на окружающие ткани. Однако нестабильность радиоактивных изотопов приводит к нестабильности химической структуры препарата, что может, в свою очередь, приводить к возникновению риска отравления здоровых тканей как в непосредственной близости от опухолевого очага, так и в процессе выведения препарата из организма.
Известно контрастное средство с направленной доставкой или лекарственное средство с направленной доставкой (RU 2007122479 А, A61K 49/18, опубл. 20.12.2008 г.), содержащее ядро, оболочку, модифицированную посредством присоединения по меньшей мере первого полипептида, содержащего по меньшей мере один цистеин, лиганд, содержащий второй комплементарный полипептид, содержащий по меньшей мере один цистеин, связанный с оболочкой через связующий элемент, который образуется посредством электростатической ассоциации между указанным первым полипептидом и указанным вторым комплементарным полипептидом с последующим образованием по меньшей мере одной дисульфидной связи между указанными цистеинами. При этом вещество, применяемое в качестве ядра, может быть выбрано из люминесцентного вещества, например, такого как нанофосфоры (например, редкоземельные компоненты с примесью YPO4 или LaPO4, или такого как 86Y, или выбрано из токсинов, радиоизотопов и химиотерапевтических средств; испускающих UV-С наночастиц, например, таких как YPO4:Pr; средств для фотодинамической терапии (PDT), например, таких как соединения на основе структур расширенного порфирина; нуклидов для лучевой терапии, например, таких как 157Sm, 177Lu, 212/3Bi, 186/8Re, 67Cu, 90Y, 131I, 114mIn, At, Ra, Но. Вещество, применяемое в качестве оболочки(ек), выбрано из карбоновых кислот, галогенангидридов, аминов, кислых ангидридов, активированных сложных эфиров, малеинимидов, изотиоцианатов, аминов, золота, SiO2, полифосфата (например, полифосфата кальция), аминокислот (например, цистеина), органического полимера (например, полиэтиленгликоль/PEG, поливинилспирт/PVA, полиамида, полиакрилата, полимочевины), органического функционального полимера (например, аммонийной соли 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[карбокси(полиэтиленгликоля)2000]), биополимера (например, полисахарида, такого как декстран, ксилан, гликоген, пектин, целлюлоза или полипептид, такой как коллаген, глобулин), цистеина или пептида с высоким содержанием цистеина или фосфолипида.
Недостатком указанного средства является обязательное наличие направляющего модуля (цистеин-содержащие полипептиды и лиганды) и потенциальная нестабильность структуры дочерних продуктов распада радиоактивных изотопов при их включении в состав ядра композиции.
Известен способ интраоперационной визуализации патологических очагов (RU 2544094 С2, кл. А61В 5/00, В82В 1/00, G1N 33/543, C0K 11/77, опубл. 10.03.2015 г. ), включающий адресную доставку в патологические очаги конъюгатов наноразмерных антистоксовых фосфоров с молекулами на основе неорганического нанокристаллического матрикса NaYF4, солегированного ионами иттербия (Yb) и эрбия (Er) - NaYF4:Yb:Er, или иттербия (Yb) и тулия (Tm), NaYF4:Yb:Tm. Адресность доставки конъюгатов наноразмерных антистоксовых фосфоров осуществляется за счет преимущественного накопления в опухоли наноразмерных частиц (EPR-эффект, выраженный для частиц размером 10-100 нм), либо адресования с помощью направляющих модулей, содержащих молекулы, пептиды, антитела или их фрагменты, специфичные к рецепторам, экспрессируемым на поверхности опухолевых клеток. Однако способ не предполагает получения самостоятельного терапевтического эффекта при использовании конъюгатов наноразмерных антистоксовых фосфоров.
Наиболее близкой по технической сущности и достигаемому результату к предлагаемому изобретению является композиция для радиоизотопно-фотодинамической терапии злокачественных новообразований по заявкам WO 2012145671 А1, кл. A61K 39/395, опубл. 26.10.2012 г. и US 20140187843 А1, кл. A61N 5/06, A61N 5/10, опубл. 03.07.2014 г., принятая за ближайший аналог (прототип).
Композиция по прототипу содержит транспортный модуль и цитотоксический компонент, действие которого обусловлено конвертацией бета-излучения изотопа 32Р или трития в электромагнитное излучение оптического диапазона посредством наночастицы на основе кристаллического матрикса NaYF4, легированного редкоземельным металлом (лантанидом), с последующим преобразованием энергии оптического излучения в продукцию химического цитотоксического агента (синглетного кислорода) с использованием фотосенсибилизатора порфириновой природы. Композиция также включает целевой фрагмент, специфичный для опухоли, являющийся антителом, или фрагментом антиген-связывающим.
К недостаткам композиции по прототипу следует отнести необходимость конвертации бета-излучения радиоактивного изотопа в оптическое излучение, невозможность осуществления оптического мониторинга распределения и динамики препарата в приповерхностных тканях, доступных для наблюдения органов без формирования цитотоксического эффекта, относительно большая величина периода полураспада бета-активного изотопа 32Р (342 часа), химическая агрессивность продукта распада (32S). Невозможность осуществления оптического мониторинга распределения и динамики препарата в приповерхностных тканях без формирования цитотоксического эффекта обусловлена присутствием в составе композиции фотосенсибилизатора, непосредственно конвертирующего световую энергию в продукцию цитотоксического агента (синглетного кислорода) либо осуществляющего конверсию излучения флуоресценции кристаллического матрикса NaYF4, легированного редкоземельным металлом. Химическая агрессивность дочернего продукта распада бета-активного изотопа 32Р обусловлена тем, что бета-активный изотоп не включается в структуру кристаллического матрикса, что обусловливает непрочную его связь с транспортным модулем, и, как следствие, в результате распада бета-активного изотопа 32Р дочерний продукт 32S может выходить из состава композиции и, попадая в кровоток, приводить к повышению токсической нагрузки на организм в целом.
В задачу изобретения положено создание новой композиции для визуализации и повреждения опухолевых клеток-мишеней с бета-активным изотопом в структуре.
Техническим результатом от использования предлагаемого изобретения является возможность осуществления локального направленного терапевтического воздействия за счет повреждающего действия бета-излучения одновременно с возможностью оптической визуализации патологического очага при снижении риска отравления близлежащих тканей.
Поставленная задача достигается тем, что композиция для визуализации и повреждения опухолевых клеток-мишеней содержит неорганические наночастицы размером 10-100 нм и размерной дисперсностью до 6% состава NaYF4, солегированные ионами иттербия (Yb) и эрбия (Er) или иттербия (Yb) и тулия (Tm), и включает цитотоксический компонент, представленный бета-изотопом, которым является изотоп иттрия-90 (90Y), причем доля изотопа иттрия-90 к общему числу изотопов иттрия составляет от 10-5 до 100%, при этом наночастицы переведены в гидрофильную форму путем использования покрытия, представленного по крайней мере одним из соединений, выбранных из полималеинового ангидрида октадецена, полиэтиленимина, поли(D,L-лактида), поли(лактид-гликолида), диоксида кремния, тетраметиламмония гидроксида, при этом наночастицы связаны с гуманизированным мини-антителом scFv 4D5 или высокоаффинным пептидом неиммуноглобулиновой природы DARPin-29, которые специфичны к раковоассоциированному антигену HER-2/new.
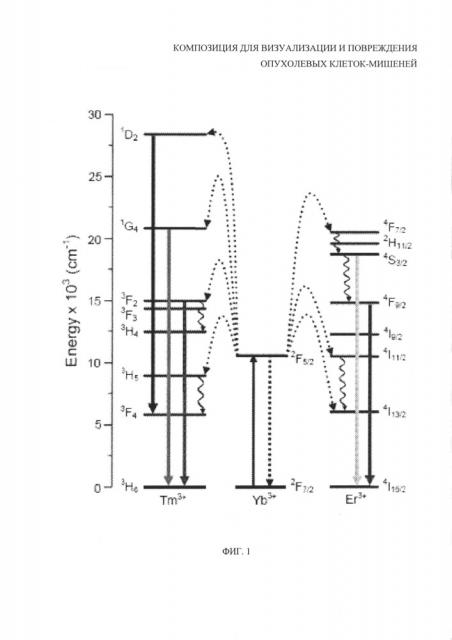
На фиг. 1 представлена диаграмма Яблонского для энергетических переходов в наночастицах состава NaYF4, солегированных редкоземельными элементами (цитируется по US 8088631 В2 "Lanthanide-doped NaYF4 nanocrystals, method of preparing and uses thereof").
На фиг. 2 представлены типичные спектры фотолюминесценции наночастиц состава NaYF4, солегированных редкоземельными элементами Yb и Tm.
На фиг. 3 представлено изображение бета-активных наночастиц состава NaYF4, полученное при помощи трансмиссионной электронной микроскопии.
На фиг. 4 представлено изображение бета-активных нанокристаллов состава NaYF4 без оболочки, полученное при помощи трансмиссионной электронной микроскопии.
На фиг. 5 представлено микроскопическое изображение клеток SKBR3 (клетки карциномы молочной железы человека), инкубированных в течение часа с наночастицами состава Na90YF4:Yb:Tm.
На фиг. 6 представлены результаты эксперимента по оценке цитотоксического действия Na90YF4:Yb:Tm в отношении опухолевых клеток SKBR3 (клетки карциномы молочной железы человека) в культуре, где: а - микроскопические изображения клеток, инкубированных в течение 96 часов с наночастицами состава Na90YF4:Yb:Tm (опыт); б - результат эксперимента по оценке жизнеспособности опухолевых клеток SKBR3 после 96 часов инкубации с наночастицам состава Na90YF4:Yb:Tm (опыт), анализ жизнеспособности клеток выполнен методом МТТ-теста.
Композиция для визуализации и повреждения клеток-мишеней содержит неорганические наночастицы состава NaYF4 и цитотоксический компонент.
Неорганические наночастицы NaYF4, обладающие оптически-контрастными свойствами, солегированы редкоземельными элементами, представляющими собой нанокристаллы малого размера кубической α-кристаллической фазы, которые в процессе синтеза переводятся в β-гексагональную фазу, а затем покрываются оболочкой для увеличения квантового выхода антистоксовой фотолюминесценции и придания им гидрофильных свойств, обеспечивающих биосовместимость композиции. Средний размер частиц достигается в пределах 10-100 нм с размерной дисперсностью до 6%.
Для придания оптически-контрастных свойств наночастицам состава NaYF4 используется их солегирование редкоземельными металлами, что обусловливает возможность реализации антистоксовой фотолюминесценции. Для солегирования матрицы NaYF4 используется иттербий Yb и тулий Tm. Выбор элементов для солегирования обусловлен тем, что ионы Yb3+ поглощают излучение в ИК-диапазоне (~980 нм) и играют роль сенсибилизаторов, безызлучательно передавая энергию возбуждения соседним ионам Yb3+ или ионам Tm3+ (акцепторам). Ключевой процесс (ап-конверсия) происходит при взаимодействии возбужденного иона Tm3+ с возбужденным ионом Yb3+ (фиг. 1). Конечным следствием этого процесса становится высвечивание кванта света в видимой или ближней ИК-области, по энергии превосходящего единичный квант поглощенного излучения. Выбор иона-акцептора обуславливает спектр высвечиваемого излучения. Выбор в качестве акцептора Tm3+ обеспечит в дальнейшем получение нанофосфоров с излучением с основными максимумами при 801 нм и 474 нм (фиг. 2). Излучение в ближней ИК-области в окне прозрачности биотканей (801 нм) в дальнейшем обеспечит большую глубину проникновения излучения при проведении оптических диагностических процедур. В то же время излучение в видимом диапазоне (474 нм) обеспечит анализ образцов тканей и проведение клеточных исследований с применением довольно простого по конструкции микроскопического оборудования.
Нанокристалл NaYF4 дополнительно покрывается оболочкой для предотвращения процессов тушения люминесценции при взаимодействии ядра с молекулами в окружающей среде. Характерное изображение нанокристаллов бета-активных наночастиц состава NaYF4, покрытых оболочкой, полученное при помощи трансмиссионной электронной микроскопии, представлено на фиг. 3.
Цитотоксический компонент композиции для визуализации и повреждения клеток-мишеней представлен бета-активным изотопом иттрия-90. Введение в структуру нанокристаллического матрикса состава NaYF4 бета-активного изотопа иттрия 90Y осуществляется на начальной стадии синтеза нанокристаллического матрикса. В присутствии раствора хлорида стабильного изотопа 89Y выделяется хлорида изотопа 90Y из раствора хлорида стронция-90, находящегося в радиоактивном равновесии с иттрием-90, что обеспечивает в дальнейшем получение оксида иттрия, меченного иттрием-90 (89Y2O3/90Y2O3), непосредственно используемого для синтеза нанокристаллического матрикса состава NaYF4.
Радиоактивность композиции для визуализации и повреждения клеток-мишеней обусловлена включением в состав препарата радиоактивного иттрия 90Y, период полураспада которого составляет 64,1 часа. Энергия частиц, имеющих широкий энергетический спектр, достигает максимальных значений 2,28 МэВ при среднем значении около 1 МэВ. Полная активность синтезированной композиции для визуализации и повреждения опухолевых клеток-мишеней определяется активностью препарата хлорида стронция-90, используемого в качестве источника бета-активного изотопа 90Y. Удельная активность синтезированной композиции для визуализации и повреждения клеток-мишеней определяется соотношением содержания стабильного и радиоактивного изотопов иттрия в смеси (89Y2O3/90Y2O3), используемой для синтеза нанокристаллического матрикса состава NaYF4.
Характер распада бета-активного изотопа 90Y
обусловливает постоянство химических свойств композиции для визуализации и повреждения клеток-мишеней, что в совокупности с жесткими связями в кристалле сохраняет структуру композиции. Это позволяет добиться снижения риска отравления здоровых тканей как в непосредственной близости от опухолевого очага, так и в процессе выведения препарата из организма, за счет удержания продуктов распада в нанокристаллическом матриксе.
Средний размер частиц композиции для визуализации и повреждения опухолевых клеток-мишеней, достигаемый в пределах 10-100 нм с размерной дисперсностью до 6%, позволяет осуществлять избирательное накопление их в опухоли за счет EPR-эффекта - наночастицы размером 10-100 нм обладают способностью проникать в опухоль за счет увеличенной проницаемости стенок сосудов опухоли и задерживаться в ней из-за отсутствия нормального лимфатического дренирования. Использование дополнительных направляющих модулей, содержащих молекулы, пептиды, антитела или их фрагменты, специфичные к рецепторам, экспрессируемым на поверхности опухолевых клеток, позволяет существенным образом увеличить направленность доставки композиции к патологическому очагу и снизить общую дозовую нагрузку на организм в целом.
В первом частном случае реализации композиция для визуализации и повреждения клеток-мишеней содержит бета-активные изотопы иттрия-90 в отношении к общему числу изотопов иттрия, составляющем от 1 до 100%, что позволяет изменять в широких пределах общую активность композиции при сохранении ее массовой концентрации во вводимом в организм препарате.
Во втором частном случае реализации композиция для визуализации и повреждения клеток-мишеней реализуется в гидрофильной форме за счет использования дополнительного гидрофильного покрытия, обеспечивающего биосовместимость наночастиц композиции.
В третьем частном случае реализации композиция для визуализации и повреждения клеток-мишеней дополняется направляющим модулем, специфичным к раковоассоциированному антигену, что позволяет существенным образом увеличить направленность доставки композиции к патологическому очагу и снизить общую дозовую нагрузку на организм в целом.
В четвертом частном случае реализации композиция для визуализации и повреждения опухолевых клеток-мишеней имеет направляющий модуль, специфичный к раковоассоциированному антигену HER2 (рецептор человеческого эпидермального фактора роста 2 типа) или его варианту, что позволяет использовать ее для терапии ряда злокачественных новообразований, в том числе рака молочной железы.
В пятом частном случае реализации композиция для визуализации и повреждения клеток-мишеней имеет в качестве направляющего модуля, специфичного к раковоассоциированному антигену HER2/new, гуманизированное мини-антитело scFv 4D5 или высокоаффинный пептид неиммуноглобулиновой природы DARPin-29.
В шестом частном случае реализации оптически-контрастные свойства композиции для визуализации и повреждения клеток-мишеней реализуются за счет легирования нанокристаллического матрикса NaYF4 ионами иттербия (Yb) и эрбия (Er), NaYF4:Yb:Er или иттербия (Yb) и тулия (Tm), NaYF4:Yb:Tm, что позволяет осуществлять оптический мониторинг распределения и динамики препарата в приповерхностных тканях доступных для наблюдения органов при использовании ап-конверсионных свойств композиции, что, в свою очередь, позволяет существенным образом увеличить толщину тканей, доступных для оптического мониторинга.
Таким образом, предлагаемое изобретение позволяет реализовать возможность осуществления локального направленного терапевтического воздействия за счет повреждающего действия бета-излучения одновременно с возможностью оптической визуализации патологического очага при общем снижении риска отравления близлежащих тканей за счет выполнения цитотоксического компонента в виде бета-активного изотопа иттрия-90, являющегося структурным элементом антистоксовых наночастиц состава NaYF4, солегированных редкоземельными элементами, благодаря чему происходит удержание продуктов распада в нанокристаллическом матриксе, обеспечиваемое характером распада 90Y и жесткими связями в кристалле.
При осуществлении конкретной реализации изобретения был получен экспериментальный образец композиции для визуализации и повреждения клеток-мишеней в растворе объемом 1 мл с концентрацией 1 мг/мл.
При синтезе нанокристаллического матрикса был получен гидроксид иттрия, меченный иттрием-90 (89Y(ОН)3/90Y(ОН)3) из оксида иттрия-89 и хлорида стронция-90, находящегося в радиоактивном равновесии с иттрием-90. Очистка гидроксида иттрия, меченного иттрием-90, от захваченных примесей стронция-90 осуществлялась в четыре этапа с использованием соляной кислоты и раствора аммиака.
Гидроксид иттрия, меченный иттрием-90 (89Y(ОН)3/90Y(ОН)3), переводился в оксид иттрия, меченный иттрием-90 (89Y2O3/90Y2O3), посредством окапывания пероксидом водорода и последующим озолением.
Нанокристаллический матрикс состава NaYF4:Yb:Tm получался растворением оксидов иттрия, эрбия и тулия в молярной пропорции 1.325:0.34:0.034 в трифторуксусной кислоте, последующим упариванием, добавлением в присутствии олеиновой кислоты и 1-октадецена трифторацетата натрия, удалением остатков воды и кислорода вакуумированием и продувкой аргоном, разложением трифторацетатов при температуре выше 280°С, охлаждением и последующим центрифугированием в присутствии спиртов.
Полученные нанокристаллы (фиг. 4) покрывались оболочкой для предотвращения деформации и повышения коэффициента конверсии за счет предотвращения гашения люминесценции при взаимодействии наночастицы с молекулами окружающей среды.
Изображение бета-активных наночастиц состава NaYF4, покрытых оболочкой, полученное при помощи трансмиссионной электронной микроскопии, представлено на фиг. 3.
Анализ диаметров полученных наночастиц проводился в программе ImageJ (National Institutes of Health, США) для композиции, имеющей структуру «ядро/оболочка» (фиг. 3). Размер полученных частиц варьировался в пределах от 33,0 нм до 37,4 нм. Среднее значение максимального линейного размера составило 35,1 нм, размерная дисперсия полученных частиц составила при этом 4,7%, что позволяет классифицировать образец как монодисперсный (<6%). На основании анализа формы частиц, представленных на фиг. 4, а также на основании проведенного рентгеноструктурного анализа было установлено, что частицы композиции, имеющие структуру «ядро/оболочка», находятся в гексагональной фазе. Измеренная радиационная активность композиции для визуализации и повреждения клеток-мишеней составила 1 МБк/мг.
Оптические свойства полученных антистоксовых нанофосфоров были изучены с использованием спектрофлуорофотометра при возбуждении на длине волны 978 нм. Полученные спектры фотолюминесценции представлены на фиг. 3. Исследования влияния формирования структуры «ядро/оболочка» на спектральные характеристики композиции показало, что интенсивность фотолюминесценции композиции с оболочкой выше в 3-10 раз по сравнению с композицией, не имеющей покрытия. Измеренный коэффициент конверсии композицией инфракрасного возбуждающего излучения в видимой или ближне-инфракрасной области превышает 1.8%.
Для обеспечения биосовместимости полученная композиция была покрыта слоем диоксида кремния. Для интенсификации направленности доставки композиция была дополнена направляющим модулем, представляющим собой высокоаффинный пептид неиммуноглобулиновой природы DARPin-29, специфичный к раковоассоциированному антигену HER-2/new. На фиг. 5 приведено изображение клеток SKBR3 (клетки карциномы молочной железы человека), полученное методом конфокальной сканирующей микроскопии, верифицирующее проникновение композиции в клетку.
Цитотоксическое действие полученной композиции было подтверждено в экспериментах по оценке жизнеспособности опухолевых клеток SKBR3 (клетки карциномы молочной железы человека) после 96 часов инкубации с Na90YF4:Yb:Tm. На фиг. 6 представлены результаты эксперимента по оценке цитотоксического действия Na90YF4:Yb:Tm в отношении опухолевых клеток SKBR3 (клетки карциномы молочной железы человека) в культуре. Анализ жизнеспособности опухолевых клеток SKBR3 после инкубации с Na90YF4:Yb:Tm показал, что жизнеспособность клеток снижается на 95% по сравнению с контролем, что свидетельствует о цитотоксическом действии полученной композиции.
Приведенный пример иллюстрирует предлагаемое изобретение, но не ограничивает его. Так, в зависимости от вида опухолевых клеток предлагаемая композиция может быть использована с направляющими модулями, специфичными к соответствующим раковоассоциированным антигенам.
Предлагаемая композиция может быть использована в препарате, предназначенном как для диагностики и локализации, так и для терапии злокачественных новообразований. Использование препарата для диагностики возможно за счет способности солегированных редкоземельными металлами наночастиц к ап-конверсии инфракрасного излучения, что позволяет осуществлять оптический мониторинг распределения и динамики препарата в приповерхностных тканях, доступных для наблюдения органов. Терапевтический эффект препарата достигается за счет атомов бета-излучающих изотопов, например иттрия-90, включенных в состав матрикса NaYF4 в терапевтически значимом количестве. Направленность доставки препарата к опухолевому очагу достигается за счет преимущественного накопления в опухоли наноразмерных частиц (EPR-эффект, выраженный для частиц размером 10-100 нм) либо адресования с помощью направляющих модулей, содержащих молекулы, пептиды, антитела или их фрагменты, специфичные к рецепторам, экспрессируемым на поверхности опухолевых клеток, например гуманизированное мини-антитело scFv 4D5 или высокоаффинный пептид неиммуноглобулиновой природы DARPin-29, специфичные к раковоассоциированному антигену HER-2/new. Жесткие связи в кристалле и характер распада 90Y обусловливают возможность минимизации риска отравления здоровых тканей за счет удержания продуктов распада в нанокристаллическом матриксе.
Композиция для визуализации и повреждения опухолевых клеток-мишеней, содержащая неорганические наночастицы размером 10-100 нм и размерной дисперсностью до 6% состава NaYF4, солегированные ионами иттербия (Yb) и эрбия (Er) или иттербия (Yb) и тулия (Tm), и включающая цитотоксический компонент, представленный бета-изотопом, которым является изотоп иттрия-90 (90Y), причем доля изотопа иттрия-90 к общему числу изотопов иттрия составляет от 10-5 до 100%, при этом наночастицы переведены в гидрофильную форму путем использования покрытия, представленного по крайней мере одним из соединений, выбранных из полималеинового ангидрида октадецена, полиэтиленимина, поли(D,L-лактида), поли(лактид-гликолида), диоксида кремния, тетраметиламмония гидроксида, при этом наночастицы связаны с гуманизированным мини-антителом scFv 4D5 или высокоаффинным пептидом неиммуноглобулиновой природы DARPin-29, которые специфичны к раковоассоциированному антигену HER-2/new.