Способ выбора параметров лазерного лечения заболеваний сетчатки
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмологии, и может быть использовано для выбора параметров лазерного лечения заболеваний сетчатки. Наносят лазерные тестовые аппликаты Nd:YAG лазером на сетчатку в тестируемой зоне, идентичной по толщине и распределению пигмента зоне запланированного проведения лазерной коагуляции. Наносят серию офтальмоскопически визуализируемых лазерных аппликатов, используя длину волны 561 нм, длительность импульса 100 мс, скважность 100 мс, мощность от 70 до 100 мВт. Затем наносят три серии офтальмоскопически невизуализируемых лазерных аппликатов, уменьшая длительность импульса сначала на 50%, потом на 90%, затем одновременно с уменьшенной на 90% длительностью импульса снижают мощность на 20%. После воздействия сразу проводят оптическую когерентную томографию тестируемой зоны. По полученным сканам определяют тестовые лазерные аппликаты с минимальными параметрами, дающие терапевтический эффект. Способ позволяет повысить точность и объективность выбора параметров лазерной коагуляции сетчатки в отсутствие побочных и аллергических реакций при проведении тестового исследования и, таким образом, повысить эффективность лазерного лечения заболеваний сетчатки. 8 ил., 1 пр.
Реферат
Изобретение относится к медицине, а именно к офтальмологии, и предназначено для выбора параметров лазерного лечения заболеваний сетчатки.
В зависимости от типа ткани и длины волны лазерное излучение может быть однородно абсорбировано хромофорами и водой или дискретно гранулами пигмента. При поглощении энергия лазерного излучения трансформируется абсорбирующими структурами во внутреннюю энергию (тепловую). В зависимости от времени экспозиции эти эффекты могут возникать не только в адсорбирующих структурах. Во время и после воздействия тепло распространяется вокруг адсорбирующего объема, в результате чего существенно повышается температура окружающих тканей и развиваются нежелательные побочные эффекты. Переход от локального к широко распространенному термальному повреждению осуществляется, когда время экспозиции превышает время релаксации, необходимое для теплового повреждения структур. Во время длительного воздействия происходит передача нагревания и относительно однородное нагревание прилегающих тканей, приводящее к развитию неспецифического некроза. Если же длительность импульса меньше времени релаксации температуры, может быть достигнуто пространственное ограничение, потому что повышение температуры вне повреждаемой структуры происходит в настолько малом объеме, что не может привести к развитию каких-либо значительных коллатеральных повреждений. Однако для коротких импульсов высокая температура в повреждаемой структуре необходима для достижения повреждения. Когда достигается высокий градиент температуры, термомеханические механизмы, такие как взрывной эффект, начинают конкурировать с чисто температурными эффектами (Roider J. Laser treatment of retinal diseases by subthreshold laser effects // Semin. Ophthalmol. - 1999. - 14, N1. - P. 19-26).
Рядом авторов доказано, что лазерная коагуляция, захватывающая только наружные слои сетчатки, без захвата внутреннего ядерного слоя приводит к пролиферации ПЭС и глиальных клеток, а также закрытию мест протекания (Wallow I.H.L., Bindlei C.D. Focal photocoagulation of diabetic macula edema: a clinicopatologic case report // Retina. - 1988. - 8. - P. 261-269).
Roider J. (Roider J. et al. Subthreshold (retinal pigment epithelium) photocoagulation in macular diseases: a pilot study // Brit. J. Ophthalmol. - 2000. - 84, N1. - P. 40-47) предложил концепцию, основанную на свойствах повторяющихся коротких импульсов. Специфическая комбинация длительности импульсов, их количества, энергии и времени повторения приводит к достижению достаточного уровня температуры в повреждаемой структуре и получению ожидаемого повреждающего эффекта. В основу концепции легли два обоснованных предположения.
Каждый единичный импульс будет приводить к большому повышению температуры на короткое время, что вызовет термальное повреждение абсорбирующей структуры. За межимпульсное время температура быстро падает до уровня температуры тела. Диффузия тепла сглаживает значительные временные термальные модуляции, и повышение температуры вне адсорбирующего объема ограничивается модуляцией глубины. Если же параметры воздействия подобрать должным образом, короткое значительное отклонение температуры в повреждаемой структуре вызовет ее полное повреждение после воздействия и будет достигнуто определенным количеством субповреждающих импульсов. В отличие от этого небольшое повышение температуры окружающих тканей не приведет к развитию повреждения. Даже если нельзя исключить термомеханические эффекты, повышение температуры в результате каждого единичного импульса приводит к развитию механических эффектов, интенсивность которых ниже повреждающего уровня.
Из уровня техники известен способ выбора параметров лазерного лечения заболеваний сетчатки, заключающийся в том, что при проведении лазерной коагуляции сетчатки (ЛКС) энергия каждого импульса в серии соответствует энергии непрерывного импульса, приводящего к легкому побледнению пигментного эпителия сетчатки (ПЭС) (Lanzeta P., Dorin G., Pirracchio A., Bandello F. // Theoretical bases of non-ophthalmoscopically visible endpoint photocoagulation // Semin. Ophthalmol. - 2001. - 16, N1. - P. 8-11). Этот метод имеет ряд недостатков: субъективность оценки, различное распределение пигмента и толщины сетчатки в зоне подбора энергии и зоне операции.
Также из уровня техники известен способ выбора параметров лазерного лечения заболеваний сетчатки, заключающийся в том, что до проведения операции (лазерной коагуляции сетчатки) наносят серию тестовых аппликатов в области нижней темпоральной аркады с различной мощностью импульса. Тестовые ожоги не видны во время или сразу после процедуры, а также, как правило, через 2 часа. Через 2 часа после тестового вмешательства выполняют флуоресцентную ангиографию (ФАГ). После чего, базируясь на данных «тестовой» ФАГ, выбирают мощность импульса, необходимую для лечения. Лазерную коагуляцию сетчатки проводят с помощью выбранной минимальной мощности энергии, вызывающей повреждение ПЭС, идентифицируемое с помощью ФАГ. Повреждение ПЭС определялось как яркая гиперфлюоресценция через 2 ч после тестового вмешательства. Данный способ более объективный, но более длительный.
К сожалению, предложенные методики подбора параметров ЛК позволяют провести оценку результатов только через несколько часов после нанесения серии пробных коагулятов, что существенно увеличивает время лечения. Кроме того, проведение ФАГ ограничено отягощенным аллергоанамнезом у пациентов.
Далее, из уровня техники известен способ выбора параметров лазерного лечения заболеваний сетчатки, заключающийся в том, что до проведения операции ЛКС наносят серию тестовых аппликатов, идентифицируемых с помощью метода микрофлюоресцентной ангиоскопии, основанного на использовании полосового фильтра, пропускающего излучение в области люминесценции флюоресцеина, после чего, базируясь на данных микрофлюоресцентной ангиоскопии, выбирают мощность импульса, необходимую для лечения (Пасечникова Н.В. Лазерное лечение при патологии глазного дна. Киев, 2007 г., 206 с.). Но при использовании данного фильтра видны только патологические зоны, где сквозь ПЭС просвечивает хориоидея, при проведении исследования необходимо учитывать, что яркость свечения глазного дна не постоянна в течение фаз циркуляции красителя. Также значение для артефактов имеет накопление флюоресцеина влагой передней камеры глаза. Визуально остальная часть глазного дна выглядит черной, что ограничивает возможность видеть анатомические ориентиры, проводя ЛКС, возникает большая вероятность нежелательных явлений (отек, кровоизлияния, отслойка сетчатки, дистофические изменения).
Из уровня техники известен способ выбора параметров лазерного лечения заболеваний сетчатки, заключающийся в нанесении лазерных тестовых аппликатов Nd:YAG лазером на сетчатку в тестируемой зоне, идентичной по толщине и распределению пигмента зоне запланированного проведения лазерной коагуляции, идентификации тестовых аппликатов и выборе минимальных параметров лазерной коагуляции, дающих терапевтический эффект, при этом тестовые аппликаты идентифицируют с помощью явления аутофлюоресценции для оценки селективного повреждения ПЭС при ЛК (Framme С et al. Autofluorescence imaging after selective RPE laser treatment in macular diseases and clinical outcome: a pilot study, Br J Ophthalmol, 2002; 86, p. 1099-1106). Аутофлюоресценция сетчатки более отчетливо демонстрирует изменения ретинального пигментного эпителия (РПЭ). Принцип аутофлюоресценции основывается на способности липофусциновых гранул, которые аккумулируются в клетках ПЭС, к флуоресценции. Липофусцин, еще называемый «пигментом старости», являющийся фрагментами метаболизма наружных сегментов фоторецепторов, по химической природе представляет собой липидно-протеиновый комплекс, аутофлуоресценция которого возникает при облучении светом с короткой длиной волны. Поскольку энергия при лазерном воздействии поглощается меланосомами ПЭС, лазерное воздействие существенно меняет картину аутофлюоресценции. Однако использование аутофлюоресценции имеет существенные ограничения: выраженное уменьшение явления аутофлюоресценции проявляется в области макулы (из-за макулярного пигмента), что делает невозможным определение центральных коагулятов; определенные трудности возникают, когда не удается зарегестрировать явление аутофлюоресценции из-за истончения сетчатки и обширного отека.
Таким образом, существует потребность в способе выбора параметров лазерного лечения заболеваний сетчатки, исключающем введение флюорофоров, при этом достаточно точном, объективном, позволяющем выбрать оптимальные параметры для лечения заболеваний сетчатки.
В соответствии с этим, техническим результатом является повышение точности и объективности выбора параметров ЛКС в отсутствие побочных и аллергических реакций при проведении тестового исследования.
Для решения этой задачи в способе выбора параметров лазерного лечения заболеваний сетчатки, включающем нанесение лазерных тестовых аппликатов Nd:YAG лазером на сетчатку в тестируемой зоне, идентичной по толщине и распределению пигмента зоне запланированного проведения лазерной коагуляции, идентификации тестовых аппликатов и выборе минимальных параметров, дающих терапевтический эффект, сначала наносят серию офтальмоскопически визуализируемых лазерных аппликатов, используя длину волны 561 нм, длительность импульса 100 мс, скважность 100 мс, мощность от 70 до 100 мВт, затем наносят три серии офтальмоскопически невизуализируемых лазерных аппликатов, уменьшая при этом длительность импульса сначала на 50%, потом на 90%, затем одновременно с уменьшенной на 90% длительностью импульса снижают мощность на 20%, после чего сразу проводят идентификацию тестовых аппликатов с помощью оптической когерентной томографии тестируемой зоны, и по полученным сканам определяют тестовые лазерные аппликаты с минимальными параметрами, дающие терапевтический эффект.
Способ осуществляют следующим образом.
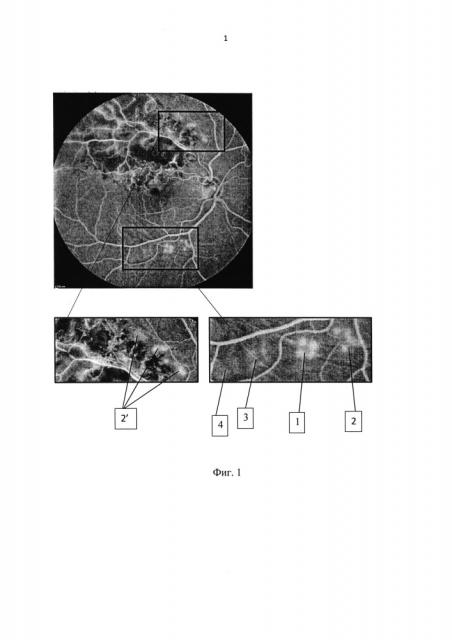
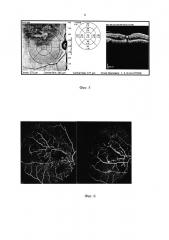
На фиг. 1-3 представлены этапы предлагаемого способа. На сетчатке в зоне, идентичной зоне повреждения (по толщине, кровоснабжению и распределению пигмента) наносят серию лазерных аппликатов, воздействуя сфокусированным лучом Nd:YAG лазера с помощью лазерной установки (нами использовалась VISULAS TRION Карл Цейсе Йена (Германия)). Сначала наносят серию офтальмоскопически визуализируемых лазерных аппликатов (длина волны 561 нм, длительность импульса 100 мс, скважность 100 мс, мощность от 70 до 100 мВт) (Фиг. 1 - снимок ФАГ, для наглядности), начиная с визуализируемого нанесенного аппликата (нежно-белое) 1 степени по L’Esperance (1). Затем уменьшают время аппликации на 50%, нанося уже офтальмоскопически невизуализируемое воздействие на ткань (2), затем данное время уменьшают на 90% (3), после чего дополнительно к уменьшенному на 90% времени воздействия снижают мощность на 20% (4).
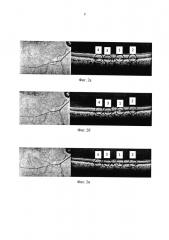
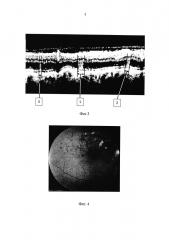
По сканам ОКТ, полученным сразу после серии данных вмешательств (Фиг. 2а), определяли тестовые коагуляционные аппликации, которые не визуализировались во время и после процедуры ЛКС (2), (3), (4). Учитывая, что ОКТ является высокоинформативным диагностическим методом, позволяющим формировать изображение поперечных сечений в реальном времени с разрешением от 1 до 10 мкм, возможно получать высокоточные поперечные срезы изучаемых тканей за счет визуализации отраженных от препятствия лучей и измерения интенсивности рассеянного или отраженного света от внутритканевых микроструктур и обрабатывать изображение хориокапилляров и ретинального пигментного эпителия с возможностью проведения анализа рефлективности (выявление зон гипо- и гиперрефлективности). Из полученных параметров излучения выбирались минимальные, дающие терапевтический эффект, которые и использовались в ходе дальнейших операций - (2') (Фиг. 1). Соотношение терапевтического и повреждающего эффектов оценивают по ширине (1), (2), (3) отображаемого лазерного аппликата (Фиг. 3) на сканах ОКТ: офтальмологически невизуализируемые аппликаты с минимальными параметрами, дающими терапевтический эффект, по толщине не менее одной трети и не более половины толщины офтальмоскопически визуализируемых лазерных аппликатов (1). На Фиг. 3 аппликатом с оптимальными параметрами является аппликат (3).
Дополнительные сканы ОКТ, проведенные через 2 часа после нанесения тестовых вмешательств (Фиг. 2б) и через трое суток (2в) ясно отражают динамику лазерного повреждающего и терапевтического воздействия.
Предлагаемый нами способ выбора параметров лазерного лечения заболеваний сетчатки позволяет провести лазерную коагуляцию области отека, минимизировав повреждения, наносимые лазерным излучением, и тем самым уменьшить вероятные отсроченные осложнения и деструктивность лазерного вмешательства. Выбор мощности внутри указанного диапазона зависит от интенсивности пигментации сетчатки и толщины отека сетчатки.
Пример. Пациентка К., возраст 74 года. Поступила в офтальмологическое отделение ГБУЗ МО МОНИКИ в мае 2015 г.
Жалобы: на появления "тумана", ухудшение зрения, плавающие помутнения правого глаза с декабря 2014 г.
Анамнез: Острота зрения правого глаза снизилась внезапно утром после пробуждения. Лечилась амбулаторно по месту жительства с незначительным положительным эффектом.
Сопутствующие заболевания: Гипертоническая болезнь III, артериальная гипертензия 2 ст.; Ишемическая болезнь сердца, постинфарктный кардиосклероз (2010 г.).
Данные первичного осмотра:
| Острота зрения: | Vis OD = 0,4 н/к | ВГД 21 мм рт.ст.(по Маклакову). |
| Vis OS = 0,7 н/к | ВГД 21 мм рт.ст.(по Маклакову). |
Диагноз: Тромбоз верхне-височной ветви центральной вены сетчатки правого глаза (в месте артериовенозного перекреста) диффузный макулярный отек, начальная возрастная катаракта обоих глаз.
Офтальмоскопически: на глазном дне правого глаза ДЗН бледно-розовый, границы четкие, экскавация 0,4, в пораженном секторе отек сетчатки, расширение и извитость верхне-височной ветви ЦВС, множественные интраретинальные геморрагии с захватом парафовеальной зоны (Фиг. 4). На ОКТ сетчатки левого глаза: дифференцируется диффузный отек с единичными мелкими кистозными полостями, площадью более 8D диска, толщина сетчатки в центральной зоне - 319 мкм, максимальная высота отека в зоне повреждения сосуда 425 мкм (Фиг. 5).
По данным ФАГ выявлено увеличение времени венозной перфузии, выраженные участки гиперфлюоресценции вследствие пропотевания, имеются также участки гипофлюоресценции, соответствующие более 12D диска ЗН, соответствующие нарушению перфузии хориокапилярного слоя (Фиг. 6).
В соответствии с предлагаемым способом пациентке нанесли лазерные тестовые аппликаты Nd:YAG лазером на сетчатку в тестируемой зоне, идентичной по толщине и распределению пигмента зоне запланированного проведения лазерной коагуляции - в зоне нижневисочной ветви ЦВС. Сначала нанесли серию офтальмоскопически визуализируемых лазерных аппликатов (1 степени по L’Esperance), используя длину волны 561 нм, длительность импульса 100 мс, скважность 100 мс, мощность 80 мВт. Затем нанесли три серии офтальмоскопически невизуализируемых лазерных аппликатов, уменьшая при этом длительность импульса сначала на 50%, потом на 90%, затем одновременно с уменьшенной на 90% длительностью импульса снижая мощность на 20%. Сразу после этого провели идентификацию (Фиг. 7) тестовых аппликатов (1), (2), (3), (4) с помощью оптической когерентной томографии тестируемой зоны, и по полученным сканам определили тестовые лазерные аппликаты с минимальными параметрами (3), дающие терапевтический эффект (А - фрагмент контрольного снимка ФАГ, Б - фрагмент скана ОКТ). Пациентке была проведена лазерная коагуляция по предлагаемой методике с подбором индивидуальных доз лазерного воздействия: на зону отека нанесли 1500 коагуляционных аппликаций диаметром 50-300 мкм, с расстоянием между ними 100-300 мкм, лазером с длиной волны 561 nm, длительностью импульса 10 мс, мощностью 80 мВт. Послеоперационный период без осложнений. Жалоб нет.
По данным ОКТ (Фиг. 8): при сравнении с предыдущим исследованием выявлено значительное уменьшение отека по площади и объему, толщина сетчатки в центральной зоне - 272 мкм (меньше на 47 мкм), максимальная высота отека в зоне повреждения сосуда 363 мкм, макулярный обьем составил 8,75 мкм3. При выписке Vis OS = 0,8 н/к. ВГД 20 мм рт.ст. При наблюдении за пациенткой в последующие месяцы показатели остроты зрения, поле зрения, данные ОКТ и ФАГ оставались стабильными.
Таким образом, предлагаемый способ позволяет повысить точность и объективность выбора параметров ЖС в отсутствие побочных и аллергических реакций при проведении тестового исследования и, таким образом, повысить эффективность лазерного лечения заболеваний сетчатки.
Способ выбора параметров лазерного лечения заболеваний сетчатки, заключающийся в нанесении лазерных тестовых аппликатов Nd:YAG лазером на сетчатку в тестируемой зоне, идентичной по толщине и распределению пигмента зоне запланированного проведения лазерной коагуляции, и выборе минимальных параметров, дающих терапевтический эффект, отличающийся тем, что сначала наносят серию офтальмоскопически визуализируемых лазерных аппликатов, используя длину волны 561 нм, длительность импульса 100 мс, скважность 100 мс, мощность от 70 до 100 мВт, затем наносят три серии офтальмоскопически невизуализируемых лазерных аппликатов, уменьшая при этом длительность импульса сначала на 50%, потом на 90%, затем одновременно с уменьшенной на 90% длительностью импульса снижают мощность на 20%, после чего сразу проводят оптическую когерентную томографию тестируемой зоны, и по полученным сканам определяют тестовые лазерные аппликаты с минимальными параметрами, дающие терапевтический эффект.