Способ моделирования гипогонадизма, вызванного метаболическими нарушениями
Иллюстрации
Показать всеИзобретение относится к экспериментальной биологии и медицине и касается моделирования гипогонадизма, развивающегося при метаболических нарушениях. Для этого мышам-самцам линии C57Bl/6 через сутки после рождения вводят стрептозотоцин однократно, подкожно в дозе 200 мг/кг. Затем, с 28-х суток после рождения, переводят животных на рацион, обогащенный насыщенными жирами. Поддерживают этот рацион до достижения гипергликемии, гиперинсулинемии, нарушений глюкозотолерантности, а также угнетения сперматогенеза и нарушения фертильности. Способ обеспечивает создание модели гипогонадизма, вызванного метаболическими нарушениями, предназначенной для поиска эффективных лекарственных средств коррекции нарушений в мужской половой системе при метаболическом синдроме. 2 ил., 6 табл., 5 пр.
Реферат
Изобретение относится к области экспериментальной биологии и медицины и касается моделирования гипогонадизма для изучения лекарственных средств для коррекции нарушений в мужской половой системе, развивающихся при диабетоподобных метаболических нарушениях.
Под термином мужской гипогонадизм понимается функциональная неполноценность мужских половых желез. При первичном гипогонадизме поражается непосредственно тестикулярная ткань, при вторичном гипогонадизме наблюдается гипофункция половых желез, возникающая вследствие поражения гипоталамо-гипофизарной системы (снижается гонадотропная функция гипофиза) [Роживанов Р.В., 2015]. Клинические проявления гипогонадизма слабо выражены, и поэтому мужской гипогонадизм считается плохо диагностируемым заболеванием [Дедов И.И., 2007].
Существует взаимосвязь метаболических нарушений и гипогонадизма [Paoletti R., 2006]. Нарушения углеводного и жирового обмена приводят к развитию гипогонадизма, распространенность которого достигает 75% [Роживанов Р.В., 2015]. В свою очередь гипогонадизм усугубляет метаболические нарушения [Гусакова Д.А., 2008]. Известны данные о связи дефицита тестостерона с развитием висцерального ожирения, инсулинорезистентности, сахарного диабета и метаболического синдрома [Тюзиков И.А., 2013].
Поскольку центральным звеном заболевания является снижение концентрации тестостерона, лечение базируется на всех возможных способах пополнения дефицита этого гормона [Роживанов Р.В., 2015]. Ввиду заместительного характера лечения оно проводится постоянно. Успешно устраняя некоторые симптомы андрогенодефицита, экзогенный тестостерон подавляет сперматогенез и лишь усугубляет такое значимое проявление гипогонадизма, как мужская инфертильность [Kliesch S., 2010].
Для разработки способов лечения мужского гипогонадизма, нацеленных на регенерацию семенников и восстановление собственного андрогенпродуцирующего аппарата, необходимо использовать адекватную экспериментальную модель гипогонадизма. Известен способ моделирования гипогонадизма путем фармакологической кастрации, осуществляемой введением фолликулина в дозе 50 ЕД/кг/сут в течение 30 суток [Хотимченко Ю.С., 1996]. Недостатком данного способа моделирования является несоответствие известной модели клиническим проявлениям гипогонадизма, вызванного метаболическими нарушениями.
Адекватного прототипа в проанализированной патентной и научно-медицинской литературе не обнаружено.
Задачей, решаемой данным изобретением, является создание модели гипогонадизма, в основе которого лежат метаболические нарушения и патоморфологические изменения в поджелудочной железе, приводящие к нарушению сперматогенеза и фертильности.
Поставленная задача решается тем, что моделируют гипогонадизм, вызванный метаболическими нарушениями, характеризующийся тем, что мышам-самцам линии С57В1/6 через сутки после рождения вводят стрептозотоцин однократно, подкожно в дозе 200 мг/кг и переводят животных на рацион, обогащенный тяжелыми насыщенными жирами, с 28-х по 70-е сутки после рождения, до достижения гипергликемии, гиперинсулинемии, нарушений глюкозотолерантности, а также угнетения сперматогенеза и нарушения фертильности.
Новым в предлагаемом способе является исследование содержания свободного тестостерона в сыворотке крови, общего количества половых клеток и процента подвижных форм половых клеток, приходящихся на эпидидимис, морфологии семенников и фертильности у мышей-самцов линии С57В1/6 в условиях однократного введения стрептозотоцина и длительной диеты с высоким содержанием жира, приводящих к формированию диабетоподобных метаболических нарушений в сыворотке крови (гипергликемия, глюкозотолерантность, гиперинсулинемия) и патоморфологических изменений в поджелудочной железе (деструктивные изменения островковой ткани). Предлагаемый способ моделирования гипогонадизма наиболее полно раскрывает клиническую картину нарушений половой сферы мужчин, страдающих диабетоподобными метаболическими нарушениями.
Стрептозотоцин - противоопухолевое средство алкилирующего действия из группы производных нитрозомочевины. Механизм противоопухолевого действия полностью не изучен, но, вероятно, обусловлен образованием метилкарбониевых ионов, которые вызывают алкилирование или связываются с различными внутриклеточными структурами, включая нуклеиновые кислоты. Образует поперечные сшивки между нитями ДНК, что и приводит к ингибированию ее синтеза [Справочник лекарственных средств Vidal, 2014]. Оказывает также гипергликемический эффект, вызывая необратимое повреждение бета-клеток поджелудочной железы [Jinzi Wu, 2015; Huang S.W., 1981].
Отличительные признаки проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и неочевидные для специалиста.
Идентичной совокупности признаков не обнаружено в проанализированной патентной и научно-медицинской литературе.
Способ может быть использован для поиска эффективных препаратов для лечения гипогонадизма, вызванного метаболическими нарушениями.
Исходя из вышеизложенного, заявляемое изобретение соответствует критериям патентоспособности изобретения «Новизна», «Изобретательский уровень» и «Промышленная применимость».
Предлагаемый способ изучен в экспериментах на 100 мышах-самцах линии C57BL/6. Животные первой категории, конвенциональные линейные мыши, получены из питомника отдела экспериментального биомедицинского моделирования НИИФиРМ им. Е.Д. Гольдберга (сертификат имеется).
Изобретение будет понятно из следующего описания и приложенных к нему чертежей.
На фиг. 1 изображена поджелудочная железа мышей-самцов линии С57В1/6 при окрашивании ткани гематоксилином и эозином: а - интактный контроль (ув. ×100); б - метаболические нарушения на 49 сутки эксперимента (ув. ×100); в - метаболические нарушения на 70 сутки эксперимента (ув. ×100); г - интактный контроль (ув. ×400); д - метаболические нарушения на 49 сутки эксперимента (ув. ×400); е - метаболические нарушения на 70 сутки эксперимента (ув. ×400).
На фиг. 2 изображен семенник мышей линии С57В1/6 при окрашивании ткани гематоксилином и эозином: а - интактный контроль (ув. ×100); б - метаболические нарушения на 70 сутки эксперимента (ув. ×100); в - интактный контроль (ув. ×400); г - метаболические нарушения на 70 сутки эксперимента (ув. ×400).
Способ осуществляют следующим образом.
У лабораторного животного (мыши-самцы линии С57В1/6) гипогонадизм, вызванный метаболическими нарушениями, моделируют введением стрептозотоцина через сутки после рождения в дозе 200 мг/кг, однократно, подкожно в область холки, объем вводимого раствора составляет 30 мкл. С 28 суток после рождения животных переводят на рацион с высоким содержанием жира. Для этого используется корм, обогащенный тяжелыми насыщенными жирами (30% жира) (Siff EF R/M with 30% Fat кат. № El5116-34, Germany). По содержанию тяжелых насыщенных жиров этот корм соответствует стандартным европейским кормам. Продолжительность назначения корма с высоким содержанием жира составляет 42 суток (с 28-х по 70-е сутки эксперимента).
На 28, 35, 42, 49, 56, 63 и 70 сутки проводят оценку уровня глюкозы в крови и фиксируют изменение массы животных. Уровень глюкозы в крови определяют при помощи глюкометра (Accu-Chek Performs Nanu ("Roche Diagnostes GmbH", Germany). Измерение исходного уровня глюкозы в крови у животных проводят после 16-часовой депривации корма, все последующие измерения уровня глюкозы также производят после 16-часовой депривации еды.
На 28, 49 и 70 сутки эксперимента проводят глюкозотолерантный тест. На первом этапе проводят забор образца крови для оценки исходного уровня глюкозы у экспериментальных животных. Через 1 ч после этого производят внутривенную инъекцию глюкозы (D-глюкоза, Sigma-Aldrich, США) в хвостовую вену в дозе 2 г/кг. Первый забор крови для исследования уровня глюкозы проводят через 30 мин после инъекции глюкозы, далее исследование содержания глюкозы производят с интервалом в 30 мин, продолжительность исследования составила 2,5 ч. Доза глюкозы 2 г/кг была выбрана в силу того обстоятельства, что, согласно данным литературы, ответ организма животных на низкие дозы глюкозы при ее внутривенном введении слабый, концентрация инсулина возрастает только в первую минуту и редко сохраняется повышенной в течение первых 5 мин наблюдения [Pacini G. et al., 2009].
На 70 сутки определяют массу животных. Уровни инсулина и свободного тестостерона в сыворотке оценивают иммуноферментным методом в соответствии с протоколами производителя (Cusabio Biotech CO., LTD, Китай).
Для морфологического исследования поджелудочной железы ее часть, прилежащую к селезенке, фиксировали в 10% формалине, заливают в парафин по стандартной методике. Депарафинизированные срезы толщиной 5 мкм окрашивают гематоксилином и эозином. На срезах определяют площадь 10 последовательных островков Лангерганса методом графического компьютерного анализа и подсчитывают в них общее количество клеток и количество пикнотизированных клеток. Затем вычисляют количество клеток на единицу площади островка и процент пикнотизированных клеток.
Продуктивность сперматогенеза мышей-самцов оценивают по общему количеству и количеству подвижных форм сперматозоидов. При подсчете общего количества сперматозоидов, приходящихся на придаток, используют гомогенизированную клеточную взвесь эпидидимиса в дозированном количестве физиологического раствора с применением лейкоцитарного меланжера и камеры Горяева.
Для морфологического исследования семенников кусочки ткани фиксируют в 10% формалине. Фиксированные ткани обезвоживают, пропитывают парафином и заливают в парафиновые блоки; с помощью микротома изготавливают тонкие серийные (не более 5 мкм) срезы и окрашивают гематоксилином и эозином. Гистологическое исследование срезов проводят с помощью световой микроскопии. На препаратах семенников оценивают состояние канальцевого аппарата, морфологические особенности клеток Лейдига и состояние стромы. Воспалительную реакцию ткани семенников оценивают по наличию воспалительного инфильтрата и состоянию сосудистого русла. Для каждого экспериментального животного делают минимум 10 микрофотографий без перекрытия по всей поверхности среза тестикулярной ткани при 400-кратном увеличении. Система состоит из микроскопа Axio Lab. Al («Carl Zeiss», Germany) с видеокамерой AxioCam ERc5s («Carl Zeiss», Germany), подключенной к персональному компьютеру. Полученные изображения обрабатывают с помощью программного обеспечения AxioVision Rel.4.8.2.
Для оценки фертильности к самцам с метаболическими нарушениями подсаживают интактных самок (в естественных условиях) на 10 суток. Соотношение самцы/самки составило 1/2 (на 10 самцов приходилось 20 самок). Через 10 суток самок и самцов рассаживают по разным клеткам. Самок умерщвляют в СО2-камере на 18 день беременности. Исследуют плоды в матке. Для оценки плодовитости вычисляют индекс плодовитости (ИП):
ИП = число оплодотворенных самок / число самок, ссаженных с самцами × 100%.
Обработку результатов проводят методами вариационной статистики с использованием программного обеспечения IBM. Вычисляют среднее арифметическое (X), ошибку среднего арифметического (m), значение вероятности (Р). Различие двух сравниваемых величин считается достоверным в том случае, если вероятность их тождества была меньше 5% (Р<0,05). В случаях нормального распределения признаков для статистической оценки применяют параметрический t-критерий Стьюдента. При больших отклонениях распределений признака от нормального вида для независимых выборок используют непараметрический критерий U-критерий Манна-Уитни. Для выявления достоверности различий качественных показателей используют критерий углового преобразования Фишера.
Пример 1
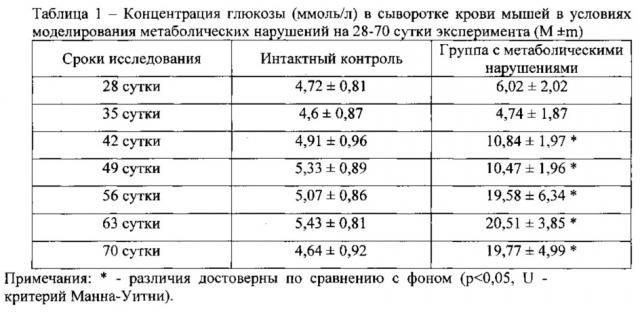
Проведенные эксперименты позволяют показать, что моделирование метаболических нарушений приводит к стойкому увеличению уровня глюкозы в крови у мышей самцов линии C57BL/6 начиная с 42 суток эксперимента. Высокий уровень глюкозы сохраняется до 70 суток (Таблица 1).
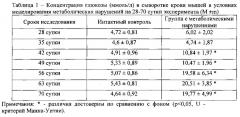
Критерием выраженности нарушения метаболизма глюкозы является глюкозотолерантный тест. У животных интактного контроля и у мышей с метаболическими нарушениями проводится глюкозотолерантный тест. В ответ на внутривенную инъекцию глюкозы (доза 2 г/кг) у интактных животных регистрируется достоверное повышение уровня глюкозы в крови на протяжении 60 мин (Таблица 2).
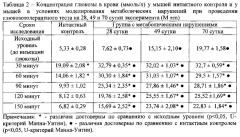
Далее - на 90, 120, 150 мин после введения глюкозы, следует поступательное снижение концентрации глюкозы. У мышей в условиях моделирования метаболических нарушений глюкозотолерантный тест проводился на 28, 49 и 70 сутки эксперимента. У животных с метаболическими нарушениями отмечается гипергликемия. Максимальное повышение уровня глюкозы регистрируется на 70 сутки эксперимента. Глюкозотолерантный тест показывает длительное сохранение высокой концентрации глюкозы у животных с метаболическими нарушениями на 28, 49 и 70 сутки эксперимента (Таблица 2). У животных на 28 сутки эксперимента снижение уровня гипергликемии наблюдается на 2 ч исследования глюкозы в крови. Между тем проведение глюкозотолерантного теста у мышей патологического контроля на 49 и 70 сутки эксперимента выявляет стойкое (без падения) сохранение высокого уровня гипергликемии с 30 минут и до 150 минут.
Пример 2
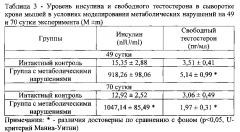
Моделирование метаболических нарушений вызывает повышение концентрации инсулина в сыворотке крови на 49 и 70 сутки эксперимента (Таблица 3). Изменения со стороны тестостерона не столь однозначны. Так, на 49 сутки отмечается повышение уровня свободного тестостерона в сыворотке крови до 146% от интактного контроля, позднее - на 70 сутки эксперимента, концентрация гормона снижается и составляет 64,3% от интактного контроля.
Пример 3
Морфологическое исследование поджелудочной железы позволяет выявить, что в отличие от мышей самцов линии С57В1/6 интактного контроля моделирование метаболических нарушений вызывает отек и гиперемию в ткани поджелудочной железы у мышей самцов линии С57В1/6 на 70 сутки эксперимента (фиг. 1). Кроме этого, у мышей в модельных условиях регистрируется мелко- и среднекапельная жировая дистрофия ацинарных клеток, утолщение и разрастание междольковых перегородок, инфильтрация островковой ткани клетками воспаления.
На 70 сутки эксперимента в поджелудочной железе у мышей в условиях моделирования метаболических нарушений отмечается уменьшение общего количества островков Лангерганса. При оценке островковой части поджелудочной железы выявляется снижение площади островка Лангерганса и количества островковых клеток в сравнении с животными интактного контроля (Таблица 4). Между тем, процент пикнотизированных клеток в островках возрастает.
Пример 4
Гистологическое исследование семенников показывает, что у животных в условиях моделирования метаболических нарушений развиваются умеренные деструктивные изменения канальцевого аппарата (фиг. 2). Отмечается некоторое снижение количества слоев сперматогенного эпителия в семенных канальцах. Наблюдается незначительный отек интерстициальной ткани, гиперемия сосудов, в единичных клетках Лейдига имеют место дегенеративные изменения - вакуолизация цитоплазмы, гиперхромия ядра. В ряде извитых канальцев наблюдается разрежение слоев сперматогенного эпителия либо исчезновение зрелых форм половых клеток. Встречаются единичные канальцы, в просвете которых отмечается клеточный детрит, состоящий из погибших сперматозоидов и сперматид. Кроме того, среди слущенного эпителия обнаруживаются в небольшом количестве «семенные шары» - крупные структуры с множественными, часто пикнотичными ядрами или их фрагментами с интенсивно окрашенной цитоплазмой.
На 49 и 70 сутки эксперимента масса тела животных в группе мышей в условиях метаболических нарушений достоверно снижается по сравнению со значениями интактного контроля. Моделирование гипогонадизма, вызванного метаболическими нарушениями, приводит на 70 сутки опыта к достоверному снижению количества подвижных форм сперматозоидов и общего количества сперматозоидов (Таблица 5).
Пример 5
При исследовании фертильности установлено, что индекс плодовитости у мышей-самцов линии C57BL/6 с метаболическими нарушениями на 70 сутки эксперимента и интактных мышей-самок линии C57BL/6 был снижен в 2,7 раза по сравнению с показателем у интактных мышей-самцов линии C57BL/6 и интактных мышей-самок линии C57BL/6 (Таблица 6).
Таким образом, однократное введение стрептозотоцина в дозе 200 мг/кг через сутки после рождения мышам-самцам линии C57BL/6 и перевод животных с 28 суток после рождения на рацион, обогащенный тяжелыми насыщенными жирами (30% жира), вызывает к 70 суткам эксперимента формирование метаболических нарушений (гипергликемия, нарушения глюкозотолерантного теста, гиперинсулинемия), патоморфологических изменений в поджелудочной железе (деструктивные изменения островковой ткани) и нарушение мужской репродуктивной системы: угнетение сперматогенеза (уменьшение общего количества и процента подвижных форм сперматозоидов, падение уровня свободного тестостерона в сыворотки крови, отек интерстициальной ткани, гиперемия сосудов, дегенеративные изменения в клетках Лейдига), нарушение фертильности.
Литература
1. Гусакова Д.А., Калинченко С.Ю., Курило Л.Ф. Первичный гипогонадизм как причина метаболического синдрома. Проблемы Репродукции, 2008; №3.
2. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. - М.: ГЭОТАР-Медиа; 2007. 432 с.: ил. - 500.
3. Роживанов Р.В., Яшина Ю.Н. Аспекты применения андрогенной заместительной терапии при лечении гипогонадизма у мужчин с сахарным диабетом и метаболическом синдромом. Ожирение и метаболизм. 2015; 12(1):11-14.
4. Справочник лекарственных средств Vidal, 2014. 1600 с.
5. Тюзиков И.А. Метаболический синдром и мужское бесплодие (обзор литературы). Андрология и генитальная хирургия, 2013. №2. С. 5-10.
6. Хотимченко Ю.С., Кропотов А.В., Лисаковская А.В. Влияние горца птичьего на дискриминационные показатели эякулята крыс, подвергнутых фармакологической кастрации // Вестник ДВО РАН. - 1996. - №5. - С. 61-65.
7. Jinzi Wu, Liang-Jun Yan. Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity // Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy, 2015. V. 8. P. 181-188.
8. Huang S.W., Taylor G.E. Immune insulitis and antibodies to nucleic acids induced with streptozotocin in mice // Clin. exp. Immunol. (1981) 43, 425-429.
9. Kliesch S. Testosterone and infertility. Urologe A 2010; 49(l):32-6.
10. Pacini G., ., Reappraisal of the intravenous glucose tolerance index for a simple assessment of insulin sensitivity in mice // American Journal of Physiology, 2009. Vol. 296. №5, R 1316-1324.
11. Paoletti R, Bolego C, Poli A, Cignarella A. Metabolic syndrome, inflammation and atherosclerosis. Vase Health Risk Manag. 2006; 2(2): 145-52.
Способ моделирования гипогонадизма, вызванного метаболическими нарушениями, отличающийся тем, что мышам-самцам линии C57Bl/6 через сутки после рождения вводят стрептозотоцин однократно, подкожно в дозе 200 мг/кг, а затем переводят животных на рацион, обогащенный насыщенными жирами, с 28-х суток до достижения гипергликемии, гиперинсулинемии, нарушений глюкозотолерантности, а также угнетения сперматогенеза и нарушения фертильности.