Способ количественного определения видового состава микробиоты пародонтальных карманов
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к стоматологии, и предназначено для получения точных количественных данных о видовом составе микроорганизмов пародонтальных карманов. В качестве исследуемого материала используют содержимое пародонтального кармана. Для осуществления предлагаемого способа проводят забор содержимого пародонтальных карманов стерильным бумажным эндодонтическим штифтом размером №25, который вводят в наиболее глубокие участки пародонтального кармана экспозицией не менее 10 сек и затем помещают в пробирку с транспортной средой. Проводят выделение тотальной ДНК из биоматерила, ПЦР в режиме реального времени, при этом используют видоспецифичные праймеры к фрагментам ДНК Porphyromonas gingivalis, Streptococcus oralis, Streptococcus sanguis, Streptococcus sobrinus, Treponema denticola. После этого концентрацию микроорганизмов в исследуемом образце рассчитывают по формуле В=1,7×(Nst×Ε×(Cst-Ct))/V, где: В - концентрация микроорганизмов, копий ДНК/мл; Nst - стандартная начальная концентрация ДНК; Ε - эффективность РТ-ПЦР - число, показывающее, во сколько раз за один цикл изменится количество фрагментов ДНК; Cst - значение порогового цикла стандартного образца; Ct - значение порогового цикла опытного образца; V - объем исследуемой пробы, мл; 1,7 - коэффициент перерасчета. Использование изобретения повышает точность способа за счет определения концентрации пародонтопатогенных бактерий в абсолютных значениях - количество копий ДНК/мл. 3 табл., 2 пр.
Реферат
Изобретение относится к области медицины, в частности к стоматологии, и предназначено для получения количественных данных о видовом составе микроорганизмов при исследовании содержимого пародонтального кармана.
Информация о количественных изменениях состава биологических жидкостей имеет большое значение для медицины и стоматологии.
Известен способ диагностики патологических изменений микрофлоры полости рта, характеризующийся тем, что исследуют ДНК, выделенную из ротовой жидкости или зубного налета больного, методом ПЦР с применением олигонуклеотидов, специфичных для пародонтопатогенов Actinobacter actinomycetemcomitans, Porphyromonas gingivalis, Bacteroides forsythi. При этом проводят одновременную идентификацию трех указанных видов микроорганизмов и при наличии положительной реакции на два и более из указанных видов диагностируют патологические изменения микрофлоры полости рта. Это позволяет прогнозировать высокий риск заболевания, проводить своевременные профилактические и лечебные мероприятия, контролировать эффективность лечения заболеваний пародонта [патент RU 2324182, 2008 г.].
Показано, что для диагностики и лечения заболеваний, сопровождающихся нарушениями микрофлоры полости рта, может определяться количественный и качественный состав короткоцепочечных жирных кислот. По их суммарному уровню, в норме 0,8-1,9 мг/г, судят об отклонениях от нормального состояния микрофлоры полости рта. Исходя из выявленных изменений подбирается фармакологический препарат и оценивается эффективность проводимого лечения [патент RU 2229130, 2004 г.].
Основными условиями такого рода диагностических исследований является возможность получения биологических образцов из конкретных областей и точное измерение объема взятого образца.
Прототипом изобретения является способ определения маркеров пародонтопатогенов Porphyromonas gingivalis, Actinibacillus actinomycetemcommitans, Treponema denticola, Bacteroides forsythus, Prevotella intermedia для диагностики степени тяжести пародонтита, включающий взятие материала из пародонтальных карманов бумажным штифтом, который вводят пинцетом в пародонтальный карман до дна на 10 секунд и затем помещают в пробирку с лизирующим раствором, после чего с помощью мультиплексной ПРЦ-системы «Дентал», разработанной ЗАО «Гентех» (Москва), спектр микроорганизмов оценивают количественно и качественно [патент RU 2386394, 2010 г.]. Недостатком данного способа является недостаточная точность определения количественного состава патогенной микрофлоры, так как предполагается использование классической ПЦР, позволяющей оценивать результаты реакции лишь по конечной точке и отвечать на вопрос о наличии или отсутствии пародонтопатогенных микроорганизмов.
Для получения количественных данных о видовом составе микробиоты биологических образцов (вагинальный секрет, соскобы из цервикального канала, слюна и др.) наиболее широко из амплификационных методов применяется ПЦР в режиме реального времени (РТ-ПЦР). Количественную оценку видового состава микробиоты при этом предлагается осуществлять в абсолютных и относительных показателях. Значения указанных показателей рассчитываются исходя из номера «порогового» цикла, на котором регистрируются первые положительные сигналы о начале амплификации специфических фрагментов ДНК [Шипицина Е.В., Мартикайнен З.М., Воробьева Н.Е., Ермошкина М.С., Степанова О.С., Донников А.Е., Скоркина Ю.А., Тумбинская Л.В. Применение теста ФЕМОФЛОР для оценки микробиоценоза влагалища. Журнал акушерства и женских болезней. 2009; LVIII(3): 44-50.]. Считается, что чем раньше начинается специфическая амплификация (раньше наступает «пороговый» цикл), тем выше исходная концентрация искомых микроорганизмов в образце. Количество ДНК искомого микроорганизма в образце принято выражать в геном-эквивалентах (ГЭ), которое прямо пропорционально количеству микроорганизмов. ГЭ соответствует количеству копий ДНК искомого микроорганизма в образце, представленного в виде десятичного логарифма - lg (ГЭ/образец). Однако значения абсолютного показателя исключительно широко варьируют в зависимости от техники взятия биоматериала, способа выделения ДНК и т.п. В частности, разная техника взятия образца часто приводит к забору исходно различных количеств биоматериала, что исключает возможность точного определения концентрации. Разные способы выделения ДНК при изначально неизвестном общем количестве взятого биоматериала также существенно искажают значения абсолютных показателей. Ошибка при этом может составлять несколько порядков, что сводит на нет возможность получения точных количественных данных о результатах амплификации.
В связи с вышеуказанным для количественной оценки данных РТ-ПЦР предлагалось использовать «относительный» количественный показатель микроорганизма, который рассчитывается как отношение количества (ГЭ/мл) искомого микроорганизма к количеству общей бактериальной массы (ОБМ), также оцениваемых в ГЭ/мл. Относительные показатели имели несколько большее клиническое значение, но также не являлись точными и объективными, так как при этом опять же неизвестным оставалось количество взятого исходно биоматериала. Результаты представлялись в двух вариантах: разница десятичных логарифмов количества соответствующей группы микроорганизмов и ОБМ и в процентах по отношению к ОБМ.
Таким образом, все вышеприведенное представляло собой попытку выразить абсолютные данные в относительных единицах (коэффициенты и прочее), что для количественных данных не является корректным.
Задачей изобретения является разработка способа количественного определения видового состава микробиоты пародонтальных карманов амплификационными методами.
Технический результат при использовании изобретения - повышение точности за счет определения концентрации пародонтопатогенных бактерий в абсолютных значениях - количество копий ДНК/мл.
Предлагаемый способ количественного определения видового состава микробиоты пародонтальных карманов осуществляется следующим образом. Проводят взятие содержимого пародонтального кармана стерильными бумажными эндодонтическими штифтами размером №25, который вводят в наиболее глубокие участки пародонтального кармана экспозицией не менее 10 секунд, последующее помещение штифта с биоматериалом в стерильную пластиковую пробирку типа Eppendorf (1,5 мл), содержащую 1 мл физиологического раствора, необходимого для продления «жизни» микроорганизмов, поскольку раствор подпитывает микробную биомассу и препятствует процессам отмирания и разложения. Затем осуществляют тщательное ресуспендирование на приборе типа Vortex. Штифт с биоматериалом находится в пробирке до момента выделения ДНК (до 2 часов при комнатной температуре, до 6 часов - при +4°С и до 6 мес - при -20°С). После этого 50 мкл биоматериала переносят в пробирку с 200 мкл реагента с ионообменной смолой (Chelex100) для выделения тотальной ДНК. Для дальнейшей амплификации используют 3 мкл супернатанта. В дальнейшем по стандартной методике осуществляют амплификацию искомых фрагментов ДНК методом ПЦР в режиме реального времени. Определяют концентрацию искомых микроорганизмов в биоматериале по формуле
где В - концентрация микроорганизмов, копий ДНК/мл;
Nst - стандартная начальная концентрация ДНК;
Е - эффективность РТ-ПЦР - число, показывающее, во сколько раз за один цикл изменится количество фрагментов ДНК;
Cst - значение порогового цикла стандартного образца;
Ct - значение порогового цикла опытного образца;
V - объем исследуемой пробы, мл;
1,7 - коэффициент перерасчета.
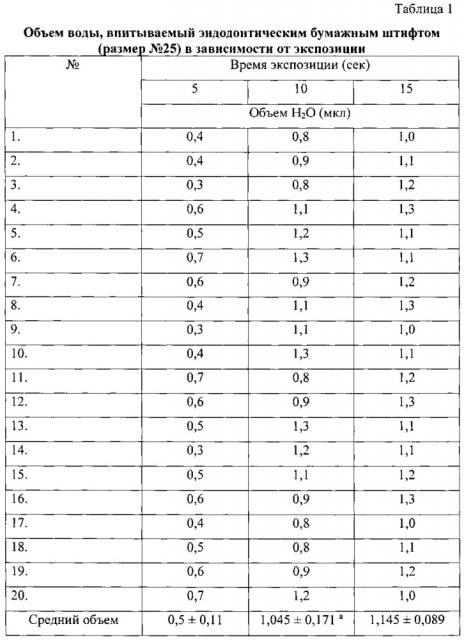
Для количественной оценки впитывающей способности стерильного бумажного эндодонтического штифта размером №25 измерялась сорбция дистиллированной Н2О при трех различных экспозициях (табл. 1): 5 сек, 10 сек и 15 сек. Для этого при использовании стеклянного градуированного капилляра (до 100 мкл) и секундомера измеряли объем воды, поглощаемой штифтом, погруженным в воду на 5, 10 или 15 сек. Бумажный штифт помещался на сухое плоское основание испытуемой стороной к капилляру, содержащему 100 мкл дистиллированной воды, который затем устанавливали нижним концом на испытуемый конец штифта, плотно прижав, для исключения просачивания жидкости. Эксперимент повторяли в трех сериях и в 20 повторах - для каждой экспозиции в отдельности. По истечении времени экспозиции определяли объем поглощенной жидкости по уменьшению объема воды в капилляре.
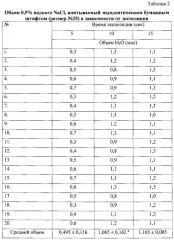
Затем для количественной оценки впитывающей способности стерильного бумажного эндодонтического штифта размером №25 была определена сорбция 0,9% водного раствора хлорида натрия (NaCl) при трех различных экспозициях (табл. 2): 5 сек, 10 сек и 15 сек. Для этого при использовании стеклянного градуированного капилляра (до 100 мкл) и секундомера измеряли объем 0,9% водного NaCl, поглощаемого штифтом, погруженным в указанный раствор на 5, 10 или 15 сек. Бумажный штифт помещался на сухое плоское основание испытуемой стороной к капилляру, содержащему 100 мкл 0,9% водного NaCl, который затем устанавливали нижним концом на испытуемый конец штифта, плотно прижав, для исключения просачивания жидкости. Эксперимент повторяли в трех сериях и в 20 повторах - для каждой экспозиции в отдельности. По истечении времени экспозиции определяли объем поглощенной жидкости по уменьшению объема соответствующего раствора в капилляре.
Далее количественная оценка впитывающей способности стерильного бумажного эндодонтического штифта размером №25 определялась сорбцией ротовой жидкости при трех различных экспозициях (табл. 3): 5 сек, 10 сек и 15 сек. Для этого при использовании стеклянного градуированного капилляра (до 100 мкл) и секундомера измеряли объем ротовой жидкости, поглощаемой штифтом, погруженным в указанный раствор на 5, 10 или 15 сек. Бумажный штифт помещался на сухое плоское основание испытуемой стороной к капилляру, содержащему 100 мкл ротовой жидкости, который затем устанавливали нижним концом на испытуемый конец штифта, плотно прижав, для исключения просачивания жидкости. Эксперимент повторяли в трех сериях и в 20 повторах - для каждой экспозиции в отдельности. По истечении времени экспозиции определяли объем поглощенной жидкости по уменьшению объема соответствующего раствора в капилляре.
Изобретение иллюстрируется следующими клиническими примерами.
Пример №1. Пациентка Р., 42 года. Диагноз: хронический генерализованный пародонтит средней степени в стадии обострения. Жалобы на подвижность зубов, запах изо рта, кровоточивость десен при чистке зубов. Пациентка курит и имеет сердечно-сосудистую патологию.
Содержимое пародонтального кармана и ротовую жидкость отбирали из наиболее глубоких участков с помощью стерильных бумажных эндодонтических штифтов размером №25, которые были введены в пародонтальный карман экспозицией не менее 10 сек. В дальнейшем штифты с биоматериалом были помещены в стерильные пластиковые пробирки типа Eppendorf (1,5 мл), содержащие по 1 мл физиологического раствора. Образцы были тщательно ресуспендированы на приборе типа Vortex. Штифты с биоматериалом находились в пробирке до момента выделения ДНК 1 час при комнатной температуре. После чего по 50 мкл каждого из исследуемых образцов было перенесено в отдельные пробирки, содержащие по 200 мкл раствора с ионообменной смолой (Chelex100) для выделения тотальной ДНК. Для дальнейшей амплификации использовалось по 3 мкл супернатанта каждого из образцов.
Для выделения тотальной ДНК из образцов ДНК использовали ионообменную смолу Chelex100. Для постановки ПЦР в реальном времени использовали подобранные нами пары видоспецифичных праймеров к фрагментам ДНК Porphyromonas gingivalis, Streptococcus oralis, Streptococcus sanguis, Streptococcus sobrinus, Treponema denticola и реакционную смесь в присутствии SYBR Green I (ООО «СИНТОЛ», согласно инструкции производителя). ПЦР проводили с помощью детектирующего амплификатора CFX96 Touch "REAL TIME" (Bio-Rad, США). Учет результатов проводили с помощью программного обеспечения Bio-Rad CFX Manager.
Результаты исследования микрофлоры зубодесневых карманов методом Real-Time PCR: обнаружены микроорганизмы Porphyromonas gingivalis, Treponema denticola, Streptococcus sobrinus.
В дальнейшем в соответствии с предлагаемым нами способом были рассчитаны концентрации искомых микроорганизмов в исследованных образцах по формуле В=1,7×(Nst×Ε×(Cst-Ct))/V, которые составили 8,4×107 копий ДНК/мл Porphyromonas gingivalis: В=1,7×(3,5×104×2,0×(20,23-18,12))/0,003=8,4×107 копий ДНК/мл; 3,1×107 копий ДНК/мл Treponema denticola: В=1,7×(3,5×104×2,0×(20,23-19,44))/0,003=3,1×107 копий ДНК/мл; 2,24×108 копий ДНК/мл Streptococcus sobrinus: В=1,7×(3,5×104×2,0×(20,23-14,56))/0,003=2,24×108 копий ДНК/мл.
Пример №2. Пациент К., 45 лет. Диагноз: хронический генерализованный пародонтит средней степени в стадии обострения. Жалобы на подвижность зубов, запах изо рта, кровоточивость десен при чистке зубов. Сопутствующие заболевания: гастрит и гипотиреоз.
Содержимое пародонтального кармана и ротовую жидкость отбирали из наиболее глубоких участков с помощью стерильных бумажных эндодонтических штифтов размером №25, которые были введены в пародонтальный карман экспозицией не менее 10 сек. В дальнейшем штифты с биоматериалом были помещены в стерильные пластиковые пробирки типа Eppendorf (1,5 мл), содержащие по 1 мл физиологического раствора. Образцы были тщательно ресуспендированы на приборе типа Vortex. Штифты с биоматериалом находились в пробирке до момента выделения ДНК 1 час при комнатной температуре. После чего по 50 мкл каждого из исследуемых образцов было перенесено в отдельные пробирки, содержащие по 200 мкл раствора с ионообменной смолой (Chelex100) для выделения тотальной ДНК. Для дальнейшей амплификации использовалось по 3 мкл супернатанта каждого из образцов.
Для выделения тотальной ДНК из образцов ДНК использовали ионообменную смолу Chelex100. Для постановки ПЦР в реальном времени использовали подобранные нами пары видоспецифичных праймеров к фрагментам ДНК Porphyromonas gingivalis, Streptococcus oralis, Streptococcus sanguis, Streptococcus sobrinus, Treponema denticola и реакционную смесь в присутствии SYBR Green I (ООО «СИНТОЛ», согласно инструкции производителя). ПЦР проводили с помощью детектирующего амплификатора CFX96 Touch "REAL TIME" (Bio-Rad, США). Учет результатов проводили с помощью программного обеспечения Bio-Rad CFX Manager.
Результаты исследования микрофлоры зубодесневых карманов методом Real-Time PCR: обнаружены микроорганизмы Porphyromonas gingivalis, Treponema denticola, Streptococcus sobrinus, Streptococcus oralis, Streptococcus sanguis.
В дальнейшем в соответствии с предлагаемым нами способом были рассчитаны концентрации искомых микроорганизмов в исследованных образцах по формуле В=1,7×(Nst×Ε×(Cst-Ct))/V, которые составили 2,01×108 копий ДНК/мл Porphyromonas gingivalis: В=1,7×(3,5×104×2,0×(20,23-15,17))/0,003=2,01×108 копий ДНК/мл; 8,77×107 копий ДНК/мл Treponema denticola: В=1,7×(3,5×104×2,0×(20,23-18,02))/0,003=8,77×107 копий ДНК/мл; 7,93×106 копий ДНК/мл Streptococcus sobrinus: В=1,7×(3,5×104×2,0×(20,23-20,03))/0,003=7,93×106 копий ДНК/мл; 2,58×107 копий ДНК/мл Streptococcus oralis: В=1,7×(3,5×104×2,0×(20,23-19,58))/0,003=2,58×107 копий ДНК/мл; и 1,32×108 копий ДНК/мл Streptococcus sanguis: В=1,7×(3,5×104×2,0×(20,23-16,9))/0,003=1,32×108 копий ДНК/мл.
Способ количественного определения видового состава микробиоты пародонтальных карманов, включающий забор содержимого пародонтальных карманов стерильным бумажным эндодонтическим штифтом размером №25, который вводят в наиболее глубокие участки пародонтального кармана экспозицией не менее 10 сек, и затем помещают в пробирку с транспортной средой, выделение тотальной ДНК из биоматерила, проведение ПЦР с использованием видоспецифичных праймеров к фрагментам ДНК Porphyromonas gingivalis, Treponema denticola, отличающийся тем, что в качестве транспортной среды используют физиологический раствор, проводят ПЦР в режиме реального времени, дополнительно используют видоспецифичные праймеры к фрагментам ДНК Streptococcus oralis, Streptococcus sanguis, Streptococcus sobrinus, после чего рассчитывают концентрацию микроорганизмов по формуле
В=1,7 × (Nst × Е × (Cst - Ct))/ V,
где В - концентрация микроорганизмов, копий ДНК/мл;
Nst - стандартная начальная концентрация ДНК;
Е - эффективность РТ-ПЦР - число, показывающее, во сколько раз за один цикл изменится количество фрагментов ДНК;
Cst - значение порогового цикла стандартного образца;
Ct - значение порогового цикла опытного образца;
V - объем исследуемой пробы, мл;
1,7 - коэффициент перерасчета.