Способ потенциометрического определения скорости генерирования пероксильных радикалов
Иллюстрации
Показать всеИзобретение относится к новому способу определения скорости генерирования пероксильных радикалов. Технический результат: разработан новый способ определения скорости генерирования пероксильных радикалов, который повышает точность, достоверность и воспроизводимость результатов, а также расширяет круг исследуемых веществ и используемых реагентов. 1 з.п. ф-лы, 4 ил., 1 пр.
Реферат
Изобретение относится к области физико-химических методов исследования радикальных реакций, в частности к способу определения скорости генерирования пероксильных радикалов. Способ может быть использован для количественного определения скорости генерирования пероксильных радикалов в растворе.
Известен способ изучения распада радикальных инициаторов и генерирования радикалов методами высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии в сочетании с жидкостной хроматографией [Werber J., Wang Y.J., Milligan M., Li X., Ji J.A. Analysis of 2,2'-azobis (2-amidinopropane) dihydrochloride degradation and hydrolysis in aqueous solutions // J. Pharm. Sci. 2011. 100(8): 3307-3315].
Недостатками данного способа являются сложность техники эксперимента, использование дорогостоящего оборудования и реактивов, а также высокие требования к исполнителю эксперимента в связи со сложностью интерпретации получаемых результатов.
Известен способ определения концентрации и скорости генерирования пероксильных радикалов, образующихся вследствие распада радикальных азоинициаторов методом электронного парамагнитного резонанса с использованием спиновых ловушек свободных радикалов, например 5,5-диметил-1-пирролин-N-оксида и 2,2-диметил -4- фенилимидазол -1- оксида [Krainev A.G., Bigelow D.J. Comparison of 2,2'-azobis(2-amidinopropane) hydrochloride (AAPH) and 2,2'-azobis(2,4-dimethylvaleronitrile)(AMVN) as free radical initiators: a spin-trapping study // J. Chem. Soc, Perkin Trans. 1996. 2: 747-754].
Недостатками данного способа также являются сложность техники эксперимента и использование дорогостоящего оборудования, а также специфических реактивов, не являющихся общедоступными.
Известен способ определения скорости генерирования пероксильных радикалов методом активированной хемилюминесценции с использованием в качестве люминофора люминола. В данном способе регистрируется увеличение интенсивности свечения люминола за счет взаимодействия с генерируемыми пероксильными радикалами [Krasowska A., Rosiak D., Szkapiak К., Lukaszewicz М. Chemiluminescence detection of peroxyl radicals and comparison of antioxidant activity of phenolic compounds // Current Topics in Biophysics. 2000. 24\(2): 89-95].
К недостаткам данного способа можно отнести то, что спектрофотометрическая регистрация сигнала также ограничивает измерения в окрашенных жидкостях, и то, что результаты, получаемые данным методом, представлены в относительных единицах свечения.
Наиболее близким решением служит способ определения скорости генерирования пероксильных радикалов, также образующихся за счет распада радикальных инициаторов, спектрофотометрическим методом с помощью измерения концентрации акцептора свободных радикалов пирогаллового красного (пирогаллосульфонфталеина) - красителя, обладающего максимумом поглощения при 540 нм [Yoshida Y., Itoh N., Saito Y., Hayakawa M, Niki E. Application of water-soluble radical initiator, 2,2'-azobis[2-(2-imidazolin-2-yl)propane] dihydrochloride, to a study of oxidative stress // Free Radic Res. 2004. 38 (4): 375-84].
К недостаткам данного способа относится то, что спектрофотометрический способ измерения сигнала не позволяет проводить измерения в окрашенных объектах, обладает недостаточной чувствительностью и точностью.
Задачей, решаемой данным изобретением, служит повышение точности, достоверности и воспроизводимости результатов, расширение круга исследуемых веществ и используемых реагентов.
Сущность заявляемого способа заключается в том, что определение скорости генерирования пероксильных радикалов проводят по изменению концентрации акцептора свободных радикалов, которая сопровождается изменением потенциала, регистрируемого при взаимодействии акцептора с генерируемыми радикалами, возникающими при термическом распаде радикального инициатора в растворе.
В качестве акцептора свободных радикалов используют восстановленную форму металла в составе комплексного соединения. При взаимодействии радикалов с восстановленной формой металла в комплексе образуется окисленная форма металла в комплексе и возникает обратимая электрохимическая система, потенциал которой зависит от соотношения окисленной и восстановленной форм. Пероксильные радикалы взаимодействуют с восстановленной формой металла в комплексе, что сопровождается постепенным уменьшением концентрации восстановленной формы металла по реакциям (1-2) и, соответственно, увеличением окислительно-восстановительного потенциала электрохимической системы согласно уравнению Нернста:
Расчет скорости производят по следующим формулам:
Wi=-d{C([MeRedL])}/dt,
где Wi - скорость генерирования радикалов, м⋅с-1;
C([MeRedL]) - концентрация восстановленной формы реагента, М.
Для расчета кинетики уменьшения концентрации восстановленной формы реагента [MeRedL] последнюю в каждый момент времени оценивают по формуле:
,
где
;
C0([MeRedL]) - начальная концентрация восстановленной формы реагента, М;
E1 - потенциал, измеренный через промежуток времени t1=t, В;
E2 - потенциал, измеренный через промежуток времени t2=ht, В;
h - отношение t1 к t2;
n - число электронов, участвующих в процессе, n=1;
F - постоянная Фарадея, равная 96485 Кл⋅моль-1;
R - универсальная газовая постоянная, равная 8,31 Дж/(моль⋅K);
T - абсолютная температура, К.
В качестве реагентов могут быть использованы комплексные соединения металлов переменной валентности, например комплекс железа (II) с ЭДТА [Fe(II)-EDTA], комплекс железа (II) с о-фенантролином [Fe(Phen)3]2+, K4[Fe(CN)6], K4[Mn(CN)6], K4[Mo(CN)8], [Fe(SCN)2], также комплексные соли металлов переменной валентности с органическими лигандами, например, тетраэтиламмония гексацианоферрат (II), тетраэтиламмония тетрахлороферрат (II), Fe(II)-TPTZ.
В качестве инициаторов, являющихся источником пероксильных радикалов, могут быть использованы азосоединения, например 2,2'-азобис(2-метилпропионамидин) дигидрохлорида (ААРН), 2,2'-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлорид (AIPN) и др.
Рабочий электрод может быть изготовлен из платины, электродом сравнения может служить стандартный хлорсеребряный электрод.
Указанные отличия существенны. Использование потенциометрического способа регистрации аналитического сигнала позволяет проводить анализ окрашенных объектов, а также увеличить чувствительность и точность метода за счет использования электрохимической детекции аналитического сигнала.
В настоящее время из патентной и научно-технической литературы неизвестен способ определения скорости генерирования пероксильных радикалов в заявляемой совокупности признаков. Впервые применена потенциометрия для решения этой задачи.
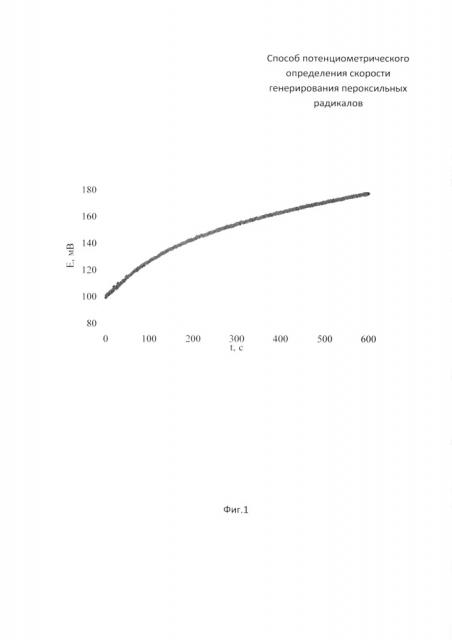
На фиг. 1 представлена зависимость потенциала от времени при совместном инкубировании радикального инициатора 2,2'-азобис(2-метилпропионамидин) дигидрохлорида (ААРН) с K4[Fe(CN)6] с при 37°C.
На фиг. 2 представлена зависимость потенциала от времени при совместном инкубировании радикального инициатора 2-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлорида (AIPN) с [Fe(II)-EDTA] с при 37°C.
На фиг. 3 представлена зависимость потенциала от времени при совместном инкубировании радикального инициатора 2,2'-азобис(2-метилпропионамидин) дигидрохлорида (ААРН) с [Fe(II)-EDTA] при 42°C.
На фиг. 4 представлена зависимость потенциала от времени при совместном инкубировании радикального инициатора 2-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлорида (AIPN) с [Fe(Phen)3]2+ c при 37°C.
Способ иллюстрируется следующими примерами.
Пример 1
В 4,9 мл водного раствора, находящегося в термостатируемой ячейке при 37°С, содержащего 0,1 М радикальный инициатор ААРН, вносят 0,1 мл 0,0125 М раствор K4[Fe(CN)6]. Затем опускают рабочий электрод и электрод сравнения. Измеряют скорость изменения потенциала.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
Результаты измерений приведены на фиг. 1.
Кинетику уменьшения концентрации K4[Fe(CN)6] в каждый момент времени оценивают по формуле:
,
где ;
C0(K4[Fe(CN)6]) - начальная концентрация восстановленной формы реагента, М;
C(K4[Fe(CN)6]) - текущая концентрация восстановленной формы реагента в каждый момент времени, М;
E1 - потенциал, измеренный через промежуток времени t1=t, В;
E2 - потенциал, измеренный через промежуток времени t2=ht, В;
h - отношение t1 к t2.
Скорость генерирования равна скорости уменьшения концентрации K4[Fe(CN)6].
Wi=-d{C(K4[Fe(CN)6])}/dt,
где Wi - скорость генерирования радикалов, м⋅с-1.
Расчет показывает, что скорость генерирования радикалов равна 1,59⋅10-7 м⋅с-1.
Пример 2
В 4,9 мл водного раствора, находящегося в термостатируемой ячейке при 37°C, содержащего 0,15 М радикальный инициатор AIPN, вносят 0,1 мл 0,015 М раствор [Fe(II)-EDTA]. Затем опускают рабочий электрод и электрод сравнения. Измеряют скорость изменения потенциала.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
Результаты измерений приведены на фиг. 2.
Кинетику уменьшения концентрации [Fe(II)-EDTA] в каждый момент времени оценивают по формуле:
,
где ;
C0([Fe(II)-EDTA]) - начальная концентрация восстановленной формы реагента, М;
C([Fe(II)-EDTA]) - текущая концентрация восстановленной формы реагента в каждый момент времени, М;
E1 - потенциал, измеренный через промежуток времени t1=t, B;
Е2 - потенциал, измеренный через промежуток времени t2=ht, В;
h - отношение t1 к t2.
Скорость генерирования равна скорости расходования [Fe(II)-EDTA].
Wi=-d{C([Fe(II)-EDTA])}/dt,
где Wi - скорость генерирования радикалов, м⋅с-1.
Расчет показывает, что скорость генерирования радикалов равна 3,94⋅10-7 м⋅с-1.
Пример 3
В 4,9 мл водного раствора, находящегося в термостатируемой ячейке при 42°C, содержащего 0,1 М радикальный инициатор ААРН, вносят 0,1 мл 0,0125 М раствор [Fe(II)-EDTA]. Затем опускают рабочий электрод и электрод сравнения. Измеряют скорость изменения потенциала.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
Результаты измерений приведены на фиг. 3.
Кинетику уменьшения концентрации [Fe(II)-EDTA] в каждый момент времени оценивают по формуле:
,
где ;
C0([Fe(II)-EDTA]) - начальная концентрация восстановленной формы реагента, М;
C([Fe(II)-EDTA]) - текущая концентрация восстановленной формы реагента в каждый момент времени, М;
Е1 - потенциал, измеренный через промежуток времени t1=t, В;
E2 - потенциал, измеренный через промежуток времени t2=ht, В;
h - отношение t1 к t2.
Расчет показывает, что скорость генерирования радикалов равна 3,67⋅10-7 м⋅с-1.
Пример 4
В 4,9 мл водного раствора, находящегося в термостатируемой ячейке при 37°C, содержащего 0,1 М радикальный инициатор AIPN, вносят 0,1 мл 0,015 М раствор [Fe(Phen)3]2+. Затем опускают рабочий электрод и электрод сравнения. Измеряют скорость изменения потенциала.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
Результаты измерений приведены на фиг. 4.
Кинетику уменьшения концентрации [Fe(Phen)3]2+ в каждый момент времени оценивают по формуле:
,
где ;
C0([Fe(Phen)3]2+) - начальная концентрация восстановленной формы реагента, М;
C([Fe(Phen)3]2+) - текущая концентрация восстановленной формы реагента в каждый момент времени, М;
Е1 - потенциал, измеренный через промежуток времени t1=t, В;
E2 - потенциал, измеренный через промежуток времени t2=ht, В;
h - отношение t1 к t2.
Скорость генерирования равна скорости уменьшения концентрации [Fe(Phen)3]2+.
Wi=-d{С([Fe(Phen)3]2+)}/dt,
где Wi - скорость генерирования радикалов, м⋅с-1.
Расчет показывает, что скорость генерирования радикалов равна 5,43⋅10-7 м⋅с-1.
1. Способ определения скорости генерирования пероксильных радикалов, включающий генерацию пероксильных радикалов на модели термического разложения азоинициатора с помощью изменения концентрации акцептора свободных радикалов, отличающийся тем, что в качестве акцептора свободных радикалов используют восстановленную форму реагента и регистрируют значение окислительно-восстановительного потенциала во времени, затем рассчитывают концентрацию восстановленной формы реагента [MeRedL] по формуле:
C([MeRedL]) - концентрация восстановленной формы реагента в каждый момент времени, М;
C0([MeRedL]) - начальная концентрация восстановленной формы реагента, М;
E1 - потенциал, измеренный через промежуток времени t1=t, В;
Е2 - потенциал, измеренный через промежуток времени t2=ht, В;
h - отношение t1 к t2;
n - число электронов, участвующих в процессе, n=1;
F - постоянная Фарадея, равная 96485 Кл⋅моль-1;
R - универсальная газовая постоянная, равная 8,31 Дж/(моль⋅K);
Т - абсолютная температура, К,
а скорость реакции генерирования пероксильных радикалов рассчитывают по формуле:
где Wi - скорость генерирования радикалов, м⋅с-1.
- изменение концентрации восстановленной формы реагента, М;
dt - промежуток времени, за который изменилась концентрация восстановленной формы реагента, с.
2. Способ по п. 1, отличающийся тем, что в качестве восстановленной формы реагента используют [Fe(II)-EDTA], [Fe(Phen)3]2+, K4[Fe(CN)6], K4[Mn(CN)6], K4[Mo(CN)8], [Fe(SCN)2], тетраэтиламмония гексацианоферрат (II), тетраэтиламмония тетрахлороферрат (II), Fe(II)-TPTZ.