Способ дифференциации энтерококков кишечной микрофлоры животных
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ предусматривает забор исследуемого материала, посев его на селективные питательные среды, инкубирование посевов при заданных параметрах с последующей идентификацией выросших колоний. Из выросших колоний проводят выделение и идентификацию чистой культуры энтерококков до вида известными способами с последующим определением у выделенных энтерококков антикарнозиновой активности (АКрА). При этом энтерококки, не обладающие антикарнозиновой активностью (АКрА) или обладающие антикарнозиновой активностью (АКрА ) при уровне выраженности данного признака, равном или меньше 1,9 мг/мл, относятся к нормальной кишечной микрофлоре животных. Изобретение позволяет упростить способ и дифференцировать энтерококки кишечной микрофлоры на нормальную и патогенную микрофлору. 2 табл., 1 пр.
Реферат
Изобретение относится к ветеринарии и может быть использовано в практической работе бактериологических лабораторий для дифференциации энтерококков кишечной микрофлоры животных на нормальную и патогенную микрофлору с целью проведения своевременных и эффективных профилактических и терапевтических мероприятий.
Энтерококки, входящие в состав нормальной микрофлоры желудочно-кишечного тракта млекопитающих, играют важную роль в обеспечении колонизационной резистентности слизистой оболочки, стимулируют местный гуморальный и клеточный иммунитет, а также участвуют в метаболических реакциях (гидролиз сахаров, синтез витаминов, деконъюгирование желчных кислот) [Бондаренко В.М., Суворов А.Н. Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции. М.: Медицина, 2007. 30 с.].
В то же время энтерококки являются представителями группы условно-патогенных бактерий и при снижении активности факторов врожденного иммунитета кишечник может стать основным источником транслокации бактерий при эндогенной энтерококковой инфекции [Ятусевич А.И., Андросик Н.Н. Малоизученные инфекционные и инвазионные болезни домашних животных. Минск: Ураджай, 2001].
Установлено, что некоторые штаммы энтерококков, приобретя ряд факторов патогенности, могут вызывать серьезные инфекционные заболевания, тогда как другие штаммы служат необходимым компонентом нормального микробиоценоза [Красная Ю.В., Нестеров А.С., Потатуркина-Нестерова Н.И. Значение бактерий рода Enterococcus в жизнедеятельности человека. Современные проблемы науки и образования (электронный журнал). 2014. №6].
Рост инфекций, вызываемых условно-патогенными микроорганизмами, диктует необходимость поиска новых способов дифференциации нормальной микрофлоры от этиологических агентов, способных вызывать развитие патологических процессов [Бухарин О.В. Персистенция патогенных бактерий. М.: «Медицина», 1999. С. 185].
Известен способ дифференциации энтерококков, являющихся представителями нормальной микрофлоры человека, от патогенных энтерококков путем разграничения потенциально опасных штаммов по их генетическому профилю с применением полимеразной цепной реакции. При обнаружении генов, кодирующих факторы вирулентности, делают заключение о патогенности штамма энтерококка [Вершинин А.Е., Колоджиева В.В., Ермоленко Е.И., Грабовская К.Б., Климович Б.В. и др. Генетическая идентификация как способ выявления патогенных и симбиотических штаммов энтерококков. Журнал микробиологии, эпидемиологии и иммунобиологии. 2008. №5. С. 82].
Известен способ дифференциации патогенных и непатогенных энтерококков разной локализации у новорожденных детей (кишечник, пупочная культя, нижние дыхательные пути, мочевыводящие пути) с помощью математической формулы с использованием линейной дискриминантной функции, характеризующей тип штамма энтерококка.
Данный способ основан на выделении энтерококков, определении их вида и изучении у выделенных штаммов энтерококков маркеров патогенности и персистенции (гемолитической, протеолитической, фибринолитической активности, полиантибиотикорезистентности, адгезивной способности, лизоцимной и антилизоцимной активностей) [Черданцева Г.А., Билимова С.И. Характеристика биологических свойств энтерококков различного происхождения. Журнал микробиологии, эпидемиологии и иммунобиологии. 2000. №4. С. 103].
Данный способ является очень трудоемким, поскольку предполагает определение у выделенных штаммов семи биологических свойств (маркеры вирулентности и персистенции), а также определение у них антибиотикорезистентности. Кроме того, применение способа в клинической практике затруднено из-за сложности математических расчетов.
Известен способ дифференциации клинических изолятов энтерококков, выделенных от животных, от энтерококков, являющихся представителями нормальной микрофлоры, по наличию у штаммов желатиназной активности, поскольку штаммы, продуцирующие желатиназу, обладают высокой вирулентностью [Qin X., Singh K.V., Weinstock G.M. et al. Effects of Enterococcus faecalis for genes on production of gelatinase and a serine protease and virulence. Infections Immunology. 2000. Vol. 68. P. 2579-2586].
Желатиназная активность в 1,5-2 раза чаще встречается среди клинических изолятов по сравнению со штаммами, выделенными от здоровых животных [ Т., AksAakal A., Ekull U. et al. Virulence Factors of Enterococcus faecium and Enterococcus faecalis Strains Isolated from Humans and Pets. Turkish Journal of Veterinary and Animal Sciences. 2006. Vol. 30. P. 477-482].
Известен способ дифференциации энтерококков на представителей нормальной микрофлоры кишечника и возбудителей гнойно-воспалительных заболеваний, основанный на способности энтерококков к инактивации факторов естественной резистентности макроорганизма (антилизоцимной, антикомплементарной, «антиинтерфероновой», антитромбоцитарной катионно-белковой активности) [Билимова С.И. Характеристика факторов персистенции энтерококков. Журнал микробиологии, эпидемиологии и иммунобиологии. Приложение, 2000. №4. с. 104-105].
Однако указанный способ трудоемок для применения в условиях клинической лаборатории и больше подходит для научно-исследовательских целей из-за необходимости определения у выделенных микроорганизмов нескольких факторов персистенции (антилизоцимной, антикомплементарной, «антиинтерфероновой», антитромбоцитарной катионно-белковой активности) и предназначен для дифференциации энтерококков - представителей симбиотической микрофлоры кишечника человека от возбудителей гнойно-воспалительных заболеваний.
Технический результат, на достижение которого направлено заявляемое изобретение, заключается в возможности дифференцировать энтерококки кишечной микрофлоры животных на нормальную и патогенную микрофлору.
Для достижения указанного технического результата в заявляемом способе дифференциации энтерококков кишечной микрофлоры животных на нормальную и патогенную микрофлору проводят забор исследуемого материала, посев его на селективные питательные среды, выделение и идентификацию чистых культур энтерококков, определение у выделенных микроорганизмов антикарнозиновой активности (АКрА) и к нормальной кишечной микрофлоре животных относят штаммы энтерококков, не обладающие АКрА и обладающие АКрА при уровне выраженности данного признака, равном или меньше 1,9 мг/мл.
Новым в заявляемом способе является то, что у выделенных культур энтерококков определяют антикарнозиновую активность (АКрА), при этом к нормальной кишечной микрофлоре животных относят штаммы энтерококков, не обладающие АКрА и обладающие АКрА при уровне выраженности данного признака равном или меньше 1,9 мг/мл.
Достигаемый при осуществлении изобретения технический результат состоит в том, что заявляемый способ путем определения у энтерококков антикарнозиновой активности позволяет дифференцировать энтерококки кишечной микрофлоры животных на нормальную и патогенную микрофлору, что способствует проведению своевременных и эффективных профилактических и терапевтических мероприятий.
В результате проведенных авторами экспериментов выявлено ранее неизвестное свойство энтерококков - их антикарнозиновая активность (АКрА).
Исследование проведено на 122 штаммах энтерококков, выделенных из кишечника здоровых коров, и 113 штаммах энтерококков, выделенных из кишечника коров при дисбактериозе.
Исследуемый материал (кал) засевали на чашки со средой Entero-coccosel agar (BD, США). Посевы инкубировали в термостате при температуре 37°С в течение 24-48 часов. Выросшие колонии пересевали на скошенный агар Шэдлера, инкубировали в термостате при температуре 37°С в течение 24-48 часов и изучали морфологию микроорганизмов при окраске мазков по Граму. Чистую культуру идентифицировали до вида с помощью мультиплексной ПЦР с использованием известных праймеров (синтез праймеров осуществлен компанией «СИНТОЛ», Москва) по видоспецифическим генам, кодирующим синтез супероксиддисмутазы [Jackson C.R., Fedorka-Cray P.J., Barrett J.B. Use of a genus- and species-specific multiplex PCR for identification of enterococci. J. Clin. Microbiol. 2004. Vol. 42(8). P. 3558-3565].
E. faecium регистрировали в 27,8% случаев, E. hirae - в 24,1%; E. durans - в 22,2%; E. faecalis в 12,9%; E. flavescens в 9,3%; E. casseliflavus в 3,7% случаев.
У всех выделенных энтерококков определяли антикарнозиновую активность.
Известен способ определения антикарнозиновой активности микроорганизмов [Патент РФ №2132879, МПК C12Q 1/04, 1999]. Согласно способу антикарнозиновую активность у выделенных энтерококков определяли следующим образом.
1. Исследуемую культуру энтерококка выращивали на плотной питательной среде при 37°С в течение 24 часов.
2. Готовили опытную пробу: из выросшей культуры делали одномиллиардную взвесь, отбирали 0,1 мл, добавляли 1,7 мл мясопептонного бульона. Затем готовили раствор карнозина: 30 мг карнозина растворяли в 1 мл физиологического раствора и получали его концентрацию, равную 30 мг/мл. Приготовленный раствор карнозина в объеме 0,2 мл добавляли в опытную пробу, где концентрация карнозина составляла 3 мг/мл.
3. Параллельно с опытной готовили 3 контрольные пробы: а) контроль 1. К 0,2 мл раствора карнозина добавляли 0,1 мл физиологического раствора и 1,7 мл мясопептонного бульона, б) контроль 2. К 0,2 мл физиологического раствора добавляли 0,1 мл одномиллиардной взвеси испытуемой культуры и 1,7 мл мясопептонного бульона, в) контроль 3. К 0,3 мл физиологического раствора добавляли 1,7 мл мясопептонного бульона.
4. Опытную и контрольные пробы инкубировали в течение 24 часов при Т 37°С.
5. Во все пробы добавляли по 0,1 мл хлороформа и выдерживали в течение 40 минут.
6. Все пробы центрифугировали при 3000 об/мин в течение 15 минут.
7. Из опытной и контрольных проб отделяли супернатант (по 0,6 мл), добавляли к нему 1,1 мл мясопептонного бульона и 0,1 мл взвеси тест-культуры M. luteus (способ приготовления взвеси: 16-18 - часовую агаровую культуру M. luteus смывают физиологическим раствором и готовят одномиллиардную взвесь по стандарту мутности. Полученную взвесь разводят физиологическим раствором в 10 раз и используют).
8. Все пробы инкубировали 24 часа при 37°С.
9. Затем замеряли оптическую плотность взвесей опытной и контрольных проб на фотоэлектроколориметре.
10. Рассчитывали антикарнозиновую активность (АКрА) исследуемой культуры энтерококков по формуле
где С - исходная концентрация карнозина, мг/мл;
OD - оптическая плотность взвеси в опыте;
OD1 - оптическая плотность взвеси в контроле 1;
OD2 - оптическая плотность взвеси в контроле 2;
OD3 - оптическая плотность взвеси в контроле 3.
Антикарнозиновая активность выражается в мг/мл (мг инактивированного карнозина в мл культуральной среды).
Результаты исследований представлены в таблице 1.
Как видно из таблицы, у разных видов штаммов энтерококков выделенных из кишечника здоровых коров, антикарнозиновая активность определялась в 42,9%-62,5% случаев, а у 37,5%-57,1% штаммов энтерококков антикарнозиновая активность не определялась.
Тогда как штаммы энтерококков, выделенные, из кишечника коров при дисбактериозе, независимо от их вида, в 100% случаев обладали антикарнозиновой активностью.
Уровень выраженности АКрА у штаммов энтерококков, выделенных от здоровых животных, составлял от 0,1 до 1,9 мг/мл; у животных с дисбактериозом кишечника - от 2,0 мг/мл до 3,0 мг/мл.
Таким образом, авторами при изучении штаммов энтерококков, выделенных из кишечника здоровых коров и коров с дисбактериозом, установлены пороговые значения антикарнозиновой активности (АКрА), позволяющие дифференцировать энтерококки кишечной микрофлоры животных на нормальную и патогенную микрофлору.
К нормальной кишечной микрофлоре животных относят штаммы энтерококков, не обладающие АКрА и обладающие АКрА при уровне выраженности данного признака, равном или меньше 1,9 мг/мл.
Предложенный способ дифференциации энтерококков кишечной микрофлоры животных был испытан в учебном хозяйстве ФГБОУ ВПО «Оренбургский государственный аграрный университет». Эффективность дифференциации, проведенной в соответствии с заявляемым способом, составила 95%.
Способ осуществляется следующим образом:
1. Проводят забор исследуемого материала (фекалии животных) и засевают на чашки с желчно-эскулиновым агаром с азидом натрия (HiMedia, Индия).
2. Посевы инкубируют в термостате при температуре 37°С в течение 24-48 часов.
3. Изучают морфологию выросших колоний при окраске мазков по Граму и пересевают на скошенный агар, инкубируют в термостате при температуре 37°С в течение 24-48 часов.
4. Выделяют и идентифицируют чистые культуры энтерококков до вида с помощью мультиплексной ПЦР с использованием известных праймеров (синтез праймеров осуществлен компанией «СИНТОЛ», Москва) по видоспецифическим генам, кодирующим синтез супероксиддисмутазы.
5. Исследуемые культуры энтерококков выращивают на плотной питательной среде при 37°С в течение 24-48 часов.
6. Из выросших культур готовят одномиллиардную взвесь, отбирают 0,1 мл, добавляют 1,7 мл мясопептонного бульона и 0,2 мл раствора карнозина (разведение карнозина готовят таким образом, чтобы его конечная концентрция в МПБ с тест-штаммом составляла 3 мг/мл). Для осуществления способа используют L-carnosine производства фирмы «Sigma-Aldrich» (USA).
7. Параллельно с опытной готовят 3 контрольные пробы: а) контроль 1. К 0,2 мл раствора карнозина добавляют 0,1 мл физиологического раствора и 1,7 мл мясопептонного бульона, б) контроль 2. К 0,2 мл физиологического раствора добавляют 0,1 мл одномиллиардной взвеси испытуемой культуры и 1,7 мл мясопептонного бульона, в) контроль 3. К 0,3 мл физиологического раствора добавляют 1,7 мл мясопептонного бульона.
8. Опытную и контрольные пробы инкубируют в течение 24 часов при Т 37°С.
9. Во все пробы добавляют по 0,1 мл хлороформа и выдерживают в течение 40 минут, затем центрифугируют при 3000 об/мин в течение 15 минут, отделяют супернатант (по 0,6 мл), добавляют к нему 1,1 мл мясопептонного бульона и 0,1 мл взвеси тест-культуры M. luteus (способ приготовления взвеси: 16-18 - часовую агаровую культуру M. luteus смывают физиологическим раствором и готовят одномиллиардную взвесь по стандарту мутности. Полученную взвесь разводят физиологическим раствором в 10 раз и используют).
10. Опытную и контрольные пробы инкубируют 24 часа при 37°С.
11. Затем замеряют оптическую плотность взвесей опытной и контрольных проб на фотоэлектроколориметре.
11. Рассчитывают антикарнозиновую активность (АКрА) исследуемой культуры энтерококков по формуле
где С - исходная концентрация карнозина, мг/мл;
OD - оптическая плотность взвеси в опыте;
OD1 - оптическая плотность взвеси в контроле 1;
OD2 - оптическая плотность взвеси в контроле 2;
OD3 - оптическая плотность взвеси в контроле 3.
Антикарнозиновая активность выражается в мг/мл (мг инактивированного карнозина в мл культуральной среды).
12. К нормальной кишечной микрофлоре животных относят штаммы энтерококков, не обладающие АКрА и обладающие АКрА при уровне выраженности данного признака, равном или меньше 1,9 мг/мл.
Пример конкретного выполнения способа.
В целях предупреждения развития послеродового эндометрита у 4 стельных коров проведено исследование фекалий.
Исследуемый материал (фекалии животных) засевали на чашки с желчно-эскулиновым агаром с азидом натрия (HiMedia, Индия). Посевы инкубировали в термостате при температуре 37°С в течение 24-48 часов.
Изучали морфологию выросших колоний при окраске мазков по Граму. По совокупности морфологических (овоидные (яйцевидные) неподвижные клетки, несколько вытянутые в длину, расположены попарно) и тинкториальных свойств (положительные при окраске по Граму) свойств отнесли данные микроорганизмы к представителям рода Enterococcus. Колонии пересеяли на скошенный агар, инкубировали в термостате при температуре 37°С в течение 24-48 часов.
Выделяли и идентифицировали чистые культуры энтерококков до вида с помощью мультиплексной ПЦР с использованием известных праймеров (синтез праймеров осуществлен компанией «СИНТОЛ», Москва) по видоспецифическим генам, кодирующим синтез супероксиддисмутазы.
Штаммы энтерококков, выделенные от животных, были идентифицированы как Е. faecium, Е. hirae, Е. casseliflavus и Е. faecalis.
Исследуемые штаммы энтерококков выращивали на плотной питательной среде при 37°С в течение 24-48 часов.
Готовили опытные пробы: из выросших культур делали одномиллиардную взвесь, отбирали 0,1 мл, добавляли 1,7 мл мясопептонного бульона. Затем готовили раствор карнозина: 30 мг карнозина растворяли в 1 мл физиологического раствора и получали его концентрацию, равную 30 мг/мл. Приготовленный раствор карнозина в объеме 0,2 мл добавляли в опытные пробы, где концентрация карнозина составляла 3 мг/мл. Использовали L-carnosine производства фирмы «Sigma-Aldrich» (USA).
Параллельно с опытными готовили по 3 контрольные пробы: а) контроль 1. К 0,2 мл раствора карнозина добавляли 0,1 мл физиологического раствора и 1,7 мл мясопептонного бульона, б) контроль 2. К 0,2 мл физиологического раствора добавляли 0,1 мл одномиллиардной взвеси испытуемой культуры и 1,7 мл мясопептонного бульона, в) контроль 3. К 0,3 мл физиологического раствора добавляли 1,7 мл мясопептонного бульона.
Опытные и контрольные пробы инкубировали в течение 24 часов при Т 37°С. Во все пробы добавляли по 0,1 мл хлороформа и выдерживали в течение 40 минут, затем центрифугировали при 3000 об/мин в течение 15 минут, отделяли супернатант (по 0,6 мл), добавляли к нему 1,1 мл мясопептонного бульона и 0,1 мл взвеси тест-культуры M. luteus (способ приготовления взвеси: 16-18 - часовую агаровую культуру M. luteus смывали физиологическим раствором и готовили одномиллиардную взвесь по стандарту мутности. Полученную взвесь разводили физиологическим раствором в 10 раз и использовали).
Опытные и контрольные пробы инкубировали 24 часа при 37°С.
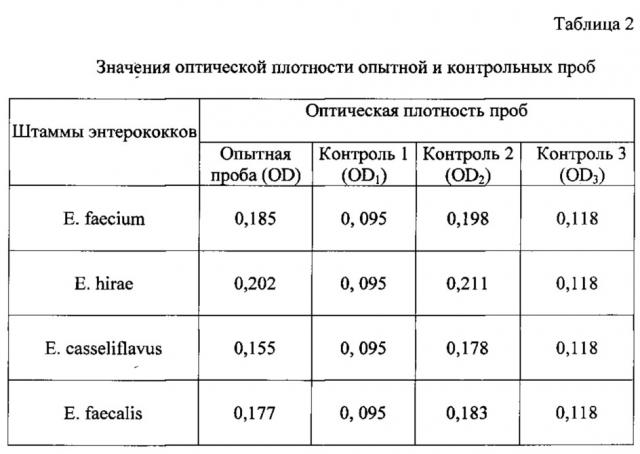
Затем замеряли оптическую плотность взвесей опытных и контрольных проб на фотоэлектроколориметре. Полученные данные представлены в таблице 2.
Рассчитывали антикарнозиновую активность (АКрА) штамма энтерококка Е. faecium:
где 3 - исходная концентрация карнозина, мг/мл;
0,185 - оптическая плотность взвеси в опыте;
0,095 - оптическая плотность взвеси в контроле 1;
0,198 - оптическая плотность взвеси в контроле 2;
0,118 - оптическая плотность взвеси в контроле 3;
1,3 - антикарнозиновая активность (АКрА) штамма энтерококка Е. faecium, мг/мл.
Рассчитывали антикарнозиновую активность (АКрА) штамма энтерококка Е. hirae:
где 3 - исходная концентрация карнозина, мг/мл;
0,202 - оптическая плотность взвеси в опыте;
0,095 - оптическая плотность взвеси в контроле 1;
0,211 - оптическая плотность взвеси в контроле 2;
0,118 - оптическая плотность взвеси в контроле 3;
1,8 - антикарнозиновая активность (АКрА) штамма энтерококка Е. hirae: мг/гл.
Рассчитывали антикарнозиновую активность (АКрА) штамма энтерококка Е. casseliflavus:
где 3 - исходная концентрация карнозина, мг/мл;
0,155 - оптическая плотность взвеси в опыте;
0,095 - оптическая плотность взвеси в контроле 1;
0,178 - оптическая плотность взвеси в контроле 2;
0,118 - оптическая плотность взвеси в контроле 3;
0 - штамм энтерококка Е. casseliflavus не обладает антикарнозиновой активностью (АКрА).
Рассчитывали антикарнозиновую активность (АКрА) штамма энтерококка Е. faecalis:
где 3 - исходная концентрация карнозина, мг/мл;
0,177 - оптическая плотность взвеси в опыте;
0,095 - оптическая плотность взвеси в контроле 1;
0,183 - оптическая плотность взвеси в контроле 2;
0,118 - оптическая плотность взвеси в контроле 3;
2,2 - антикарнозиновая активность (АКрА) штамма энтерококка Е. faecalis, мг/гл.
Таким образом у двух животных были выделены штаммы энтерококков Е. faecium и Е. hirae, обладающие АКрА с уровнем выраженности 1,3 мг/мл и 1,8 мг/мл соответственно.
От третьего животного был высеян штамм энтерококка Е. casseliflavus, не обладающий антикарнозиновой активностью.
От четвертого животного был высеян штамм энтерококка Е. faecalis, обладающий антикарнозиновой активностью с уровнем выраженности 2,2 мг/мл.
Согласно заявляемому способу к нормальной кишечной микрофлоре животных относят штаммы энтерококков, не обладающие АКрА и обладающие АКрА при уровне выраженности данного признака, равном или меньше 1,9 мг/мл.
Таким образом был сделан вывод о том, что три штамма энтерококков Е. faecium, Е. hirae и Е. casseliflavus относятся к нормальной микрофлоре кишечника. Дальнейшее наблюдение за животными подтвердило правильность проведенной дифференциации выделенных штаммов энтерококков.
А выделенный штамм энтерококка Е. faecalis является патогенным и может вызвать послеродовой эндометрит. Животное отнесено к группе риска по развитию инфекционно-воспалительного заболевания и ему назначен бактериофаг энтерококковый жидкий, что предотвратило развитие заболевания.
Таким образом, использование заявляемого способа позволяет дифференцировать энтерококки кишечной микрофлоры животных на нормальную и патогенную микрофлору, что способствует проведению своевременных и эффективных профилактических и терапевтических мероприятий.
Способ дифференциации энтерококков кишечной микрофлоры животных на нормальную и патогенную микрофлору, заключающийся в том, что проводят забор исследуемого материала, посев его на селективные питательные среды, выделение и идентификацию чистых культур энтерококков, определение у выделенных микроорганизмов антикарнозиновой активности (АКрА) и к нормальной кишечной микрофлоре животных относят штаммы энтерококков, не обладающие АКрА и обладающие АКрА при уровне выраженности данного признака, равном или меньше 1,9 мг/мл.