Способ определения содержания бактерий с использованием в качестве метки модифицированных магнитных наночастиц
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к электрохимическому иммуноанализу. Предложен способ определения содержания грамотрицательных бактерий в анализируемой среде. В водной среде при температуре 37°С конъюгируют бактерии с магнитными наночастицами Fe3O4, Fe0, NiFe2O4 или MgFe2O4, модифицированными декстраном. Отделяют несвязавшиеся наночастицы с использованием магнитного поля. Помещают в среду рабочий электрод из золота, платины или графитсодержащих материалов, поверхность которого предварительно модифицируют антителами, специфичными к определяемому штамму бактерий, для образования иммунокомплекса на поверхности электрода в течение 20 мин при температуре 37°С. Промывают электрод буферным раствором, содержащим нормальную лошадиную сыворотку и твин-20. Помещают извлеченный из анализируемой среды рабочий электрод в электрохимическую ячейку, содержащую фоновый электролит. Определяют содержание бактерий по величине электрохимического отклика окисления наночастиц, локализованных в иммунокомплексе на поверхности рабочего электрода. Изобретение позволяет увеличить чувствительность и точность анализа, снизить предел обнаружения клеток бактерий до 10 КОЕ/мл, сократить время проведения анализа. 1 з.п. ф-лы, 7 ил., 5 пр.
Реферат
Изобретение относится к электрохимическому иммуноанализу, а именно к качественному и количественному селективному определению содержания бактерий в пробах различного состава. Изобретение может быть использовано в микробиологии, биотехнологии, медицине, экологии и технологии пищевых производств.
Изобретение создано с целью устранения недостатков широко используемых в настоящее время методов анализа: низкая чувствительность и экспрессность (бактериологический посев), возможность получения ложных результатов (иммуноферментный анализ), высокие требования к оснащению лаборатории и квалификации персонала (ДНК-анализ).
Известен подход [Qi Zhang, Xiaojun Chen, Fulai Tu, Cheng Yao / Ultrasensitive enzyme-free electrochemical immunoassay for free thyroxine based on three dimensionally ordered macroporous chitosan-Au nanoparticles hybrid film // Biosensors and Bioelectronics 59 (2014) 377-383] к определению содержания бактерий Е. coli, где золотой электрод модифицировали гиалуроновой кислотой и специфичными антителами. Сопротивление электрода изменялось в зависимости от количества бактерий в исследуемой пробе. Основной недостаток такого подхода - высокий риск получения ложных результатов, возникающий вследствие влияния факторов внешней среды на величину сопротивления индикаторного электрода.
Предложен подход [Ana Clarissa dos Santos Pires, Nilda de Ferreira Soaresa, Luis Henrique Mendes da Silva, Maria do Carmo Hespanhol da Silva, Mauro Vieira De Almeida, Mireille Le Hyaric, de Andrade,Freitas Soares, Aparecida Barbosa Mageste, Samira Gama Reis / A colorimetric biosensor for the detection of foodborne bacterial / Sensors and Actuators В 153 (2011) 17-23] к определению бактерий Е. coli и S. aureus фотометрическим методом с использованием в качестве меток органических веществ, изменяющих цвет раствора при взаимодействии с бактериальными метаболитами. Главным недостатком является узкий интервал линейности данного метода.
Описан метод электрохимического иммуноанализа, в качестве метки в котором использовали наночастицы Fe3O4 [Brainina, K.Z., Kozitsina, A.N., Glazyrina, Y.A. / Hybrid electrochemical/magnetic assay for Salmonella typhimurium detection // IEEE Sensors Journal Volume 10, Issue 11, 2010, №5483125, pp. 1699-1704]. Аналитическим сигналом в данном варианте иммуноанализа служил максимальный ток электровосстановления ионов Fe3+, полученных после кислотного разложения меченного наночастицами иммунокомплекса. Основным недостатком является необходимость проведения длительного и многостадийного кислотного разложения иммунокомплекса.
Известен способ определения содержания бактерий Е. coli [Патент РФ №2542487. Козицина А.Н., Малышева Н.Н., Глазырина Ю.А., Матери А.И. «Способ определения содержания грамотрицательных патогенных бактерий в анализируемой среде». Дата приоритета 15.07.2013], где в качестве метки использовали наночастицы магнетита, покрытые электроактивными органическими соединениями, в частности полипирролом, хинолинмодифицированным поливинилбензилхлоридом, ферроценмодифицированным оксидом кремния. Максимальный ток окисления/восстановления электроактивного покрытия служил аналитическим сигналом. Существенным недостатком предложенного метода является сложная технология получения нанокомпозитов и трудности при их длительном хранении.
Наиболее близким техническим решением, выбранным в качестве прототипа, служит способ определения содержания патогенных микроорганизмов в различных объектах, включающий конъюгирование микроорганизмов с сигналообразующей меткой, магнитную сепарацию с последующим концентрированием конъюгатов и определением наличия и концентрации микроорганизмов с помощью введенной метки. В качестве сигналообразующей метки выступают электрохимически активные магнитные наночастицы, аналитический сигнал от которых получают напрямую в результате их разряда-ионизации на поверхности рабочего электрода. Концентрирование метки осуществляют путем образования иммунокомплекса «антитело-меченная магнитными наночастицами бактерия» на поверхности рабочего электрода. Величина электрохимического отклика от магнитной нанометки пропорциональна содержанию бактерий в исследуемой пробе [Патент РФ №2538153. Козицына А.Н., Митрофанова (Свалова) Т.С., Матери А.И. «Электрохимический способ иммуноанализа для определения микроорганизмов». Дата приоритета 22.03.2013 г.]. К недостаткам предложенного способа можно отнести невысокий предел обнаружения (100 КОЕ/мл) и недостаточную точность определения малых количеств микроорганизмов, а также невозможность обнаружения в пробах грамположительных бактерий.
Предлагаемое техническое решение направлено на повышение чувствительности и точности определения, расширение круга определяемых бактерий, а также на уменьшение временных затрат на проведение процедуры иммуноанализа.
Предлагаемый способ электрохимического иммуноанализа включает в себя инкубацию бактерий с модифицированными магнитными наночастицами, магнитную сепарацию свободных наночастиц, образование иммунокомплекса на поверхности электрода и детектирование электрохимического отклика от магнитной нанометки, интенсивность которого пропорциональна содержанию бактерий в исследуемой пробе. Схема проведения процедуры иммуноанализа приведена в приложении 1. Магнитные наночастицы модифицируют декстраном [V. Zavisova, М. Koneracka, J. Kovac, М. Kubovcikova, I. Antal, P. Kopcansky, M. Bednarikova, M. Muckova / The cytotoxicity of iron oxide nanoparticles with different modifications evaluated in vitro // Journal of Magnetism and Magnetic Materials 380 (2015) 85-89] с целью облегчения проникновения их в клеточную мембрану и реализации более равномерного распределения наночастиц на поверхности грамотрицательной бактериальной клетки. Также модификация поверхности магнитных наночастиц позволяет сократить время проведения процедуры иммуноанализа вследствие облегчения процессов клеточного эндоцитоза в случае поглощения модифицированных магнитных наночастиц и уменьшить поверхностную энергию наночастиц и, следовательно, предотвратить их агрегацию, в результате чего размер частиц не изменяется в течение всего эксперимента. Это позволяет существенно улучшить чувствительность и точность, а получение прямого аналитического сигнала непосредственно от магнитной нанометки, включенной в иммунокомплекс на поверхности рабочего электрода, приводит к сокращению времени проведения анализа.
Таким образом, согласно предложенному способу локализацию и удерживание магнитных наночастиц на поверхности микробной клетки осуществляют за счет ферментативных реакций в клеточной мембране грамотрицательных бактерий с (био)органическими соединениями, после чего на поверхности рабочего электрода формируют меченный наночастицами иммунокомплекс и детектируют электрохимический сигнал. Это позволяет снизить предел обнаружения (до 10 КОЕ/мл), сократить время проведения процедуры иммуноанализа, уменьшить материало- и трудозатраты и реализовать высокое качество анализа проб, содержащих бактерии разных штаммов. Все это в конечном итоге приведет к снижению себестоимости анализа.
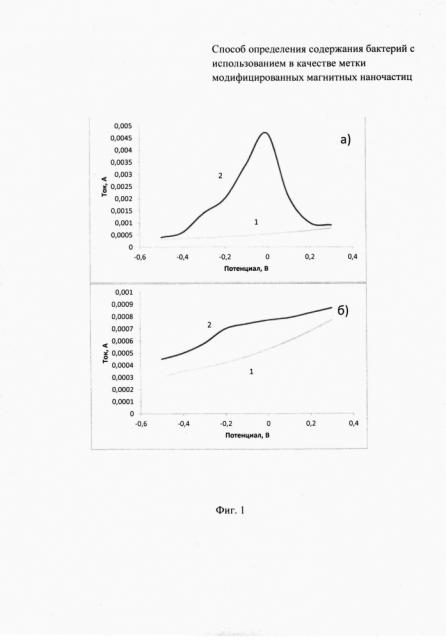
На фиг. 1 представлены циклические вольтамперограммы, зарегистрированные в модельных растворах, содержащих (а, 1-2) и не содержащих (б, 1-2) бактерии Salmonella thyphimurium: 1 - вольтамперограмма фонового электролита; 2 - вольтамперограмма пробы.
На фиг. 2 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 3-4) и не содержащих (б, 3-4) бактерии Salmonella thyphimurium: 3 - вольтамперограмма фонового электролита; 4 - вольтамперограмма пробы.
На фиг. 3 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 3-4) и не содержащих (б, 3-4) бактерии Escherichia coli: 5 - вольтамперограмма фонового электролита; 6 - вольтамперограмма пробы.
На фиг. 4 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 7-8) и не содержащих (б, 7-8) бактерии Salmonella infantis: 7 - вольтамперограмма фонового электролита; 8 - вольтамперограмма пробы.
На фиг. 5 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 9-10) и не содержащих (б, 9-10) бактерии Escherichia coli: 9 - вольтамперограмма фонового электролита; 10 - вольтамперограмма пробы.
На фиг. 6 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 11-12) и не содержащих (б, 11-12) бактерии Staphylococcus Aureus: 11 - вольтамперограмма фонового электролита; 12 - вольтамперограмма пробы.
На фиг. 7 представлены циклические вольтамперограммы, зарегистрированные в пробах, содержащих (а, 13-14) и не содержащих (б, 13-14) бактерии Salmonella thyphimurium.
Способ иллюстрируется следующими примерами.
Пример 1
Вытяжку из анализируемой пробы (проба воздуха) инкубируют с наночастицами Fe3O4, модифицированными декстраном, в течение 20 минут при температуре 37°С. После инкубации свободные наночастицы отделяют с использованием магнитного поля в течение 5 минут. Далее в анализируемую среду помещают платиновый электрод, модифицированный антителами против Salmonella thyphimurium, и выдерживают в течение 20 минут при температуре 37°С. Для ускорения процесса доставки меченых бактерий к поверхности рабочего электрода используют магнитное поле (напряженностью 31.83⋅103 А/м). Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор LiClO4 в ацетонитриле. В качестве аналитического сигнала используют электрохимический отклик окисления предварительно восстановленного магнетита, локализованного в иммунокомплексе на поверхности платинового электрода. Для проведения контрольного (холостого) эксперимента используют раствор, не содержащий компонентов бактериальной природы (физиологический раствор). В анализируемой пробе обнаружено 9 КОЕ/мл.
Пример 2
Пробу природной воды инкубируют с наночастицами Fe0, модифицированными декстраном, в течение 20 минут при температуре 37°С. После инкубации свободные наночастицы отделяют с использованием магнитного поля в течение 5 минут. Далее в анализируемую среду помещают графитсодержащий электрод, модифицированный антителами против Escherichia coli, и выдерживают в течение 20 минут при температуре 37°С. Для ускорения процесса доставки меченых бактерий к поверхности рабочего электрода используют магнитное поле (напряженностью 31.83⋅103 А/м). Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор LiClO4 в диметилформамиде. В качестве аналитического сигнала используют электрохимический отклик окисления предварительно восстановленного магнетита, локализованного в иммунокомплексе на поверхности графитсодержащего электрода. Для проведения контрольного (холостого) эксперимента используют раствор, не содержащий компонентов бактериальной природы (физиологический раствор). В анализируемой пробе воды обнаружено 103 КОЕ/мл.
Пример 3
Пробу природной воды инкубируют с наночастицами NiFe2O4, модифицированными декстраном, в течение 20 минут при температуре 37°С. После инкубации свободные наночастицы отделяют с использованием магнитного поля в течение 5 минут. Далее в анализируемую среду помещают золотой электрод, модифицированный антителами против Salmonella infantis, и выдерживают в течение 20 минут при температуре 37°С. Для ускорения процесса доставки меченых бактерий к поверхности рабочего электрода используют магнитное поле (напряженностью 31.83⋅103 А/м). Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор KNO3 в смеси вода/этиловый спирт (в соотношении 3/1). В качестве аналитического сигнала используют электрохимический отклик окисления предварительно восстановленного магнетита, локализованного в иммунокомплексе на поверхности золотого электрода. Для проведения контрольного (холостого) эксперимента используют раствор, не содержащий компонентов бактериальной природы (физиологический раствор). В анализируемой пробе воды обнаружено 103 КОЕ/мл.
Пример 4
Вытяжку из анализируемой пробы (фекалии инфицированных животных) инкубируют с наночастицами MgFe2O4, модифицированными декстраном, в течение 20 минут при температуре 37°С. После инкубации свободные наночастицы отделяют с использованием магнитного поля в течение 5 минут. Далее в анализируемую среду помещают графитсодержащий электрод, модифицированный антителами против Escherichia coli, и выдерживают в течение 20 минут при температуре 37°С. Для ускорения процесса доставки меченых бактерий к поверхности рабочего электрода используют магнитное поле (напряженностью 31.83⋅103 А/м). Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор NEt4BF4 в диметилсульфоксиде. В качестве аналитического сигнала используют электрохимический отклик окисления предварительно восстановленного магнетита, локализованного в иммунокомплексе на поверхности графитсодержащего электрода. Для проведения контрольного (холостого) эксперимента используют раствор, не содержащий компонентов бактериальной природы (физиологический раствор). В анализируемой пробе обнаружено 5⋅105 КОЕ/мл.
Пример 5
Вытяжку из анализируемой пробы (фекалии инфицированных животных) инкубируют с наночастицами Fe3O4, модифицированными декстраном, в течение 20 минут при температуре 37°С. После инкубации свободные наночастицы отделяют с использованием магнитного поля в течение 5 минут. Далее в анализируемую среду помещают графитсодержащий электрод, модифицированный антителами против Salmonella thyphimurium, и выдерживают в течение 20 минут при температуре 37°С. Для ускорения процесса доставки меченых бактерий к поверхности рабочего электрода используют магнитное поле (напряженностью 31.83⋅103 А/м). Затем электрод промывают буферным раствором, содержащим нормальную лошадиную сыворотку (НЛС) и твин-20. Извлеченный из анализируемого раствора электрод помещают в электрохимическую ячейку. В качестве фонового электролита используют раствор Na2HPO4 в диметилсульфоксиде. В качестве аналитического сигнала используют электрохимический отклик окисления предварительно восстановленного магнетита, локализованного в иммунокомплексе на поверхности графитсодержащего электрода. Для проведения контрольного (холостого) эксперимента используют раствор, не содержащий компонентов бактериальной природы (физиологический раствор). В анализируемой пробе обнаружено 60 КОЕ/мл.
1. Способ определения содержания грамотрицательных бактерий в анализируемой среде, характеризующийся конъюгированием бактерий с электрохимической меткой, в качестве которой используют магнитные наночастицы, осуществляемым в водной среде при температуре 37°С, отделением несвязавшихся наночастиц с использованием магнитного поля, помещением в среду рабочего электрода, изготовленного из золота, платины или графитсодержащих материалов, поверхность которого предварительно модифицируют антителами, специфичными к определяемому штамму бактерий, образованием иммунокомплекса на поверхности электрода в течение 20 мин при температуре 37°C с использованием магнитного поля, промыванием электрода буферным раствором, содержащим нормальную лошадиную сыворотку и твин-20, помещением извлеченного из анализируемой среды рабочего электрода в электрохимическую ячейку, содержащую фоновый электролит, и определением содержания микроорганизмов по величине аналитического сигнала, в качестве которого используют электрохимический отклик окисления наночастиц, локализованных в иммунокомплексе на поверхности рабочего электрода, отличающийся тем, что в качестве магнитных наночастиц используют Fe3O4, Fe0, NiFe2O4, MgFe2O4, модифицированные декстраном.
2. Способ по п.1, отличающийся тем, что в качестве фоновых электролитов используют растворы LiClO4, KNO3, NEt4BF4 или Na2HPO4 в ацетонитриле, диметилформамиде, диметилсульфоксиде, воде и смеси вода/этиловый спирт.