Способ культивирования адгезионных клеток
Иллюстрации
Показать всеИзобретение относится к клеточной технологии. Описан способ получения адгезионных клеток в соответствии с которым: a. адгезионные клетки вносят в культуральный сосуд, который содержит микроносители в культуральной среде; b. клетки амплифицируют, проводя несколько последовательных пассажей клеток в том же самом культуральном сосуде, причем каждый пассаж клеток, следующий за первым пассажем клеток, проводят: i. используя всю или часть популяции клеток, которая была получена в течение предшествующего пассажа клеток, после проведения ферментативной обработки популяции клеток для открепления клеток от микроносителей; и ii. внося культуральную среду и увеличивая количество микроносителей; и c. популяцию адгезионных клеток, полученную в течение последнего пассажа клеток, собирают после необязательного проведения ферментативной обработки указанной популяции клеток для открепления клеток от микроносителей. Изобретение расширяет арсенал средств для получения адгезионных клеток. 3 н. и 37 з.п. ф-лы, 2 ил., 8 табл., 7 пр.
Реферат
Объектом изобретения является способ получения адгезионных клеток, в соответствии с которым адгезионные клетки вводят в культуральный сосуд, который содержит микроносители в культуральной среде, и несколько последовательных пассажей клеток проводят в одном сосуде, причем каждый раз используя всю или часть клеточной популяции предшествующего пассажа клеток для проведения следующего пассажа клеток. Изобретение также относится к применению этого способа для получения биологических агентов, в частности, для изготовления вакцин или лекарственных соединений.
В 1980-х годах развитие технологии культивирования клеток на микроносителях упростило крупномасштабное получение адгезионных клеток и, соответственно, получение биологических агентов. Получение адгезионных клеток, предназначенных для получения биологических агентов для фармацевтического применения, тем не менее должно соответствовать некоторому числу нормативных требований, в частности: запрету использования адгезионных клеток после некоторого числа «пассажей клеток» из-за существования риска морфологической и/или биологической трансформации клеток. Это, в частности, относится к случаю клеток линии Vero.
В US 4664912 описан способ, используемый в промышленном масштабе для получения партии адгезионных клеток из клеточной затравки, имеющей свое происхождение из рабочего банка клеток. Он основан на последовательности пассажей клеток, которые каждый раз проходят в различных биореакторах, рабочие объемы которых увеличиваются на протяжении последовательных пассажей клеток. Это дает возможность каждый раз увеличивать количество микроносителей, одновременно сохраняя оптимальную концентрацию микроносителей в культуральной среде, которая обычно составляет от 1 до 5 г/л. Клеточная биомасса поэтому увеличивается на протяжении последовательных пассажей клеток до тех, пор пока не будет достигнута желаемая промышленная партия клеток. Перенос клеток из одного биореактора в другой биореактор проводят после открепления адгезионных клеток от микроносителей посредством обработки трипсином и затем блокирования действия фермента внесением сывороточных белков или сыворотки в среду для того, чтобы сохранить в максимальной степени целостность клеток. Полученную суспензию клеток затем переносят (в присутствии или отсутствии используемых микроносителей) в больший биореактор, который содержит большее число новых микроносителей. Однако этот способ промышленного получения адгезионных клеток требует применения и работы с большим количеством материала, что влияет на стоимость получения биологических объектов.
Для снижения стоимости получения адгезионных клеток, предназначенных для получения биологических объектов, в EP 1060241 предложен более быстрый способ получения, в котором больше не требуется начинать каждый раз с клеточной затравки из рабочего банка при необходимости получения промышленной партии клеток. Способ состоит из переноса после каждого пассажа клеток большинства клеток (от 80 до 90% клеточной биомассы) в один или несколько других биореакторов для продолжения амплификации клеточной биомассы и для промышленного получения партии клеток, в то время как оставшиеся 10-20% клеток сохраняют для поддержания запаса «питающих клеток», из которого можно получить дополнительные партии клеток. Тем не менее, этот способ имеет следующие недостатки:
- полученные партии клеток проявляют некоторую гетерогенность в том, что не все они имеют одинаковое число пассажей клеток;
- поддержание запаса «питающих» клеток в культуре во время каждой операции переноса неизбежно приводит к «старению» клеток, которое прямо связано с числом проведенных пассажей клеток, и поэтому может использоваться только в течение ограниченного периода времени для уже указанных нормативных причин.
Для того чтобы освободиться от использования протеолитических ферментов, таких как трипсин, который опасен для целостности клеток, в Ohlson et al., Cytotechnology (1994), vol. 14, pages 67-80, описана технология переноса адгезионных клеток с микроносителей на микроносители (перенос с шариков на шарики) без ферментативной обработки. Близкий контакт между микроносителями, покрытыми адгезионными клетками и не покрытыми микроносителями, обеспечивает перенос клеток на непокрытые микроносители, на которых клетки можно амплифицировать. Поэтому, для усиления клеточного роста непокрытые микроносители добавляют к культуральной среде, которая содержит микроносители, покрытые адгезионными клетками, и культуральную среду периодически перемешивают для обеспечения контакта между микроносителями. Тем не менее, получаемая клеточная популяция является «несинхронизированной», поскольку клетки находятся на разных стадиях клеточного цикла, что может быть главным недостатком для получения биологических агентов.
Все еще существует необходимость оптимизации способов крупномасштабного получения адгезионных клеток, а также получения биологических агентов из них, таким образом, чтобы снизить стоимость получения.
Для достижения этого объектом настоящего изобретения является:
способ получения адгезионных клеток, в соответствии с которым:
а. адгезионные клетки вносят в культуральный сосуд, который содержит микроносители в культуральной среде;
b. клетки амплифицируют, проведя последовательные пассажи клеток в этом одном культуральном сосуде, причем каждый пассаж клеток, следующий за первым пассажем клеток, проводят:
i. используя всю или часть клеточной популяции, которая получена в течение предшествующего пассажа клеток, после проведения ферментативной обработки клеточной популяции для открепления клеток от микроносителей; и
ii. внося культуральную среду и увеличивая количество микроносителей; и
c. клеточную популяцию, полученную в течение финального пассажа клеток, собирают после необязательного проведения ферментативной обработки указанной клеточной популяции для открепления клеток от микроносителей.
Объектом настоящего изобретения также является:
способ получения биологического агента, продуцируемого адгезионными клетками, в соответствии с которым:
а. адгезионные клетки вносят в культуральный сосуд, который содержит микроносители в культуральной среде;
b. клетки амплифицируют, проводя нескольких последовательных пассажей клеток в этом одном культуральном сосуде, причем каждый пассаж клеток, следующий за первым пассажем клеток, проводят:
i. используя всю или часть клеточной популяции, которая получена в течение предшествующего пассажа клеток, после проведения ферментативной обработки указанной клеточной популяции для открепления клеток от микроносителей; и
ii. внося культуральную среду и увеличивая количество микроносителей;
c. клеточную популяцию, полученную в течение финального клеточного пассажа, обрабатывают таким образом, чтобы она продуцировала биологический агент, причем указанную обработку проводят в том же культуральном сосуде, который использовали для амплификации клеток; и
d. собирают биологический агент.
В соответствии с одним аспектом процесса получения биологического агента им является инфекционный агент, и обработку клеточной популяции проводят ее заражением, осуществляемым в течение финального пассажа клеток, причем указанным инфекционным агентом является инфекционная среда.
В соответствии с одним конкретным аспектом изобретения инфекционным агентом является вирус бешенства, а инфекционной средой является вирусная инфекционная среда, свободная от любого продукта животного происхождения.
В общем, число пассажей клеток, проводимых в одном культуральном сосуде, составляет 2, 3 или 4.
Концентрация микроносителей в культуральной среде в течение первого пассажа клеток составляет обычно <1 г/л и предпочтительно ≤0,5 г/л.
Очень предпочтительно, чтобы для ферментативной обработки использовали раствор, содержащий протеолитический фермент, такой как трипсин.
В соответствии с другим аспектом способа по изобретению каждый пассаж клеток, следующий за первым пассажем клеток, проводят, увеличивая объем культуральной среды.
Предпочтительно, чтобы первый пассаж клеток проводили в объеме культуральной среды, который составляет от 1/5 до половины рабочего объема культурального сосуда.
В другом варианте осуществления способа по изобретению культуральная среда свободна от сыворотки животного происхождения.
Предпочтительно, чтобы культуральная среда была свободна от продуктов животного происхождения.
В соответствии с другим аспектом концентрация белка в культуральной среде составляет ≤15 мг/л.
По еще одному аспекту культуральная среда также содержит клеточный протекторный агент.
Предпочтительно, чтобы клеточным протекторным агентом был поливинилпирролидон или полоксамер.
В соответствии с еще одним вариантом осуществления способа по изобретению культуральный сосуд представляет собой биореактор, который имеет рабочий объем между 3 и 3000 литрами, предпочтительно между 20 и 1000 литрами и особенно предпочтительно между 20 и 500 литрами.
В еще одном варианте осуществления изобретения культуральным сосудом является биореактор для однократного применения.
В одном конкретном аспекте способа по изобретению адгезионными клетками являются клетки Vero.
В общем, собираемая клеточная популяция содержит по меньшей мере 60-кратное количество клеток, исходно внесенных в культуральный сосуд.
В другом аспекте изобретение относится к способу получения адгезионных клеток, в соответствии с которым:
а. размораживают запас адгезионных клеток, затем
b. с размороженными клетками проводят один из вариантов осуществления способа по изобретению.
В еще одном аспекте изобретение относится к способу получения адгезионных клеток, в соответствии с которым после получения адгезионных клеток в первом культуральном сосуде в соответствии со способом по изобретению:
а. клеточную популяцию, собранную после ферментативной обработки указанной клеточной популяции для открепления клеток от микроносителей, переносят во второй культуральный сосуд, который имеет больший рабочий объем и который содержит культуральную среду, содержащую большее количество микроносителей относительно количества микроносителей, присутствующего в течение последнего пассажа клеток, проведенного в первом культуральном сосуде, и
b. один из вариантов осуществления способа по изобретению выполняют в этом втором сосуде.
В одном конкретном аспекте один из вариантов осуществления способа по изобретению повторяют в третьем культуральном сосуде, который имеет больший рабочий объем, чем рабочий объем второго культурального сосуда.
Изобретение также относится к использованию клеток, которые были получены в соответствии со способом по изобретению, для получения биологических агентов.
В итоге, изобретение относится к способу получения адгезионных клеток в культуральном сосуде, который содержит микроносители в культуральной среде, в соответствии с которым количество получаемых клеток увеличивается с кратностью ≥ 60 в результате проведения последовательных пассажей клеток в одном и том же культуральном сосуде.
Подробное описание изобретения
Изобретение относится к способу получения адгезионных клеток, в соответствии с которым для амплификации клеток и для получения промышленных партий клеток проводят несколько последовательных пассажей клеток в одном и том же клеточном культуральном сосуде. Посредством этого способа уменьшается число используемых культуральных сосудов, а получаемые партии клеток являются гомогенными, поскольку они все имеют одинаковое число пассажей клеток. Этот способ также служит для получения биологических агентов.
В рамках настоящего изобретения «пассаж клеток» начинается, когда суспензию адгезионных клеток вносят в контакт с микроносителями в культуральной среде, и обычно заканчивается, когда адгезионные клетки освобождают от микроносителей с помощью ферментативной обработки, и они снова представляют собой суспензию в культуральной среде. Пассаж клеток обычно включает в себя следующие фазы:
- фазу колонизации микроносителей, которая соответствует периоду времени, в течение которого клетки, которые были приведены в контакт с микроносителями в культуральной среде, прикрепляются к микроносителям;
- фазу амплификации клеток, прикрепленных к микроносителям, которая соответствует периоду времени, в течение которого клетки умножаются на микроносителях до тех пор, пока доступная поверхность колонизированных микроносителей более чем на 70% и предпочтительно более чем на 80% покрыта клетками. Когда более 70% доступной поверхности колонизированных микроносителей покрыто клетками, считается, что адгезионные клетки являются «по существу конфлюэнтными» или достигли «стадии конфлюэнтности»; и
- фазу открепления по существу конфлюэнтных клеток от микроносителей посредством ферментативной обработки, так что максимум клеток открепляется от своей подложки (в общем, более 80% и предпочтительно более 90%) в течение короткого интервала времени (в общем, менее 30 минут и часто в течение периода времени меньше 20 минут). Клеточная популяция затем представляет собой по существу суспензию клеток, высвобожденных из своих микроносителей (или открепленных от своих микроносителей).
В случае настоящего изобретения в зависимости от использования получаемых адгезионных клеток финальный пассаж клеток, проводимый в культуральном сосуде, включает в себя или не включает в себя фазу открепления.
В контексте настоящего изобретения последовательные пассажи клеток проводят в дном и том же культуральном сосуде, используя всю или часть клеточной популяции, полученной в течение предшествующего пассажа клеток, для проведения следующего пассажа клеток. Обычно для проведения следующего пассажа клеток используют по меньшей мере 80% клеточной популяции, полученной в течение предшествующего пассажа клеток. Для получения максимального количества клеток предпочтительно проводить пассажи клеток, каждый раз используя всю клеточную популяцию, полученную в течение предшествующего пассажа клеток, для проведения следующего пассажа клеток. Хотя в конце каждого пассажа клетки освобождают (открепляют) от их микроносителей посредством ферментативной обработки, отсутствует рекомендованный в прототипе перенос клеточной биомассы в один или несколько других клеточных культуральных сосудов для продолжения клеточной амплификации. Амплификацию клеточной биомассы проводят в настоящем изобретении в одном и том же культуральном сосуде. Этот способ очень предпочтителен, поскольку аналогичное количество клеток получают за такой же период времени без необходимости использования и работы с несколькими культуральными сосудами, что уменьшает пространство, требуемое для получения промышленного количества клеток, и, соответственно, по существу снижает стоимость производства. Удивительно то, что хотя амплификация клеточной биомассы требует ферментативной обработки на каждом клеточном пассаже, количество клеток, которое получается в конце осуществления способа по изобретению, значительно превышает количество клеток, полученное с использованием стандартной технологии «перенос с микроносителей на микроносители» (смотрите пример 2).
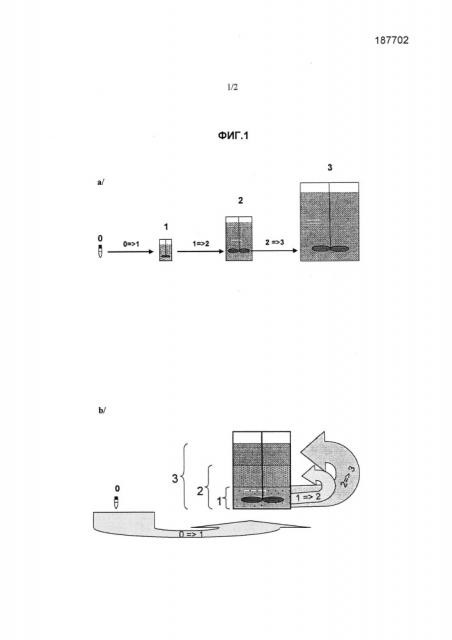
Каждый новый пассаж клеток, который соответствует пассажу клеток, следующему за первым пассажем клеток, проводят в одном культуральном сосуде. Для начала пассажа, следующего за первым пассажем клеток, культуральную среду и объем микроносителей, превышающий количество микроносителей, внесенное в течение предшествующего пассажа клеток, вносят для увеличения доступной поверхности клеточной подложки. Следует понимать, что термин «новый пассаж клеток» или «пассаж, следующий за первым пассажем клеток», означает пассаж клеток, следующий за пассажем клеток, который проводили в культуральном сосуде. Следует также понимать, что внесение или добавление микроносителей в культуральный сосуд соответствует внесению непокрытых микроносителей. Для облегчения прикрепления адгезионных клеток предпочтительно использовать новые микроносители. Хотя обычно объем культуральной среды соответственно увеличивается с каждым пассажем, следующим за первым пассажем клеток, увеличение количества микроносителей обычно пропорционально выше увеличения объема среды, что, в общем, приводит к постепенному увеличению концентрации микроносителей в культуральной среде в течение последовательных пассажей клеток. В течение финального пассажа клеток при использовании, например, в качестве микроносителей декстрановых микрошариков, продаваемых под наименованием CytodexTM (CytodexTM 1, 2 или 3), концентрация микроносителей в культуральной среде обычно составляет от 1 до 7 г/л, но может достигать 10-15 г/л. Способ по изобретению, в соответствии с которым клеточная биомасса увеличивается в результате последовательных пассажей клеток в одном и том же культуральном сосуде, называют «способ все-в-одном» (смотрите фиг.1b).
Обычно в одном культуральном сосуде проводят 2 клеточных пассажа, 3 клеточных пассажа или 4 клеточных пассажа. В зависимости от дальнейшего использования полученного продукта клеточная популяция, которую собирают в конце выполнения способа по изобретению, представляет собой либо суспензию клеток, высвобожденных из своих микроносителей (в этом случае финальный пассаж клеток проводят, включая стадию открепления клеток), либо суспензию клеток, прикрепленных к микроносителям (в этом случае финальный пассаж клеток проводят, исключая стадию открепления клеток). Когда способ получения адгезионных клеток включает в себя два последовательных пассажа клеток, проводимых в одном и том же культуральном сосуде, способ по изобретению означает выполнение следующих стадий:
а. культуральную среду, микроносители и адгезионные клетки вносят в культуральный сосуд,
b. клеткам обеспечивают условия культивирования, которые позволяют им прикрепляться к микроносителям и пролиферировать на них,
с. клетки открепляют от микроносителей посредством ферментативной обработки и часть клеток (необязательно) удаляют из культурального сосуда,
d. культуральную среду и микроносители вносят повторно, так чтобы количество вносимых микроносителей превышало количество ранее внесенных микроносителей,
е. клеткам повторно обеспечивают условия культивирования, которые позволяют им прикрепляться к микроносителям и пролиферировать на них, и
f. полученную популяцию клеток собирают после необязательного открепления клеток от их микроносителей посредством ферментативной обработки, причем стадии (а)-(е) проводят в одном и том же культуральном сосуде.
Стадии (а)-(с) соответствуют первому клеточному пассажу, а стадии (d)-(f) соответствуют второму клеточному пассажу, который заканчивается со сбором клеток.
Когда в одном сосуде проводят более двух последовательных пассажей клеток, это означает повтор стадий (c), (d) и (e) после стадии (е) в одном культуральном сосуде перед выполнением стадии (f) сбора клеток. Обычно стадии (c), (d) и (e) повторяют один раз после стадии (е), что соответствует проведению трех последовательных пассажей клеток, или стадии (c), (d) и (e) повторяют два раза после стадии (е), что соответствует проведению 4 последовательных пассажей клеток. Предпочтительно выполнять стадию (с) (которая соответствует откреплению клеток от их микроносителей), когда клетки по существу являются конфлюэнтными. Обычно объем культуральной среды также увеличивают при каждом добавлении микроносителей (стадия d).
Когда популяцию клеток, собираемую в конце осуществления способа по изобретению, используют для создания запаса клеток, финальный пассаж клеток обычно включает в себя стадию открепления клеток посредством ферментативной обработки, которую обычно проводят в том же культуральном сосуде. Клеточная популяция затем представляет собой по существу суспензию клеток, высвобожденных из своих микроносителей.
Когда популяцию клеток используют для получения биологического агента, финальный пассаж клеток часто проводят, не включая стадию открепления клеток. Популяцию клеток, полученных в форме суспензии клеток, прикрепленных к микроносителям, затем напрямую обрабатывают в том же культуральном сосуде таким образом, что она продуцирует целевой биологический агент. Предполагается, что термин «биологический агент» означает любое вещество или организм, который может продуцироваться адгезионными клетками. В частности, это могут быть вирусы или белки (антитела, антигены, ферменты и т.п.). Когда способ получения биологического агента, продуцируемого адгезионными клетками, включает в себя два последовательных пассажа клеток, проводимых в одном культуральном сосуде, способ по изобретению, таким образом, означает выполнение следующих стадий:
а. культуральную среду, микроносители и адгезионные клетки вносят в культуральный сосуд,
b. клеткам обеспечивают условия культивирования, которые позволяют им прикрепляться к микроносителям и пролиферировать на них,
с. клетки открепляют от микроносителей посредством ферментативной обработки и часть клеток (необязательно) удаляют из культурального сосуда,
d. культуральную среду и микроносители вносят повторно, так чтобы количество вносимых микроносителей превышало количество ранее внесенных микроносителей,
е. клеткам повторно обеспечивают условия культивирования, которые позволяют им прикрепляться к микроносителям и пролиферировать на них,
f. полученную клеточную популяцию обрабатывают таким образом, чтобы она продуцировала биологический агент, и
g. собирают биологический агент, причем стадии (a)-(f) проводят в одном и том же культуральном сосуде.
Когда больше двух последовательных пассажей клеток проводят в одном сосуде, это означает повторение стадий (c), (d) и (e) после стадии (e) в одном культуральном сосуде перед выполнением стадии (f) получения биологического агента. Обычно стадии (c), (d) и (e) повторяют один раз после стадии (е), что соответствует проведению трех последовательных пассажей клеток, или стадии (c), (d) и (e) повторяют дважды после стадии (е), что соответствует проведению 4 последовательных пассажей клеток. Предпочтительно выполнять стадию (с) (которая соответствует откреплению клеток от своих микроносителей), когда клетки по существу конфлюэнтны. Обычно культуральный объем также увеличивают каждый раз при добавлении микроносителей (стадия d).
Когда задачей является получение рекомбинантного белка, такого как, например, цитокин, антитело или вакцинный белок, клеточную суспензию помещают в условия культивирования, которые обеспечивают продукцию этого белка с использованием подходящей среды для получения белка. Например, можно упомянуть среду, описанную в EP 0354129 для получения рекомбинантных белков в клетках СНО и Vero.
Когда биологическим агентом является инфекционный агент, суспензию клеток, прикрепленных к микроносителям, инфицируют внесением инфекционного агента (бактерии, вирусы, паразиты и т.п.) в культуральный сосуд, обычно после замены культуральной среды инфекционной средой. Инфекционным биологическим агентом, в частности, может быть рекомбинантный вирус (рекомбинантные поксвирусы, рекомбинантные аденовирусы) или могут быть вирусы, такие как вирус бешенства, вирус гриппа, полиовирус и т.п. Биологический агент обычно собирают, удаляя культуральный супернатант в одну или несколько стадий - смотрите пример 7. Если биологический агент, наоборот, является внутриклеточным, как в случае нелитических вирусов, часто предпочтительно собрать супернатант и клетки, которые впоследствии обрабатывают литическими агентами.
Используемая для получения биологических агентов среда, в частности, инфекционная среда, которую используют для получения вирусов, таких как вирус бешенства, предпочтительно может быть свободна от сыворотки животного происхождения, от белка животного происхождения или даже от любого продукта животного происхождения.
Микроносители, подходящие для объекта изобретения, обычно имеют форму микрошариков, которые предпочтительно являются непористыми, для того чтобы облегчить действие ферментов. Они имеют диаметр обычно между 90 и 250 мкм. Их плотность немного выше плотности культуральной среды, для того чтобы обеспечить их выделение простым отстаиванием, но одновременно она не должна быть слишком высокой, чтобы получить полное ресуспендирование микрошариков при умеренной интенсивности перемешивания среды. При стандартных условиях культивирования плотность микроносителей обычно находится между 1,020 и 1,050 г/мл. Поверхность микрошариков выбирают так, чтобы облегчить прикрепление шариков. Матрикс микроносителей предпочтительно является нежестким, для того чтобы обеспечить лучшее сохранение клеток при столкновении между шариками. Средняя доступная поверхность для прикрепления клеток обычно составляет между 4000 и 5000 см2/г микрошариков. Эти характеристики, в частности, относятся к микрошарикам с перекрестно-сшитым декстрановым матриксом, продаваемым под наименованием CytodexTM (Cytodex 1, Cytodex 2, Cytodex 3), но также они относятся к другим микрошарикам, основой матрикса которых является перекрестно-сшитый полистирол (Biosilon, Solohill), или стеклянным микрошарикам (Sigma Aldrich).
В контексте настоящего изобретения концентрация микроносителей в течение первого пассажа клеток, в частности, при использовании в качестве микроносителей микрошариков CytodexTM, таких как микрошарики CytodexTM 1, обычно снижена до концентрации <1 г/л, причем в прототипе микроносители используют в концентрации между 1 и 5 г/л. Обычно она составляет ≤0,5 г/л; более определенно она составляет 0,1-0,4 г/л, и конкретнее она составляет 0,1-0,3 г/л. Эта концентрация фактически соответствует исходной концентрации микроносителей в культуральной среде после внесения клеток в культуральный сосуд. Таким образом, она составляет <1 г/л, предпочтительно ≤0,5 г/л; в частности, она составляет 0,1-0,4 г/л и более конкретно она составляет 0,1-0,3 г/л.
Исходное количество клеток, которое вносят в культуральный сосуд, выбирают так, чтобы более 80% микроносителей были колонизированы клетками. Для получения данной степени колонизации в культуральный сосуд обычно вносят исходное количество клеток, которое по меньшей мере в 5-10 раз выше количества микроносителей, присутствующих в культуральной среде. Например, в случае получения клеток Vero исходное количество клеток, которое вносят в культуральный сосуд, обычно находится между 5×103 и 5×104 клеток/см2 микрошариков CytodexTM, что представляет собой приблизительно от 5 до 50 клеток на микрошарик. Фактически, поскольку концентрация микроносителей в культуральной среде в течение первого пассажа клеток ниже той, которую обычно используют в прототипе, соответственно следует, что исходная концентрация клеток также будет ниже.
В конце каждого пассажа клетки открепляют от микроносителей в течение короткого периода времени (в общем менее 30 минут и предпочтительно в течение менее 15 минут) путем обработки клеток раствором фермента, имеющего протеолитическую активность (протеазы). В контексте изобретения клетки обычно открепляют от микроносителей в культуральном сосуде, который использовали для проведения последовательных пассажей клеток, что означает, что все фазы культивирования клеток и все обработки клеток, которые проводят в течение последовательных пассажей, осуществляют в одном и том же культуральном сосуде. Также, необязательно, можно открепить клетки от микроносителей после переноса их во второй сосуд, где проходит ферментативная обработка, и затем повторно внести полученную клеточную суспензию в первый культуральный сосуд, в котором проходят последовательные клеточные пассажи. Этот способ не является предпочтительным, поскольку он приводит к потере клеток в ходе проведения переноса.
Раствор протеолитического фермента обычно содержит сериновую протеазу, такую как трипсин, проназа® или диспаза®. Когда микроносителями являются микрошарики Cytodex 3, также можно использовать папаин, фицин или коллагеназу. Обычно для открепления адгезионных клеток от микрошариков CytodexTM используют раствор трипсина. Предпочтительно, чтобы протеаза была неживотного происхождения, то есть ее получают, используя способ, в котором не используется материал животного происхождения. Ее получают, например, с использованием растительного материала, химическим синтезом или генетической рекомбинацией с использованием бактерий, дрожжей, грибов или растений. Например, можно использовать раствор фермента, свободный от какого-либо продукта животного происхождения, продаваемый Invitrogen под торговым наименованием TrypLETM Select или TrypLETM Express. Эту протеазу, белковая последовательность которой описана в WO 94/25583, получают ферментацией штамма DSM 2672 Fusarium oxysporum или с помощью генетической рекомбинации. Она имеет ферментативную активность, аналогичную трипсину. Для облегчения открепления клеток к раствору фермента можно добавить хелатирующий агент, который связывает ионы кальция, такой как, например, EDTA, EGTA или цитрат, или, необязательно, адгезионные клетки можно обработать хелатирующим агентом перед проведением ферментативной обработки. Концентрация протеазы и, необязательно, хелатирующего агента а среде, а также температура, при которой проводят ферментативную обработку клеток (обычно между 20 и 38°C), задают таким образом, чтобы более 80% клеток открепились от своей подложки за короткий период времени (≤30 минут). Перед проведением самой ферментативной обработки обычно удаляют по меньшей мере половину объема культуральной среды. Обычно удаляют приблизительно 2/3 объема культуральной среды. Затем протеолитическую активность нейтрализуют добавлением в среду ингибитора обычно пептидной или белковой природы, который нейтрализует действие протеаз. Предпочтительно, чтобы композиция ингибитора была свободной от любого загрязнения животного происхождения. Этим ингибитором являются, например, рекомбинантный апротинин или экстракты очищенных фракций, содержащих трапсиновый ингибитор из соевых бобов или лимской фасоли (Worthington Biochemical). Среду обычно перемешивают на протяжении фазы открепления клеток от микроносителей, за исключением периода, в течение которого удаляют культуральную среду.
Количественную оценку полученной клеточной суспензии обычно проводят, используя обычные системы подсчета, с помощью которых также можно определить жизнеспособность клеток. Хотя часть клеточной популяции можно удалить из культурального сосуда при избыточном росте клеток, часто используют всю клеточную популяцию для инициации пассажа клеток, следующего за первым пассажем клеток, который проводят в том же сосуде. Для увеличения клеточной биомассы в течение последовательных пассажей необходимо ввести в культуральный сосуд в начале каждого пассажа клеток, следующего за первым пассажем клеток (который начинается после стадии открепления клеток с использованием ферментативной обработки), большее количество микроносителей, чем количество ранее внесенных микроносителей. Если в течение последовательных пассажей клеток поддерживают постоянный объем культуры, то это означает увеличение концентрации микроносителей на каждом клеточном пассаже, следующем за первым пассажем клеток. С другой стороны, в течение последовательных пассажей клеток можно поддерживать постоянную концентрацию микроносителей, если объем культуральной среды увеличивается в таком же соотношении на каждом новом клеточном пассаже. Весьма предпочтительно в начале каждого пассажа клеток, следующего за первым пассажем клеток, увеличивать как объем культуральной среды, так и концентрацию микроносителей, для того чтобы получить максимальную амплификацию клеток. Ориентировочно, на каждом новом клеточном пассаже клетки культивируют в объеме культуральной среды, который в 1,2-3 раза превышает объем, в котором клетки содержали в течение предшествующего пассажа. Аналогичным образом, на каждом новом клеточном пассаже концентрация микроносителей в культуральной среде в 2-10 раз превышает концентрацию, которая была в течение предшествующего пассажа клеток. В контексте настоящего изобретения обычно нецелесообразно удалять использованные микроносители в конце каждого пассажа клеток (то есть в конце стадии открепления клеток). Даже хотя указанные микроносители могут быть повторно колонизированы клетками, количество использованных микроносителей из предшествующих пассажей клеток обычно не учитывают при вычислении количества носителей, которые вносят в начале каждого нового пассажа клеток. Фаза прикрепления клеток на микроносители обычно длится от 1 до 10 часов в зависимости от типа клеток. После фазы прикрепления может быть предпочтительно удалить всю или часть культуральной среды после осаждения микроносителей, и заменить ее новой средой, для того чтобы ускорить пролиферацию клеток, прикрепленных к микроносителям.
Культуральной средой, подходящей для объекта изобретения, может быть стандартная среда для культивирования клеток с добавленной сывороткой животного происхождения. Предпочтительно, чтобы культуральная среда не содержала ни сыворотку, ни сывороточный белок. Культуральная среда, в частности, может быть свободна от любого белка животного происхождения или даже от любого продукта животного происхождения. Предполагается, что термин «белок или продукт животного происхождения» означает белок или продукт, способ получения которых включает в себя по меньшей мере одну стадию, в которой используют материал животного происхождения или человеческий материал. Особенно предпочтительно, чтобы среда, используемая для культивирования клеток, могла быть свободна от любого белка или могла содержать очень маленькое количество белков в виде рекомбинантных белков или белков, выделенных из растений (сои, риса и т.п.) или из дрожжей. Они наиболее часто включают низкомолекулярные белки (≤10 кДа) (также называемые полипептиды) в очень низкой концентрации. Общая концентрация белка в данной культуральной среде обычно составляет ≤15 мг/л по методу Бредфорд. В частности, это так для среды VP SFM, продаваемой InVitrogen, которая подходит для способа по изобретению, в частности, для культивирования клеток Vero. Также можно упомянуть бессывороточную среду Opti ProTM (InVitrogen), Episerf (InVitrogen), Ex-cell® MDCK (Sigma-Aldrich), Ex-CellTM Vero (SAFC biosciences), бессывороточную MP-BHK® (MP Biomedicals), бессывороточную SFC-10 BHK express (Promo cell), безбелковую SFC-20 BHK express (Promo cell), HyQ PF Vero (Hyclone ref. SH30352.02), Hyclone SFM4 Megavir, среду MDSS2 (Axcell biotechnology), модифицированную по Искову среду DMEM (Hyclone), питательную среду Хэма (Ham-F10, Ham-F12), среду Лейбовитца L-15 (Hyclone), среду Pro Vero (Lonza) и среду Power MDCK (Lonza), которые свободны от любого продукта животного происхождения и которые содержат мало белков или совсем не содержат их.
Когда культуральная среда свободна от животной сыворотки или сывороточного белка или имеет общую концентрацию белка <15 мг/л (по Брэдфорд), обычно добавляют клеточный протекторный агент, который защищает клетки от усилий сдвига, возникающих при перемешивании среды. Наиболее часто используемые клеточные протекторные агенты обычно имеют поверхностно-активные свойства. Ими, в частности, являются полимеры винилового спирта, также известные как поливиниловые спирты (ПВС), полимеры этиленгликоля, также известные как полиэтиленгликоли (ПЭГ), полимеры 1-винил-2-пирролидона, также известные как поливинилпирролидон (ПВП) или полоксамеры, которые представляют собой «блок-сополимеры» этиленоксида и пропиленоксида, имеющие формулу HO(C2H4O)a(C3H6O)b(C2H4O)aH, в которой а обозначает число этиленоксидных звеньев, а b обозначает число пропиленоксидных звеньев. Эти клеточные протекторные агенты обычно используют в диапазоне концентраций от 0,001% до 2% (вес/объем) в культуральной среде. Среди особенно предпочтительных клеточных протекторных агентов можно упомянуть полоксамер 188 и ПВР. Полоксамер 188 имеет средний моле