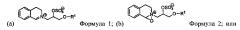Композиции, содержащие липазы, и способы обработки поверхности
Иллюстрации
Показать всеИзобретение относится к композициям, содержащим липазные ферменты и отбеливающие агенты, а также к способам получения и использованию таких композиций. Описан способ очистки ткани, или твердой поверхности, или другой поверхности при уходе за тканями и бытовом уходе, включающий стадии, на которых: (a) вводят в контакт поверхность с водным раствором, содержащим (i) липазу; и (ii) отбеливающий компонент и (iii) необязательное моющее вспомогательное вещество; (b) промывают и высушивают ткань или твердую поверхность; при этом липаза включает вариант родительской липазы, причем родительская липаза содержит аминокислотную последовательность с, по меньшей мере, 60% идентичностью со зрелым полипептидом SEQ ID NO: 1 и причем вариант липазы имеет аминокислотную последовательность с, по меньшей мере, 60% идентичностью со зрелым полипептидом SEQ ID NO: 1, или его фрагмент, имеющий липазную активность, причем указанный вариант содержит следующие замены: (a) G91A+D96G+T231R+N233R; (b) T37R+N39R+G91A+D96G+T231R+N233R; (c) G91A+D96G+G225R+T231R+N233R; или (d) G91A+D96G+A150G+T231R+N233R, соответствующие указанным положениям в зрелом полипептиде SEQ ID NO: 1, причем вариант имеет липазную активность. Технический результат - улучшенная стабильность к окислительному распаду. 3 н. и 20 з.п. ф-лы, 5 пр.
Реферат
Ссылка на перечень последовательностей
Данная заявка содержит Перечень последовательностей в компьютерно-читаемой форме, включенный путем ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям, содержащим липазные ферменты и отбеливающие агенты, а также способам получения и использования таких композиций, которые предпочтительно представляют собой продукты для ухода за тканями и бытового ухода.
Уровень техники
Производители моющих средств продолжают пытаться обеспечить композиции для очистки, в частности композиции для очистки тканей и посуды, которые обеспечивают наиболее надежные чистящие системы. В случае очистки липазными ферментами, они могут быть особенно подвержены окислению, особенно если такие ферменты вступают в контакт с отбеливателем при хранении или во время стадии мытья или обработки, либо оба включены в стадию мытья или обработки, или один или другой компонент перенесены со стадии предварительной обработки, в частности, например со стадии предварительной отбеливающей обработки. Это приводит к потере активности или эффективности композиции в целом, и, в частности, к потере ферментативной активности. Определенные отбеливающие компоненты особенно проблематичны, например, предварительно полученные перкислоты и отбеливающие катализаторы или ускорители. WO 2007/001262 относится к композициям для очистки, содержащим органические катализаторы с улучшенной совместимостью ферментов, особенно улучшенной совместимостью фермента амилазы. Остается потребность в композиции, которая облегчает эту проблему.
Сущность изобретения
В соответствии с настоящим изобретением представлен способ очистки и/или обработки ткани, твердой поверхности и/или другой поверхности для ухода за тканями и/или бытового ухода, включающий стадии, на которых:
а) вводят в контакт ткань, твердую поверхность и/или другую поверхность для ухода за тканями и/или бытового ухода с водным раствором, содержащим липазу; и (ii) отбеливающий компонент и (iii) необязательное моющее вспомогательное вещество;
b) промывают и высушивают ткань или твердую поверхность;
характеризующийся тем, что липаза имеет улучшенную стабильность к окислительному распаду по сравнению со зрелым полипептидом SEQ ID NO: 1 и липазную активность, предпочтительно вариант липазы содержит вариант липазы, содержащий замену в одном или более положениях, выбранных из группы положений, соответствующих Т37, N39 и G91, зрелого полипептида SEQ ID ΝΟ: 1. Настоящее изобретение также представляет способ получения композиции моющего средства, содержащей вариант липазы, проявляющий улучшенную стабильность к окислительному распаду по сравнению с вариантом липазы SEQ ID NO: 1, и липазную активность, при этом способ включает стадию, на которой смешивают вариант липазы с моющим вспомогательным веществом. Предпочтительно вариант липазы представляет собой вариант SEQ ID NO: 1, содержащий замену в одном или более положениях, выбранных из группы положений, соответствующих Т37, N39 и G91, зрелого полипептида SEQ ID ΝΟ: 1. В соответствии с дополнительным аспектом настоящего изобретения представлена композиция, содержащая вариант липазы, имеющий липазную активность и проявляющий улучшенную стабильность к окислительному распаду, и моющее вспомогательное вещество. Настоящее изобретение также представляет композицию для очистки и/или обработки, содержащую вариант липазы, имеющий липазную активность и содержащий замену в одном или более положениях, выбранных из группы положений, соответствующих Т37, N39 и G91, зрелого полипептида SEQ ID ΝΟ: 1, и моющее вспомогательное вещество. Может быть предпочтительным, чтобы композиции также содержали отбеливающий компонент.
В соответствии с дополнительным аспектом настоящего изобретения представлен способ получения композиции моющего средства, содержащей липазу и проявляющей улучшенную стабильность к окислительному распаду, включающий стадию, на которой смешивают вариант липазы, содержащий замену в одном или более положениях, выбранных из группы положений, соответствующих Т37, N39 и G91, зрелого полипептида SEQ ID NO: 1, при этом вариант имеет липазную активность, с моющим вспомогательным веществом.
Вариант липазы, проявляющий улучшенную стабильность к окислительному распаду, может быть определен при помощи следующего теста в Примере 1. Варианты липазы, проявляющие улучшенную стабильность к окислительному распаду, имеют RРмытья, по меньшей мере, 1,01, или, по меньшей мере, 1,2 или даже, по меньшей мере, 1,5. Традиционная липаза для сравнения представляет собой липазу с SEQ ID ΝΟ: 1.
Подробное описание изобретения
Определения
Если не указано иное, все уровни компонентов или композиций относятся к активной части такого компонента или композиции и не включают примеси, например, остаточные растворители или побочные продукты, которые могут присутствовать в коммерчески доступных источниках таких компонентов или композиций.
Все процентные содержания и соотношения (1) рассчитаны по массе, если не указано иное, и (2) рассчитаны, исходя из общей массы композиции, если не указано иное.
Как используют в данной заявке, формы единственного числа при использовании в формуле изобретения подразумевают один или более заявленных или описанных объектов.
Как используют в данной заявке, термины «включают», «включает» и «включая» подразумевают как неограничивающие.
Как используют в данной заявке, термин «твердый» включает гранулированную, порошкообразную, стержневидную и таблетированную формы продукта.
Как используют в данной заявке, термин «жидкость» включает жидкие, гелеобразные, пастообразные и газообразные формы продуктов.
Как используют в данной заявке, термин «липаза» или «липолитический фермент» или «липидная эстераза» представляет собой фермент в классе ЕС 3.1.1 как определено Enzyme Nomenclature. Он может иметь липазную активность (триацилглицерол липаза, ЕС 3.1.1.3), кутиназную активность (ЕС 3.1.1.74), стеролэстеразную активность (ЕС 3.1.1.13) и/или воск-сложноэфирную гидролазную активность (ЕС 3.1.1.50). Для целей в соответствии с настоящим изобретением, липазную активность определяют в соответствии с процедурой, описанной в Примерах. В одном аспекте, варианты в соответствии с настоящим изобретением имеют, по меньшей мере, 20%, например, по меньшей мере, 25%, по меньшей мере, 30%, по меньшей мере, 35%, по меньшей мере, 40%, по меньшей мере, 45%, по меньшей мере, 50%», по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%», или, по меньшей мере, 100%) липазной активности зрелого полипептида SEQ ID ΝΟ: 1.
Как используют в данной заявке, термин «аллельный вариант» означает любую из двух или более альтернативных форм гена, занимающих один и тот же хромосомный локус. Аллельная вариация возникает в природе за счет мутации, и может в результате приводить к полиморфизму в популяциях. Генные мутации могут быть молчащими (без изменений в кодируемом полипептиде) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант полипептида является полипептидом, кодируемым аллельным вариантом гена.
Как используют в данной заявке, термин «кДНК» означает молекулу ДНК, которая может быть получена путем обратной транскрипции из зрелой сплайсированной молекулы мРНК, полученной из эукариотической или прокариотической клетки. кДНК не содержит интронные последовательности, которые могут присутствовать в соответствующей геномной ДНК. Исходный, первичный РНК транскрипт является предшественником мРНК, который обрабатывается с помощью серий стадий, включая сплайсинг, перед появлением в виде зрелой сплайсированной мРНК.
Как используют в данной заявке, термин «кодирующая последовательность» означает полинуклеотид, который непосредственно определяет аминокислотную последовательность варианта. Границы кодирующей последовательности, как правило, определяют при помощи открытой рамки считывания, которая начинается с инициирующего кодона, такого как ATG, GTG или TTG и заканчивается терминирующим кодоном, таким как ТАА, TAG или TGA. Кодирующая последовательность может быть геномной ДНК, кДНК, синтетической ДНК или их комбинацией.
Как используют в данной заявке, термин «контрольные последовательности» означает последовательности нуклеиновых кислот, необходимые для экспрессии полинуклеотида, кодирующего вариант в соответствии с настоящим изобретением. Каждая контрольная последовательность может быть нативной (то есть, из того же гена) или чужеродной (то есть, из другого гена) к полинуклеотиду, кодирующему вариант, или нативной или чужеродной друг к другу. Такие контрольные последовательности включают, но не ограничиваясь приведенным, лидерную, полиаденилированную последовательность, пропептидную последовательность, промотор, сигнальную пептидную последовательность и транскрипционный терминатор. Как минимум, контрольные последовательности включают промотор и транскрипционные и трансляционные стоп сигналы. Контрольные последовательности могут быть обеспечены линкерами с целью введения специфических сайтов рестрикции, облегчающих лигирование контрольных последовательностей с кодирующей областью полинуклеотида, кодирующего вариант.
Как используют в данной заявке, термин «экспрессия» включает любую стадию, вовлеченную в продуцирование варианта, включая, но не ограничиваясь приведенным, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Как используют в данной заявке, термин «вектор экспрессии» означает молекулу линейной или циклической ДНК, которая содержит полинуклеотид, кодирующий вариант, и функционально связана с контрольными последовательностями, которые обеспечивают ее экспрессию.
Как используют в данной заявке, термин «фрагмент» означает полипептид, имеющий одну или более (например, несколько) аминокислот, удаленных с аминного и/или карбоксильного конца зрелого полипептида; при этом фрагмент имеет липазную активность. В одном аспекте, фрагмент содержит, по меньшей мере, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, и, по меньшей мере, 95% количества аминокислот зрелого полипептида.
Как используют в данной заявке, термин «условия высокой строгости» означает для зондов, по меньшей мере, 100 нуклеотидов в длину, предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл резаной и денатурированной ДНК из молок лососевых, и 50%» формамида, в соответствии со стандартными процедурами саузерн-блоттинга в течение от 12 до 24 часов. Материал-носитель окончательно промывают три раза, каждый в течение 15 минут с использованием 2Х SSC, 0,2% SDS при 65°С.
Как используют в данной заявке, термин «клетка-хозяин» означает любой тип клетки, который является восприимчивым к трансформации, трансфекции, трансдукции, или подобным с конструктом нуклеиновой кислоты или вектором экспрессии, содержащим полинуклеотид в соответствии с настоящим изобретением. Термин «клетка-хозяин» охватывает любое потомство родительской клетки, которое не является идентичным родительской клетке из-за мутаций, которые происходят во время репликации.
Как используют в данной заявке, термин «улучшенное свойство» означает характеристику, связанную с вариантом, который является улучшенным по сравнению с родительским. Такие улучшенные свойства включают улучшенную производительность в присутствии органического катализатора. В некоторых предпочтительных воплощениях настоящее изобретение относится к композиции или способу, в котором вариант имеет улучшенную стабильность к органическому катализатору, выбранному из группы, состоящей из органических катализаторов, имеющих следующие формулы:
их смесей, где каждый R1 независимо представляет собой разветвленную алкильную группу, содержащую от 3 до 24 атомов углерода, или линейную алкильную группу, содержащую от 1 до 24 атомов углерода, в частности, где R представляет собой 2-бутилоктил, и предпочтительно улучшенная стабильность существует в присутствии Формулы 2, в которой R представляет собой 2-бутилоктил.
Как используют в данной заявке, термин «выделенный» означает вещество в форме или среде, которые не встречаются в природе. Неограничивающие примеры выделенных веществ включают (1) любое не встречающееся в природе вещество, (2) любое вещество, включая, но не ограничиваясь приведенным, любой фермент, вариант, нуклеиновую кислоту, белок, пептид или кофактор, которое, по меньшей мере, частично удалено из одного или более или всех составляющих, встречающихся в природе, с которым оно связано в природе; (3) любое вещество, модифицированное рукою человека относительно этого вещества, найденного в природе; или (4) любое вещество, модифицированное путем увеличения количества вещества по отношению к другим компонентам, с которыми оно природно связано (например, множество копий гена, кодирующего вещество; использование более сильного промотора, чем промотор, природно связанный с геном, кодирующим вещество). Выделенное вещество может присутствовать в пробе ферментационного бульона.
Как используют в данной заявке, термин «условия низкой строгости» означает для зондов, по меньшей мере, 100 нуклеотидов в длину, предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл резаной и денатурированной ДНК из молок лососевых, и 25% формамида, в соответствии со стандартными процедурами саузерн-блоттинга в течение от 12 до 24 часов. Материал-носитель окончательно промывают три раза, каждый в течение 15 минут с использованием 2Х SSC, 0,2% SDS при 50°С.
Как используют в данной заявке, термин «зрелый полипептид» означает полипептид в его конечной форме после трансляции и любых посттрансляционных модификаций, таких как N-терминальный процессинг, С-терминальное усечение, гликозирование, фосфорилирования и т.д. В одном аспекте, зрелый полипептид представляет собой аминокислоты от 1 до 269 SEQ ID NO: 1.
Как используют в данной заявке, термин «условия средней строгости» означает для зондов, по меньшей мере, 100 нуклеотидов в длину, предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл разаной и денатурированной ДНК из молок лососевых, и 35% формамида, в соответствии со стандартными процедурами саузерн-блоттинга в течение от 12 до 24 часов. Материал-носитель окончательно промывают три раза, каждый в течение 15 минут с использованием 2Х SSC, 0,2% SDS при 55°С.
Как используют в данной заявке, термин «условия средней-высокой строгости» означает для зондов, по меньшей мере, 100 нуклеотидов в длину, предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл резаной и денатурированной ДНК из молок лососевых, и либо 35% формамида, в соответствии со стандартными процедурами саузерн-блоттинга в течение от 12 до 24 часов. Материал-носитель окончательно промывают три раза, каждый в течение 15 минут с использованием 2Х SSC, 0,2% SDS при 60°С.
Как используют в данной заявке, термин «мутант» означает полинуклеотид, кодирующий вариант.
Как используют в данной заявке, термин «конструкт нуклеиновой кислоты» означает молекулу нуклеиновой кислоты, или одно- или двухцепочечную, которая выделена из гена, встречающегося в природе, или модифицирована, чтобы содержать сегменты нуклеиновых кислот таким образом, чтобы иначе они не могли бы существовать в природе, или которая является синтетической, содержащей один или более контрольных последовательностей.
Как используют в данной заявке, термин «функционально связанный» означает конфигурацию, в которой контрольная последовательность расположена в соответствующем положении по отношению к кодирующей последовательности полинуклеотида, таким образом, что контрольная последовательность направляет экспрессию кодирующей последовательности.
Как используют в данной заявке, термин «родитель» или «родительская липаза» означает липазу, в которой изменение производится для получения вариантов фермента в соответствии с настоящим изобретением. Родитель может быть полипептидом (дикого типа), встречающимся в природе, или его вариантом или фрагментом.
Идентичность последовательностей: Сходство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается параметром «идентичность последовательностей». Для целей настоящего изобретения, идентичность последовательностей между двумя аминокислотными последовательностями определяют, используя алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453) как выполнено в Needle программе EMBOSS пакета (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 5.0.0 или более поздней. Использованными параметрами являются штраф на внесение делеции в выравнивание 10, штраф на продолжение делеции 0,5 и EBLOSUM62 (EMBOSS версии BLOSUM62) постановочная матрица. Результаты выполнения Needle, обозначенные «самая длинная идентичность» (полученная, используя - опцию без замечаний), используют как процентную идентичность и рассчитывают следующим образом:
(Идентичные остатки × 100)/(Длина выравнивания - Общее количество делеций в выравнивании)
Для целей настоящего изобретения, идентичность последовательностей между двумя дезоксирибонуклеотидными последовательностями определяют, используя алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, ранее) как выполнено в Needle программе EMBOSS пакета (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, ранее), предпочтительно версии 5.0.0 или более поздней. Использованными параметрами являются штраф на внесение делеции в выравнивание 10, штраф на продолжение делеции 0,5 и EDNAFULL (EMBOSS версии NCBI NUC4.4) постановочная матрица. Результаты выполнения Needle, обозначенные «самая длинная идентичность» (полученная, используя - опцию без замечаний), используют как процентную идентичность и рассчитывают следующим образом:
(Идентичные дезоксирибонуклеотиды × 100)/(Длина выравнивания - Общее количество делеций в выравнивании)
Как используют в данной заявке, термин «подпоследовательность» означает полинуклеотид, имеющий один или более (например, несколько) нуклеотидов, удаленных с 5' и/или 3' конца последовательности, кодирующей зрелый полипептид; при этом подпоследовательность кодирует фрагмент, имеющий липазную активность. В одном аспекте, подпоследовательность содержит, по меньшей мере, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, и, по меньшей мере, 95% количества нуклеотидов последовательности, кодирующей зрелый полипептид.
Как используют в данной заявке, термин «вариант» означает полипептид, имеющий липазную активность, содержащий замену в одном или более (например, нескольких) положениях. Замена означает замену аминокислоты, занимающей положение, на отличающуюся аминокислоту. Варианты в соответствии с настоящим изобретением имеют, по меньшей мере, 20%, например, по меньшей мере, 25%, по меньшей мере, 30%, по меньшей мере, 35%, по меньшей мере, 40%, по меньшей мере, 45%, по меньшей мере, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, или, по меньшей мере, 100% липазной активности зрелого полипептида SEQ ID NO: 1.
Как используют в данной заявке, термин «условия очень высокой строгости» означает для зондов, по меньшей мере, 100 нуклеотидов в длину, предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл резаной и денатурированной ДНК из молок лососевых, и 50% формамида, в соответствии со стандартными процедурами саузерн-блоттинга в течение от 12 до 24 часов. Материал-носитель окончательно промывают три раза, каждый в течение 15 минут с использованием 2Х SSC, 0,2% SDS при 70°С.
Как используют в данной заявке, термин «условия очень низкой строгости» означает для зондов, по меньшей мере, 100 нуклеотидов в длину, предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл резаной и денатурированной ДНК из молок лососевых, и 25% формамида, в соответствии со стандартными процедурами саузерн-блоттинга в течение от 12 до 24 часов. Материал-носитель окончательно промывают три раза, каждый в течение 15 минут с использованием 2Х SSC, 0,2% SDS при 45°С.
Как используют в данной заявке, термин липаза «дикого типа» означает липазу, экспрессируемую микроорганизмом, встречающимся в природе, таким, как бактерия, дрожжи или мицелиальный гриб, встречающийся в природе.
Правила для обозначения вариантов
Для целей настоящего изобретения, зрелый полипептид, раскрытый в SEQ ID NO: 1, используют для определения соответствующего аминокислотного остатка в другой липазе. Аминокислотную последовательность другой липазы выравнивают со зрелым полипептидом, раскрытым в SEQ ID ΝΟ:1, и, исходя из выравнивания, номер положения аминокислоты, соответствующий любому аминокислотному остатку в зрелом полипептиде, раскрытом в SEQ ID NO: 1определяют, используя алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который выполняется в Needle программе EMBOSS пакета (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версия 5.0.0 или более поздняя. Использованными параметрами являются штраф на внесение делеции в выравнивание 10, штраф на продолжение делеции 0,5 и EBLOSUM62 (EMBOSS версия BLOSUM62) постановочная матрица.
Идентификация соответствующего аминокислотного остатка в другой липазе может быть определена путем выравнивания множественных полипептидных последовательностей, используя несколько компьютерных программ, включая, но не ограничиваясь приведенным, MUSCLE (сравнение множественных последовательностей путем log-ожидания; версия 3.5 или более поздняя; Edgar, 2004, Nucleic Acids Research 32: 1792-1797), MAFFT (версия 6.857 или более поздняя; Katoh and Kuma, 2002, Nucleic Acids Research 30: 3059-3066; Katoh et al., 2005, Nucleic Acids Research 33: 511-518; Katoh and Toh, 2007, Bioinformatics 23: 372-374; Katoh et al., 2009, Methods in Molecular Biology 537: 39-64; Katoh and Toh, 2010, Bioinformatics 26: 1899-1900). и EMBOSS EMMA с использованием ClustalW (1.83 или более поздняя; Thompson et al., 1994, Nucleic Acids Research 22: 4673-4680), используя их соответствующие параметры умолчания.
Если другой фермент отличался от зрелого полипептида SEQ ID ΝΟ: 1 таким образом, что сравнение основывалось на традиционной последовательности дает сбой при обнаружении их взаимосвязи (Lindahl and Elofsson, 2000, J. Mol Biol. 295: 613-615), то могут быть использованы другие алгоритмы сравнения последовательностей попарно. Большая чувствительность поиска на основе последовательностей может быть достигнута используя программы поиска, которые используют вероятностные представления семейств полипептидов (профилей) для поиска по базам данных. Например, PSI-BLAST программа генерирует профили за счет итеративного процесса поиска по базе данных и является способной к обнаружениию отдаленных гомологов (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще большая чувствительность может быть достигнута, если семейство или суперсемейство для полипептида имеет один или более представителей в базах данных структуры белка. Программы, такие как GenTHREADER (Jones, 1999, J. Mol Biol. 287: 797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881) используют информацию из множества источников (PSI-BLAST, прогнозирование вторичной структуры, профили структурного выравнивания и возможности сольватации), как входящие данные в нейронной сети, что предсказывает структурную складку для запрашиваемой последовательности. Аналогично, способ Gough et al., 2000, J. Mol. Biol. 313: 903-919, может быть использован для выравнивания последовательности неизвестной структуры с моделями суперсемейства, представленными в базе данных SCOP. Эти выравнивания могут быть в свою очередь использованы, чтобы сгенерировать гомологичные модели для полипептида и такие модели могут быть оценены на правильность использования множества инструментов, разработанных для такой цели.
Для белков известной структуры, некоторые инструменты и ресурсы являются доступными для восстановления и генерирования структурных выравниваний. Например, SCOP суперсемейства белков были структурно выравнены и такие выравнивания являются доступными и загружаемыми. Две или более белковые структуры могут быть выравнены, используя множество алгоритмов, таких как матрица выравнивания расстояния (Holm and Sander, 1998, Proteins 33: 88-96) или комбинаторное удлинение (Shindyalov and Bourne, 1998, Protein Engineering 11: 739-747), и внедрение этих алгоритмов может дополнительно быть использовано в базах данных запрашиваемой структуры со структурой, представляющей интерес, для обнаружения возможных структурных гомологов (например, Holm and Park, 2000, Bioinformatics 16: 566-567).
В описании вариантов в соответствии с настоящим изобретением, описанная ниже номенклатура адаптирована для легкости ссылки. Применяют приемлемые однобуквенные или трехбуквенные аббревиатуры аминокислот IUPAC.
Замены. Для аминокислотной замены используют следующую номенклатуру: исходная аминокислота, положение, замещенная аминокислота. Соответственно, замена треонина в положении 226 на аланин обозначают как «Thr226Ala» или «Т226А». Множественные мутации разделены путем добавления отметок («+»), например, «Gly205Arg+Ser41 lPhe» или «G205R+S411F», представляющие замены в положениях 205 и 411 глицина (G) на аргинин (R) и серина (S) на фенилаланин (F), соответственно.
Множественные замены. Варианты, содержащие множественные замены, разделены путем добавления отметок («+»), например, «Argl70Tyr+Glyl95Glu» или «R170Y+G195E», представляющие замену аргинина и глицина в положениях 170 и 195 на тирозин и глутаминовую кислоту, соответственно.
Различные замены. Когда различные изменения могут быть введены в положение, различные изменения разделяют запятой, например, «Arg170Tyr,Glu» или «R170Y,E» представляет замену аргинина в положении 170 на тирозин или глутаминовую кислоту. Таким образом, «Tyr167Gly,Ala+Arg170Gly,Ala» обозначает следующие варианты: «Tyr167Gly+Arg170Gly», «Tyr167Gly+Arg170Ala», «Tyr167Ala+Arg170Gly» и «Tyr167Ala+Arg170Ala».
Варианты липазы
Для достижения стабильности к окислительному распаду варианта липазы, определяют значение относительной производительности (RРмытья), т.е. производительность мытья (Р) варианта липазы для тестирования, и делят на производительность мытья липазы SEQ ID NO: 1. Таким образом, RРмытья = Р(вариант липазы в соответствии с настоящим изобретением) / P(SEQ ID NO: 1 липазы). Варианты липазы, имеющие улучшенную стабильность к окислительному распаду, будут иметь значение RРмытья, по меньшей мере, 1,01, предпочтительно, по меньшей мере, 1,1, или даже, по меньшей мере, 1,5.
Вариант липазы, приемлемый для использования в настоящем изобретении, содержит замену в одном или более положениях, выбранных из группы положений, соответствующих Т37, N39 и G91. Предпочтительно вариант липазы представляет собой выделенный вариант липазы. Приемлемые варианты липазы для использования в настоящем изобретении предпочтительно содержат замену в одном или более (например, нескольких) положениях, соответствующих положениям T37A,D,E,F,G,H,I,L,N,P,Q,R,S,V,W,Y, N39A,C,D,E,F,G,I,K,L,M,P,Q,R,T,V,W,Y и G91D,H,I,P,Q или даже G91A зрелого полипептида SEQ ID ΝΟ: 1, где вариант имеет липазную активность. Наиболее предпочтительно такое одно или более замен объединяют с одним, предпочтительно обоими из T231R и N233R.
Предпочтительно вариант имеет идентичность последовательности, по меньшей мере, 60%, например, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, или, по меньшей мере, 99%, но менее, чем 100%, с аминокислотной последовательностью родительской липазы.
В другом воплощении, вариант имеет, по меньшей мере, 60%, например, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%, по меньшей мере, 95%, например, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, или, по меньшей мере, 99%, но менее, чем 100%, идентичности последовательности со зрелым полипептидом SEQ ID NO: 1.
В одном аспекте, количество замен в вариантах в соответствии с настоящим изобретением составляет 1-20, например, 1-10 и 1-5, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 замен.
В другом аспекте, вариант содержит замену в одном или более (например, нескольких) положениях, соответствующих положениям T37A,D,E,F,G,H,I,L,N,P,Q,R,S,V,W,Y, N39A,C,D,E,F,G,I,K,L,M,P,Q,R,T,V,W,Y и G91D,H,I,P,Q зрелого полипептида SEQ ID ΝΟ:1. В другом аспекте, вариант содержит изменение в двух положениях, соответствующих любому из положений T37A,D,E,F,G,H,I,L,N,P,Q,R,S,V,W,Y, N39A,C,D,E,F,G,I,K,L,M,P,Q,R,T,V,W,Y и G91D,H,I,P,Q зрелого полипептида SEQ ID ΝΟ:1. В другом аспекте, вариант содержит изменение в трех положениях, соответствующих любому из положений T37A,D,E,F,G,H,I,L,N,P,Q,R,S,V,W,Y, N39A,C,D,E,F,G,I,K,L,M,P,Q,R,T,V,W,Y и G91D,H,I,P,Q зрелого полипептида SEQ ID NO: 1.
В другом аспекте, вариант содержит или состоит из замены ия в положении, соответствующем положению Т37 зрелого полипептида SEQ ID ΝΟ: 1, которое замещено на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val., предпочтительно на Ala, Arg, Asn, Asp, Gln, Glu, Gly, His, Ile, Leu, Phe, Pro, Ser, Trp, Tyr или Val. В другом аспекте, вариант содержит или состоит из замены Т37А, T37D, Т37Е, T37F, T37G, Т37Н, T37I, T37L, T37N, Т37Р, T37Q, T37R, T37S, T37V, T37W или T37Y зрелого полипептида SEQ ID NO: 1.
В другом аспекте, вариант содержит или состоит из замены в положении, соответствующем положению N39 зрелого полипептида SEQ ID NO: 1, которое замещено на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val., предпочтительно на Ala, Arg, Asp, Cys, Gln, Glu, Gly, Ile, Leu, Lys, Met, Phe, Pro, Thr, Trp, Tyr или Val. В другом аспекте, вариант содержит или состоит из замены N39A, N39C, N39D, N39E, N39F, N39G, N391, N39K, N39L, N39M, N39P, N39Q, N39R, N39T, N39V, N39W, N39Y зрелого полипептида SEQ ID NO: 1.
В другом аспекте, вариант содержит или состоит из замены в положении, соответствующем положению G91, зрелого полипептида SEQ ID ΝΟ: 1, которое замещено на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val., предпочтительно на Asp, Gln, His, Ile или Pro. В другом аспекте, вариант содержит или состоит из замены G91D, G91H, G91I, G91P, G91Q зрелого полипептида SEQ ID ΝΟ: 1. В предпочтительном аспекте вариант содержит или состоит из замены в положении, соответствующем G91, которое представляет собой G91A.
В другом аспекте, вариант содержит или состоит из замен в положениях, соответствующих положениям Т37 и N39, например таким, как описано выше.
В другом аспекте, вариант содержит или состоит из замен в положениях, соответствующих положениям Т37 и G91, например таким, как описано выше.
В другом аспекте, вариант содержит или состоит из замен в положениях, соответствующих положениям N39 и G91, например таким, как описано выше.
В другом аспекте, вариант содержит или состоит из замен в положениях, соответствующих положениям Т37, N39 и G91, например таким, как описано выше.
Варианты могут дополнительно включать одно или более дополнительных замен в одном или более (например, нескольких) других положениях.
Замены аминокислот могут иметь незначительный характер, что является консервативными заменами аминокислот или инсерциями, которые существенно не влияют на складывание и/или активность белка; небольшие делении, обычно 1-30 аминокислот; небольшие удлинения амино- или карбоксильного конца, такого как амино-концевой остаток метионина; небольшие остатки линкерного пептида до 20-25; или небольшое удлинение, которое облегчает очистку путем изменения суммарного заряда или другой функции, такой как полигистидиновый тракт, антигенный эпитоп или связывающий домен.
Примеры консервативных замен находятся в пределах групп основных аминокислот (аргинин, лизин и гистидин), кислых аминокислот (глутаминовая кислота и аспарагиновая кислота), полярных аминокислот (глутамин и аспарагин), гидрофобных аминокислот (лейцин, изолейцин и валин), ароматических аминокислот (фенилаланин, триптофан и тирозин) и небольших аминокислот (глицин, аланин, серии, треонин и метионин).
Альтернативно, замены аминокислот имеют такую природу, что физико-химические свойства полипептидов изменены. Например, аминокислотные изменения могут улучшить термическую стабильность полипептида, изменить субстратную специфичность, изменить рН оптимум и т.п.
Например, варианты могут содержать замену в положении, соответствующем положениям D96, Т143, А150, Е210, G225, Т231, N233 и Р250 зрелого полипептида SEQ ID NO: 1. В некоторых воплощениях замену выбирают из D96G, Т143А, A150G, E210Q, G225R, T231R, N233R и P250R.
В предпочтительном воплощении вариант липазы для использования в настоящем изобретении относится к вариантам, выбранным из:
Незаменимые аминокислоты в полипептиде могут быть определены в соответствии с процедурами, известными в данной области техники, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез (Cunningham and Wells, 1989, Science 244: 1081-1085). В последнем способе, одиночные аланиновые мутации вводят в каждый остаток в молекуле, и полученные в результате мутантные молекулы тестируют на липазную активность для идентификации аминокислотных остатков, которые являются критическими для активности молекулы. См. также, Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Активный сайт фермента или другое биологическое взаимодействие может быть также определено с помощью физического анализа структуры, как определено с помощью таких методов, как ядерный магнитный резонанс, кристаллография, дифракция электронов или фотоаффинное мечение, в сочетании с мутацией предполагаемого контактного сайта аминокислот.См., например, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, J. Mol. Biol. 224: 899-904; Wlodaver et al., 1992, FEBS Lett. 309: 59-64, Идентичность незаменимых аминокислот, также может быть выведена из выравнивания с родственным полипептидом.
Варианты могут состоять из, по меньшей мере, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, и, по меньшей мере, 95% количества аминокислот зрелого полипептида.
В воплощении, вариант имеет улучшенную производительность, в частности в присутствии отбеливающего компонента. Предпочтительные варианты имеют улучшенную производительность в присутствии органического катализатора, выбранного из группы, состоящей из органических катализаторов, имеющих следующие формулы:
их смесей, где каждый R1 независимо представляет собой разветвленную алкильную группу, содержащую от 3 до 24 атомов углерода, или линейную алкильную группу, содержащую от 1 до 24 атомов углерода; и восстанавливают вариант.
В некоторых воплощениях R1 независимо представляет собой разветвленную алкильную группу, содержащую от 8 до 18 атомов углерода, или линейную алкильную группу, содержащую от 8 до 18 атомов углерода.
В некоторых воплощениях R1 независимо выбирают из группы, состоящей из 2-пропилгептила, 2-бутилоктила, 2-пентилнонила, 2-гексилдецила, н-додецила, н-тетрадецила, н-гексадецила, н-октадецила, изо-нонила, изо-децила, изо-тридецила и изо-пентадецила. Предпочтительно R1 выбирают из группы, состоящей из 2-бутилоктила, 2-пентилнонила, 2-гексилдецила, изо-тридецила и изо-пентадецила. Предпочтительные варианты имеют улучшенную производительность в присутствии катализатора формулы Ь), в которой R представляет собой 2-бутилоктил.
Родительские липазы
Родительская липаза может быть полипептидом с, по меньшей мере, 60% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 1.
В аспекте, родитель имеет идентичность последовательностей со зрелым полипептидом SEQ ID NO: 1, по меньшей мере, 60%, например, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99%, или 100%, который имеет липазную активность. В одном аспекте, аминокислотная последовательность родителя отличается на не более, чем 20 аминокислот, например,