Способ получения 2-этилгексаноата никеля
Иллюстрации
Показать всеИзобретение относится к области синтеза органических солей металлов и может быть использовано для получения 2-этилгексаноата никеля, который применяется как катализатор органических реакций, компонент топлива, стабилизатор или модифицирующая добавка, а также в микроэлектронике. Способ получения солей 2-этилгексаноата никеля заключается во взаимодействии алифатической карбоновой кислоты с водным раствором аммиака, взятых в эквимолекулярном соотношении, в водной фазе при температуре 20-65°С в течение 20-60 мин с получением растворимой в воде аммонийной соли карбоновой кислоты на первой стадии, введения водного раствора хлорида металла к раствору аммонийной соли карбоновой кислоты на второй стадии, экстракцией образовавшейся соли металла алифатической карбоновой кислоты органическим растворителем, отличающийся тем, что в качестве алифатической карбоновой кислоты используют 2-этилгексановую кислоту, а в качестве хлорида металла - хлорид никеля, органического растворителя - бензол, гексан, хлороформ, петролейный эфир фракции 40-70°С или бензиновые фракции с температурой кипения 40-100°С, а процесс взаимодействия раствора хлорида никеля и раствора 2-этилгексаната аммония проводят при температуре 20-30°С в течение 1-2 часа, хлорид никеля берут в эквивалентном соотношении к 2-этилгексановой кислоте, равным 1,2-1,3:1, массовый расход органического растворителя для экстракции 2-этилгексаноата никеля составляет 1,2-1,5:1 по отношению к исходной 2-этилгексановой кислоте. Технический результат: увеличение выхода целевого продукта, упрощение процесса. 5 з.п. ф-лы, 16 пр., 1 табл.
Реферат
Изобретение относится к области синтеза органических солей металлов, а именно 2-этилгексаноата никеля.
2-этилгексаноат никеля применяется как катализатор органических реакций, компонент топлива, стабилизатор или модифицирующая добавка в производстве полимерных материалов, а также это соединение используется в микроэлектронике.
Известен способ получения 2-этилгексаноатов металлов методом электрохимического синтеза [патент RU 2137751, кл. С07С 51/41, С07С 53/126, опубл. 20.09.1999]. Способ заключается во взаимодействии соответствующего металла, выбранного из группы, включающей Ва, Sr, с 2-этилгексановой кислотой, используя в качестве растворителя алифатический спирт, или металла, выбранного из группы, включающей Pb, Bi, электрохимическим растворением анода из соответствующего металла в алифатическом спирте в присутствии 2-этилгексановой кислоты. Выпавшие осадки отделяют фильтрованием и десольватацией в вакууме при температуре до 100°C с получением целевых продуктов. Из недостатков метода можно выделить использование в качестве растворителей алифатических спиртов и их большой расход.
Из электрохимических способов получения 2-этилгексаноатов металлов можно также выделить способ получения 2-этилгексаноатов металлов с использованием анионообменной мембраны [патент RU 2127250, кл. С07С 51/41, С07С 53/126, С25В 3/12, опубл. 10.03.1999]. Сущность способа состоит в том, что происходит анодное растворение соответствующих металлов в органическом растворителе в присутствии 2-этилгексановой кислоты и аммонийной соли 2-этилгексановой кислоты, которая выступает в качестве электропроводной добавки. Процесс осуществляют в электролизере с анионообменной мембраной, в качестве растворителя используют метанол, а и процесс проводят при периодическом добавлении 2-этилгексановой кислоты по мере ее расходования. Недостатками является использование большого количества метанола в качестве растворителя.
Известен способ получения 2-этилгексаноатов щелочноземельных металлов [патент ЕР 0086362, кл. С07С 51/41, опубл. 18.03.1987] путем взаимодействия соответствующих кислот с оксидами и гидроксидами металлов. В результате интенсивной экзотермической реакции получается спек, который затем подвергают помолу. Недостатками известного способа, несмотря на его дешевизну, является то, что полученный продукт загрязнен остатками непрореагировавших оксида или гидроксида металла, а также невозможность применения этого способа для получения 2-этилгексанатов многовалентных металлов.
Известен также метод получения растворимых в органических растворителях солей 2-этилгексановой кислоты [патент US 2584041, кл. С07С 51/41, опубл. 29.01.1952]. Метод заключается во взаимодействии порошков свинца, кобальта, марганца, железа, меди, цинка и никеля, а также некоторых других металлов с алифатическими кислотами при нагревании и интенсивном перемешивании в присутствии существенного количества воды и кислорода. В качестве растворителей используют обычно высококипящие неполярные органические растворители, не смешивающиеся с водой. После завершения реакции воду отгоняют из реакционной смеси, растворы фильтруют от возможных остатков не вступившего в реакцию металла. Соли, как правило, не выделяют, конечными продуктами являются растворы солей в каком-либо органическом растворителе. Недостатками способа является использование большого избытка кислоты (до 25% по весу), медленное протекание реакции с большими индукционными периодами, необходимость введения очень большого количества воды и очень большой расход кислорода. В дальнейшем этот метод был модифицирован с использованием катализаторов - солей аммония [патент ЕР 0512342, кл. C12N 15/09; C12Q 1/68, опубл. 16.06.1993] или щелочных металлов [патент ЕР 0094760, кл. B01J 23/04; B01J 27/00; B01J 31/00; B01J 31/04; С07В 61/00; С07С 51/00; С07С 51/41; С07С 53/126; С07С 67/00; C09D 9/00; C10L 1/188; С10М 129/40, опубл. 20.03.1984], что позволило снизить содержание кислоты в конечном продукте, а также необходимое для реакции количество воды и расход кислорода и повысить эффективность процессов растворения металлов. Из недостатков этих методов стоит отметить содержание в растворах примесей либо катиона, либо катионов щелочных металлов, что исключает использование их в микроэлектронике.
Наиболее близким по своей технической сущности и достигаемому эффекту является способ получения солей карбоновых кислот путем взаимодействия алифатической карбоновой кислоты с водным раствором аммиака, взятых в эквимолекулярном соотношении в водной фазе при температуре 20-65°C в течение 20-60 мин с получением растворимой в воде аммонийной соли карбоновой кислоты на первой стадии, введения водного раствора хлорида металла к раствору аммонийной соли карбоновой кислоты на второй стадии, экстракцией образовавшейся соли металла алифатической карбоновой кислоты органическим растворителем. Известным способом получен 2,5-диметил-2-этилгексаноат бария, при этом в качестве алифатической карбоновой кислоты использована 2,5-диметил-2-этилгексановая кислота, в качестве хлорида металла - хлорид бария, органического растворителя - ксилол [Kinetics of BaTiO3 and PbTiO3 Formation from Metallo-organic Precursors, A.S. Shaikh, G.M. Vest J. Amer Ceram. Soc. V. 69, N 9, 682 (1986)]. Процесс синтеза описывается следующими химическими уравнениями:
Недостатком метода является использование в качестве органического растворителя высококипящего вещества - ксилола.
Задачей настоящего изобретения является упрощение процесса получения 2-этилгексаноата никеля и увеличение выхода целевого продукта.
Поставленная задача решается предлагаемым способом получения солей 2-этилгексаноата никеля путем взаимодействия алифатической карбоновой кислоты с водным раствором аммиака, взятых в эквимолекулярном соотношении, в водной фазе при температуре 20-65°C в течение 20-60 мин с получением растворимой в воде аммонийной соли карбоновой кислоты на первой стадии, введения водного раствора хлорида металла к раствору аммонийной соли карбоновой кислоты на второй стадии, экстракцией образовавшейся соли металла алифатической карбоновой кислоты органическим растворителем, при этом в качестве алифатической карбоновой кислоты используют 2-этилгексановую кислоту, а хлорида металла - хлорид никеля, органического растворителя - бензол, гексан, хлороформ, петролейный эфир фракции 40-70°C или бензиновые фракции с температурой кипения 40-100°C, а процесс взаимодействия раствора хлорида никеля и раствора 2-этилгексаноата аммония проводят при температуре 20-30°C в течение 1-2 часа, хлорид никеля берут в эквивалентном соотношении к 2-этилгексановой кислоте, равным 1,2-1,3:1, массовый расход органического растворителя для экстракции 2-этилгексаноата никеля составляет 1,2-1,5:1 по отношению к исходной 2-этилгексановой кислоте.
Процесс получения 2-этилгексаноата никеля по предлагаемому способу протекает в гомогенной жидкой фазе при постоянном перемешивании, что обеспечивает полное взаимодействие реагентов с получением целевого продукта и сокращает продолжительность каждой стадии. Первая стадия реакции - взаимодействие водного раствора аммиака с 2-этилгексановой кислоты - протекает с выделением тепла, что исключает необходимость дополнительного нагрева реакционной массы извне.
Способ иллюстрируется следующими примерами.
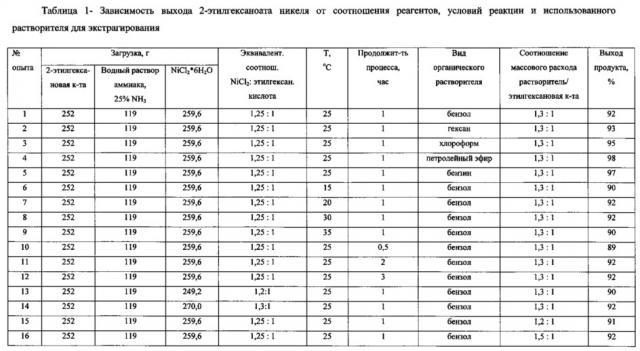
В круглодонную колбу вместимостью 1 л, снабженную механической мешалкой, загружают 252 г (1,747 моль, 280 мл) 2-этилгексановой кислоты и далее при перемешивании добавляют 119 г (1,747 моль, 131 мл) 25% водного раствора аммиака. Происходит самопроизвольный нагрев реакционной массы до 60°С. Реакционную массу перемешивают 45 мин, при этом происходит ее естественное охлаждение до 25°С. Предварительно готовят раствор хлорида никеля путем растворения 259,6 г (1,092 моль) NiCl2⋅6H2O в 180 г воды. К полученному раствору 2-этилгексаноата аммония при постоянном перемешивании приливают по каплям раствор хлорида никеля. Эквивалентное соотношение расхода хлорида никеля к 2-этилгексановой кислоте равно 1,25:1 (2*1,092/1,747). Образовавшийся коллоидный осадок 2-этилгексаноата никеля зеленого цвета экстрагируют бензолом, взятым в количестве 332 г (377 мл). Массовый расход растворителя для экстракции 2-этилгексаноата никеля составил 1,32:1 по отношению к 2-этилгексановой кислоте. Органический слой с помощью делительной воронки отделяют от водного и испаряют в роторном испарителе. Образовавшийся 2-этилгексаноат никеля дополнительно высушивают над сульфатом магния. Выход целевого продукта составил 92% (277,0 г) по отношению к карбоновой кислоте.
Результаты с использованием других растворителей приведены в таблице 1.
Особенностями заявленного способа являются:
- использование в качестве алифатической карбоновой кислоты 2-этилгексановой кислоты,
- использование в качестве хлорида металла - хлорида никеля,
- проведение процесса взаимодействия раствора хлорида никеля и раствора 2-этилгексаноата аммония при температуре 20-30°С в течение 1-2 часов,
- эквивалентное соотношение хлорида никеля к 2-этилгексановой кислоте составляет 1,2-1,3:1,
- использование в качестве органического растворителя бензола, гексана, хлороформа, петролейного эфира фракции 40-70°С или бензиновых фракций с температурой кипения 40-100°С,
- массовый расход органического растворителя для экстракции 2-этилгексаноата никеля составляет 1,2-1,5:1 по отношению к продукту.
Оптимальными условиями для достижения не менее 92% выхода 2-этилгексаноата никеля являются температура процесса 20-30°С и продолжительность реакции 1-2 часа. При температуре ниже 20°С необходим подогрев реакционной массы, а выше 30°С - охлаждение. При продолжительности протекания процесса менее 1 часа происходит неполное взаимодействие реагентов, а продолжительность процесса более 2 часов никак не сказывается на увеличении выхода. Оптимальное эквивалентное соотношение хлорида никеля к 2-этилгексановой кислоте составляет 1,2-1,3:1, при соотношении хлорида никеля к 2-этилгексановой кислоте меньше чем 1,2:1 или больше чем 1,3:1 не способствует увеличению выхода 2-этилгексаноата никеля.
В качестве органических растворителей для экстрагирования полученного 2-этилгексаноата никеля выбраны такие органические растворители, как бензол, хлороформ, гексан, петролейный эфир фракции 40-70°С или бензиновые фракции с температурой кипения 40-100°С. Это выбор связан с низкокипящими свойствами используемых растворителей.
В качестве оптимального расхода органического растворителя для экстрагирования полученного 2-этилгексаноата никеля выбрано массовое соотношение растворитель/этилгексановая кислота, равное 1,3:1, при уменьшении предложенного расхода происходит неполное извлечение целевого продукта, а при большем - большой расход органического растворителя.
Предлагаемый способ позволяет упростить процесс получения 2-этилгексаноата никеля и увеличить его выход за счет подбора оптимальных условий процесса, таких как соотношение хлорида никеля к 2-этилгексановой кислоте, вид низкокипящих органических и их расход для экстракции 2-этилгексаноата никеля.
1. Способ получения солей 2-этилгексаноата никеля путем взаимодействия алифатической карбоновой кислоты с водным раствором аммиака, взятых в эквимолекулярном соотношении, в водной фазе при температуре 20-65°C в течение 20-60 мин с получением растворимой в воде аммонийной соли карбоновой кислоты на первой стадии, введения водного раствора хлорида металла к раствору аммонийной соли карбоновой кислоты на второй стадии, экстракцией образовавшейся соли металла алифатической карбоновой кислоты органическим растворителем, отличающийся тем, что в качестве алифатической карбоновой кислоты используют 2-этилгексановую кислоту, а в качестве хлорида металла - хлорид никеля, а процесс взаимодействия раствора хлорида никеля и раствора 2-этилгексаноата аммония проводят при температуре 20-30°C в течение 1-2 часа, хлорид никеля берут в эквивалентном соотношении к 2-этилгексановой кислоте, равным 1,2-1,3:1, массовый расход органического растворителя для экстракции 2-этилгексаноата никеля составляет 1,2-1,5:1 по отношению к исходной 2-этилгексановой кислоте.
2. Способ получения солей 2-этилгексаноата никеля по п. 1, отличающийся тем, что в качестве органического растворителя используется бензол.
3. Способ получения солей 2-этилгексаноата никеля по п. 1, отличающийся тем, что в качестве органического растворителя используется гексан.
4. Способ получения солей 2-этилгексаноата никеля по п. 1, отличающийся тем, что в качестве органического растворителя используется хлороформ.
5. Способ получения солей 2-этилгексаноата никеля по п. 1, отличающийся тем, что в качестве органического растворителя используется петролейный эфир фракции 40-70°C.
6. Способ получения солей 2-этилгексаноата никеля по п. 1, отличающийся тем, что в качестве органического растворителя используются бензиновые фракции с температурой кипения 40-100°C.