Гидразинотиазоловые производные усниновой кислоты, проявляющие ингибирующее действие в отношении фермента тирозил-днк-фосфодиэстеразы 1 человека
Иллюстрации
Показать всеИзобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к соединениям, представляющим собой гидразинотиазоловые производные усниновой кислоты общей формулы I, где R-α-пиненовый, фенильный, 4-фторфенильный, 4-гидроксифенильный, 4-метоксифенильный или 3-метокси-4-гидроксифенильный заместители. Соединения по изобретению проявляют способность ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1). Технический результат – ингибитор Tdp1 на основе гидразинотиазоловых производных усниновой кислоты. 1 ил., 1 табл., 7 пр.
Реферат
Изобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к соединениям, представляющим собой гидразинотиазоловые производные усниновой кислоты, общей формулы I:
где R - α-пиненовый, фенильный, 4-фторфенильный, 4-гидроксифенильный, 4-метоксифенильный или 3-метокси-4-гидроксифенильный заместители, у которых выявлена биологическая активность, заключающаяся в способности ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1).
В последние годы ведутся активные поиски ингибиторов Tdp1, который рассматривается как перспективная фермент-мишень для создания лекарственных препаратов для лечения онкологических и нейродегенеративных заболеваний [1].
Tdp1 относится к классу фосфодиэстераз - ферментов, расщепляющих фосфодиэфирные связи [2]. Природный мутант этого фермента SCAN1 вызывает тяжелое нейродегенеративное заболевание - синдром спиноцеребеллярной атаксии и нейропатии [3].
Tdp1 играет важную роль в удалении повреждений ДНК, создаваемых топоизомеразой 1 (Top1), ее ингибитором камптотецином и антираковыми препаратами. Нормальный ферментативный цикл топоизомеразы 1 включает обратимую реакцию трансэтерификации. Остаток тирозина-723 активного центра фермента образует переходный ковалентный комплекс с 3'-фосфатом основания ДНК. При этом образуется одноцепочечный разрыв, который позволяет «разрезанной» цепи вращаться вокруг интактной, снимая локальное напряжение в спирали. Затем целостность ДНК восстанавливается за счет обратной реакции. В нормальных условиях скорость реакции лигирования значительно выше, чем скорость расщепления, но в ряде случаев переходные комплексы оказываются стабильными. В частности, ингибиторы Top1, такие как камптотецин и его производные, применяющиеся в клинике, существенно замедляют скорость обратной реакции [4]. Невозможность восстановить структуру ДНК приводит к образованию одноцепочечных разрывов, которые могут превратиться в более токсичные двухцепочечные. Помимо ингибиторов, ряд повреждений ДНК вблизи от места присоединения Top1 также могут блокировать реакцию лигирования.
Tdp1 расщепляет 3'-диэфирную связь между остатком тирозина и 3'-концом ДНК, а также удаляет другие повреждения с 3'-конца ДНК [5, 6]. При этом на 3'-конце ДНК остается фосфат, на 5'-конце - гидроксильный остаток. Такая структура является субстратом для фермента полинуклеотидкиназа-3'-фосфатаза (PNKP), которая восстанавливает традиционную для эксцизионной репарации оснований (ЭРО) конфигурацию 3'-OH, 5'-фосфат [7]. В результате, Tdp1 противостоит ингибиторам Top1, которые являются достаточно эффективными антираковыми препаратами (см. обзоры [8, 9]). Предполагается, что именно Tdpl ответственна за лекарственную устойчивость некоторых видов рака [4, 10]. Эта гипотеза подтверждается рядом исследований: мыши, нокаутные по Tdp1, и человеческие клеточные линии, имеющие мутацию SCAN1, гиперчувствительны к камптотецину [11-14]. И, наоборот, в клетках с повышенным уровнем экспрессии Tdp1 камптотецин и этопозид вызывают меньше повреждений ДНК [15, 16]. Таким образом, сочетание препаратов, воздействующих на Top1 и Tdp1, может существенно повысить эффективность химиотерапии.
Известно также, что подавление активности Tdp1 делает опухолевые клетки гиперчувствтительными к противораковому препарату темозоломиду (метилирование пуринов) [17], метилметансульфонату (образование апуриновых/апиримидиновых сайтов), блеомицину (одноцепочечные/двухцепочечные разрывы с 3'-фосфогликолятами), перекиси водорода и ионизирующему излучению (разрывы и др. виды повреждений) [18]. Это предполагает участие Tdpl в различных путях репарации ДНК.
Таким образом, ингибиторы Tdp1 могут увеличить цитотоксичность камптотецинов. Терапевтическим эффектом таких веществ может быть селективное увеличение активности ингибиторов Top1 в опухолях с нарушениями в процессах репарации ДНК и контроля клеточного цикла.
В литературе описано немного ингибиторов Tdp1, и они обладают относительно мягким ингибирующим действием (в диапазоне 100-0,9 мкМ)
Известно соединение (Z)-4-тиоксо-5-(2,3,4-тригидроксибензилиден)тиазолидин-2-он, обладающее выраженной ингибиторной активностью по отношению к Tdp1 [19].
Недостатком известного соединения являются не очень высокие ингибиторные характеристики в отношении Tdp1 (IC50 для одноцепочечной ДНК составляет порядка 0,9 мкМ).
Наиболее близким к заявляемым соединениям прототипом является фурамидин, представляющий собой гетероциклический диамидин [20] общей формулы II:
Недостатком известного соединения являются низкие ингибиторные характеристики в отношении Tdp1 (IC50 для одноцепочечной ДНК составляет порядка 100 мкМ).
Задачей изобретения является создание более эффективного и специфичного ингибитора Tdpl на основе природных полифенольных соединений, а именно (+)-усниновой кислоты.
(+)-Усниновая кислота (III) является уникальным и доступным отечественным растительным метаболитом.
Широко изучены антибактериальные, фунгицидные и антиоксидантные свойства усниновой кислоты, но известны также данные об активности (+)-усниновой кислоты и ее производных в отношении репарационного фермента ПАРП1 [21].
Поставленная задача решается предлагаемыми соединениями, представляющими собой гидразинотиазоловые производные усниновой кислоты, общей формулы (I) с повышенными ингибирующими характеристиками в отношении Tdp1 (IC50 для одноцепочечной ДНК 0.045÷0.19 мкМ).
Технический результат: повышение ингибирующего действия на фермент Tdp1 и расширение арсенала ингибиторов данного фермента.
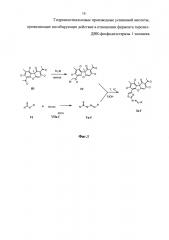
Предлагаемые соединения могут быть синтезированы в соответствии со схемой, приведенной на фиг. 1.
В качестве исходного соединения берут R-(+)-усниновую кислоту со структурной формулой (III) {[α]20D+478(с0.1;СНСl3)}, полученную экстракцией из смеси лишайников рода Usnea по методике [22]. Для получения целевых соединений предварительно синтезируют бромзамещенное производное (+)-усниновой кислоты (соединение IV) и ряд тиосемикарбазонов Va-f. Бромирование усниновой кислоты (III) бромом проводят в присутствии бромоводородной кислоты по методике, описанной в работе [23], и получают соединение IV. Замещенные тиасемикарбазоны Va-Vf получают при взаимодействии тиасемикарбазида (соединение VI) с соответствующими альдегидами VIIa-f, спектральные данные совпадают с литературными [24-26]. Синтез соединений Va и Vf описан в работе [24]. Синтез соединений Vb и Vc описан в работе [25]. Синтез Vd, Ve описан в работе [26]. Финальным этапом получают соединения Ia-If с целевой активностью реакцией соединения IV с тиасемикарбазонами (соединения Va-Vf) с последующей их очисткой колоночной хроматографией.
Более конкретно способ получения заявляемых соединений (Ia-If) заключается в следующем.
На первом этапе получают усниновую кислоту экстракцией воздушно-сухого сырья (смесь лишайников рода Usnea) хлороформом при кипячении с последующим выделением чистой усниновой кислоты в виде желтых кристаллов при перекристаллизации из смеси хлороформ - этиловый спирт (1:10). Полученную усниновую кислоту (III) бромируют добавлением заранее приготовленного комплекса брома с диоксаном (2 ммоль брома растворяют в 14 мл диоксана) в присутствии нескольких капель бромоводородной кислоты в течение 7 суток при комнатной температуре. После концентрирования реакционной смеси на ротационном испарителе и колоночной хроматографии выделяют бромзамещенное производное (+)-усниновой кислоты (IV). Далее синтезируют замещенные тиасемикарбазоны Va-Vf путем медленного прикапывания спиртового раствора соответствующего альдегида VIIa-f к водному раствору тиасемикарбазида (соединение VI). Выпавший осадок промывают водой, отфильтровывают и сушат на воздухе, в дальнейшей реакции он используется без очистки.
Синтез соединений Ia-If проводят кипячением эквимолярных количеств соединения IV и соответствующего тиасемикарбазона Va-f (соединение V) в этиловом спирте в течение 1 часа, выделяют соединения Ia-If после очистки методом колоночной хроматографии с выходами 29% для соединения Iа и 74-93% для соединений Ib-If.
Структура и чистота полученных соединений Ia-If подтверждена данными ЯМР-спектроскопии и масс-спектрометрии.
Соединения общей формулы (I) являются новыми, неописанными ранее гидразинотиазоловыми производными (+)-усниновой кислоты.
Соединения общей формулы (I) после проведения углубленных фармакологических исследований могут использоваться для дальнейшей разработки новых низкотоксичных высокоэффективных противораковых средств.
Ниже приводятся конкретные примеры реализации заявляемого технического решения.
Пример 1. Синтез соединения Iа
Предварительно синтезируют бромзамещенное производное (+)-усниновой кислоты (IV) по методике [23]. Для этого к 1 ммоль (+)-усниновой кислоты III (344 мг) добавляли комплекс бромдиоксана (2 ммоль брома (0.10 мл) растворяли в 14 мл диоксана), несколько капель HBr и оставляли на 7 суток при комнатной температуре. После концентрирования реакционной смеси на ротационном испарителе хроматографировали полученный остаток на силикагеле (60-200μ), элюент - CH2Cl2. Выход 283 мг (67%). Далее синтезировали тиасемикарбазон Va по методике [24]. Для этого 3.3 ммоль (495 мг) миртеналя растворили в 5 мл этилового спирта и медленно при перемешивании при комнатной температуре прикапывали к раствору 3.3 ммоль (300 мг) тиосемикарбазида в воде. Выпавший белый осадок отфильтровали, промыли дистиллированной водой, высушили на воздухе. Выход 606 мг (76%).
Далее к 1 ммоль 6,6-диметилнорпин-2-ен-2-карбальдегид тиосемикарбазона (Va), добавляли 1 ммоль бромзамещенного производного (+)-усниновой кислоты (IV) и кипятили в 10 мл этилового спирта в течение 1 часа. Растворитель отогнали и реакционную смесь хроматографировали на SiO2, элюент - хлористый метилен.
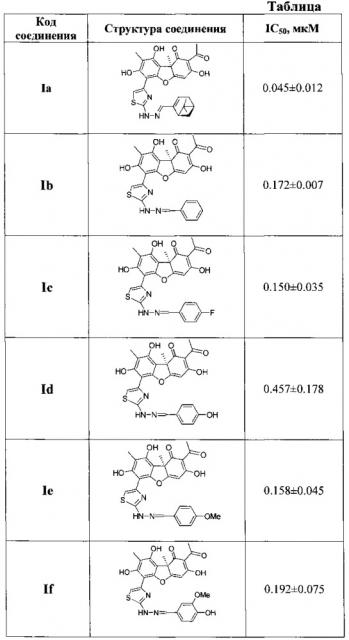
В результате получили гидразинотиазоловое производное усниновой кислоты, представляющее собой (2R)-4-ацетил-10-{2-[(E)-2-{[(lR,5S)-6,6-диметилбицикло[3.1.1]гепт-2-en-2-ил]метилиден}гидразин-1yl]-1,3-тиазол-4-ил}-5,11,13-тригидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(13),4,6,9,11-пентаен-3-он (Iа) в виде аморфного порошка красного цвета, с выходом 29%.
ЯМР 1H (CHCl3, δ, м.д., J Гц): 0.83 (3H, с, Н-26), 1.18 (1H, д, H-20), 1.39 (3H, с, Н-25), 1.77 (1H, д, Н-20), 2.99 (1H, т, J=5.6 Hz, Н-19), 1.75 (3H, с, Н-15), 2.17 (3H, с, Н-10), 2.18 (1H, м, Н-21), 2.38-2.60 (2Н, м, Н-22), 2.67 (3Н, с, Н-12), 5.91 (1H, ш.т, Н-23), 5.94 (1H, с, Н-4), 7.11 (1H, Н-14), 7.43 (1H, с, Н-17), 8.88 (1H, ш.с, NH), 10.28 (1H, с, ОН-9), 12.49 (1H, ш.с, ОН-7), 18.80 (1H, с, ОН-3). ЯМР 13С (СНСl3, δ, м.д.): 8.22 (С-10), 20.70 (С-26), 25.90 (С-25), 27.67 (С-12), 30.99 (С-22), 32.03 (С-15), 32.24 (С-20), 37.5 (С-24), 40.01 (С-21), 40.60 (С-19), 59.35 (С-9b), 97.25 (С-4), 97.49 (С-6), 103.21 (C-9a), 104.32 (С-14), 105.08 (С-2), 108.90 (С-8), 131.71 (С-23), 143.18 (С-18), 144.72 (С-13), 144.78 (С-17), 151.23 (С-9), 151.50 (С-7), 156.46 (С-5a), 166.48 (С-16), 180.63 (С-4a), 191.51 (С-3), 198.07 (С-1), 201.25 (С-11). Найдено: m/z 547.1728 [М]+C29H29N3O6S1. Вычислено: М=547.1772.
Пример 2. Синтез соединения Ib
Соединение Ib получали аналогично примеру 1, за исключением того, что к 1 ммоль бензальдегид тиосемикарбазона Vb, синтезированного по методике [25], добавляли 1 ммоль соединения IV, полученного по методике [23], и кипятили в 10 мл этилового спирта в течение 1 часа. Растворитель отогнали, и реакционную смесь хроматографировали на SiO2, элюент - хлороформ с градиентом метилового спирта от 0 до 5%.
В результате получили гидразинотиазоловое производное усниновой кислоты, представляющее собой (R,E)-2-ацетил-6-(2-(2-бензилиденгидразинил)тиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bН)-он (Ib).
Светло-коричневый аморфный порошок. Выход 82%. Т.пл. 169-171°С. [α]25D -112 (с 0.6; СНСl3). Спектр ЯМР 1Н (СНСl3, δ, м.д., J Гц): 1.66 (3Н, с, Н-15), 2.17 (3Н, с, Н-10), 2.63 (3Н, с, Н-12), 5.84 (1Н, с, Н-4), 7.09 (1Н, Н-14), 7.28-7.50 (5Н, м, Н-аром.), 9.03 (1Н, ш с, NH), 10.26 (1Н, с, ОН-9), 12.55 (1Н, с, ОН-7), 18.75 (1Н, с, ОН-3). ЯМР 13С (СНСl3, δ, м.д.): 8.36 (С-10), 27.75 (С-12), 32.03 (С-15), 59.28 (С-9b), 97.20 (С-4), 97.57 (С-6), 103.36 (С-9a), 104.70 (С-14), 105.15 (С-2), 108.81 (С-8), 126.62 (2С, С-20, С-22), 128.52 (2С, С-19, С-23), 129.62 (С-21), 133.37 (С-18), 142.38 (С-17), 143.49 (С-13), 151.19 (С-9), 151.49 (С-7), 156.34 (С-5а), 166.30 (С-16), 180.51 (С-4a), 191.49 (С-3), 197.97 (С-1), 201.24 (С-11). Найдено: m/z 503.1141 [М]+C26H21N3O6S1. Вычислено: М=503.1146.
Пример 3. Синтез соединения 1 с
Соединение Iс получали аналогично примеру 1, за исключением того, что к 1 ммоль 4-фторбензальдегид тиосемикарбазона Vc, синтезированного по методике [25], добавляли 1 ммоль соединения IV, полученного по методике [23], и кипятили в 10 мл этилового спирта в течение 1 часа. Растворитель отогнали, и реакционную смесь хроматографировали на SiO2, элюент - хлористый метилен.
В результате получили гидразинотиазоловое производное усниновой кислоты, представляющее собой (R,E)-2-ацетил-6-(2-(2-(4-фторбензилиден)гидразинил)тиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1 (9bН)-он (Iс).
Светло-коричневый аморфный порошок. Выход 89%. Т.пл. 130-135°С. [α]25D -132 (с 0.3; СНСl3). Спектр ЯМР 1Н (CDCl3, δ, м.д., J Гц): 1.65 (3Н, с, Н-15), 2.16 (3Н, с, Н-10), 2.64 (3Н, с, Н-12), 5.86 (1H, с, Н-4), 6.96 (2Н, м, Н-20, Н-22), 7.08 (1H, с, Н-14), 7.47 (2Н, м, Н-19, Н-23), 9.14 (1H, ш с, NH), 10.24 (1Н, с, ОН-9), 12.24 (1H, ш с, ОН-7), 18.81 (1Н, с, ОН-3). ЯМР, 13С (CDCl3, δ, м.д.): 8.36 (С-10), 27.69 (С-12), 32.04 (С-15), 59.22 (С-9b), 97.27 (С-4), 97.57 (С-6), 103.45 (С-9а), 104.65 (С-14), 105.12 (С-2), 108.73 (С-8), 115.64 (2С, д, JC-F 22.1, С-20, С-22), 128.38 (2С, д, JC-F 8.4, С-19, С-23), 129.64 (д, JC-F 3.2, С-18), 141.25 (С-17), 143.33 (С-13), 151.21 (С-9), 151.50 (С-7), 156.26 (С-5a), 163.42 (д, JC-F 251.1, С-21), 166.28 (С-16), 180.43 (С-4a), 191.52 (С-3), 197.91 (С-1), 201.34 (С-11). Найдено: m/z 521.1044 [М]+C26H20N3O6F1S1. Вычислено: М=521.1051.
Пример 4. Синтез соединения Id
Соединение Id получали аналогично примеру 1, за исключением того, что к 1 ммоль 4-гидроксибензальдегид тиосемикарбазона Vd, синтезированного по методике [26], добавляли 1 ммоль соединения IV, полученного по методике [23], и кипятили в 10 мл этилового спирта в течение 1 часа. Растворитель отогнали и реакционную смесь хроматографировали на SiO2, элюент - хлороформ с градиентом метилового спирта от 0 до 5%.
В результате получили гидразинотиазоловое производное усниновой кислоты, представляющее собой (R,E)-2-ацетил-6-(2-(2-(4-гидроксибензилиден)гидразинил)тиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bН)-он (Id).
Красный аморфный порошок. Выход 93%. Т.пл. 180-185°С. [α]25D -115 (с 0.3; СНСl3). Спектр ЯМР 1Н (СНСl3, δ, м.д., J Гц): 1.70 (3Н, с, Н-15), 2.18 (3Н, с, Н-10), 2.65 (3Н, с, Н-12), 5.48 (1Н, ш с, ОН-21) 5.89 (1Н, с, Н-4), 6.79 (2Н, д, J 8.6, Н-20, Н-22) 7.12 (1Н, с, Н-14), 7.45 (2Н, д, J 8.6, Н-19, Н-23), 7.52 (1Н, с, Н-17), 8.68 (1Н, ш с, NH), 10.29 (1Н, с, ОН-9), 12.54 (1Н, ш с, ОН-7), 18.78 (1Н, с, ОН-3). ЯМР 13С (СНСl3, δ, м.д.): 8.34 (С-10), 27.80 (С-12), 32.10 (С-15), 59.38 (С-9b), 97.28 (С-4), 97.64 (С-6), 103.38 (С-9а), 104.60 (С-14), 105.21 (С-2), 108.91 (С-8), 115.67 (2С, С-19, С-23), 126.23 (С-18), 128.50 (2С, С-20, С-22), 142.36 (С-17), 143.53 (С-13), 151.20 (С-9), 151.53 (С-7), 156.45 (С-5а), 157.22 (С-21), 166.39 (С-16), 180.69 (С-4а), 191.61 (С-3), 198.08 (С-1), 201.34 (С-11). Найдено: m/z 519.1098 [М]+C26H21N3O7S1. Вычислено: М=519.1095.
Пример 5. Синтез соединения Iе
Соединение Iе получали аналогично примеру 1, за исключением того, что к 1 ммоль 4-метоксибензальдегид тиосемикарбазона Ve, синтезированного по методике [26], добавляли 1 ммоль соединения IV, полученного по методике [23], и кипятили в 10 мл этилового спирта в течение 1 часа. Растворитель отогнали и реакционную смесь хроматографировали на SiO2, элюент - хлороформ с градиентом метилового спирта от 0 до 5%.
В результате получили гидразинотиазоловое производное усниновой кислоты, представляющее собой (R,E)-2-ацетил-6-(2-(2-(4-метоксибензилиден)гидразинил)тиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bН)-он (Iе).
Красный аморфный порошок. Выход 79%. Т.пл. 137-140°С. [α]25D -113 (с 0.3; СНСl3). Спектр ЯМР 1Н (CDCl3, δ, м.д., J Гц): 1.65 (3Н, с, Н-15), 2.19 (3Н, с, Н-10), 2.64 (3Н, с, Н-12), 5.82 (1H, с, Н-4), 6.79 (2Н, д, J 8.7, Н-20, Н-22) 7.07 (1Н, с, Н-14), 7.36 (1Н, с, Н-17), 7.41 (2Н, д, J 8.6, Н-19, Н-23), 8.72 (1Н, ш с, NH), 10.25 (1Н, ш с, ОН-9), 12.54 (1Н, с, ОН-7), 18.77 (1Н, с, ОН-3). ЯМР, 13С (CDCl3, δ, м.д.): 8.42 (С-10), 27.76 (С-12), 32.13 (С-15), 55.16 (ОМе-21), 59.27 (С-9b), 97.17 (С-4), 97.73 (С-6), 103.44 (С-9а), 104.42 (С-14), 105.16 (С-2), 108.84 (С-8), 114.00 (2С, С-20, С-22), 126.17 (С-18), 128.19 (2С, С-19, С-23), 142.32 (С-17), 143.49 (С-13), 151.17 (С-9), 151.53 (С-7), 156.45 (С-5а), 160.81 (С-21), 166.46 (С-16), 180.59 (С-4а), 191.58 (С-3), 197.97 (С-1), 201.35 (С-11). Найдено: m/z 533.1250 [М]+C27H23N3O7S1. Вычислено: М=533.1251.
Пример 6. Синтез соединения If
Соединение If получали аналогично примеру 1, за исключением того, что к 1 ммоль 4-гидрокси-3-метоксибензальдегид тиосемикарбазона Vf, синтезированного по методике [24], добавляли 1 ммоль соединения IV, полученного по методике [23], и кипятили в 10 мл этилового спирта в течение 1 часа. Растворитель отогнали, и реакционную смесь хроматографировали на SiO2, элюент - хлороформ с градиентом метилового спирта от 0 до 5%.
В результате получили гидразинотиазоловое производное усниновой кислоты, представляющее собой (R,E)-2-ацетил-6-(2-(2-(4-гидрокси-3-метоксибензилиден)гидразинил)тиазол-4-ил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bН)-он (If).
Красный аморфный порошок. Выход 74%. Т.пл. 173-175°С. [α]25D -106 (с 0.2; СНСl3). Спектр ЯМР 1Н (CDCl3, δ, м.д., J Гц): 1.65 (3Н, с, Н-15), 2.19 (3Н, с, Н-10), 2.64 (3Н, с, Н-12), 3.92 (3Н, с, ОМе-20), 5.76 (1Н, ш с, ОН-21), 5.83 (1H, с, Н-4), 6.79 (1H, д, J 8.1, Н-22), 6.89 (1Н, дд, J 8.1, 1.8, Н-23), 7.05 (1Н, д, J 1.8, Н-19), 7.06 (1H, с, Н-14), 7.29 (1Н, с, Н-17), 8.74 (1Н, ш с, NH), 10.28 (1Н, с, ОН-9), 12.56 (1Н, ш с, ОН-7), 18.78 (1H, с, ОН-3). ЯМР 13С (CDCl3, δ, м.д.): 8.06 (С-10), 27.44 (С-12), 31.78 (С-15), 55.47 (ОМе-20), 58.88 (С-9b), 96.82 (С-4), 97.38 (С-6), 103.11 (С-9а), 103.97 (С-14), 104.78 (С-2), 107.04 (С-8), 113.98 (С-22), 121.26 (С-23), 125.62 (С-18), 142.21 (С-17), 143.15 (С-13), 146.29 (С-21), 147.03 (С-22), 150.80 (С-9), 151.17 (С-7), 156.01 (С-5а), 166.00 (С-16), 180.16 (С-4а), 191.16 (С-3), 197.53 (С-1), 201.10 (С-11). Найдено: m/z 549.1198 [М]+C27H23N3O8S1. Вычислено: М=549.1200.
Пример 7. Исследование влияния предлагаемых соединений на активность Tdp1.
Рекомбинантная тирозил-ДНК-фосфодиэстераза 1 человека (КФ 3.1.4.) была экспрессирована в системе Escherichia coli (плазмида рЕТ 16B-Tdp1 предоставлена доктором Кальдекотт К.У., Университет Сассекса, Великобритания) и выделена как описано [2, 27].
В качестве тест-системы для определения ингибирующих свойств исследуемых соединений использована реакция удаления тушителя флуоресценции Black Hole Quencher 1 (BHQ1) с 3'-конца олигонуклеотида, катализируемая Tdp1. На 5'-конце олигонуклеотида находится (5,6)-FAM - флуорофор, интенсивность флуоресценции которого возрастает при удалении тушителя. Для измерения флуоресценции использовался флуориметр POLARstar OPTIMA производства BMG LABTECH.
Реакционные смеси объемом 200 мкл содержали буфер (50 мМ Tris-НСl, рН 8,0; 50 мМ NaCl; 7 мМ меркаптоэтанол), 50 нМ олигонуклеотид и различные концентрации ингибиторов. Реакция запускалась добавлением Tdp1 до конечной концентрации 1,3 нМ. Измерения проводились в линейном диапазоне зависимости скорости реакции от времени (до 8 минут) через каждые 55 секунд. Влияние предлагаемых соединений оценивали по величине IС50 (концентрация ингибитора, при которой активность фермента снижена наполовину). Обсчет значений IC50 проводили с помощью программы MARS Data Analisys 2.0 (BMG LABTECH).
Влияние исследуемых соединений на активность Tdp1 представлено в таблице. Из таблицы видно, что величины IC50 для предлагаемых соединений составляют 0.045-0.19 мкМ, что в 2000-500 раз ниже, чем у соединения-прототипа.
Таким образом, предложены соединения, представляющие собой гидразинотиазольные производные усниновой кислоты общей формулы (I), где R - α-пиненовый (соединение Ia), фенильный (соединение Ib) или 4-фторфенильный (соединение Iс), 4-гидроксифенильный (соединение Id), 4-метоксифенильный (соединение Iе) или 3-метокси-4-гидроксифенильный (соединение If) заместители, у которых выявлена биологическая активность, заключающаяся в способности ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1).
Предлагаемые соединения оказывают специфическое ингибирующее действие на фермент тирозил-ДНК-фосфодиэстераза 1 человека (Tdpl) и, являясь эффективными соединениями, расширяют арсенал ингибиторов данного фермента и могут быть использованы для разработки лекарственных препаратов, применимых в клинической медицине.
Источники информации
1. Cortes Ledesma F., et al., Nature, 2009, 461, 674-678.
2. Interthal H., et al., Proc. Natl. Acad. Sci. U.S.A. 2001, 98, 12009-12014.
3. Rass U., et al., Cell., 2007, 130, 991-1004.
4. Dexheimer TS, et al., Anticancer Agents Med Chem. 2008, 8, 381-389.
5. Ben Hassine S, et al., The EMBO Journal, 2009, 28, 632-640.
6. Povirk LF. ISRN Mol. Biol., 2012, 1-16.
7. Vance JR, Wilson ТЕ. J. Biol. Chem., 2001, 276, 15073-15081.
8. Pommier Y. Nat. Rev. Cancer, 2006, 6, 789-802.
9. Pommier Y., et al. Chem Biol., 2010, 17, 421-133.
10. Beretta GL, et al., Curr. Med. Chem. 2010, 17, 1500-1508.
11. El-Khamisy SF, et al, DNA Repair (Amst)., 2009, 8 760-766.
12. Das BB, et al., The EMBO Journal, 2009, 28, 3667-3680.
13. Katyal S, et al., EMBO J, 2007, 26, 4720-4731.
14. Hirano R., et al., EMBO J., 2007, 26, 4732-4743.
15. Barthelmes HU, et al, J Biol Chem. 2004, 279, 55618-25565.
16. Nivens MC, et al., Cancer Chemother Pharmacol., 2004, 53, 107-115.
17. Alagoz M., et al., Nucleic Acids Res., 2014, 42, 3089-3103.
18. Murai J., et al., J Biol Chem. 2012, 287, 12848-12857.
19. Sirivolu V.R., et al., J. Med. Chem. 2012, 55, 8671-8684.
20. Antony S, et al., Nucleic Acids Res. 2007, 35, 4474-4484.
21. Zakharenko A., et al., Med. Chem., 2012, 8, 883-893.
22. Салахутдинов Н.Ф., и др., Патент РФ №2317076 CI, он. 20.02.2008.
23. Лузина О.А. и др., Химия Природных Соединений, 2012, №3, 350-355.
24. de Oliveira RB, et al., Eur. J. Med. Chem, 2008, 43, 1983-1988.
25. Saeed A., et al., Chem. Biol. Drug Des., 2015, 85, 225-230.
26. Aslam M., et al., Eur. J. Med. Chem, 2011, 46, 5473-5479.
27. Lebedeva N.A., et al., FEBS Lett., 2011, 585, 683-686.
Гидразинотиазоловые производные усниновой кислоты общей формулы I:
где R-α-пиненовый, фенильный, 4-фторфенильный, 4-гидроксифенильный, 4-метоксифенильный или 3-метокси-4-гидроксифенильный заместители, проявляющие ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека.