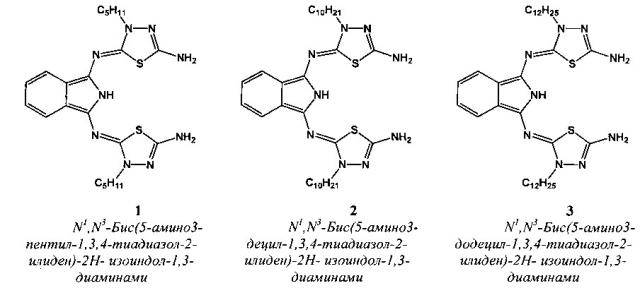
Способ получения n1,n3-бис(5-амино-3-алкил-1,3,4-тиадиазол-2-илиден)-2н-изоиндол-1,3-диаминов
Иллюстрации
Показать всеИзобретение относится к химической промышленности, а именно к способу получения N1,N3-бис(5-амино-3-алкил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диаминов, где в качестве алкильных заместителей выступают пентильный, децильный и додецильный радикалы. Соединения могут быть использованы в качестве жирорастворимых красителей для крашения восков, синтетических волокон, полимеров, углеводородов, жиров, спиртов, пластических масс, резины. Способ получения N1,N3-бис(5-амино-3-алкил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамина осуществляют путем взаимодействия соответствующих 5-амино-2-имино-3-пентил-1,3,4-тиадиазолина, 5-амино-3-децил-2-имино-1,3,4-тиадиазолина, 5-амино-3-додецил-2-имино-1,3,4-тиадиазолина, фталонитрила и хлорида в среде высококипящего спирта при нагревании и перемешивании реакционной массы, очистке конечного продукта. Смешивание проводят в среде бутанола, в качестве хлорида используют хлорид кальция. Перемешивание проводят в течение 47-48 часов при температуре кипения высококипящего спирта, а очистку проводят перекристаллизацией из пиридина. Технический результат - повышение выхода целевых продуктов. 12 ил., 3 пр.
Реферат
Изобретение относится к химической промышленности, а именно к способу получения N1,N3-бис(5-амино-3-алкил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диаминов, где в качестве алкильных заместителей выступают пентильный, децильный и додецильный радикалы. Эти химические соединения могут быть использованы в качестве жирорастворимых красителей для крашения восков, синтетических волокон, полимеров, углеводородов, жиров, спиртов, пластических масс, резины.
Известен способ получения N1,N3-бис(5-амино-3-децил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамин, N1,N3-бис(5-амино-3-додецил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамин с выходами 27,6 и 31% соответственно [Е.А. Danilova, T.V. Melenchuk, Е.Е. Melekhonova, М.А. Tyutina, M.K. Islyaikin. Three-unit products of condensation of alkylsubstituted thiadiazoles with 1,1-dimethoxy-3-iminoisoindoline // Macroheterocycles. - 2009. - Vol. 2, No. 3. - P. 246-250], в котором в раствор метанолята натрия, состоящий из 0,75 моль металлического натрия и 50 мл метанола, вносят 3 ммоль фталонитрила и выдерживают при перемешивании при комнатной температуре в течение 2,5 ч. Затем в образовавшийся желтый раствор добавляют (0,75 ммоль) хлорида аммония, перемешивают 10 минут и добавляют 6,1 ммоль 5-амино-2-имино-3-пентил-1,3,4-тиадиазолина или 5-амино-2-имино-3-децил-1,3,4-тиадиазолина. Реакционную массу нагревают до 40-45°С и перемешивают при этой температуре в течение 14-16 часов. По окончании выдержки реакционную массу выливают в 150 мл воды. В течение суток выпадает осадок. Осадок отфильтровывают и сушат при комнатной температуре. Получают вещество малинового цвета, нерастворимое в воде и хорошо растворимое в органических растворителях. Очистку продукта проводят методом колоночной хроматографии на колонке, заполненной оксидом алюминия, элюируя смесью дихлорметан : метанол : гексан = 10:1:3.
За прототип принят способ получения N1,N3-бис(5-амино-3-пентил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамина [Патент №2373205 Российская Федерация, МПК6 C07D 417/14, С09В 21/00. N1,N3-Бис(5-амино-3-пентил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамин [Текст] / Меленчук Т.В., Данилова Е.А., Исляйкин М.К., Судьина Е.Е.; заявитель и патентообладатель Государственное образовательное учреждение высшего профессионального образования «Ивановский государственный химико-технологический университет». - 2008128228/04; заявл. от 10.07.2008; опубл. 20.11.09],
в котором в раствор метанолята натрия, состоящий из 0,02 г (0,75 моль) металлического натрия и 50 мл метанола, вносят 0,38 г (3 ммоль) фталонитрила и выдерживают при перемешивании при комнатной температуре в течение 2,5 ч. Затем в образовавшийся желтый раствор добавляют 0,04 г (0,75 ммоль) хлорида аммония, перемешивают 10 минут и добавляют 1,14 г (6,1 ммоль) 5-амино-2-имино-3-пентил-1,3,4-тиадиазолина. Реакционную массу нагревают до 40-45°С и перемешивают при этой температуре в течение 14-16 часов. По окончании выдержки реакционную массу выливают в 150 мл воды. В течение суток выпадает осадок. Осадок отфильтровывают и сушат при комнатной температуре. Получают вещество малинового цвета, нерастворимое в воде и хорошо растворимое в органических растворителях. Очистку продукта проводят методом колоночной хроматографии на колонке, заполненной оксидом алюминия, элюируя смесью дихлорметан : метанол : гексан = 10:1:3. Выход готового продукта 0.13 г (11.5%) формулы: N1,N3-бис(5-амино-3-пентил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамин, который предложен в качестве жирорастворимого красителя.
Недостатком прототипа является низкий процент выхода целевого продукта, который не превышает 12%, что делает его практическое использование нерентабельным.
Техническим результатом изобретения является повышение выхода целевых продуктов.
Указанный результат достигается тем, что в способе получения N1,N3-бис(5-амино-3-пентил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамина, N1,N3-бис(5-амино-3-децил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамина и N1,N3-бис(5-амино-3-додецил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диамина, заключающемся во взаимодействии соответствующих 5-амино-2-имино-3-пентил-1,3,4-тиадиазолина, 5-амино-3-децил-2-имино-1,3,4-тиадиазолина, 5-амино-3-додецил-2-имино-1,3,4-тиадиазолина, фталонитрила и хлорида в среде высококипящего спирта при нагревании и перемешивании реакционной массы, очистке конечного продукта, согласно изобретению смешивание производят в среде бутанола, в качестве хлорида используют хлорид кальция, нагревают реакционную массу до 115-117°С, перемешивают при этой температуре в течение 46-48 часов, а очистку проводят перекристаллизацией из пиридина.
Полученные вещества не требуют дальнейшей трудоемкой и затратной хроматографической очистки, так как в ходе синтеза не образуется большое количество побочных продуктов.
Изобретение позволяет получить вещества красного и малинового цветов, нерастворимые в воде и хорошо растворимые в метаноле, слаборастворимые в ацетоне, дихлорметане, хлороформе с выходом 72-89%.
Изобретение поясняется чертежами, где на фиг. 1 изображен ЭСП 1 λmax, нм (lgε, С=2.79⋅10-4 г-моль/л), (МеОН), на фиг. 2 - ИК спектр 1 (табл. KBr), на фиг. 3 - 1Н ЯМР 1 (CDCl3, 300 МГц), на фиг. 4 - масс-спектр 1 (MALDI-TOF), на фиг. 5 - ЭСП 2 λmax, нм (lgε, С=3.12⋅10-5 г-моль/л), (МеОН), на фиг. 6 - ИК спектр 2 (табл. KBr), на фиг. 7 - 1Н ЯМР 2 (CDCl3, 300 МГц), на фиг. 8 - масс-спектр 2 (MALDI-TOF), на фиг. 9 - ЭСП 3 λmax, нм (lgε, С=5.20⋅10-4 г-моль/л), (МеОН), на фиг. 10 - ИК спектр 3 (табл. KBr), на фиг. 11 - 1Н ЯМР 3 (CDCl3, 300 МГц), на фиг. 12 - масс-спектр 3 (MALDI-TOF).
Структура полученных соединений установлена с использованием электронной спектроскопии (фиг. 1, 5, 9), ИК (фиг. 2, 6, 10), Н1 ЯМР (фиг. 3, 7, 11), масс-спектрометрии (фиг. 4, 8, 12), и данных элементного анализа.
Для осуществления изобретения используют следующие вещества:
- н-бутанол (ГОСТ 6006-78 ч);
- хлорид кальция (ГОСТ 450-77);
- 5-амино-2-имино-3-пентил-1,3,4-тиадиазолин, 5-амино-3-децил-2-имино-1,3,4-тиадиазолин, 5-амино-3-додецил-2-имино-1,3,4-тиадиазолин не являются товарными продуктами и могут быть получены алкилированием 2,5-диамино-1,3-4-тиадиазола соответствующим алкил бромидом [Данилова Е.А., Меленчук Т.В., Трухина О.Н, Исляйкин М.К. Исходные соединения для макрогетероциклов. Диаминотиадиазолы. (обзор) // Макрогетероциклы. - 2010. - Vol. 3, No. 1. - Р. 68-81].
Изобретение осуществляют следующим образом.
Пример 1
В раствор н-бутанола вносят 0.171 г (1.3 ммоль) фталонитрила, 0.6203 г (3.3 ммоль) 5-амино-2-имино-3-пентил-1,3,4-тиадиазолина и 0.0147 г (0.13 ммоль) хлорида кальция и выдерживают при перемешивании и температуре кипения реакционной массы 115°С в течение 47 часов. По окончании выдержки растворитель отгоняют, остаток сушат под вакуумом при комнатной температуре. Получают вещество малинового цвета, нерастворимое в воде и хорошо растворимое в метаноле, слаборастворимое в ацетоне, дихлорметане, хлороформе. Очистку проводят перекристаллизацией из пиридина. Выход: 0.64 г (89%).
ЭСП, фиг. 1, λmax, нм (lgε, С=2.79⋅10-4 г-моль/л), (МеОН): 459 (3.82), 490 (3.89), 526 (3.71)
ИК спектр, фиг. 2, (табл. KBr), , см-1: 3313, 3288 (N-H), 2956, 2929, 2871, 2858 (С-Н, alk), 1610, 1596 (C=N), 1548, 1505, 1466.
1Н ЯМР, фиг. 3, (CDCl3, 300 МГц): δН (м.д.) = 7.59-7.89 (м., 4Н аром.), 5.32 (ш.с, 3Н; NH, NH2); 4.54 (тр. 4Н; N-CH2-.); 1.58 (с., 4Н; N-CH2-CH2-); 1.28 (м., 4Н; -СН2-); 0.91 (тр. 6Н; -СН3).
Масс-спектр, фиг. 4, (MALDI-TOF), m/z 483 [М-2Н]+ C22H31N9S2 ММ=485.2
Найдено, %: С 53.86; Н 6.57; N 17.05; S 6.34.
C22H31N9S2. Вычислено, %: С 54.41; Н 6.43; N 25.96; S 13.20
Пример 2
В раствор н-бутанола вносят 0.171 г (1.3 ммоль) фталонитрила, 0.854 г (3.3 ммоль) 5-амино-2-имино-3-децил-1,3,4-тиадиазолина и 0.0147 г (0.13 ммоль) хлорида кальция и выдерживают при перемешивании и температуре кипения реакционной массы 117°С течение 48 часов. По окончании выдержки растворитель отгоняют, остаток сушат под вакуумом при комнатной температуре. Получают вещество малинового цвета, нерастворимое в воде и хорошо растворимое в метаноле, слаборастворимое в ацетоне, дихлорметане, хлороформе. Очистку проводят перекристаллизацией из пиридина. Выход: 0.47 г (72.5%).
ЭСП, фиг. 5, λmax, нм (lgε, С=3.12⋅10-5 г-моль/л), (МеОН): 461 (4.18), 492 (4.24), 529 (4.06)
ИК спектр, фиг. 6, (табл. KBr), , см-1: 3300, 3183 (N-H), 2954, 2924, 2853 (С-Н, alk), 1618, 1598 (C=N), 1537, 1513, 1466.
1Н ЯМР, фиг. 7, (CDCl3, 300 МГц): δН (м.д.) = 7.56-7.85 (м., 4Н аром.), 7.24 (ш.с, 3Н; NH, NH2); 3.39 (тр. 4Н, N-CH2-.); 1.68 (с. 4Н, N-CH2-CH2-); 1.25 (м. 28Н, -СН2-); 0.86 (тр. 6Н, -СН3).
Масс-спектр, фиг. 8, (MALDI-TOF), m/z 624 [М-Н]+ C32H51N9S2 ММ=625.4
Найдено, %: С 60.13; Н 8.77; N 20.45; S 9.83.
C32H21N9S2. Вычислено, %: С 61.40; Н 8.21; N 20.14; S 10.24
Пример 3
В раствор н-бутанола вносят 0.171 г (1.3 ммоль) фталонитрила, 0.947 г (3.3 ммоль) 5-амино-2-имино-3-додецил-1,3,4-тиадиазолина и 0.0147 г (0.13 ммоль) хлорида кальция и выдерживают при перемешивании и температуре кипения реакционной массы 116°С течение 47 ч. 30 мин. По окончании выдержки растворитель отгоняют, остаток сушат под вакуумом при комнатной температуре. Получают вещество малинового цвета, нерастворимое в воде и хорошо растворимое в метаноле, слаборастворимое в ацетоне, дихлорметане, хлороформе. Очистку проводят перекристаллизацией из пиридина. Выход: 0.52 г (80.2%).
ЭСП, фиг. 9, λmax, нм (lgε, С=5.20⋅10-4 г-моль/л), (МеОН): 466, 498 (3.75), 536
ИК спектр, фиг. 10, (табл. KBr), ν, см-1: 3390, 3285, 3120, (N-H), 2955, 2922, 2854 (С-Н, alk), 1698, 1610 (C=N), 1545.
1Н ЯМР, фиг. 11, (CDCl3, 500 МГц): δН (м.д.) = 7.58-7.90 (м., 4Н аром.), 7.24 (ш.с, 3Н; NH, NH2); 4.28 (с, 2H; -NH2); 3.74 (тр. 4Н; N-CH2-.); 1.87 (с, 4Н; N-CH2-CH2-); 1.30 (м., 36Н-СН2-); 0.89 (тр., 6Н, -СН3).
Масс-спектр, фиг. 12, (MALDI-TOF), m/z 681 [М+Н]+ C36H59N9S2 ММ=682.0
Найдено, %: С 63.40; Н 8.22; N 17.47; S 9.18. C36H59N9S2.
C36H59N9S2 Вычислено, %: С 63.40; Н 8.72; N 18.48; S 9.40.
Способ получения N1,N3-бис(5-амино-3-алкил-1,3,4-тиадиазол-2-илиден)-2Н-изоиндол-1,3-диаминов, заключающийся во взаимодействии 5-амино-2-имино-3-пентил-1,3,4-тиадиазолина, 5-амино-3-децил-2-имино-1,3,4-тиадиазолина или 5-амино-3-додецил-2-имино-1,3,4-тиадиазолина, фталонитрила и хлорида в среде высококипящего спирта, нагревании и перемешивании реакционной массы, очистке конечного продукта, отличающийся тем, что смешивание производят в среде бутанола, в качестве хлорида используют хлорид кальция, нагревают реакционную массу до 115-117°С, перемешивают при этой температуре в течение 46-48 часов, а очистку проводят перекристаллизацией из пиридина.