Средство для профилактики и лечения доброкачественной гиперплазии предстательной железы
Иллюстрации
Показать всеЗаявленное средство относится к области медицины и предназначено для профилактики и лечения доброкачественной гиперплазии предстательной железы. Для профилактики и лечения доброкачественной гиперплазии предстательной железы применяют 4-гидроксиметил-2,6-диизоборнилфенола в дозе 10 мг/кг массы тела. Использование заявленного изобретения позволяет повысить эффективность профилактики и лечения доброкачественной гиперплазии предстательной железы. 9 ил., 1 пр.
Реферат
Изобретение относится к области медицины, конкретно к фармакологии, и касается средства профилактики и лечения доброкачественной гиперплазии предстательной железы.
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее распространенных заболеваний мужчин пожилого возраста, причем частота ее выявлений в последние годы возрастает [1]. Эта патология представляет собой неопролиферацию стромальной и железистой ткани с формированием новых железистых структур [2]. Результаты исследований, проведенных в настоящее время, свидетельствуют о многофакторности ДГПЖ [3]. Старение организма, окссидативный стресс, гормональный дисбаланс, активация факторов роста и ряд других причин участвуют в возникновении и развитии этого заболевания.
Препаратами терапии ДГПЖ первой линии являются блокаторы альфа-адренорецепторов (доксазолин и др.). Их применение позволяет предотвратить развитие такого серьезного осложнения ДГПЖ, как задержка мочеиспускания [4]. Однако лекарственные средства такого плана вызывают ряд нежелательных побочных эффектов (гипотензия, головокружение, головная боль, усталость и др.). В ряде случаев они побуждают пациента отказаться от лечения [5]. Широкое распространение при терапии ДГПЖ получили ингибиторы 5-альфа-редуктазы, приводящие к снижению гормонального дисбаланса. Однако при этом у 12% пациентов выявляется побочное действие на половую сферу [5]. В последние годы для терапии данного заболевания рекомендуют ингибитор 5-альфа редуктазы растительного происхождения - Простамол Уно, побочное действие которого не выражено. Однако его эффективность, по данным Европейской ассоциации урологов при ДГПЖ, не является окончательно клинически доказанной [6]. Также недостаточно доказанной в клинике является и эффективность применения препарата афала, представляющего собой сверхмалые дозы антител к простатическому специфическому антигену [6]. Отмеченные недостатки применения используемых препаратов обуславливают поиск новых средств лечения ДГПЖ [5].
В последние годы получены данные, свидетельствующие о необходимости проведения при этой патологии антиоксидантной терапии [7]. Это связано с тем, что нарушение антиоксидантно-прооксидантного баланса может быть основным фактором, ответственным за развитие ДГПЖ [8]. Уже доказана эффективность использования индигала при ДГПЖ [4]. В состав этого вещества входит антиоксидант, относящийся к индолам - индол-3-карбинол. Однако индигал не является лекарственным средством, а считается биологически активной добавкой. К числу лекарственных средств - антиоксидантов, эффективность которых при ДГПЖ исследована, относятся дигидрокверцитин и n-тирозол [9,10]. Они являются полифенолами. Установлено, что оба лекарственных средства задерживают развитие ДГПЖ у экспериментальных животных. Судя по степени снижения площади эпителия ацинусов, действие n-тирозола оказалось более выраженным, чем у дигидрокверцитина [9,10].
Лекарственное средство 4-гидроксиметил-2,6-диизоборнилфенол относится к синтетическим антиоксидантам фенольной природы [11]. В связи с тем, что n-тирозол оказался наиболее эффективным, чем дигидрокверцитин при ДГПЖ, он был выбран в качестве прототипа. Прототип сходен с заявляемым веществом и по химическому строению.
Задачей, решаемой данным изобретением, является расширение арсенала средств, используемых для лечения ДГПЖ.
Поставленная задача решается применением 4-гидроксиметил-2,6-диизоборнилфенола для профилактики и лечения ДГПЖ.
В результате проведенных нами экспериментальных исследований обнаружено неизвестное до сих пор свойство 4-гидроксиметил-2,6-диизоборнилфенола - препятствовать развитию ДГПЖ у крыс.
Свойство 4-гидроксиметил-2,6-диизоборнилфенола препятствовать развитию ДГПЖ является для специалиста фактом неочевидным и не вытекает из уровня техники в данной области, не обнаружено в патентной и научно-медицинской литературе. Свойство 4-гидроксиметил-2,6-диизоборнилфенола препятствовать развитию ДГПЖ может быть использовано в практическом здравоохранении для повышения качества лечения. Таким образом, предлагаемое техническое решение соответствует критериям патентоспособности изобретения, а именно «новизна», «изобретательский уровень» и «промышленная применимость».
Данное изобретение будет понятно из следующего описания и приложенных к нему фигур (1-9).
На фиг. 1-8
- фон
- сульпирид (фиг. 1-6, эглонил) (контроль)
- (фиг. 1-6 эглонил + 4-гидроксиметил-2,б-диизоборнилфенол)
- (фиг. 1-6 эглонил + n-тирозол)
различия достоверны # по сравнению с фоном, при Р≤0,05 - различия достоверны * по сравнению с группой контроля, при Р≤0,05.
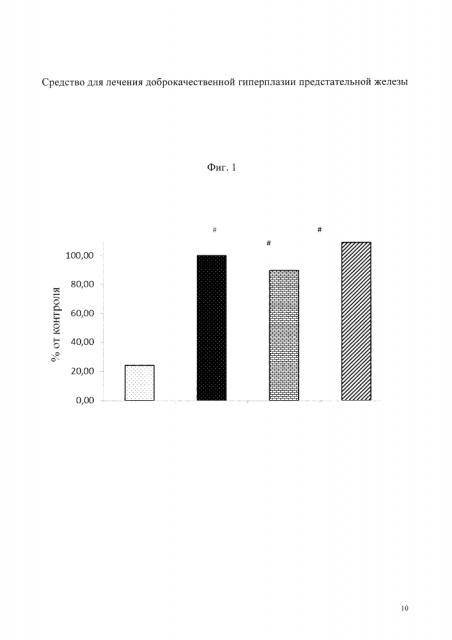
На фиг. 1 изображены данные по объему вентральной доли простаты, у животных, получавших сульпирид - (контроль); сульпирид в сочетании с 4-гидроксиметил-2,6-диизоборнилфенолом, сульпирид в сочетании с n-тирозолом.
На фиг. 2 изображены результаты подсчетов количества центров пролиферации первого типа в вентральной доле простаты, у животных, получавших сульпирид - (контроль); сульпирид в сочетании с 4-гидроксиметил-2,6-диизоборнилфенолом, сульпирид в сочетании с n-тирозолом
На фиг. 3 изображены результаты подсчетов количества центров пролиферации второго типа в вентральной доле простаты, у животных, получавших сульпирид - (контроль); сульпирид в сочетании с 4-гидроксиметил-2,6-диизоборнилфенолом, сульпирид в сочетании с n-тирозолом.
На фиг. 4 изображены результаты подсчета площади эпителия в вентральной доле простаты, у животных, получавших сульпирид - (контроль); сульпирид в сочетании с 4-гидроксиметил-2,6-диизоборнилфенолом, сульпирид в сочетании с n-тирозолом.
На фиг. 5 изображены результаты подсчета площади стромы в вентральной доле простаты, у животных, получавших сульпирид - (контроль); сульпирид в сочетании с 4-гидроксиметил-2,6-диизоборнилфенолом, сульпирид в сочетании с n-тирозолом.
На фиг. 6 изображены результаты подсчета стромально-эпителиального соотношения в вентральной доле простаты, у животных, получавших сульпирид - (контроль); сульпирид в сочетании с 4-гидроксиметил-2,6-диизоборнилфенолом, сульпирид в сочетании с n-тирозолом.
На фиг. 7 изображены результаты подсчета площади просвета ацинусов, у животных, получавших сульпирид - (контроль); сульпирид в сочетании с 4-гидроксиметил-2,6-диизоборнилфенолом, сульпирид в сочетании с n-тирозолом.
На фиг. 8 изображены результаты определения в простате АОА, у животных, получавших сульпирид - (контроль); сульпирид в сочетании с 4-гидроксиметил-2,6-диизоборнилфенолом, сульпирид в сочетании с n-тирозолом.
На фиг. 9. изображена морфологическая картина вентральной доли предстательной железы крыс а) интактных животных; б) крыс, получавших сульпирид. Адематозная форма гиперплазии. Ацинарные структуры с папиллярными разрастаниями, образование дочерних ацинусов (стрелки); в) крыс, получавших сульпирид. Центры пролиферации, состоящие из 2-3 ацинусов (стрелки); г) крыс, получавших 4-гидроксиметил-2,6-диизоборнилфенол. Уменьшение площади эпителия, снижение количества центров пролиферации. Окраска гематоксилин-эозином, × 100.
Пример 1
Эксперименты проведены на 40 белых крысах-самцах популяции Вистар (возраст 5 мес, масса тела 450-660 г), 10 из которых составили фоновую (интактные животные), 10 - контрольную и 20 экспериментальные группы. Животные были получены из отдела экспериментальных биологических моделей «ФГБУ НИИФ и РМ им. Е.Д. Гольдберга» (г. Томск). Крыс содержали в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986).
ДГПЖ железы вызывали гиперпролактинемией, для получения которой крысам-самцам вводили ежедневно в течение 60 дней сульпирид (эглонил; Синтелабо групп, Франция) [Coppenolle]. Данная модель рекомендована для экспериментального изучения эффективности лекарственных средств при ДГПЖ [13].
Все исследуемые животные были разделены на следующие группы: 1 - фон - интактные животные; 2 - контроль - сульпирид ежедневно внутрибрюшинно, в дозе 40 мг/кг и растворитель - крахмальная слизь ежедневно внутрижелудочно по 0,5 мл/100 г массы животного в течение 60 дней; 3 - опыт - сульпирид ежедневно, внутрибрюшинно, в дозе 40 мг/кг + 4-гидроксиметил-2,6-диизоборнилфенол (Институт химии Коми НЦ УрО РАН) ежедневно внутрижелудочно в дозе 10 мг/кг в течение 60 дней 4 - n-тирозол в дозе 7,8 мг/кг т.д. Через 2 мес после начала эксперимента проводили эвтаназию в СО2 камере. Для исследования была выбрана боковая доля предстательной железы, так как сульпирид даже при длительном применении не влияет на морфологию передней и задней долей [14]. Латеральную долю предстательной железы препарировали, определяли ее объем. Для проведения морфологического анализа у половины животных в группе выделенную долю предстательной железы фиксировали в 10% формалине и заливали в парафин. Депарафинированные срезы окрашивали гематоксилином и эозином. На окрашенных срезах с помощью графического компьютерного анализа на стандартной площади измеряли площадь эпителиальных структур, стромы, просвета ацинусов, вычисляли стромально-паренхиматозное соотношение. Кроме того, в 10-ти последовательных полей зрения определяли количество центров пролиферации 1) структур, состоящих из 2-3 плотно прилегающих друг к другу ацинусов (центр пролиферации первого типа), и 2) центров с дочерними ацинусами (центры пролиферации второго типа). В предстательной железе оставшейся части животных исследовали анти- и прооксидантную активность. Для этого боковую долю предстательной железы препарировали, помещали в физиологический раствор, гомогенизировали. Антиоксидантную активность определяли с помощью индуцированной люминалом хемилюминесценции и методом гашения интенсивности люминолзависимой хемилюминесценции (CL) в радикалопродуцирующей системе после добавления биологической пробы соответственно [12] с помощью кюветного биолюминометра Lumat LB9507 (Berthold Technologies, США). Количественно уровень антиоксидантной активности определяли с помощью светосуммы хемилюминесценции образца гомогената ткани, которую выражали в RLU/lr ткани/сек, где RLU (относительная единица света relative light units=10 фотонам). Результаты обрабатывали методом вариационной статистики с использованием непараметрического U критерия Манна-Уитни.
Установлено, что объем вентральной доли предстательной железы у крыс, получавших сульпирид, возрастал более чем в 4 раза (фиг. 1). В группе животных, которым на фоне сульпирида вводили 4-гидроксиметил-2,6-диизоборнилфенол, этот показатель имел тенденцию к снижению и составил 89,5% от контроля (сульпирид). При использовании n-тирозола объем железы составил 121% от контроля, т.е. имел, напротив, тенденцию к возрастанию.
В предстательной железе крыс, получавших сульпирид (контроль), отмечалось развитие аденоматозной формы доброкачественной гиперплазии, которая была представлена ацинарными структурами, окруженными прослойками соединительной ткани. В ацинусах часто встречались папиллярные разрастания эпителия. Наблюдалось также разрастание соединительной ткани стромы, появление очагов ее клеточной инфильтрации, усиленное слущивание эпителиальных клеток в просвет ацинусов (рис. 1Б). В ткани предстательной железы крыс этой группы выявлялось ряд последовательных стадий развития пролиферативных процессов, наблюдаемых при развитии ДГПЖ [15]. Начальная стадия представляла собой центры пролиферации, состоящие из 2-3 плотно прилегающих друг к другу ацинусов (пролиферативный центр первого типа, рис. 1 В, стрелки). На последующей стадии наблюдалось появление дочерних ацинусов (центры пролиферации второго типа, рис. 1Б, стрелки).
При введении 4-гидроксиметил-2,6-диизоборнилфенола количество центров пролиферации первого типа имело тенденцию к снижению и составляло 71% от контроля (фиг. 2). В простате крыс, получавших n-тирозол, этот показатель, напротив, имел тенденцию к возрастанию и составлял 129% от контроля. На фоне использования 4-гидроксиметил-2,6-диизоборнилфенола пролиферативные центры второго типа также выявлялись, но в значительно меньшей степени (фиг. 3). Так, их число в простате крыс этой группы достоверно сокращалось в 3,2 раза. Снижение этого показателя на фоне введения n-тирозол оказалось статистически не значимым.
При подсчете площади эпителия ацинусов было установлено, что введение сульпирида привело к достоверному увеличению этого показателя (фиг. 4) на 34%. Оба антиоксиданта обладали антипролиферативными свойствами. Степень выраженности этого эффекта оказалась сходной. Так, площадь эпителия на фоне введения 4-гидроксиметил-2,6-диизоборнилфенола составила 66%, n-тирозола - 58% от контрольных значений. Площадь стромы при развитии ДГПЖ достоверно возрастала (фиг. 5). В простате крыс, получавших антиоксиданты, уменьшения стромального компонента ткани не выявлялось.
Стромально-эпителиальное соотношение на фоне развития ДГПЖ имело тенденцию к снижению, что, очевидно, является результатом преобладания эпителиального компонента ткани в результате его преимущественного разрастания (фиг. 6). Следует отметить, что снижение стромально-эпителиального соотношения является одним из основных факторов развития ДГПЖ [16]. Этот показатель у крыс, получавших 4-гидроксиметил-2,6-диизоборнилфенол, достоверно превышал контрольные значения и практически не отличался от фона, что свидетельствуют о нормализации изначальной структуры ткани железы. В группе крыс, получавших n-тирозол, значение стромально-эпителиального отношения не отличалось от контроля.
В результате подсчета площади просвета ацинусов (фиг. 7) было установлено, что этот показатель в группах интактных, контрольных животных, а также крыс, получавших 4-гидроксиметил-2,6-диизоборнилфенол, оказался сходным. На фоне введения n-тирозола площадь просвета ацинусов достоверно возрастала по сравнению с контрольными и фоновыми значениями, что может свидетельствовать о развитии застойных явлений в простате. Данный факт может быть причиной, отмеченной выше, тенденции к увеличению объема железы в этой группе. Это является крайне нежелательным, так как при ДГПЖ и так существует опасность задержки мочеиспускания, обусловленная увеличением объема простаты.
Определение антиоксидантной активности ткани железы контрольных животных показало (фиг. 8), что развитие ДГПЖ привело к существенному достоверному снижению (на 75%) этого показателя. На фоне использования 4-гидроксиметил-2,6-диизоборнилфенола уровень антиоксидантной защиты статистически значимо возрастал по сравнению с контролем и достоверно не отличался от фоновых значений. Введение n-тирозола также приводило к повышению среднего значения антиоксидантной активности ткани, но этот показатель оставался достоверно сниженным по сравнению с контролем.
Полученные данные свидетельствуют о том, что 4-гидроксиметил-2,6-диизоборнилфенол является эффективным средством профилактики и терапии ДГПЖ экспериментальных животных. В пользу этого свидетельствует его существенные антипролиферативные свойства (снижение количество центров с дочерними ацинусами, площади эпителия ацинусов). n-Тирозол также обладает анти пролиферативным действием, но его эффективность оказалась выраженной в меньшей степени (судя, прежде всего, по количеству центров с дочерними ацинусами). 4-Гидроксиметил-2,6-диизоборнилфенол, в отличие от n-тирозола. не приводил к застойным явлениям в ткани, что, несомненно, способствовало его большей эффективности. Терапевтическое действие 4-гидроксиметил-2,6-диизоборнилфенола связано, судя по АОА, с его антиоксидантными свойствам. Эффективность n-тирозола на ткань простаты, в этом плане, оказалась не выраженной. Последнее позволяет заключить, что более высокая эффективность 4-гидроксиметил-2,6-диизоборнилфенола может быть связана с его антиоксидантными свойства по отношению к ткани простаты крыс с ДГПЖ.
Литература
1. Кирпатовский В.И., Марктчан К.Г., Фролова Е.В., Казаченко А.В. Роль гормональных факторов и нарушения кровоснабжения предстательной железы в патогенезе ДГПЖ // Экспериментальная и клиническая урология. 2013. №2. С.38.
2. Патологоанатомическая диагностика опухолей человека / Рук-во для врачей под ред. Краевского Н.А., Смольянникова А.В., Саркисова Д.С.М.: Медицина. 1993. Т.2. С.386.
3. Кирпатовский В.И., Мудрая И.С., Мкртчян К.Г. и др. Андрогены и хроническая ишемия - два незавависимых патогенетических фактора развития ДГПЖ // Экспериментальная и клин, урология. 2014. №2. С.20.
4. Павлов В.Н., Казихинуров А.А., Измайлов А.А. Пути оптимизации медикаментозного лечения больных с доброкачественной гиперплазией предстательной железы // Бюлл. Сиб. мед. - 2012. Т.11, №2. С.133.
5. Гудков А.В. Опыт клинического применения афалы при доброкачественной гиперплазии предстательной железы // Бюл. эксперим. биол. и мед. 2009. №8. С.57.
6. Зайцев В.И. Выбор метода лечения СНВП при ДГПЖ // Медицинские аспекты здоровья мужчины. 2011. (2). С.69.
7. Ходченкова И.П., Зарубина И.В., Шабанов П.Д. Метаболические изменения в предстательной железе и иммунный статус крыс при доброкачественной гиперплазии // Психо-фармаколог. и биол. наркология. 2005. Т.5, №4. С.1084.
8. Srivastava D.S.L, Mittal R.D. Free radical injury and antioxidant status in patint with benign prostate hyperplasia and prostate cancer // Indian J Clin Biochem. 2005 Jul. 20(2). C. 162-165.
9. Боровская Т.Г., Кривова H.A., Заева О.Б. и др. Влияние дигидрокверцитина на морфологию и антиоксидантно-прооксидантный баланс предстательной железы крыс при индуцированной сульпиридом доброкачественной гиперплазии // Бюллетень экспериментальной биологии и медицины. 2014. Том 158, №10. С.520.
10. Боровская Т.Г., Камалова С.И., Кривова Н.А. и др. Влияние n-тирозола на морфологию и антиоксидантно-прооксидантный баланс предстательной железы при индуцированной сульпиридом доброкачественной гиперплазии // Бюл. ВСНЦ СО РАМН. 2014. №5(99). С.40.
11. Кучин А.В., Чукичева И.Ю., Федорова И.В., Буравлев Е.В. Производные 2,6-диизоборнилфенола // Заявка на патент РФ №2011127776 приоритет от 06.07.2011.
12. Coppenolle V.F., Slomianny С, Carpentier F. et al. // Am. J. Physiol. Endocrinol. Metab. 2001. Vol.280, №1. p.120-129.
13. Боровская Т.Г. Фомина Т.И. Дурнев А.Д. и др. Методические рекомендации по доклиническому изучению простатотропной активности лекарственных средств // В кн. Руководство по проведению доклинических исследований лекарственных средств. Под. ред. Миронова А.Н. 41. Москва. 2013. С.736.
14. Marks L.S., Epstein J.I., Partin А.В., Simon I. et al. // J. Urol., 2000. May, 163,5. 1451-6.
15. Кудрявцев Ю.В., Сивков A.B. Морфологические изменения в ткани предстательной железы на фоне ее доброкачественной гиперплазии // Эксперим. и клин. урология. 2010. №1. С. 19-22.
16. Чайка А.В., Бородин А.Д., Черноус В.А., Вербовой П.П. Применение комплексного фитопрепарата «тадимакс» в лечении доброкачественной гиперплазии предстательной железы // Медико-социальные проблемы семьи. 2012. Т.17, №1. С.80.
Применение 4-гидроксиметил-2,6-диизоборнилфенола крысам-самцам репродуктивного возраста в качестве средства для профилактики и лечения доброкачественной гиперплазии предстательной железы.