Лечение амиотрофического бокового склероза с использованием полученных из пуповины клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способам лечения амиотрофического бокового склероза, что может быть использовано в медицине. Пациенту вводят клетки, полученные из ткани пуповины, способные к самообновлению и размножению, обладающие потенциалом к дифференцированию в клетку нейронного фенотипа. Изобретение позволяет сохранить функцию двигательных нейронов у пациента с амиотрофическим боковым склерозом. 5 н. и 24 з.п. ф-лы, 19 ил., 25 табл., 25 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ЗАЯВКИ
Настоящая заявка испрашивает преимущество заявки на патент США № 13/026995, поданной 14 февраля 2011 года, которая является частичным продолжением заявки на патент США № 12/429849, поданной 24 апреля 2009 года, которая является продолжением заявки на патент США № 10/877269, поданной 25 июня 2004 года, в настоящее время патент США № 7524489, выданный 28 апреля 2009 года, который испрашивает преимущество предварительной заявки на патент США № 60/483264, поданной 27 июня 2003 года, полное содержание которых включено в настоящий документ путем ссылки. Другие смежные заявки включают следующие одновременно находящиеся на рассмотрении заявки тех же заявителей, полное содержание каждой из которых включено в настоящий документ путем ссылки: заявка на патент США № 10/877012, поданная 25 июня 2004 года, в настоящее время патент США № 7510873, выданный 31 марта 2009 года; заявка на патент США № 10/877446, поданная 25 июня 2004 года; заявка на патент США № 10/877445, поданная 25 июня 2004 года; заявка на патент США № 10/877541, поданная 25 июня 2004 года, в настоящее время патент США № 7413734, выданный 19 августа 2008 года; заявка на патент США № 10/877009, поданная 25 июня 2004 года, в настоящее время патент США № 7560276, выданный 14 июля 2009 года; заявка на патент США № 10/876998, поданная 25 июня 2004 года; заявка на патент США № 11/315943, поданная 22 декабря 2005 года, в настоящее время патент США № 7875273, выданный 25 января 2001 года; и предварительная заявка на патент США № 60/555908, поданная 24 марта 2004 года.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится по существу к композициям, способам и наборам для клеточной или регенеративной терапии неврологических заболеваний и расстройств, таких как амиотрофический боковой склероз. Более конкретно, настоящее изобретение представляет фармацевтические композиции, устройства и способы для терапии амиотрофического бокового склероза с использованием клеток, полученных из ткани пуповины.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В ходе настоящего описания упоминаются различные патенты и другие публикации. Каждая из данных публикаций полностью включена в настоящий документ путем ссылки.
Неврологические заболевания и другие расстройства центральной и периферической нервной системы являются одними из самых тяжело протекающих заболеваний для пациента не только из-за их физических проявлений, но также и их необратимости. Одно из таких заболеваний представляет собой амиотрофический боковой склероз (АБС) (также известный как болезнь Лу Герига).
АБС представляет собой прогрессирующее нейродегенеративное заболевание, в основном поражающее двигательные нейроны и приводящее к мышечной слабости и атрофии. Заболевание характеризуется избирательной и преждевременной дегенерацией и гибелью двигательных нейронов. Пораженные нейроны страдают от потери дендритов, изменений цитоскелета и накопления белков и телец включения. АБС приводит к прогрессирующему параличу, как правило, приводящему к летальному исходу в течение нескольких лет из-за остановки дыхания, вызванного параличом дыхательных мышц. Средняя продолжительность заболевания от его появления до смерти больного составляет от трех до пяти лет. Только приблизительно 10% пациентов, страдающих АБС, продолжают жить в течение десяти или более лет. В США АБС страдают от 20000 до 30000 человек, и каждый год такой диагноз ставится еще 5000 человек.
Механизмы патогенеза АБС до конца не выяснены, однако считается, что АБС обусловлен рядом процессов, включая дисфункцию митохондрий, окислительный стресс, эксайтотоксичность, а также изменения в цитоскелете, аксональном транспорте, процессинге белков и кальциевом гомеостазе (Ilieva et al. (2009 г.), J. Cell Biol. 187: 761-72). Несмотря на значительные усилия, в настоящее время имеются лишь очень ограниченные терапевтические возможности замедления течения заболевания, хотя некоторые успехи достигнуты в паллиативной терапии. Аллогенная клеточная терапия может обеспечить эффективную многофакторную терапию при лечении АБС путем стимулирования трофических факторов, что приводит к снижению дегенерации двигательных нейронов, сохранению функций двигательных нейронов и продлению жизни.
В связи с очень тяжелым протеканием АБС и нехваткой подходов к его лечению существует значительная потребность в создании способов лечения АБС у пациента и тем самым повышения качества жизни пациента.
СУЩНОСТ Ь ИЗОБРЕТЕНИЯ
Описанные проблемы решаются с использованием композиций, способов и наборов, представленных в примерах осуществления, описанных в настоящем документе. Настоящее изобретение представляет композиции и способы, применимые к клеточной или регенеративной терапии неврологических заболеваний и расстройств, таких как амиотрофический боковой склероз. В частности, в настоящем изобретении предложены фармацевтические композиции, устройства и способы для регенерации или восстановления нервной ткани с использованием клеток, полученных из ткани пуповины.
В одном аспекте настоящего изобретения предложена выделенная клетка, полученная из ткани пуповины и по существу свободная от крови, причем клетка способна к самообновлению и размножению в культуре и обладает потенциалом к дифференцированию в клетку нейронного фенотипа; причем для роста клетке необходим L-валин, и клетка способна расти в среде, содержащей по меньшей мере приблизительно 5% кислорода. Данная клетка дополнительно обладает одной или более из следующих характеристик: (a) потенциал к по меньшей мере приблизительно 40 удвоениям в культуре; (b) закрепление и размножение на поверхности сосуда для культивирования с покрытием или без покрытия, причем сосуд для культивирования с покрытием содержит покрытие из желатина, ламинина, коллагена, полиорнитина, витронектина или фибронектина; (c) выработка по меньшей мере одного из тканевого фактора, виментина и альфа-актина гладких мышц; (d) выработка по меньшей мере одного из CD10, CD13, CD44, CD73, CD90, PDGFr-альфа, PD-L2 и HLA-A, B, C; (e) отсутствие выработки по меньшей мере одного из CD31, CD34, CD45, CD80, CD86, CD117, CD141, CD178, B7-H2, HLA-G и HLA-DR, DP, DQ по результатам анализа с использованием проточной цитометрии; (f) экспрессия гена, которая, по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости, повышена для по меньшей мере одного из генов, кодирующих: интерлейкин-8; ретикулон 1; CXCL1 (хемокиновый (мотив C-X-C) лиганд 1/стимулятор активности роста меланомы, альфа); CXCL6 (хемокиновый (мотив C-X-C) лиганд 6/белок хемотаксиса гранулоцитов 2)); CXCL3 (хемокиновый (мотив C-X-C) лиганд 3); TNFAIP3 (индуцируемый фактором некроза опухоли альфа белок 3); (g) экспрессия гена, которая, по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости, понижена для по меньшей мере одного из генов, кодирующих: SHOX2 (содержащий гомеобокс ген низкорослости 2); HSPB2 (27 кДа белок теплового шока 2); CXCL12 (хемокиновый (мотив C-X-C) лиганд 12/стромальный фактор 1); эластин (надклапанный аортальный стеноз, синдром Вильямса-Бойрена); мРНК Homo sapiens; кДНК DKFZp586M2022 (из клона DKFZp586M2022); Meox2 (содержащий мезенхимальный гомеобокс ген 2, содержащий гомеобокс блокировки роста ген); SIX1 (гомолог содержащего гомеобокс гена sine oculis 1) (Drosophila); кристаллин, альфа B; DAAM2 (ассоциированный с белком Disheveled активатор морфогенеза 2); белок DKFZP586B2420; аналог нейтралина 1; тетранектин (связывающийся с плазминогеном белок); STAC (ген, содержащий домен src-гомологии 3 (SH3) и богатый цистеином домен); холестерин-25-гидроксилаза; RUNX3 (связанный с карликовостью фактор транскрипции 3); рецептор интерлейкина-11, альфа; PCOLCE (усилитель проколлаген-C-эндопептидазы); FZD7 (гомолог frizzled 7) (Drosophila); гипотетический ген BC008967; коллаген, тип VIII, альфа 1; TNC (тенасцин C, гексабрахион); IRX5 (содержащий гомеобокс IRX белок 5); гефестин; интегрин, бета 8; SV2A (гликопротеин синаптического пузырька 2); NBL1 (нейробластома, ген подавления онкогенности 1); IGFBP2 (связывающийся с инсулиноподобным фактором роста белок 2, 36 кДа); кДНК Homo sapiens FLJ12280 fis, клон MAMMA1001744; CRLF1 (подобный цитокиновому рецептору фактор 1); KCNN4 (активируемый кальцием калиевый канал средней/низкой проводимости, подсемейство N, член 4); интегрин, бета 7; транскрипционный коактиватор с мотивом связывания с PDZ (TAZ); SIX2 (гомолог содержащего гомеобокс гена sine oculis 2) (Drosophila); белок KIAA1034; VAMP5 (везикуло-ассоциированный мембранный белок 5/миобревин); EFEMP1 (содержащий EGF фибулинподобный белок внеклеточного матрикса 1); EGR3 (белок раннего ростового ответа 3); DLX5 (содержащий гомеобокс distal-less ген 5); гипотетический белок FLJ20373; AKR1C3 (альдокеторедуктаза семейства 1, член C3/3-альфа-гидроксистероиддегидрогеназа, тип II); бигликан; транскрипционный коактиватор с мотивом связывания с PDZ (TAZ); фибронектин 1; проэнкефалин; интегрин, бета-подобный 1 (с доменами EGF-подобных повторов); мРНК Homo sapiens, полноразмерная вставка кДНК, клон EUROIMAGE 1968422; EphA3; белок KIAA0367; NPR3 (рецептор натрийуретического пептида C/гуанилатциклаза C/рецептор атрионатрийуретического пептида C); гипотетический белок FLJ14054; мРНК Homo sapiens; кДНК DKFZp564B222 (из клона DKFZp564B222); BNIP3L (ген белка, подобного белку 3, взаимодействующему с BCL2/белком аденовируса E1B 19 кДа); AE-связывающий белок 1; COX7A1 (полипептид 1 субъединицы VIIa цитохром c оксидазы) (мышечный); аналог нейтралина 1; BTG1 (ген транслокации B-клеток 1); гипотетический белок FLJ23191; и DKFZp586L151, (h) секреция по меньшей мере одного из MCP-1, IL-6, IL-8, GCP-2, HGF, KGF, FGF, HB-EGF, BDNF, TPO, MIP1a, RANTES и TIMP1; и (i) отсутствие секреции по меньшей мере одного из TGF-бета2, ANG2, PDGFbb, MIP1b, I309, MDC и VEGF по результатам ИФА.
В конкретных вариантах осуществления клетка, полученная из пуповины, имеет все идентификационные признаки любого из: клеточного типа UMB 022803 (P7) (№ доступа ATCC PTA-6067) или клеточного типа UMB 022803 (P17) (№ доступа ATCC PTA-6068).
В определенных вариантах осуществления клетки, полученные из ткани пуповины, выделяют в присутствии одной или более ферментативных активностей, содержащих металлопротеазную активность, муколитическую активность и нейтральнопротеазную активность. Предпочтительно клетки имеют нормальный кариотип, который сохраняется в процессе пассирования клеток при культивировании. В предпочтительных вариантах осуществления клетки, полученные из послеродового материала, содержат каждый из CD10, CD13, CD44, CD73, CD90, PDGFr-альфа и HLA-A, B, C и не содержат любой из CD31, CD34, CD45, CD117, CD141 или HLA-DR, DP, DQ по результатам анализа с использованием проточной цитометрии.
В другом аспекте настоящего изобретения предложена популяция клеток, содержащая клетки, полученные из ткани пуповины, как описано выше. В одном варианте осуществления популяция представляет собой по существу однородную популяцию клеток, полученных из ткани пуповины. В конкретном варианте осуществления популяция содержит клональную клеточную линию клеток, полученных из ткани пуповины. В другом варианте осуществления популяция представляет собой неоднородную популяцию, содержащую клетки, полученные из ткани пуповины, и клетки по меньшей мере одного другого типа. В определенных вариантах осуществления клетки другого типа представляют собой астроциты, олигодендроциты, нейроны, предшественники нейронов, нейронные стволовые клетки или другие мультипотентные или плюрипотентные стволовые клетки. В других вариантах осуществления популяцию клеток культивируют в контакте с одним или более факторами, которые стимулируют дифференцирование стволовых клеток в направлении нейронной линии дифференцирования.
В соответствии с настоящим изобретением также предложен клеточный лизат, приготовленный из клеток, полученных из ткани пуповины. Клеточный лизат можно разделить на фракцию, обогащенную мембранными фрагментами, и растворимую клеточную фракцию. Настоящее изобретение также представляет внеклеточный матрикс, продуцируемый клетками, полученными из ткани пуповины, а также кондиционированную среду, в которой выращивали клетки.
В другом аспекте настоящего изобретения предложен способ лечения пациента с нейродегенеративным состоянием, причем способ содержит введение пациенту клеток, полученных из ткани пуповины, как описано выше, в количестве, эффективном для лечения нейродегенеративного состояния. В определенных вариантах осуществления нейродегенеративное состояние представляет собой острое нейродегенеративное состояние, такое как травма головного мозга, травма спинного мозга или травма периферического нерва. В других вариантах осуществления данное состояние представляет собой хроническое или прогрессирующее нейродегенеративное состояние, такое как болезнь Паркинсона, болезнь Альцгеймера, болезнь Хантингтона, амиотрофический боковой склероз, опухоль, рассеянный склероз или хроническая травма периферического нерва.
В одном варианте осуществления клетки, полученные из ткани пуповины, перед введением индуцируют in vitro для дифференцирования в клетки нейронной линии дифференцирования. В другом варианте осуществления клетки модифицируют методами генетической инженерии для выработки продукта гена, который способствует лечению нейродегенеративного состояния.
В определенных вариантах осуществления клетки вводят вместе с клетками по меньшей мере одного другого типа, такими как астроциты, олигодендроциты, нейроны, предшественники нейронов, нейронные стволовые клетки или иные мультипотентные или плюрипотентные стволовые клетки. В данных вариантах осуществления клетки другого типа можно вводить одновременно, до или после клеток, полученных из ткани пуповины. Аналогичным образом в данных или других вариантах осуществления клетки вводят вместе с по меньшей мере одним другим агентом, таким как лекарственное средство для нейронной терапии или другой полезный вспомогательный агент, такой как противовоспалительный агент, противоапоптозные агенты, антиоксидант или фактор роста. В данных вариантах осуществления другой агент можно вводить одновременно, до или после клеток, полученных из ткани пуповины.
В определенных вариантах осуществления клетки вводят в заранее определенное место в центральной или периферической нервной системе пациента. Их можно вводить путем инъекции или инфузии или инкапсулировать в имплантируемое устройство, либо путем имплантации содержащей клетки матрицы или каркаса.
Один вариант осуществления настоящего изобретения представляет собой способ лечения амиотрофического бокового склероза, содержащий введение пациенту клеток, полученных из ткани пуповины, в количестве, эффективном для лечения амиотрофического бокового склероза. В данном варианте осуществления клетки, полученные из ткани пуповины, выделены из ткани пуповины человека и по существу свободны от крови, способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцированию в клетки других фенотипов, могут произвести по меньшей мере 40 удвоений и обладают следующими характеристиками: (a) экспрессия каждого из CD10, CD13, CD44, CD73, CD90, PDGFr-альфа, PD-L2 и HLA-A, B, C; (b) отсутствие экспрессии любого из CD31, CD34, CD45, CD80, CD86, CD 117, CD141, CD178, B7-H2, HLA-G или HLA-DR, DP, DQ; и (c) повышенная экспрессия интерлейкина-8, ретикулона 1 и CXCL3 (хемокинового (мотив C-X-C) лиганда 3) по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости. В другом варианте осуществления способа клетки, полученные из ткани пуповины, не экспрессируют hTERT или теломеразу. В еще одном варианте осуществления клетки, полученные из ткани пуповины, вводят путем инъекции (такой как, например, внутривенная или подоболочечная инъекция) или инфузии. В одном варианте осуществления клетки, полученные из ткани пуповины, оказывают трофический эффект на нервную систему пациента.
Другой вариант осуществления настоящего изобретения представляет собой способ лечения амиотрофического бокового склероза, содержащий введение пациенту эффективного количества по существу однородной популяции клеток, полученных из ткани пуповины. В данном варианте осуществления популяция клеток, полученных из ткани пуповины, выделена из ткани пуповины человека и по существу свободна от крови, способна к самообновлению и размножению в культуре, обладает потенциалом к дифференцированию в клетки других фенотипов, может произвести по меньшей мере 40 удвоений и обладает следующими характеристиками: (a) экспрессия каждого из CD10, CD13, CD44, CD73, CD90, PDGFr-альфа, PD-L2 и HLA-A, B, C; (b) отсутствие экспрессии любого из CD31, CD34, CD45, CD80, CD86, CD 117, CD141, CD178, B7-H2, HLA-G или HLA-DR, DP, DQ; и (c) повышенная экспрессия интерлейкина-8, ретикулона 1 и CXCL3 (хемокинового (мотив C-X-C) лиганда 3) по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости. В одном варианте осуществления клетки, полученные из ткани пуповины, не экспрессируют hTERT или теломеразу. В другом варианте осуществления по существу однородную популяцию клеток, полученных из ткани пуповины, вводят путем инъекции или инфузии. В альтернативном варианте осуществления по существу однородную популяцию клеток, полученных из ткани пуповины, вводят путем внутривенной или подоболочечной инъекции. В другом варианте осуществления по существу однородная популяция клеток, полученных из ткани пуповины, оказывает трофический эффект на нервную систему пациента.
Другой вариант осуществления настоящего изобретения представляет собой способ лечения амиотрофического бокового склероза, содержащий введение пациенту фармацевтической композиции, содержащей клетки, полученные из ткани пуповины, в количестве, эффективном для лечения амиотрофического бокового склероза. В данном варианте осуществления клетки, полученные из ткани пуповины, выделены из ткани пуповины человека и по существу свободны от крови, способны к самообновлению и размножению в культуре, обладают потенциалом к дифференцированию в клетки других фенотипов, могут произвести по меньшей мере 40 удвоений и обладают следующими характеристиками: (a) экспрессия каждого из CD10, CD13, CD44, CD73, CD90, PDGFr-альфа, PD-L2 и HLA-A, B, C; (b) отсутствие экспрессии любого из CD31, CD34, CD45, CD80, CD86, CD 117, CD141, CD178, B7-H2, HLA-G или HLA-DR, DP, DQ; и (c) повышенная экспрессия интерлейкина-8, ретикулона 1 и CXCL3 (хемокинового (мотив C-X-C) лиганда 3) по сравнению с клеткой человека, представляющей собой фибробласт, мезенхимальную стволовую клетку или клетку костного мозга гребня подвздошной кости. В одном варианте осуществления клетки, полученные из ткани пуповины, не экспрессируют hTERT или теломеразу. В еще одном варианте осуществления клетки, полученные из ткани пуповины, вводят путем инъекции (такой как, например, внутривенная или подоболочечная инъекция) или инфузии. В одном варианте осуществления клетки, полученные из ткани пуповины, оказывают трофический эффект на нервную систему пациента.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция для лечения пациента с нейродегенеративным состоянием, таким как амиотрофический боковой склероз, содержащая фармацевтически приемлемый носитель и описанные выше клетки, полученные из ткани пуповины. Нейродегенеративное состояние, нуждающееся в лечении, может представлять собой острое нейродегенеративное состояние или может представлять собой хроническое или прогрессирующее состояние.
В определенных вариантах осуществления фармацевтическая композиция содержит клетки, перед приготовлением композиции индуцированные in vitro для дифференцирования в клетки нейронной линии дифференцирования, или клетки, модифицированные методами генетической инженерии для выработки продукта гена, который способствует лечению нейродегенеративного состояния.
В определенных вариантах осуществления фармацевтическая композиция содержит клетки по меньшей мере одного другого типа, такие как астроциты, олигодендроциты, нейроны, предшественники нейронов, нейронные стволовые клетки или другие мультипотентные или плюрипотентные стволовые клетки. В данных или других вариантах осуществления фармацевтическая композиция содержит по меньшей мере один другой агент, такой как лекарственное средство для нейронной терапии, или другой полезный вспомогательный агент, такой как противовоспалительный агент, противоапоптозные агенты, антиоксидант или фактор роста.
В определенных вариантах осуществления фармацевтическую композицию готовят для введения путем инъекции или инфузии. В альтернативном варианте осуществления композиция может содержать имплантируемое устройство с инкапсулированными клетками или матрицу или каркас, содержащие клетки.
В соответствии с другим аспектом настоящего изобретения предложен набор для лечения пациента с нейродегенеративным состоянием. Набор содержит фармацевтически приемлемый носитель, популяцию описанных выше клеток, полученных из ткани пуповины, и инструкции по использованию набора в соответствии со способом лечения пациента. Набор может дополнительно содержать по меньшей мере один реагент и инструкции по культивированию клеток, полученных из ткани пуповины. Он также может содержать популяцию клеток по меньшей мере одного другого типа или по меньшей мере один другой агент для лечения нейродегенеративного состояния.
В соответствии с другим аспектом настоящего изобретения предложен способ лечения пациента с нейродегенеративным состоянием (таким как, например, амиотрофический боковой склероз), который содержит введение пациенту препарата, изготовленного из описанных выше клеток, полученных из ткани пуповины. Такой препарат может содержать клеточный лизат (или его фракцию) из клеток, полученных из ткани пуповины, внеклеточный матрикс клеток, полученных из ткани пуповины, или кондиционированную среду, в которой выращивали клетки, полученные из ткани пуповины. В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и препарат, изготовленный из клеток, полученных из ткани пуповины, который может представлять собой клеточный лизат (или его фракцию) из клеток, полученных из ткани пуповины, внеклеточный матрикс клеток, полученных из ткани пуповины, или кондиционированную среду, в которой выращивали клетки, полученные из ткани пуповины. Также предложены наборы для реализации на практике данного аспекта настоящего изобретения. Данные наборы могут включать один или более из фармацевтически приемлемого носителя или другого агента или реагента, один или более из клеточного лизата или его фракции, внеклеточного матрикса или кондиционированной среды для клеток, полученных из ткани пуповины, а также инструкции по использованию компонентов набора.
Другие характеристики и преимущества настоящего изобретения станут понятны после изучения следующего подробного описания и примеров.
КРАТКОЕ ОПИСАНИЕ ФИГУР
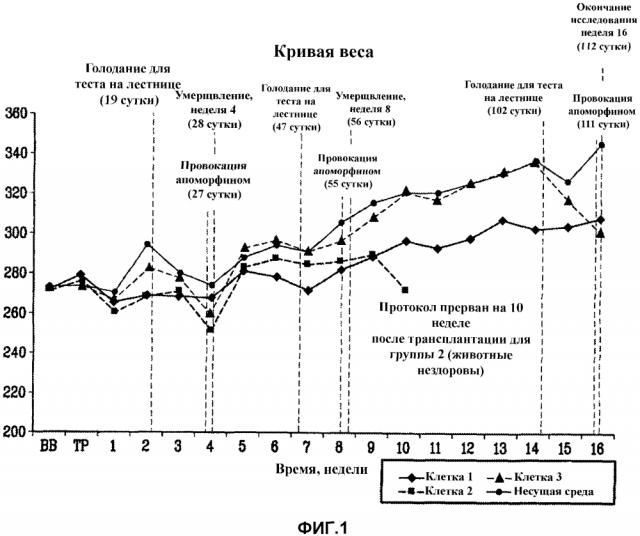
На фиг.1 представлены результаты контроля веса животных на протяжении исследования.
На фиг.2 представлен отклик различных групп клеток на провокационную пробу с апоморфином.
На фиг.3 представлены результаты мониторинга различий в количестве поворотов головы налево и направо на протяжении исследования.
На фиг.4 представлены результаты мониторинга потребления корма животными на протяжении исследования с использованием лестничного испытания.
На фиг.5 представлены гистограммы с результатами качественного анализа окрашивания на (а) Iba-1; (b) ED-1; и (c) DAPI клеточных трансплантатов в соответствии со следующими критериями: 0 = нет (отсутствие клеток); 1 = видимое окрашивание; 2 = достаточное окрашивание; 3 = очень густое окрашивание; 4 = плотное окрашивание.
На фиг.6 представлены гистограммы с результатами качественного анализа окрашивания на (а) GFAP и (b) виментин клеточных трансплантатов в соответствии со следующими критериями: 0 = нет (отсутствие клеток); 1 = видимое окрашивание; 2 = достаточное окрашивание; 3 = очень густое окрашивание; 4 = плотное окрашивание.
На фиг.7 представлен эффект клеток, полученных из ткани пуповины человека (hUTC), на выживаемость в крысиной модели АБС SOD1 (G93A) для (A) групп 1 и 2 и (B) групп 3 и 4.
На фиг.8 представлены продолжительности жизни животных в группах, получавших несущую среду в качестве контроля и получавших hUTC (смотрите пример 21). Гистограмма показывает, что в группах, получавших клетки, особенно в группе исследования 2, продолжительность жизни была на 15,75 суток (2,25 нед., P<0,035) больше, чем в группах, получавших несущую среду, хотя возраст, при котором начиналась болезнь, был аналогичным.
На фиг.9 представлены результаты измерения двигательной активности животных, получавших или не получавших клетки hUTC. На фиг.9А представлены результаты теста по BBB-шкале (Basso-Beattie-Bresnahan) для групп 1 и 2. На фиг.9B представлены результаты теста «наклонная плоскость» для групп 1 и 2. На фиг.9C представлены результаты теста по BBB-шкале для групп 3 и 4. На фиг.9D представлены результаты теста «наклонная плоскость» для групп 3 и 4. Представленные данные показывают разделение по двум главным требованиям мышечной слабости для групп, получавших несущую среду и клетки.
На фиг.10 представлена кривая выживаемости для 10-недельной группы исследования (по всем субъектам).
На фиг.11 представлена кривая выживаемости для 12-недельной группы исследования (по всем субъектам).
На фиг.12 представлена кривая выживаемости для 12-недельной группы исследования (последние две пары).
На фиг.13 представлены результаты теста «наклонная плоскость» для 10-недельной группы исследования.
На фиг.14 представлены результаты теста по BBB-шкале для 10-недельной группы исследования.
На фиг.15 представлены результаты теста «наклонная плоскость» для первых шести пар из 12-недельной группы исследования.
На фиг.16 представлены результаты теста «наклонная плоскость» для последних двух пар из 12-недельной группы исследования.
На фиг.17 представлены результаты по BBB-шкале для первых шести пар из 12-недельной группы исследования.
На фиг.18 представлены результаты по BBB-шкале для последних двух пар из 12-недельной группы исследования.
На фиг.19 представлен вид окрашенных крезиловым фиолетовым сечений поясничного отдела спинного мозга крыс SOD1 G93A. На фиг.19А представлен вид окрашенных крезиловым фиолетовым сечений поясничного отдела спинного мозга для животных с нечетными номерами. На фиг.19B представлен вид окрашенных крезиловым фиолетовым сечений поясничного отдела спинного мозга для животных с четными номерами. На фиг.19C представлен вид окрашенных крезиловым фиолетовым сечений поясничного отдела спинного мозга для нормальных животных.
ПОДРОБНОЕ ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ
Определения
Для различных терминов, используемых в описании и формуле изобретения, приняты следующие определения.
Стволовые клетки представляют собой недифференцированные клетки, определяющиеся по способности на уровне единичной клетки как самообновляться, так и дифференцироваться для получения клеток-потомков, включая самообновляющихся предшественников, необновляющихся предшественников и окончательно дифференцированные клетки. Стволовые клетки также характеризуются своей способностью дифференцирования in vitro в функциональные клетки различных клеточных линий дифференцирования из множества зародышевых листков (энтодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от множества зародышевых листков, и способствовать образованию по существу большинства, если не всех, тканей после инъекции в бластоцисты.
По своему потенциалу развития стволовые клетки разделяются на: (1) тотипотентные; (2) плюрипотентные; (3) мультипотентные; (4) олигопотентные; и (5) унипотентные. Тотипотентные клетки способны преобразовываться во все типы эмбриональных и внеэмбриональных клеток. Плюрипотентные клетки способны преобразовываться во все типы эмбриональных клеток. Мультипотентные клетки включают клетки, способные преобразовываться в подмножество клеточных линий дифференцирования, но в рамках конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (ГСК) могут вырабатывать потомков, которые включают ГСК (самообновление), олигопотентные ограниченные клетки-предшественники крови и все типы клеток и элементов (например, тромбоциты), которые представляют собой нормальные компоненты крови). Клетки, которые являются олигопотентными, способны преобразовываться в более ограниченное подмножество клеточных линий дифференцирования, чем мультипотентные стволовые клетки; а клетки, которые являются унипотентными, способны преобразовываться в единственную клеточную линию дифференцирования (например, сперматогенные стволовые клетки).
Стволовые клетки также разделяются на категории по источнику их потенциального получения. Взрослая стволовая клетка по существу представляет собой мультипотентную недифференцированную клетку, присутствующую в ткани, содержащей множество дифференцированных типов клеток. Взрослая стволовая клетка способна к самообновлению. В нормальных условиях они также могут дифференцироваться для получения специализированных типов клеток той ткани, в которой они находятся, а также, возможно, тканей других типов. Эмбриональная стволовая клетка представляет собой плюрипотентную клетку из внутренней клеточной массы эмбриона на стадии бластоцисты. Фетальная стволовая клетка представляет собой клетку, происходящую из тканей или мембран плода. Неонатальная стволовая клетка представляет собой мультипотентную или плюрипотентную клетку, происходящую по существу из доступной после родов внеэмбриональной ткани, а именно плаценты и пуповины. Известно, что данные клетки обладают признаками, характерными для плюрипотентных стволовых клеток, включая быструю пролиферацию и потенциал дифференцирования в клетки многих клеточных линий дифференцирования. Неонатальные стволовые клетки можно получить из крови (например, клетки, полученные из пуповинной крови) или получить не из крови (например, из отличных от крови тканей пуповины и плаценты).
Эмбриональную ткань, как правило, определяют как ткань, происходящую из эмбриона (что для человека обозначает срок развития от оплодотворения до приблизительно шести недель). Ткань плода обозначает ткань, происходящую из плода, что для человека обозначает срок развития от приблизительно шести недель до рождения. Внеэмбриональная ткань представляет собой ткань, связанную с эмбрионом или плодом, но не происходящую из них. Внеэмбриональные ткани включают внеэмбриональные мембраны (хорион, амнион, желточный мешок и аллантоис), пуповину и плаценту (которая самостоятельно образована из хориона и базальной отпадающей материнской плаценты).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает характеристики специализированной клетки, например, такой как нервная клетка или мышечная клетка. Дифференцированная клетка представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцирования клетки. Термин «коммитированный» применительно к способу дифференцирования относится к клетке, дошедшей в процессе дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцирование до конкретного типа клеток или подмножества типов клеток и не сможет в нормальных условиях дифференцироваться в другой тип клеток или вернуться к менее дифференцированному типу. Дедифференцирование обозначает процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования клетки. В настоящем документе линия дифференцирования клетки определяет наследственность клетки, т.е. из каких клеток она произошла и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования.
В широком смысле клетка-предшественник представляет собой клетку, обладающую способностью образовывать клетки-потомки, которые будут более дифференцированы по сравнению с ней, и при этом сохраняющую способность к восполнению пула клеток-предшественников. По данному определению стволовые клетки также сами являются клетками-предшественниками, так же как и более непосредственные предшественники окончательно дифференцированных клеток. При описании клеток, составляющих предмет настоящего изобретения, как более подробно описано ниже, можно использовать данное широкое определение клетки-предшественника. В более узком смысле клетку-предшественник часто определяют как клетку, которая является промежуточным предшественником в процессе дифференцирования, т.е. она происходит из стволовой клетки и является промежуточным звеном в получении зрелого типа клеток или подмножества типов клеток. Клетки-предшественники данного типа по существу не способны к самообновлению. Соответственно при отсылке к клетке данного типа в настоящем документе она будет называться «необновляющейся клеткой-предшественником» или «промежуточной клеткой-предшественником».
В настоящем документе фраза «дифференцируется в нейронную линию дифференцирования или фенотип» относится к клетке, которая становится частично или полностью коммитированной к конкретному нейронному фенотипу ЦНС или ПНС, т.е. нейрону или глиальной клетке, причем последняя категория включает, без ограничений, астроциты, олигодендроциты, шванновские клетки и микроглии.
Клетки, составляющие предмет настоящего изобретения, по существу называются «клетками, полученными из ткани пуповины» (либо UTC, либо hUTC). Они также могут иногда называться «клетками, полученными из пуповины» (UDC). Кроме того, клетки могут быть описаны как являющиеся стволовыми клетками или клетками-предшественниками, причем последний термин используется в широком смысле. Термин «полученный из» используется для указания того, что клетки были получены из их биологического источника и были выращены или иным образом обработаны in vitro (например, культивированы в ростовой среде для размножения популяции и/или получения клеточной линии). Манипуляции in vitro над пуповинными стволовыми клетками и уникальные характеристики клеток, полученных из пуповины, которые составляют предмет настоящего изобретения, более подробно описаны ниже.
Для описания клеток в процессе культивирования используются различные термины. Культура клеток по существу обозначает клетки, взятые из живого организмам и выращенные в контролируемых условиях («в культуре» или «культивированные»). Первичная культура клеток обозначает культуру клеток, тканей или органов, взятых непосредственно из организма(ов) до первого пересева. Клетки размножают в культуре, когда их помещают в ростовую среду в условиях, облегчающих рост и/или деление клеток, что приводит к большей популяции клеток. При размножении клеток в культуре скорость пролиферации клеток иногда измеряют по количеству времени, которое необходимо клеткам для удвоения численности. Данное время называют временем удвоения.
Клеточная линия представляет собой популяцию клеток, образованную одним или более пересевами из первичной культуры клеток. Каждый цикл пересева называют пассажем. Клетки, которые пересеивают, называются клетками, которые пассированы. Конкретная популяция клеток, или клеточная линия, иногда относится или характеризуется количеством выполненных с ней пассажей. Например, пассированная десять раз культивируемая популяция клеток может называться культурой P10. Первичная культура, т.е. первая культура после выделения клеток из ткани, обозначается P0. После первого пересева клетки описывают как вторичную культуру (P1, или культура первого пассажа). После второго пересева клетки превращаются в третичную культуру (P2, или культура второго пассажа) и т.п. Специалистам в данной области будет понятно, что за период пассирования популяция клеток может многократно удваиваться; следовательно, количество удвоений популяции в культуре больше номера пассажа. Степень размножения клеток (т.е. количество удвоений популяции) за период времени между п