Способ регулирования процесса селективной флотации
Иллюстрации
Показать всеИзобретение относится к способу регулирования селективной флотации. Способ регулирования процесса селективной флотации включает дозировку сульфидизатора, активаторов, депрессирующих реагентов и собирателей по электрохимическим параметрам пульпы. В потоке пульпы измеряют разность потенциалов между двумя электродами: молибденовым и ионоселективным электродом, в качестве которого используют или аргентитовый, или оловянный, или никелевый. По отклонению измеренной разности потенциалов биметаллической электродной пары от заданной оптимальной величины корректируют подачу сульфидизатора, активатора, ксантогената и депрессирующих реагентов таким образом, что при увеличении разности потенциалов увеличивают дозировку реагентов, а при уменьшении разности потенциалов дозировку реагентов уменьшают. Технический результат - повышение надежности подачи и точности контроля дозировки депрессирующих реагентов. 19 ил., 7 табл., 4 пр.
Реферат
Изобретение относится к способу регулирования селективной флотации, включающем разделение минералов с помощью реагентов - сульфидизатора, депрессоров, дозировка которых корректируется по электрохимическому потенциалу пульпы.
В процессе флотации широко известно применение для контроля электрохимических свойств пульпы электродных систем на основе металлических и кристаллических электродов для измерения окислительного потенциала (Eh) пульпы и концентрации в ней ионов различных реагентов. Измерение потенциалов указанных электродов производится по отношению к референтному электроду, например, насыщенному хлорсеребряному или каломельному электроду, по известной схеме (Кантерев В.М., Казаков А.В., Кулаков М.В. «Потенциометрические и титрометрические приборы», М., изд-во «Машиностроение», 1969, стр. 17-18.
Классическая схема потенциометрии первоначально предназначалась исключительно для лабораторных исследований. Применение такой системы в жестких промышленных условиях вызвало значительные трудности.
Применение референтного электрода в представленной системе измерения является основным недостатком таких систем контроля из-за ненадежности данного электрода. Главной причиной ненадежности референтного электрода является известкование поверхности чувствительного элемента и обрастание минеральными частицами перерабатываемой руды, особенно при применении известковой технологии. Такие электроды требуют постоянного пополнения раствором KCl и требуют частого обслуживания.
К недостаткам существующих промышленных систем контроля следует также отнести нестабильность электродных функций применяемых измерительных датчиков, что требует постоянного ручного контроля работы систем регулирования дозировки депрессоров и повышает эксплуатационные расходы.
Селективная флотация сульфидов с применением сульфидизатора является широко распространенной областью флотационного обогащения. Основы коррекции дозировки сульфидизатора по электрохимическим параметрам флотационной пульпы с помощью сульфид-серебряного электрода заложены еще в XIX веке (Никольский Н.К. «Автоматический контроль и регулирование процессов сульфидизации и сульфидной депрессии минералов при флотации», М., изд-во Недра, 1969. стр. 147). Потенциал сульфид-серебряного электрода (металлическое серебро, на поверхности которого наносится пленка сульфида-серебра) определяется электрохимическими реакциями:
Практика промышленного применения сульфид-серебряных электродов показала низкую надежность их работы, особенно при низких концентрациях сульфидных ионов в пульпе. В связи с этим получили развитие работы по разработке способов селективной флотации с применением сульфидизатора, дозировка которого корректировалась по электрохимическому потенциалу, измеренному с помощью платинового электрода (SU, а.с. №199048, B03D 1/14, 1966 г.).
Целью изобретения явилось измерение остаточной концентрации ионов серы с помощью платинового и референтного электродов взамен ненадежного сульфид-серебряного электрода. Однако следует отметить недостатки платиновых электродов. Электроды характеризуются невоспроизводимостью электродных функций для различных серийно выпускаемых образцов. Потенциал платинового электрода существенно зависит от чистоты металла, формы электрода, способа обработки поверхности, концентрации растворенных в жидкой фазе кислорода и водорода. Аналогичные способы контроля электрохимического потенциала с помощью платинового электрода, и имеющие те же недостатки, предложены в патентах:
US, патент №4.011.072. кл. B03D 1/08, 1977 г.;
US, патент №3.883.421 кл. 209/1; 209/166, 1975 г..
В практике флотации до настоящего времени остается актуальным вопрос о способе автоматической дозировки ксантогената. Эта проблема может быть решена с помощью Ag2S-электрода. Механизм работы Ag2S-электрода определяется электрохимической реакцией
Известна возможность контроля дозировки собирателей по Ag2S-электроду (SU, а.с. №9000859, кл. B03D 1/00, 1979 г.).
Отличительной особенностью известного способа является совместное применение аэрофлота и ксантогената. К недостаткам предлагаемого способа следует отнести то, что он не исключает лабораторной стадии при его реализации.
Представляет интерес способ регулирования процесса разделения медно-свинцового концентрата (SU, а.с. №629974, кл. B03D 1/00, 1977 г.).
Авторы отмечают, что в селективной флотации коллективного медно-свинцового концентрата по цинк-цианистому методу дозировка депрессирующих реагентов (ZnSO4 и NaCN) для создания необходимой их концентрации в пульпе зависит от сорбционной емкости руды по отношению к этим реагентам, что определяется свойствами перерабатываемой руды. Как показывает практика, эти свойства часто меняются, в результате чего при постоянной загрузке депрессоров, определяемой для какого-то среднего состава руды, в пульпе часто имеет место избыток или недостаток, это приводит к нарушению селективности и повышению потерь металлов в разноименных концентратах. Поэтому контроль и автоматическое регулирование процесса флотационного разделения коллективного концентрата имеет большое практическое значение. Предложенный способ отличается тем, что в жидкой фазе пульпы определяют концентрацию цинка и корректируют расход цианида натрия в количестве, обеспечивающем образование комплексов Zn(CN)3--Zn(CN)4-2. Предложенный способ был реализован на Джезказганской фабрике на базе вольтамперометрического анализатора с применением стационарного ртутного электрода с принудительным обновлением ртутной капли. Естественно такой способ мог быть реализован только с помощью системы отбора и фильтрации флотационной пульпы. Возможность осуществления такого контроля является исключением из общей практики флотационного обогащения. Обычно электрохимические параметры в отобранной жидкой фазе пульпы не соответствуют параметрам пульповых продуктов.
Наиболее близким по технической сущности и достигаемому результату к предложенному, является способ регулирования процесса селективной флотации, включающий дозировку сульфидизатора, активаторов, депрессирующих реагентов и собирателей по электрохимическим параметрам пульпы (RU, патент №2372145, кл. B03D 1/02, 2008 г.).
Одной из главных отличительных особенностей известного способа является осуществление корректировки дозирования дитиокарбамата по концентрации анионов депрессора в пульпе с помощью дитиокарбамат-селективного электрода, потенциал которого измеряется по отношению к насыщенному хлорсеребряному электроду сравнения. В отличительной особенности способа фиксируется оптимальной значение дитиокарбамат-селективного электрода от минус 380 мВ до минус 400 мВ. Предложенный способ относится к области флотационного обогащения медно-никелевых пирротинсодержащих руд, на примере Талнахской обогатительной фабрики. В применяемой промышленной технологии на этой обогатительной фабрике применяется соль сернистой кислоты для депрессии пирротина и пентландита в медном цикле (Блатов И.А. Обогащение медно-никелевых руд. - М.: Издательский дом «Руда и металлы», 1998., стр. 35). Нами показано, что коррекция дозировки соли сернистой кислоты по значению водородного показателя в пульпе обеспечивает повышение извлечения меди до 85% и снижение содержания в концентрате никеля до 0,86%. Однако, техническое решение по патенту RU №2372145 предусматривает дозировку соли сернистой кислоты по соотношению с расходом дитиокарбамата (2,5-3,5):1, которое эмпирически подобрано в ходе исследований. При селективной флотации коллективного никель-пирротинового концентрата по методу совместной дозировки депрессирующих реагентов (соли сернистой кислоты и дитиокарбамата) создание необходимой их концентрации в пульпе зависит от сорбционной емкости руды по отношению к этим реагентам, что определяется свойствами перерабатываемой руды. Как показывает практика, эти свойства часто меняются, в результате чего при постоянной загрузке депрессоров по эмпирически найденному соотношению, определяемого для какого-то среднего состава руды, в пульпе часто имеет место избыток или недостаток, это приводит к нарушению селективности процесса и повышению потерь металла. Нами также показано, что в пульпе активность ионов диметилдитиокарбамата (ДМДК) при постоянной его дозировке изменяется при изменении рН (Машевский Г.Н. «К вопросу о методологии исследования процесса флотации на базе ионометрии», « Обогащение руд», 2006, №3, стр. 29-33).
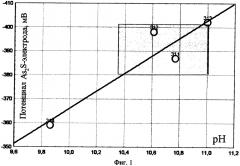
На фиг. 1 демонстрируется зависимость потенциала Ag2S-электрода, контролирующего ионы ДМДК, от рН пульпы. На чертеже отмечена оптимальная область потенциалов дитиокарбамат-селективного электрода, обозначенная в отличительных особенностях предлагаемого способа, которая достигается при одном и том же расходе ДМДК только за счет колебаний величины водородного показателя в результате изменения расхода соли сернистой кислоты. Таким образом, осуществить оптимальную дозировку не зависимо для двух реагентов по одному сигналу потенциометрического датчика в промышленных условиях затруднительно.
Применение для коррекции дозировки дитиокарбамата (ДМДК) с помощью Ag2S-электрода основано на электрохимической реакции Ag0+ДМДК-→AgДМДК+е-.
Недостатком известного способа регулирования процесса селективной флотации является использование при контроле электрохимического потенциала ненадежного референтного хлорсеребряного электрода.
Главной причиной ненадежности референтного электрода является известкование поверхности чувствительного элемента и обрастание минеральными частицами перерабатываемой руды.
Технический результат, на достижение которого направлено настоящее изобретение заключается в повышении надежности подачи и точности контроля дозировки депрессирующих реагентов.
Указанный технический результат достигается тем, что в способе регулирования процесса селективной флотации, включающем дозировку сульфидизатора, активаторов, депрессирующих реагентов и собирателей по электрохимическим параметрам пульпы, согласно изобретению в потоке пульпы измеряют разность потенциалов между двумя электродами: молибденовым и ионоселективным электродом в качестве которого используют или аргентитовый, или оловянный, или никелевый, и по отклонению измеренной разности потенциалов биметаллической электродной пары от заданной оптимальной величины, корректируют подачу сульфидизатора, активатора, ксантогената и депрессирующих реагентов таким образом, что при увеличении разности потенциалов увеличивают дозировку реагентов, а при уменьшении разности потенциалов дозировку реагентов уменьшают.
Предложенный способ регулирования процесса селективной флотации включает в себя измерение электрохимического потенциала пульпы в ее потоке без применения эталонного вспомогательного электрода путем измерения разности потенциалов двух электродов - ионоселективного (аргентитового; или оловянного, при использовании в технологии сернистого натрия, действующего как сульфидизатор или депрессор; или никелевого, при использовании цианидной технологии для депрессии сульфидов цинка и железа) и молибденового и по измеренной разности потенциалов корректируют подачу сульфидизатора, активатора, ксантогената и депрессирующих реагентов таким образом, что при увеличении разности потенциалов увеличивают дозировку реагента, а при уменьшении разности потенциалов уменьшают дозировку реагента.
Из теории электрохимии известна устойчивость работы молибденового электрода в сложных системах по ионному составу (Машевский Г.Н., Петров А.В., Романенко С.А. и др. «Новый подход к регулированию флотационного процесса селективного отделения сульфидных минералов от пирита в известковой среде», «Обогащение руд», издательский дом «Руда и Металлы», №1, 2012 г., стр. 12-16).
Известно применение оловянного электрода в технологии сернистого натрия (Сохин Ю.М. «Контроль сернистого натрия в технологическом процессе», Цв. Металлы, №7, 1958, стр. 66-70).
А также известно применение никелевого электрод при использовании цианидной технологии для депрессии сульфидов цинка и железа (Борисов Б.М., Машевский Г.Н., Рой Н.И. «Индикаторные электроды для потенциометрического измерения концентрации ионов цианида», « Новые исследования в химии, металлургии, обогащении», выпуск 4, «Научные труды Ленинградского горного института», Л, 1972 г., стр. 10-14).
Формирование потенциала молибденового электрода во флотационной пульпе определяется двумя электрохимическими реакциями:
Таким образом, показания молибденового электрода учитывают только изменения электрохимического потенциала пульпы и величины водородного показателя и электрод может быть использован во флотационных системах в качестве опорного электрода вместо ненадежного хлорсеребряного электрода сравнения.
Необходимость разработки нового способа регулирования селективной флотации возникла в связи с отсутствием до настоящего времени надежных методов контроля электрохимических параметров пульпы в промышленных условиях. Надежность предлагаемого способа обеспечивается за счет возможности установки молибденового и ионоселективного кристаллического или металлического (аргентитового, или оловянного, или никелевого) электродов непосредственно в потоке пульпы, что предотвращает известкование их поверхности и обрастание минеральными частицами перерабатываемой руды. Надежность электрических измерений обеспечивается низкоомностью электродов. Таким образом, устраняются перечисленные недостатки применяемых в настоящее время способов регулирования процесса селективной флотации.
Известно, что отрицательными факторами, осложняющими регулирование процессов селективной флотации, являются:
изменение электрохимических характеристик (стеклянных, сульфид-серебряных, платиновых и пленочных мембранных) применяемых электродов требует осуществления постоянного ручного контроля работы систем автоматического контроля и подстройки параметров алгоритма коррекции доз применяемого реагентного режима;
короткий срок службы применяемых электродов в промышленных условиях (2-3 месяца), что увеличивает эксплуатационные расходы.
Основной задачей разработки нового способа регулирования процессов селективной флотации является устранение при контроле электрохимических параметров пульпы применения вспомогательного хлорсеребряного электрода и использование электродов из химически стойкого материала, существенно инертного для конкретных химических веществ флотационной пульпы. Один из электродов является ионоселективным (кристаллическим или металлическим), избирательно откликающимся на дозировку конкретного реагента.
Основное преимущество предлагаемого способа заключается в определении электрохимических характеристик пульпы с помощью биметаллической пары, обладающей практически неограниченным сроком службы.
Исходя из физико-химической сущности процесса селективной флотации в целях обеспечения оптимальной корректировки дозирования сульфидизатора, собирателя и депрессирующих реагентов предложенный способ регулирования процессов селективной флотации включает в себя контроль электрохимического потенциала пульпы без применения референтного вспомогательного хлорсеребряного или каломельного электродов.
В отличие от существующей практики флотационного обогащения, оперирующей дозировками расхода реагентов в г/т и корректировкой дозирования депрессоров с помощью контроля водородного показателя рН или окислительного потенциала пульпы, контролируемого платиновым электродом, предлагаемый способ предусматривает контроль электрохимического потенциала пульпы с помощью биметаллической пары, включающей в себя аргентитовый и молибденовый электроды. Причем аргентитовый электрод выполняет роль ионоселективного электрода, избирательно обратимого к ионам сульфидизатора, ксантогената, цианида, дитиокарбамата.
Способ регулирования процессов селективной флотации поясняется примерами его осуществления и графическими материалами.
На фиг. 1 демонстрируется зависимость потенциала Ag2S-электрода, контролирующего ионы ДМДК, от рН пульпы.
Фиг. 2 демонстрируется кинетика изменения электродных потенциалов в пульпе после измельчения руды Артемьевского месторождения в дистиллированной воде: кривая 1 - потенциал Ag2S - электрода; кривая 2 - разница потенциалов Ag2S - и Мо- электродов Δ(Ag-Mo); кривая 3 - потенциал ЕМ - электрода; кривая 4 - рН пульпы. Совпадение кривых 1 и 2 подтверждает возможность применения предлагаемого способа корректировки подачи собирателя по разности потенциалов биметаллической электродной пары Δ(Ag-Mo).
Фиг. 3 демонстрирует сравнительные тренды кинетики изменения электрохимических параметров в ходе флотационного опыта, поставленного на оборотной воде по действующей технологии в производственных условиях Николаевской обогатительной фабрики: кривая 1 - потенциал Ag2S-электрода; кривая 2 - разница потенциалов Ag2S- и Мо-электродов Δ(Ag-Mo); кривая 3 - потенциал ЕМ - электрода; кривая 4 - рН пульпы. Совпадение кривых 1 и 2 подтверждает возможность применения предлагаемого способа корректировки подачи сернистого натрия по разности потенциалов биметаллической электродной пары Δ(Ag-Mo) в условиях применения реальной оборотной воды и последующей подаче в процесс ZnSO4. На чертеже отмечена область оптимального значения электрохимического параметра Δ(Ag-Мо), обеспечивающего предотвращение процессов электрохимического окисления поверхности галенита.
Фиг. 4 демонстрирует функции отклика технологических показателей в операции основной Cu-Pb флотации на вариацию разности потенциалов биметаллической электродной пары Δ(Ag-Mo): кривая 1 - показатель селективности операции основной Cu-Pb флотации; кривая 2- извлечение Cu в концентрат; кривая 3 - извлечение Pb в концентрат; кривая 4 - извлечение Zn в концентрат. Измеренные значения разности потенциалов биметаллической электродной пары Δ(Ag-Mo) объясняют большую дисперсию технологических показателей в проводимых опытах.
Фиг. 5 демонстрирует взаимосвязь значений разности потенциалов биметаллической электродной пары Δ(Ag-Mo) с кривыми обогатимости по свинцу в операции основной Cu-Pb флотации. Измеренные значения разности потенциалов биметаллической электродной пары Δ(Ag-Mo) объясняют причину большой дисперсии технологических показателей по извлечению свинца и качеству концентратов в проводимых опытах.
Фиг. 6 демонстрирует функции отклика технологических показателей на вариацию разности потенциалов биметаллической электродной пары Δ(Ag-Mo) при проведении опытов в перечистном цикле грубого концентра, получаемого в основной операции медно-свинцовой флотации: кривая 1 - показатель селективности; кривая 2 - извлечение Cu в концентрат; кривая 3 - извлечение Pb в концентрат; кривая 4 - извлечение Zn в концентрат. На чертеже отмечена область значения разности потенциалов биметаллической электродной пары Δ(Ag-Mo), в которой достигаются лучшие технологические результаты.
Фиг. 7 демонстрирует кинетику изменения электродного потенциала Ag2S-электрода (кривая 1) и разницы потенциалов Ag2S- и Мо-электродов Δ(Ag-Mo) (кривая 2) в опыте №15 по схеме перечистного цикла). На чертеже отмечена область измеренных значений разности потенциалов биметаллической электродной пары Δ(Ag-Мо), которая не является оптимальной и объясняет причину худших технологических результатов по сравнению с опытом №16 (фиг. 9 и 10).
Фиг. 8 демонстрирует кинетику изменения электродного потенциала Ag2S- электрода (кривая 1) и разницы потенциалов Ag2S- и Мо-электродов Δ(Ag-Mo) (кривая 2) в опыте №16 по схеме перечистного цикла). На чертеже отмечена область измеренных значений разности потенциалов биметаллической электродной пары Δ(Ag-Мо), которая является оптимальной и соответствует значениям, найденным при нейросетевом моделировании (Фиг. 6).
Фиг. 9 демонстрирует сравнительную оценку показателей селективности процесса флотации в опыте №16 (кривая 1) и опыте №15 (кривая 2).
Фиг. 10 демонстрирует сравнительную оценку показателей селективности процесса флотации в опыте №16 и опыте №15 во взаимосвязи со значениями электрохимического параметра Δ(Ag-Mo), отмеченного на плоскости в виде изолиний. Лучшие технологические показатели в опыте №16 обусловлены оптимальными значениями параметра Δ(Ag-Mo) по определению при нейросетевом моделировании перечистного цикла.
Фиг. 11 демонстрирует кинетику изменения электродных потенциалов в пульпе после измельчения руды в питании основной медной флотации на обогатительной фабрике Пюхасалми: кривая 1 - потенциал Ag2S-электрода; кривая 2 - разница потенциалов Ag2S- и Мо-электродов Δ(Ag-Mo); кривая 3 - рН пульпы; кривая 4 - потенциал Мо-электрода Совпадение кривых 1 и 2 подтверждает возможность применения предлагаемого способа корректировки подачи собирателя - ксантогената по разности потенциалов биметаллической электродной пары Δ(Ag-Mo) в условиях применения реальной оборотной воды и развитии процессов комплексообразования собирателя в присутствии гидроксоокисных соединений железа.
Фиг. 12. Функция отклика извлечения меди на вариацию разности потенциалов биметаллической пары Δ(Ag-Mo), установленная при нейросетевом моделировании.
Фиг. 13 демонстрирует взаимосвязь значений разности потенциалов биметаллической электродной пары Δ(Ag-Mo) с кривыми обогатимости по меди на обогатительной фабрике Пюхасалми.
Фиг. 14 демонстрирует кинетику изменения электрохимических параметров пульпы на пробе жайремской руды при измельчении без реагентов: кривая 1 - потенциал Ag2S- электрода; кривая 2 - разница потенциалов Ag2S- и Мо-электродов Δ(Ag-Mo); кривая 3 - потенциал ЕМ- электрода; кривая 4 - потенциал Мо- электрода Совпадение кривых 1 и 2 подтверждает возможность применения предлагаемого способа корректировки подачи собирателя - ксантогената по разности потенциалов биметаллической электродной пары Δ(Ag-Mo). Показано, что выщелачивание из руд ионных компонентов, включая катионы меди, не оказывает влияние на применение предлагаемого способа.
Фиг. 15 демонстрирует кинетику изменения электрохимических параметров пульпы на пробе жайремской руды при осуществлении депрессии сфалерита с помощью Na2S: кривая 1 - потенциал Ag2S-электрода; кривая 2 - разница потенциалов Ag2S- и Мо-электродов Δ(Ag-Mo); кривая 3 - потенциал Мо-электрода. Совпадение кривых 1 и 2 подтверждает возможность применения предлагаемого способа корректировки подачи Na2S по разности потенциалов биметаллической электродной пары Δ(Ag-Mo).
Фиг. 16 демонстрирует кинетику изменения электрохимических параметров пульпы на пробе жайремской руды при осуществлении депрессии сфалерита с помощью Na2S с предварительной агитацией пульпы с активатором Na2SiF6: кривая 1 - потенциал Ag2S- электрода; кривая 2 - разница потенциалов Ag2S- и Мо-электродов Δ(Ag-Mo); кривая 3 - потенциал ЕМ-электрода; кривая 4 - потенциал Мо-электрода. Совпадение кривых 1 и 2 подтверждает возможность применения предлагаемого способа корректировки подачи Na2S по разности потенциалов биметаллической электродной пары Δ(Ag-Mo) в условиях предварительной агитацией пульпы с активатором Na2SiF6.
Фиг. 17 демонстрирует функции отклика селективности процесса (кривая 1), извлечения свинца (кривая 2) и извлечения цинка (кривая 3) на вариацию разности потенциалов биметаллической пары Δ(Ag-Mo), установленные при нейросетевом моделировании.
Фиг. 18. Зависимость потенциала Sn-электрода от величины потенциала Ag2S-электрода, снятая в промышленных условиях Кентауской фабрики.
Фиг. 19. Характеристика работы системы регулирования процесса сульфидизации на базе оловянного электрода при переработке свинцово-цинковых руд на шестой секции Кентаузской обогатительной фабрики.
ПРИМЕР 1
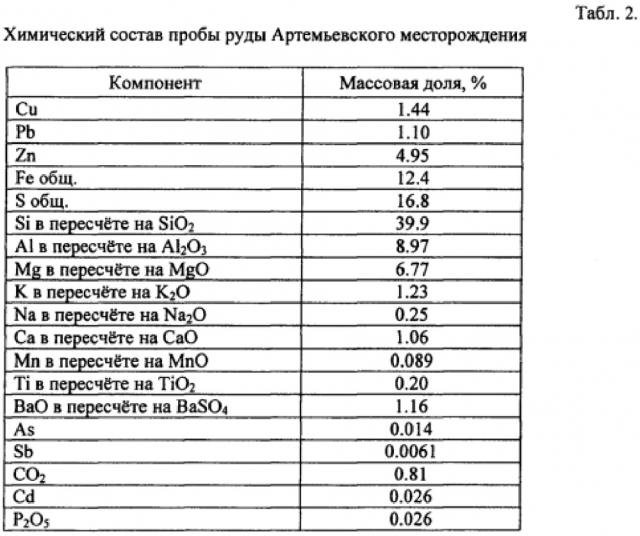
Исследованию подвергалась проба полиметаллической колчеданной руды Артемьевского месторождения. Минералогический и химический состав пробы представлены в табл. 1 и 2.
С целью доказательства возможности осуществлять контроль ионов ксантогената в пульпе с помощью биметаллической пары электродов без использования референтного вспомогательного хлорсеребряного электрода, в которой роль ионоселективного электрода выполняет аргентит, выполнено измельчение руды до крупности 70% класса минус 0,074 мм в дистиллированной воде. Кинетические кривые изменения электродных потенциалов представлены на фиг. 2. При подаче ксантогената в пульпу наблюдается хорошее совпадение кинетических кривых 1 (потенциал Ag2S- электрода по отношению к вспомогательному хлорсеребряному электроду сравнения) и 2 (разность потенциалов биметаллической электродной пары Δ(Ag-Mo)).
Кинетика изменения потенциалов мембранного пленочного электрода ЕМ (кривая 3) подтверждает отсутствие существенного развития процессов комплексообразования в пульпе. После подачи ксантогената в пульпу наблюдается сорбция собирателя минералами как по аргентитовому, так и по мембранному пленочному электродам. Поведение водородного показателя (кривая 4) в принципе не влияет на тенденцию совпадения кривых 1 (Ag2S) и 2 (Δ(Ag-Mo)).
Таким образом, постановка опыта на дистиллированной воде показала, что выщелачиваемые ионы из руды не нарушают совпадения кривой 1, отражающей изменение концентрации ионов ксантогената в пульпе, измеряемой Ag2S электродом по отношению к вспомогательному хлорсеребряному сравнения, с кривой 2, отражающей измерение разности потенциалов биметаллической пары Δ(Ag-Mo).
Технологическая схема Николаевской обогатительной фабрики предусматривает операции получения «медных головок» после первой и второй стадий измельчения, после чего осуществляется операция основной медно-свинцовой флотации. В этой операции предусматривается депрессия сфалерита путем применения Na2S и ZnSO4, дозы которых обычно назначаются в соотношении 1:4. Создания необходимой концентрации в пульпе ионов депрессоров зависит от сорбционной емкости руды по отношению к этим реагентам, что определяется свойствами перерабатываемой руды. Как показывает практика, эти свойства часто меняются, в результате чего при постоянной загрузке депрессоров, определяемой для какого-то среднего состава руды, в пульпе часто имеет место избыток или недостаток, это приводит к нарушению селективности процесса флотации. Кроме того, в этой операции сернистый натрий выполняет также роль сульфидизатора, который предотвращает электрохимическое окисление поверхности галенита. На фиг. 3 приведена сравнительная кинетика изменения потенциалов Ag2S-электрода по отношению к референтному хлорсеребряному электроду сравнения и кинетика изменения разности потенциалов биметаллической электродной пары, в которой ионоселективным электродом, обратимым по отношению к сульфидным ионам является аргентит, Δ(Ag-Mo).
Можно утверждать, что после подачи в процесс ZnSO4 остаточная концентрация сульфидных ионов остается на оптимальном уровне, достаточном для предотвращения электрохимического окисления поверхности галенита. Это доказывает отмеченное на фиг. 7 значение Δ(Ag-Mo)=0 мВ. Оптимальность этого значения Δ(Ag-Mo) подтверждена при нейросетевом моделировании рассматриваемой операции. Поведение кинетики изменения рН (кривая 4) находится в соответствии с классическими технологическими представлениями об изменении водородного показателя при дозировке Na2S и ZnSO4. При дробной подаче Na2S наблюдается постепенное возрастание рН пульпы, а после подачи ZnSO4 наблюдается снижение водородного показателя. Измеряемые в пульпе потенциалы ЕМ-электрода (кривая 3) не отражают процессы десорбции собирателя с поверхности минералов. По-видимому, это связано с тем, что в предыдущих операциях применялся не ионогенный собиратель Aero - 9863.
Для оценки взаимосвязи электрохимических параметров пульпы с технологическими показателями операции основной Cu-Pb флотации вычислены нейросетевые модели, выходными функциями которых были приняты операционной извлечение Cu, Pb, Zn и параметр селективности: сумма извлечений Cu, Pb в концентрат и извлечения Zn в хвосты. Обобщенный статистический массив по поставленным двенадцати опытов включал 11135 наблюдений электрохимических параметров пульпы.
Результат анализа в виде функций отклика выходных технологический показателей, на вариацию интересующего нас параметра - разности потенциалов биметаллической электродной пары Δ(Ag-Mo) представлен на фиг. 4. Из чертежа следует, что не оптимальность дозировки сернистого натрия может существенно снизить показатель селективности.
Наличие оптимальной области значений разности потенциалов биметаллической электродной пары Δ(Ag-Mo) подчеркивает построение классических кривых обогатимости в координатах «εCu-βCu» (фиг. 9) с нанесением на плоскость изолиний Δ(Ag-Mo).
В заключении рассматриваемого примера отметим, что взамен ионоселективного аргентитового электрода в биметаллической потенциометрической паре может быть применен оловянный электрод.
В основе работы оловянного электрода лежит электронная реакция:
Известна также реакция растворения сульфидной пленки в соответствии с уравнением:
или
В щелочной среде происходит образование на поверхности оловянного электрода гидроокиси олова в соответствии с реакцией:
Растворимость в воде гидроокиси олова и отмеченное поведение оловянного электрода в присутствии сульфидных ионов создают предпосылки для широкого использования самоочищающегося датчика в производственных условиях.
ПРИМЕР 2
Исследованию подвергалась проба полиметаллической колчеданной руды Артемьевского месторождения. Осуществлено два сравнительных опыта №15 и №16 по схеме перечистного цикла с тремя перечитками, обозначенными как 151, 152, 153 и 161, 162, 163. Питанием флотации была проба суммарного концентрата первой и второй медно-свинцовой флотации, отобранная с промышленного процесса и содержащая 16.82% Cu, 14.86% Pb, 7.4% Zn и 18.61% Fe. Проба №15 исследовалась с применением технической воды. Проба №16 исследовалась с применением модифицированной оборотной воды, обработанной Са(ОН)2. По всем трем перечисткам обоих опытов составлен общий статистический массив из 5127 наблюдений по измеренным в ходе опытов электрохимических параметров пульпы. Взаимосвязь между технологическими показателями и электрохимическими параметрами установлена с помощью расчета обобщенных регрессионных нейросетевых моделей. Результаты расчета представлены на фиг. 6. На фиг. 6 отмечена область значения разности потенциалов биметаллической электродной пары Δ(Ag-Mo), в которой достигаются лучшие технологические результаты. Под показателем селективности понимается Sel = сумма извлечений Cu и Pb в концентраты + извлечение Zn в хвосты. Возможность контроля процесса по значениям разности потенциалов биметаллической электродной пары Δ(Ag-Mo) подтверждается трендами кинетических кривых электрохимических параметров, представленных по опыту №15 (фиг. 7) и опыту №16 (фиг. 8). При обработке пульпы сернистым натрием в операции пульподготовки наблюдается хорошее совпадение кинетических кривых 1 (потенциал Ag2S-электрода) и 2 (значения разности потенциалов биметаллической электродной пары Δ(Ag-Mo). Причем, отмеченная область значений разности потенциалов биметаллической электродной пары Δ(Ag-Mo) в опыте №15 существенно отличается от оптимальной области, найденной при нейросетевом моделировании (фиг. 6) по сравнению с областью, отмеченной на тренде в опыте №16 (фиг. 8). В этом заключается основная причина худших результатов по селективности процесса в опыте №15, отмеченная на фиг. 9.
Таким образом, можно утверждать, что корректировка подачи Са(ОН)2 и Na2S по значения разности потенциалов биметаллической электродной пары Δ(Cd-Mo) является эффективной.
При рассмотрении кинетических кривых на фиг. 7 можно видеть, что при регулировке подачи сульфидизатора наблюдается картина резкого поглощения реагента в пульпе. После подачи в пульпу NaCN потенциал Ag2S-электрода стабилизируется из-за присутствия в пульпе циан ионов. При подаче NaCN в пульпу на кинетической кривой ЕМ-электрода (3) отмечается резкий скачок потенциалов ЕМ- электрода в отрицательную область, что связано с образованием в пульпе металл цианистых комплексов. При подаче в пульпу ZnSO4 потенциал ЕМ-электрода еще больше смещается в отрицательную область, что связано с образованием комплекса [Zn(CN)4]2-. Отметим, что в ходе всей флотации показания ЕМ-электрода практически остаются на том же уровне, что свидетельствует об отсутствии сорбции цианистых соединений на поверхности сфалерита. В отличие от опыта №15 на кинетической кривой 3 в опыте №16 (фиг. 8) отмечается существенное смещение потенциала ЕМ-электрода в положительную область, что говорит о наличии сорбции цианистых соединений на поверхности сфалерита, отмеченное наблюдение также подчеркивает причину более лучших технологических показателей в опыте №16 по сравнению с опытом №15.
Таким образом, приведенный пример подтверждает возможность применения предлагаемого способа коррекции подачи цианида натрия на основе измеряемой разности потенциалов биметаллической пары, в которой в качестве ионоселективного электрода используется аргентит, обратимый к циан ионам.
В заключение рассмотренного примера отметим возможность использования вместо аргентитового электрода металлический никель. Нами установлено, что величина тока обмена i0 на поверхности никелевого электрода в растворах цианистого калия выше по сравнению с другими электродными системами и составляет величину 5,26⋅10-5 а/см2. Таким образом, на никелевом электроде интенсивнее протекает электродная реакция и более воспроизводима и устойчива величина потенциала электрода.
ПРИМЕР 3
Исследованию подвергалась медно-цинковая колчеданная руда, перерабатываемая на обогатительной фабрике Пюхасалми (Финляндия). Исследования проводились непосредственно в промышленных условиях. В период испытаний руда характеризовалась химическим и минералогическим составом, представленными в табл. 3 и 4.
Электрохимические параметры пульпы контролировались с помощью мультисенсорной потенциометрической системы. За период испытаний собран минутный статистический массив, включающий 2580 наблюдений.
Кинетика изменения значений электрохимических параметров во время испытаний представлена на фиг. 11. Селекция меди и цинка обеспечивалась подачей в мельницу известкового молока и ZnSO4. Кинетика изменения потенциалов Мо-электрода (кривая 4 на фиг. 15) показывает существенное изменение электрохимического потенциала пульпы в результате изменения свойств перерабатываемой руды и вариации расхода депрессоров. Несмотря на это отмечается хорошее совпадение кривых 1 и 2, которое подтверждает возможность применения предлагаемого способа корректировки подачи собирателя - ксантогената по разности потенциалов биметаллической электродной пары Δ(Ag-Mo), в которой Ag2S-электрод является ионоселективным по отношению к ионам ксантогената, в условиях применения реальной оборотной воды и развитии процессов комплексообразования собирателя в присутствии гидроксоокисных соединений железа, образующихся в пульпе при измельчении и электрохимическом окислении пирита и пирротина.
При нейросетевом моделировании исследуемого процесса установлена взаимосвязь технологических результатов с вариацией разности потенциалов биме