Оптимизированная нуклеотидная последовательность и фармацевтическая композиция на ее основе с пролонгированной экспрессией трансгена vegf
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен способ продления времени жизни мРНК трансгена vegf в клетке млекопитающего, трансфицированной генной конструкцией. Проводят точечные делеции в 3'некодирующей области гена фактора роста эндотелия сосудов (vegf), при этом делетированный нуклеотид не заменяется либо заменяется на цитозин в точках замещения гуанина или аденина. Затем определяют время жизни мРНК при каждой делеции. Сведения анализируют и конструируют генную конструкцию, содержащую 3'некодирующую область с совокупностью одиночных делеций и/или замен на цитозин, показавших наилучший результат по продлению жизни мРНК. Кроме того, предложены варианты плазмидной ДНК, сконструированной для осуществления указанного способа, и мРНК трансгена vegf, полученная в результате транскрипции плазмидной ДНК. Также изобретение относится к применению плазмидной ДНК, в том числе в составе фармацевтической композиции, для регенерации тканей организма. Изобретение позволяет увеличить общую продукцию терапевтического белка vegf за счет увеличения времени жизни мРНК, достигнутой посредством введения оптимальных изменений в последовательность 3'UTR гена vegf. 6 н. и 2 з.п. ф-лы, 9 ил., 2 табл., 2 пр.
Реферат
Область техники
Изобретение относится к биотехнологии, а именно к разработке оптимизированных геннотерапевтических препаратов с высокой стабильностью и пролонгированной экспрессией трансгена vegf.
Современный уровень техники
Геннотерапевтические препараты
Все большее значение в современной медицине приобретают геннотерапевтичекие препараты - группа лекарственных средств, действующим веществом которых являются генные конструкции - нуклеиновые кислоты, содержащие один или несколько генов, кодирующих терапевтические белки.
К настоящему времени в мире уже зарегистрированы и внедрены в клиническую практику 5 таких препаратов, а несколько сотен находятся на стадиях экспериментальных и клинических исследований. Общее количество клинических исследований в рамках генной терапии с 1989 года превысило 1900 [1]. Один из 5 зарегистрированных геннотерапевтических препаратов - «Неоваскулген» (ОАО «Институт Стволовых Клеток Человека») - разработан нами и внедрен в клиническую практику на территории России (РУ № ЛП-000671 от 28.09.11) и Украины (РУ №899/13300200000 от 25.01.2013).
Таким образом, в условиях развития биотехнологии сформировался принципиально новый класс фармацевтических препаратов -геннотерапевтические лекарственные средства.
К наиболее безопасным вариантам генных конструкций, несущих трансген, относится плазмидная ДНК. Именно плазмидная ДНК с геном vegf является действующим веществом упомянутого выше геннотерапевтического препарата «Неоваскулген». Главной проблемой плазмидной ДНК как вектора для доставки трансгена в клетки-мишени абсолютным большинством исследователей признается низкая эффективность трансфекции: лишь 1-2% от общего количества молекул генных конструкций поступает в клетки и/или экспрессируется ими [2]. При этом, количество молекул поступившей в клетку плазмидной ДНК и общее число трансфицированных клеток являются одними из основных факторов, напрямую определяющих уровень продукции терапевтического белка и, соответственно, биологический эффект лекарственного средства. В этой связи, в условиях развития геннотерапевтических препаратов как нового фармакологического класса высоко актуальной является разработка методов, направленных на увеличение продукции терапевтического белка, кодируемого генной конструкцией при снижении количества вводимого в организм препарата или повышении эффективности действия. Это особенно важно для плазмидной ДНК, эффективность трансфекции которой крайне низкая.
Повышение общей концентрации терапевтического белка может быть обеспечено посредством двух основных подходов. Первый - наиболее очевидный - состоит в увеличении уровня трансфекции генных конструкций. Иными словами, чем большее количество плазмидной ДНК поступит в клетки-мишени, тем большая концентрация кодируемого ей белка будет продуцирована. В рамках данного подхода предложен целый ряд физических и химических методов. Однако физические методы увеличения уровня трансфекции требуют применения специального оборудования и не всегда безопасны и выполнимы в клинической практике. Химические же методы требуют изменения состава геннотерапевтического препарата, что требует дополнительных ресурсов для производства, а также может быть сопряжено с негативными эффектами добавленных компонентов.
Второй - альтернативный подход - заключается в продлении времени жизни продукта транскрипции введенной генетической конструкции - мРНК, что приводит к увеличению количества циклов трансляции и, соответственно, повышению результирующего количества терапевтического белка за счет его пролонгированной продукции. Фундаментальные основы данного подхода были сформированы за счет накопления сведений о регуляции времени жизни мРНК. Так, описан целый ряд регуляторных молекул, вовлеченных в модуляцию стабильности мРНК, такие как РНК-связывающие протеины и регуляторные РНК (микроРНК, длинный некодирующие РНК). Важно, что воздействие указанных веществ на мРНК опосредуется через связывание с ее 3'-нетранслируемой областью (3'UTR), содержащей специальные последовательности - дестабиизирующие элементы, в частности, аденин-уридин-обогащенный элемент (AU-rich element). Ряд веществ, такие как AU-rich element RNA-binding protein 1 (AUF1), tristetraprolin (TTP), KH-type splicing regulatory protein (KSRP), связываясь со специфическими сайтами 3'UTR индуцируют деградацию мРНК, тогда как другие, например polyadenylate-binding protein-interacting protein 2 (PAIP2), наоборот, обеспечивают стабилизацию мРНК [3, 4].
Координация процессов деградации и стабилизации мРНК имеет важное значение для нормального функционирования клеток, а некоторые патологические состояния воспалительного или онкологического генеза, по мнению ряда авторов, могут быть связаны с посттранскрипционной дисрегуляцией, приводящей либо к недостаточной, либо к избыточной продукции факторов роста, онкогенов и других биологически активных веществ [4]. В этой связи, последовательность нуклеотидов 3'UTR имеет принципиальное значение для трансдукции регуляторных влияний, эффектором которых является мРНК, и детерминации времени жизни мРНК в целом.
Анализируя данные современного уровня техники, становится очевидным, что изменение последовательности нуклеотидов 3'UTR, особенно дестабилизирующих элементов, может обеспечить продление жизни мРНК. Более того, разработаны методы сайт-направленного мутагенеза, позволяющие технически выполнить необходимые изменения в генной конструкции и, соответственно, мРНК как продукта ее транскрипции. Однако до сих пор нет точных, исчерпывающих и систематизированных данных о том, какие варианты последовательности 3'UTR, какие ее минорные сайты или их комбинации за какие аспекты функционирования мРНК отвечают [3]. Отчасти это связно с тем, что количество изоформ мРНК, отличающихся последовательностью нуклеотидов 3'UTR, варьирует в широких пределах, в том числе из-за альтернативных сплайсинга и полиаденилирования. При этом, качественный и количественный состав дестабилизирующих элементов 3'UTR определяется также и кодирующей областью нуклеиновой кислоты. Все это, в сочетании с тем фактом, что 3'UTR определяет не только время жизни мРНК, но и другие составляющие ее «физиологии», как транспорт из ядра клетки, цитоплазматическая локализация, эффективность трансляции и т.д., предопределяет сложности и, во многом, непредсказуемость моделирования времени жизни мРНК через изменение последовательности 3'UTR, что может выражаться как в увеличении времени жизни транскрипта, так и в снижении.
Несмотря на все трудности и недостаточную изученность вопроса детерминации, или «программирования», времени жизни мРНК через изменение последовательности 3'UTR, предпринимаются попытки эмпирически подобрать такие варианты изменений в соответствующей области конкретных вариантов генных конструкций, которые увеличили бы стабильность мРНК без негативного влияния на ее функционирование.
В частности, описан способ увеличения продукции трансгена за счет замены последовательности AU-rich элемента, представленной AUUUA, на другие варианты и их комбинации, ограниченные следующими: AUGUA, AUAUA, GUGUG, AGGGA, GAGAG [5]. Однако, указанная последовательность дестабилизирующего элемента в 3'UTR характерна далеко не для всех генов (описана большинством исследователей для G-CSF), а, с другой стороны - ей не исчерпывается перечень дестабилизирующих элементов, в связи с чем, продление жизни мРНК может быль нивелировано.
Другими авторами разработана специальная последовательность 3'UTR гена эритропоэтина, обеспечивающая пролонгированную продукцию трансгена, входящего в состав плазмидной ДНК. Последовательность строго конкретизирована и имеет длину 100 нуклеотидов [6].
Описаны также способы элиминации специфических последовательностей 3'UTR, ответственных за связывание с различными микроРНК, индуцирующими деградацию мРНК [7].
Однако большинство предлагаемых изменений последовательности 3'UTR относятся к протяженным делециям или заменам, что неизбежно сопряжено с риском возникновения негативных эффектов на метаболизм мРНК. Кроме того, предлагаемые решения крайне зависимы от кодирующей области гена, поэтому одни неприменимы, другие недостаточно эффективны для гена vegf и продления жизни продукта его транскрипции.
Стоящие же перед нами задачи сводились к необходимости увеличить продукцию VEGF таргетными клетками (на примере клеток человека линии HEK293, мультипотентных мезенхимных стромальных клеток, фибробластов человека и пр.), в которые проникла плазмидная ДНК, за счет увеличения продолжительности жизни специфической мРНК указанного гена с помощью оптимизиции его 3 'UTR.
VEGF и его биологическая роль
VEGF - семейство биологически активных белков, впервые выделенных J. Folkman с соавт. в 1971 [8], которые считаются одними из основных ауто- и паракринных факторов регуляции васкуло-, ангио- (VEGF-А, В; PIGF) и лимфогенеза (VEGF-C, D); вырабатываются клетками всех тканей организма, включая эпителиальные.
В постнатальном периоде развития человека наибольшее влияние на формирование кровеносных сосудов оказывает VEGF-A (изоформы 121, 145, 148, 165, 183, 189, 206) [9]. Обнаружены три типа рецепторов VEGF. 1 и 2 тип вовлечены в ангиогенез, 3 - в образование лимфатических сосудов. При этом, рецептор 1 типа обладает большей афинностью к VEGF, однако его тиразинкиназная активность гораздо ниже, чем у рецептора 2 типа, что расценивается как один из регуляторных механизмов, предотвращающих избыточную активность VEGF. Соответственно, именно через рецептор 2 типа в норме реализуются эффекты VEGF [10, 11]. После взаимодействия VEGF со специфическим рецептором 2 типа происходит аутофосфорилирование его внутриклеточных тирозиновых сайтов (Y951, 1054, 1059, 1175, 1214) киназных и карбокситерминального доменов [11], которые, в свою очередь, активируют ряд внутриклеточных белков, таких как фосфолипазы Cγ, Cβ3, адаптерные белки SRK, NCK, SHB, SCK и др., являющиеся первыми звеньями сложных каскадов трансдукции сигналов, изменяющих морфофункциональное состояние клеток-мишеней (главным образом, эндотелиальных). В частности, фосфолипаза Cγ гидролизирует мембранный фосфолипид PIP2 с образованием диацилглицерола и инозитол-1,4,5-трифосфата, увеличивающего внутриклеточное содержание кальция, которые вместе активируют протеинкиназу С, которая, в свою очередь, запускает последовательную активацию сигнального пути RAS-ERK, приводящего к индукции митоза. В результате, повышается пролиферативная активность эндотелиальных клеток [10]. Фосфолипаза Cβ3 участвует в полимеризации актина и формировании стресс-фибрилл, обеспечивающих миграцию и двигательную активность клеток, в целом [12]. Через активацию сигнального пути «фосфоинозитид-3-киназа - протеинкиназа В» (PI3K/AKT) VEGF блокирует апоптоз, ингибируя каспазы 3, 7 и 9, тем самым повышая выживаемость клеток. Кроме того, ось PI3K/AKT с помощью ионов кальция модулирует работу эндотелиальной NO-синтазы, что сопровождается увеличением продукции NO и повышением проницаемости сосудов, что является необходимым звеном в ангиогенезе (рис. 3) [13, 14]. Таким образом, VEGF через специфический рецептор 2 типа индуцирует активацию, миграцию, пролиферацию и дифференцировку эндотелиоцитов и их клеток-предшественниц, повышение выживаемости клеток, что в сочетании с модуляцией межклеточных взаимодействий и повышением проницаемости сосудов служит необходимыми условиями формирования капилляро-подобных структур с последующим ремоделированием в «зрелые» сосуды [10-16].
Учитывая роль VEGF как ключевого ангиогенного фактора, различные варианты кодирующего его гена используются для создания генных конструкций, показанных для лечения пациентов с заболеваниями сердечнососудистой системы ишемического генеза [17, 18]. Кроме того, неспецифический ангиогенный эффект таких геннотерапевтических препаратов может оказать положительное влияние при других патологических состояниях, требующих активации репаративного процесса: травмы периферических нервов [19], синдром диабетической стопы [20], боковой амиотрофический склероз [21], повреждения костей скелета [22, 23] и др.
Что касается костной ткани, то как в случае первичного, так и вторичного остеогистогенеза именно сосуды, прорастающие в рыхлую волокнистую соединительную или хрящевую ткани, создают необходимые условия для дифференцировки резидентных клеток в остеобластическом направлении, а также для миграции камбиальных резервов (периваскулярно и с кровотоком). Помимо опосредованного через ангиогенез влияния, VEGF оказывает и прямое стимулирующее действие на клетки остеобластического дифферона, которые не только продуцируют VEGF [24], но и экспрессируют его рецепторы 1 и 2 типов как в эмбриогенезе [25], так и в постнатальном периоде развития [26]. Показано, что под воздействием VEGF пролиферация камбиальных клеток костной ткани значительно увеличивается (до 70%), а также активируется миграция остеогенных клеток по градиенту концентрации VEGF [27-29].
В последние годы, помимо канонического - рецепторного - механизма действия VEGF, появились данные о принципиально ином механизме, который обозначают как «интракринный». Подтверждением этому стали результаты исследований, продемонстрировавших, что прогениторные клетки, коммитированные в остеобластическом направлении (экспрессирующие Osx), синтезируют VEGF не только «на экспорт», но и для обеспечения собственной дифференцировки в остеобластическом направлении [30].
Таким образом, VEGF обладает широким спектром действия на клетки эндотелиальной и мезенхимальных клеточных линий. Основной его биологический эффект связан с индукцией формирования кровеносных и лимфатических сосудов, однако, по всей видимости, для VEGF характерны и другие механизмы прямого действия на клетки различных дифферонов через рецепторные и интракринные механизмы.
В этой связи, плазмидная ДНК с геном vegf, характеризующаяся пролонгированной экспрессией трансгена, стала бы эффективным инструментом в разработке лекарственных препаратов и ген-активированных медицинских изделий, предназначенных не только для лечения пациентов с заболеваниями сердечно-сосудистой системы, но и другой патологией, при которой локальное повышение уровня VEGF в affected area обеспечило бы усиление репаративного процесса.
Перечень иллюстраций:
Рис. 1. Динамика продукции (накопления) мРНК культурами клеток, трансфицированными различными вариантами генных конструкций: 1 - Seq#1 (исходная генная конструкция), 2 - Seq#2, 3 - Seq#3, 4 - Seq#4, 5 - Seq#5, 6 - Seq#6, 7 - Seq#7, 8 - Seq#8, 9 - Seq#9, 10 - Seq#10, 11 - Seq#11
Рис. 2. Динамика продукции (накопления) мРНК гена vegf трансфицированной культурой клеток: А - исходная генная конструкция (Seq#1); В - оптимизированная генная конструкция SEQ#11. Результаты представлены как кратное увеличение по сравнению с уровнем продукции мРНК эндогенного VEGF.
Рис. 3. Динамика продукции мРНК гена vegf трансфицированной культурой клеток: А - эндогенная продукция (культура нетрансфицированных клеток); В - исходная генная конструкция (Seq#1); С - оптимизированная генная конструкция Seq#11.
Рис. 4. Белок VEGF, выделенный из клеточных культур, трансфицированных генными конструкциями, 4 сут после трансфекции: А - оптимизированной генной конструкцией Seq#11; В - исходной генной конструкцией (Seq#11); С - контроль, культура нетрансфицированных клеток. Вестерн-блоттинг, нормализация по β-актину.
Рис. 5. Изменение уровня кровотока в ишемизированной конечности на разных сроках наблюдения: - Non ChLI control, - ChLI non treated, - Water for injection, - Seq#11 (200 mkg × 1 and 14 d), - Seq#11 (100 mkg × 14 d).
Рис. 6. Ишемизированная мышца через 35 сут после операции и введения: А - воды для инъекций, В - Seq#11 (200 mkg × 1 and 14 d).
Рис. 7. CD34+-cells / muscle fibers ratio. 1 - non ChLI control; 2 - ChLI non treated; 3 - water for injection; 4 - Seq#11 (100 mkg × 14 d).
Рис. 8. Дефекты теменных костей кроликов, 30 сут после имплантации остеопластических материалов: А - кальциевый фосфат с плазмидной ДНК Seq#11, В - кальциевый фосфат без плазмидной ДНК.
Рис. 9. Карта оптимизированной последовательности Seq#11.
Краткое описание настоящего изобретения
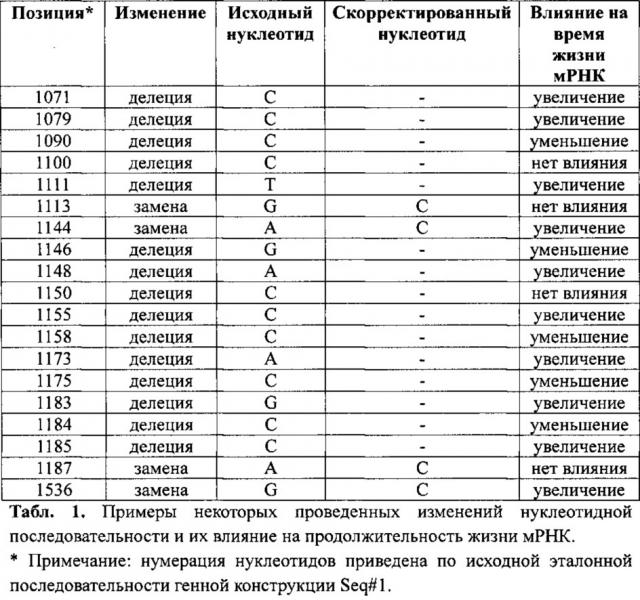
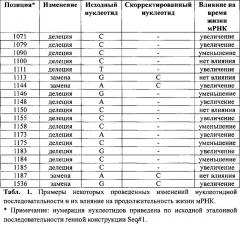
С использованием методов сайт-направленного мутагенеза и количественного ПНР анализа молекул РНК в клетке нами были проанализированы конструкции, несущие различные изменения последовательности нуклеотидов 3'UTR терапевтического гена vegf, по сравнению с исходной генной конструкцией (Seq#1, разработана нами ранее). Примеры влияния некоторых изменений приведены в табл.1. Как видно из приведенных данных, некоторые изменения нуклеотидной последовательности (делеции или замены) сказывались на продолжительности жизни положительным образом (например делеция С 1079), другие не оказывали никакого влияния (например, делеция С 1100) или приводили к уменьшению жизни мРНК (например, делеция С 1090). При этом разница в продолжительности жизни мРНК гена vegf в клетке в крайних случаях (делеция С 1079 - увеличение; делеция С 1090 - уменьшение) составляла в среднем более 6 ч. при средней жизни мРНК 6 ч.
На втором этапе исследования все изменения, оказывающие положительное влияние, были использованы для создания ряда вариантов генных конструкций, несущих от четырех до десяти "положительных" мутаций в различных комбинациях, т.е. отличающихся последовательностью нуклеотидов на отрезке 1070-1600 (Seq#2-11).
На основании полученных данных нами была выбрана и синтезирована оригинальная 3'UTR концевая часть гена vegf, которая в совокупности с кодирующей частью гена обеспечивала увеличение продолжительности жизни транскрипта гена на 70% (SEQ#11), в которую были сведены некоторые мутации, оказавшие в совокупности наибольшее положительное влияние, а именно: делеция С 1079, делеция Τ 1111, замена А на С 1144, делеция А 1148, делеция С 1155, делеция А 1173, делеция С 1185, замена G на С 1536.
Полученный вариант генетической конструкции характеризуется максимальным временем жизни мРНК и, соответственно, наибольшей общей продукцией белка VEGF, превышающей таковую, характерную для исходной генных конструкций (Seq#1).
На основе разработанной оптимизированной генной конструкции и адъювантов, обеспечивающих криопротекцию, стабилизацию рН и получение изотонического раствора для инъекций, были созданы фармацевтические композиции, обладающие выраженной ангиогенной активностью.
Разработанные фармацевтические композиции предназначена для применения в случае заболеваний и патологических состояний, в лечении которых требуется стимуляция ангиогенеза (ишемия тканей) или репаративной регенерации тканей, которая может быть осуществлена через активацию ангиогенеза (восстановление целостности периферических нервов, костей скелета и др.)
Для производства разработанных фармацевтических композиций создан бактериальный (Е.colli) штамм-продуцент генной конструкции Seq#11, депонированный во Всероссийской коллекции микроорганизмов в соответствии с Будапештским Договором по международному депонированию микроорганизмов с целью патентования. Номер депонирования штамма VKM B-2967D. Справку о Международном депонировании штамма прилагаем.
Подробное описание настоящего изобретения
Сайт-направленный мутагенез 3'UTR гена vegf был выполнен с использованием QuikChange Lightning Site-Directed Mutagenesis Kit (Agilent Technologies, США), согласно инструкции производителя.
В результате сайт-направленного мутагенеза исходной плазмидной ДНК (Seq#1), нами были получены различные варианты изменений в 3 'UTR гена vegf. Полученные варианты плазмидной ДНК с геном vegf отличающиеся последовательностью 3'UTR, были использованы для трансфекции клеток линии HEK293 с последующим определением динамики накопления продукта экспрессии генной конструкции - мРНК гена vegf.
Для этого, клетки HEK293 в количестве 2×105 помещали в лунки 6-луночного планшета с культуральной средой DMEM/F-12 с добавлением 10% FBS. После прикрепления клеток в культуральную среду вносили 10 мкг одного из полученных вариантов плазмидной ДНК (в 100 мкл воды для инъекций). В качестве негативного контроля использовали 100 мкл воды для инъекций без плазмидной ДНК, что позволяло оценить уровень продукции мРНК эндогенного vegf. Для определения уровня экспрессии гена vegf методом РТ-ПЦР из клеток через 6, 12, 24, 36 и 48 ч. после трансфекции выделяли общую РНК на колонках с помощью набора PureLink RNA Mini Kit (Invitrogen, США), согласно инструкции производителя. Кратко, осажденные клетки тщательно лизировали в объеме 350 мкл лизирующего буфера в присутствии 1% β-меркаптоэтанола. Добавляли равный объем 70% этанола, вортексировали и переносили на колонки. Центрифугировали 1 мин при 12,4 тыс.об/мин. Сливали отцентрифугированную жидкость. Добавляли на мембрану 600 мкл промывочного раствора 1, центрифугировали 15 сек при 12,4 тыс.об/мин, убирали жидкость. Добавляли на мембрану 500 мкл промывочного раствора 2, центрифугировали при тех же условиях, убирали жидкость. Повторяли отмывку с промывочным раствором 2. Переносили колонки в новые пробирки и центрифугировали 1 мин. при 12,4 тыс.об/мин. Переносили колонки в пробирки для сбора РНК. Непосредственно на мембрану вносили 15 мкл воды, без РНКаз, инкубировали 1 мин. при комнатной температуре, центрифугировали 90 сек при 12,4 тыс.об/мин. До дальнейшего применения пробы хранились при температуре -80°C. Далее проводили синтез первой цепи кДНК с помощью реактивов компании Promega (США). Уровень экспрессии таргетных генов (в молях) определяли по сравнению с экспрессией гена домашнего хозяйства β-актина с помощью набора для проведение ПЦР в реальном времени в присутствии SYBR Green I и референсного красителя ROX (Синтол, Россия) На рис 1. приведен пример одной из нуклеотидных замен, обеспечивающих увеличение жизни мРНК. Постановка реакции обратной транскрипции:
1) на льду: к 10 мкл РНК добавляли 2,5 мкл Random Hexamer, инкубировали 5 мин. при 70°C;
2) убирали лед;
3) осаждали капли;
4) приготавливали смесь для каждого образца:
- 5 мкл буфера для обратной транскриптазы MMLV 5Х
- 1,25 дНТП
- 1,25 RNase Inhibitor
- 1 мкл MMLV Tранскриптазы
- 4 мкл H2O
5) добавляли по 12,5 мкл смеси в каждую пробирку, инкубировали 1 ч. при 37°C;
6) останавливали реакции инкубацией при 75°C в течение 5 мин. Все образцы кДНК хранились при температуре -80°C.
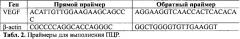
Для выполнении ПЦР в реальном времени использовали прямые и обратные праймеры к vegf и β-actin (табл.2): Реакционную смесь для ПЦР в реальном времени в присутствии SYBR Green I применяли согласно инструкции производителя. Измерения проводили на приборе CFX90 Touch Real-time PCR Detection System.
В результате проведенных исследований были выявлены мутации, положительно влияющие на время жизни мРНК (делеция С 1071, делеция С 1079, делеция Τ 1111, замена А на С 1144, делеция А 1148, делеция С 1155, делеция А 1173, делеция G 1183, делеция С 1185, замена G на С 1536 и др.). Указанные изменения в различных комбинациях из 4-10 мутаций были сведены в синтетические конструкты, включающие кодирующую часть гена vegf и 3'UTR, оптимизированные по отношению к гену vegf. Основные из полученных вариантов представлены Seq#2-11. Чтобы выбрать наиболее оптимальный вариант из разработанных генных конструкций, было выполнено сравнительное исследование, в ходе которого определяли динамику накопления мРНК трансфицированными клетками с помощью ПЦР-РТ, как указано выше. Результаты основных десяти генных конструкций в виде кратности увеличения концентрации мРНК на сроках 24 и 48 ч после трансфекции представлены на рис. 1.
Как следует из графика, в некоторых случаях комбинации нескольких мутаций, каждая из которых в отдельности оказывала положительное влияние на время жизни мРНК, не сопровождались значимым увеличением накопления мРНК, по сравнению с исходной генной конструкцией (Seq#1). Среди генных конструкций, характеризовавшихся увеличением времени жизни мРНК, отсутствие снижения концентрации определялось только в случае Seq#11, тогда как в остальных случаях уровень мРНК снижался через 48 ч. после трансфекции по сравнению с показателем на сроке 24 ч. В этой связи, именно данная генная конструкция была выбрана как наиболее оптимальная и подвергнута дальнейшим сравнительным исследованиям.
На рис. 2. приведен результат ПЦР-РТ конструкции Seq#11 в сравнении с неоптимизированной последовательностью Seq#1. На приведенном графике видно, что уже через 12 ч. уровень мРНК гена VEGF оптимизированной конструкции превышал значение параметра в контроле, где для трансфекции была использована исходная плазмидная ДНК. Важно, что динамика прироста концентрации мРНК в обеих группах совпадала с пиком на отметке в 24 ч. после трансфекции. Однако только в случае исходной генной конструкции наблюдалось постепенное снижение уровня мРНК, обусловленное быстрой биодеградацией молекул, тогда как в случае оптимизированной конструкции (Seq#11) определялась фаза «плато» длительностью не менее 6 ч. с последующим плавным снижением концентрации мРНК. При этом на крайней временной точке разница между группами по данному показателю составила 190%.
Разработанная плазмидная ДНК, несущая ген vegf, была исследована in vitro для количественной оценки продукции белка VEGF клетками HEK273. При этом, концентрация терапевтического белка определялась в культуральной среде с помощью ELISA через 6, 12, 24, 48, 72 и 96 ч. после трансфекции клеток. Оказалось, что накопленная концентрация терапевтического белка в культуральной среде клеток, трансфицированных генной конструкцией, значительно превышала значение параметра в контроле, в том числе в группах с альтернативными вариантами разработанных генных конструкций, характеризовавшихся неоптимальной последовательностью 3'UTR гена vegf и стандартным временем жизни мРНК трансгена (рис. 3). Важно, что максимальный прирост концентрации VEGF в культуральной среде обеих групп трансфицированных клеток (увеличение в 2,3-2,4 раза) наблюдался через 36 часов после начала эксперимента, что соответствовало данным ПЦР-РТ с пиковой концентрацией мРНК генных конструкций на временной точке 24 часа. В дальнейшем, если концентрация белка VEGF в среде трансфицированных оптимизированной генной конструкцией клеток продолжала нарастать высокими темпами, то в группе с исходной плазмидной ДНК прирост существенно замедлялся, незначительно превышая прирост в контрольной группе (культура без трансфекции).
Определение накопленной концентрации белка VEGF в культуральной среде позволяет судить о динамике его продукции клетками и количественном приросте на каждом контрольном сроке, однако не позволяет оценить внутриклеточную концентрацию белка на каждой из временных точек. При этом особенно важным в комплексной оценке времени жизни мРНК генных конструкций является определение уровня белка VEGF в клетках на крайних сроках наблюдения. В этой связи, клетки после 4 сут культивирования были подвергнуты Вестерн-блоттинг анализу по стандартной методике с использованием антител к белку VEGF. Концентрация белка оказалась наибольшей в лизате клеток, трансфицированных оптимизированной генной конструкцией Seq#11 (рис. 4). При этом уровень белка в случае клеток, трансфицированных исходной конструкцией, на данном сроке наблюдения незначительно превышал эндогенную концентрацию (контроль).
Более того, кондиционированная среда клеток, трансфицированных оптимизированными генными конструкциями, характеризовалась статистически значимо большей ангиогеннной активностью, определенной в стандартном тесте HUVEC tube formation assay.
Сопоставляя результаты проведенных исследований, можно заключить, что мРНК оптимизированной генной конструкции (Seq#11) характеризовалась большим временем жизни, что привело к более длительной продукции высоких концентраций терапевтического белка VEGF вплоть до крайних сроков наблюдения. Исходная же генная конструкция характеризовалась меньшей стабильностью мРНК, коротким и менее выраженным биологическим эффектом.
Таким образом, основной технический результат настоящего изобретения состоит в увеличении общей продукции терапевтического белка за счет увеличения времени жизни мРНК, достигнутой посредством выявления оптимальных изменений последовательности 3'UTR гена vegf. Неожиданным стал тот факт, что замена всего одного нуклеотида в целевой области оказала столь выраженный эффект на продолжительность жизни мРНК и, соответственно, продукцию терапевтического белка. Во всех известных работах в данной области исследователи выполняли другие изменения, с вовлечением гораздо большего количества нуклеотидов. Учитывая недостаточную изученность функционального предназначения каждого сайта в 3'UTR мРНК, наиболее благоприятными с точки зрения безопасности и нивелирования влияния на другие аспекты метаболизма мРНК являются именно минимальные, точечные изменения, в случае, если они позволяют добиться нужного эффекта. Важно отметить, что длина последовательности 3'UTR гена vegf составляет не менее 250 нуклеотидов, следовательно, общее количество только единичных, точечных мутаций в виде замены одного нуклеотида на другой составляет не менее 750. Принимая во внимание другие возможные варианты изменений (делеции, дупликации, инсерции), а также с учетом задействования более одного сайта, количество вариантов генных конструкций, отличающихся 3'UTR гена vegf составляет сотни тысяч. Таким образом, выявление нескольких вариантов изменений последовательности, приводящих к увеличению продолжительности жизним мРНК без негативного влияния на другие аспекты ее функционирования равносильно выигрышу в лотерею.
Учитывая опыт в разработке геннотерапевтических препаратов были созданы фармацевтические композиции на основе разработанной оптимизированных генных конструкций и фармакологически приемлемых вспомогательных веществ, представленных, по меньшей мере, одним криопротектантом, обладающим свойствами наполнителя, и стабилизатором рН, в эффективных количествах обеспечивающих получение изотонического раствора плазмидной ДНК для инъекций.
Состав фармацевтической композиции, обеспечивающий сохранение свойств оптимизированной плазмидной ДНК, представляет собой:
- плазмидная ДНК от 0,1 до 10 мг/мл, предпочтительно от 0,5 до 4 мг/мл, наболее предпочтительно от 0,8 до 1,2 мг/мл.
- глюкоза (декстроза) от 200 до 400 мМ, предпочтительно от 250 до 350 мМ, наболее предпочтительно от 280 мМ до 320 мМ.
- фосфат натрия (смесь тризамещенного, двузамещенного и однозамещенного фосфатов натрия) в концентрации от 3 до 30 мМ, предпочтительно от 5 до 20 мМ, наболее предпочтительно от 8 до 12 мМ.
рН раствора от 7,0 до 9,0, предпочтительно от 7,2 до 8,5, наиболее предпочтительно от 7,4 до 8,2.
Состав одного из вариантов фармацевтической композиции следующий:
- плазмидная ДНК по Seq#11 - 1,2 мг;
- декстрозы моногидрат - 60 мг;
- натрия гидрофосфата додекагидрат - 3,94 мг;
- натрия дигидрофосфата дигидрат - 0,16 мг.
Данный вариант были использован в исследованиях, описанных в примерах.
Разработанные генные конструкции и фармацевтические композиции на их основе были исследованы in vivo в экспериментальных моделях, воспроизводящих основные патофизиологические и патоморфологические симптомы, характерные для заболеваний, являющихся известными показаниями к применению плазмидной ДНК с геном vegf.
Пример 1. Модель хронической ишемии нижних конечностей.
Исследование было выполнено на иммунодефицитных мышах (n=90), которым для моделирования хронической ишемии нижней конечности (ХИНК) выполнялось пересечение правой бедренной артерии в паховой области. Введение фармацевтической композиции на основе плазмидной ДНК по Seq#11 выполнялось в двух вариантах: 100 мкг однократно на 14-е сут и по 200 мкг двукратно с на 1-е и 14-е сут - в проксимальный и дистальный участок послеоперационной раны. Контролем служили три группы животных: здоровые, оперированные но без введения каких-либо веществ; оперированные с введением воды для инъекций. Животных выводили из эксперимента через 7, 21, 35 сут после операции, конечности подвергали гистологическому исследованию с определением количества сосудов и отношения числа эндотелиоцитов к мышечным волокнам. На сроках 1, 7, 14, 21, 28 и 35 сут выполняли лазерную сканирующую доплерометрию для определения уровня кровотока (blood flow perfusion rate) в ишемизированной и здоровой конечности.
Оказалось, что независимо от дозы и режима введения, уровень кровотока в ишемизированной конечности увеличивался только в экспериментальных группах через 7 сут после введение разработанного геннотерапевтического препарата. Уровень кровотока увеличивался, достигая к крайнему сроку наблюдения значений, близких к параметру здоровых животных. В контрольных группах оперированных животных уровень кровотока оставался на низком уровне без положительной динамики (рис. 5).
Функциональные результаты были подтверждены данными гистологического исследования. В экспериментальных группах было выявлено большее количество сосудов (рис. 6), а также большее отношение CD34+-клеток (эндотелиоцитов) к мышечным волокнам (рис. 7).
Пример 2. Модель костного дефекта критического размера. Разработанная генная конструкция по Seq#11 была объединена с матриксом из кальциевого фосфата по ранее разработанному протоколу:
1. Подготовка носителя:
а) отмывка (инкубирование в 0,5 M фосфатного буфера в объеме 1 мл при температуре 37°C при постоянном встряхивании в течение 12 ч.);
б) уравновешивание (обработка 10 мМ фосфатного буфера в объеме 1 мл при температуре 37°C при постоянном встряхивании, 3 раза по 10 мин.);
в) высушивание (инкубирование при температуре 37°C до полного высыхания - 3 ч.).
2. Нанесение нуклеиновой кислоты (инкубирование с раствором плазмидной ДНК по Seq#11 в 10 мМ фосфатном буфере в концентрации 1 мкг/мкл при температуре 37°C и постоянном встряхивании в течение 12 ч.).
3. Обработка полученного комплекса «носитель-генная конструкция»:
а) отмывка (обработка 5 мМ раствором фосфата в объеме 1 мл 3 раза);
б) высушивание (инкубирование при температуре 37°C до полного высыхания - 3 ч.).
Полученный ген-активированный костный графт был исследован в ортотопических условиях. Исследование было выполнено на кроликах породы Шиншилла (n=15). Каждому животному выполнялись два одинаковых симметричных полнослойных дефекта обеих теменных костей, диаметром по 10 мм, которые являются «критическими» для кроликов, так как естественный восстановительный процесс, без каких-либо оптимизирующих влияний не завершается полной консолидацией. В дефекты правых теменных костей имплантировали ген-активированный остеопластический материал (экспериментальная группа), состоящий из кальциевого фосфата и плазмидной ДНК Seq#11, в дефекты левых теменных костей - носитель без плазмидной ДНК (контрольная группа). Животных выводили из эксперимента через 30, 60 и 90 сут, результаты оценивали с использованием компьютерной томографии и гистологических методов.
В связи с исходно высокой плотностью выбранного носителя (около 1800 HU) и длительностью его биорезорбции (более 6 мес.) объективно оценить признаки репаративного остеогенеза в сравнительном аспекте не удалось. Однако по данным гистологического исследования, только в случае применения ген-активированного остеопластического материала признаки остеогенеза наблюдались уже через 30 сут после операции в центральной части дефекта (рис. 8).
Как видно на рис. 8 гранулы материла, расположенные в центральной части дефекта, выполненного рыхлой волокнистой соединительной тканью, являлись источником репаративного остеогенеза, тогда как в контроле кальциевый фосфат без плазмидной ДНК был окружен только рыхлой волокнистой соединительной тканью без признаков образования костной ткани. Полученные данные свидетельствуют о том, что введение плазмидной ДНК Seq#11 в область костного дефекта критических размеров привело к выраженной индукции репаративного остеогенеза, что может быть обусловлено как опосредованным через ангиогенез действием, так и прямым влиянием VEGF на клетки мезенхимальной линии.
Таким образом, представленные выше примеры иллюстрируют тот факт, что разработанная оптимизированная генная конструкция и фармацевтическая композиция на ее основе обладают выраженной ангиогенной активностью, что позволяет рассчитывать на эффективность ее использования в лечении ишемических заболеваний сердечно-сосудистой системы. Кроме того, оптимизированная генная конструкция с геном vegf может оказаться эффективной в лечении других патологических состояний, требующих активации репаративного процесса, таких как: повреждения кожи и опорно-двигательного аппарата, травмы периферических нервов, синдром ди