Способ и микрофлюидный чип для культивирования клеток или клеточной модели
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложен микрофлюидный чип и способ для культивирования клеток или клеточной модели в данном микрофлюидном чипе. Микрофлюидный чип включает микрофлюидные каналы с клапанами для перекрытия каналов, ячейку для культивирования, рабочую камеру с мембраной и средство создания постоянного давления в замкнутом контуре циркуляции. Причём мембрана выполнена с возможностью изменения объема рабочей камеры. Рабочая камера, клапаны и входная часть ячейки соединены микрофлюидными каналами с образованием замкнутого контура циркуляции питательной среды. Рабочая камера с клапанами и микрофлюидными каналами представляет собой насос-маршрутизатор. Способ включает заполнение микрофлюидных каналов и ячейки питательной средой, размещение вставки с клетками или клеточной моделью в ячейке культивирования. При этом в контуре циркуляции создают постоянное давление и пульсирующее течение питательной среды. Изобретения обеспечивают возможность моделирования в микрофлюидном чипе гидродинамическую составляющую микроциркуляции in vivo, а также моделирования системного ответа организма. 2 н. и 37 з.п. ф-лы, 15 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к биохимии и молекулярной биологии, а именно, к устройствам для культивирования и/или исследования клеток человека, животных, растений и/или культур вирусов, и может быть использовано для воспроизведения in vitro гидродинамических аспектов микроциркуляции in vivo в исследовательских целях, в т.ч. необходимых для разработки и проведения испытаний лекарственных препаратов и способов их доставки, научно-исследовательских работах и т.п.
Заявляемый микрофлюидный чип предусматривает возможность сокультивирования различных клеточных моделей (клеток различных органов и тканей млекопитающих), а также использования первичного материала, например, полученного из резекций или биопсий, что позволяет использовать чип при разработке лекарственных препаратов (в т.ч. в качестве модели «человек-на-чипе» или «орган-на-чипе») и в персонализированной медицине.
Уровень техники
Транспорт веществ к клеткам организма, обмен растворенными веществами с клетками и отвод веществ от клеток осуществляется внеклеточными жидкостями, 90% объема которых приходится на плазму крови, интерстициальную (межклеточную) жидкость и лимфу. Интерстициальная жидкость и лимфа составляют около 80% этого объема, а плазма крови - всего 20%. Причем плазма и лимфа в основном выполняют транспортную функцию, а интерстициальная жидкость - участвует в обмене веществ.
Важным фактом, ставшим известным сравнительно недавно, является то, что обусловленная повышенным давлением в капиллярах фильтрация, т.е. поступление жидкости из плазмы крови в ткань, идет практически на всем протяжении капилляров, а не только на артериальных участках. Таким образом, наибольшая доля объема интерстициальной жидкости в норме отводится лимфатической системой [Adamson R.H. и др. Oncotic pressures opposing filtration across non-fenestrated rat microvessels // J. Physiol. 2004. T. 557. №3. C. 889-907.]
Среди известных пассивных механизмов, обеспечивающих транспорт веществ, можно выделить два основных: диффузию и адвекцию. Диффузия по большей части обеспечивает проникновение из капилляров в межклеточное пространство (интерстициальную область) ткани глюкозы, аминокислот, кислорода, а также вывод углекислого газа и других продуктов обмена веществ. Адвекция служит для переноса низкомолекулярных гидрофильных соединений и обусловлена разностью осмотических и гидростатических давлений в капилляре и межклеточном пространстве. Этими же механизмами обеспечивается доставка большинства лекарственных препаратов.
Процессы диффузии и адвекции зависят не только от осмотического и гидростатического давления, но и являются периодическими временными процессами, обусловленными гидродинамическими факторами, в частности артериальной сосудодвигательной функцией и насосной функцией сердца [Jain R.K. Transport of Molecules in the Tumor Interstitium: A Review // Cancer Res. 1987. T. 47. №17. C. 3039-3051.] Циклическое изменение гидростатического давления, обусловленное движением жидкости, и сопутствующие ему механические воздействия играют важную роль в регуляции молекулярно-биологических процессов клетки, в частности, влияют на экспрессионный профиль и выработку экстрацеллюлярного матрикса, способствуя формированию полноценной ткани. Самой важной разновидностью механических воздействий, обеспечивающей активацию соответствующих сигнальных путей, являются касательные напряжения, создаваемые движением жидкости вдоль поверхности клеток или через образованную ими пористую структуру - межклеточное пространство. При моделировании механических воздействий in vitro их характер и интенсивность зависят от моделируемого органа или ткани. Также существуют подтвержденные экспериментально сведения о том, что специфичные механические воздействия на клетки могут способствовать решению одной из наиболее значимых и сложных задач биологии - направленной дифференцировке плюрипотентных стволовых клеток [Chen Н.С., Hu Y.C. Bioreactors for tissue engineering // Biotechnol. Lett. 2006. T. 28. №18. C. 1415-1423].
Наиболее простыми и распространенными системами для культивирования клеток являются статические in vitro системы, по сути представляющие собой чашки Петри различных размеров и форм. Основным недостатком статических систем является ограничение транспорта веществ диффузией, что в совокупности с высокой трудоемкостью обслуживания приводит к тому, что клеточные модели проводят часть времени в среде, избыточно насыщенной питательными веществами, а часть - в истощенной, но наполненной продуктами жизнедеятельности клеток. Динамические системы, то есть системы обеспечивающие транспорт веществ адвекцией (в процессе циркуляции или перемешивания среды каким-либо другим способом), лишены данного недостатка.
Очевидно, что чем лучше in vitro система воспроизводит условия in vivo, тем в большей степени полученные на ней результаты будут отражать свойства моделируемой in vivo системы. Из уровня техники известны in vitro системы (биореакторы) на основе микрофлюидных чипов (микрожидкостных систем) для культивирования клеток, моделирования тканей и органов человека, которые в отличие от промышленных биореакторов, предназначены для максимально полного и правдоподобного воспроизведения физиологических условий in vivo, например, рН культуральной среды, концентрацию кислорода, удаление продуктов метаболизма, поддержание состава культуральной среды, формирование физиологичных механических воздействий. В зависимости от решаемой задачи этот список может быть существенно расширен. Для указанных целей нередко используются микрофлюидные чипы с ячейками для культивирования клеток объемом менее 1 мл, объединенными сетью каналов диаметром менее 1 мм [Ashraf M.W., Tayyaba S., Afzulpurkar N. Micro Electromechanical Systems (MEMS) Based Microfluidic Devices for Biomedical Applications // Int. J. Mol. Sci. 2011. T. 12. №12. C. 3648-3704.].
Несмотря на то, что микрофлюидные чипы из-за малого объема культивируемых клеток повышают требования к чувствительности аналитических методов, во многих случаях их применение оправдано возможностью получения более точных и достоверных результатов исследований на клеточных моделях по сравнению с традиционными статическими in vitro системами. В большинстве случаев микрофлюидные чипы изготавливают из полидиметилсилоксана (ПДМС) или полистирола. Реже используются другие полимерные материалы или стекло. ПДМС обладает рядом полезных свойств, в частности, высокой эластичностью, оптической прозрачностью, низкой интенсивностью флуоресценции, высокой газопроницаемостью, биологической инертностью [Halldorsson S. и др. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices // Biosens. Bioelectron. 2015. T. 63. C. 218-231.]. Обычно питательная среда подается в микрофлюидный чип извне с помощью плунжерных насосов. Реже движение жидкости обусловлено центробежной силой, смачиванием, или встроенным в микрофлюидный чип насосом. Применение эластичных материалов, таких как ПДМС, позволяет изготавливать микрофлюидные чипы со встроенными микронасосами и клапанами для управления движением жидкости по системе каналов. Как правило, такие устройства управляются пневматически. Варианты конструктивного решения микрофлюидных чипов с активными компонентами хорошо описаны в материалах патентов US 7445926, US 6793753, US 7258774, US 7766033 и US 8763642.
Важным свойством, присущим только небольшому числу известных конструкций микрофлюидных биореакторов, является наличие замкнутого контура циркуляции питательной среды. Дело в том, что при упомянутых объемах ячеек концентрация метаболитов в системе с проточной ячейкой для культивирования может быть ниже на несколько порядков, чем в статической системе или системе с замкнутым контуром, что обусловлено однократной экспозицией культуральной среды в проточной системе и приводит к неприменимости данных систем для анализа широкого спектра метаболитов стандартными методами. Кроме того, применение в динамических микрофлюидных биореакторах замкнутого контура циркуляции позволяет проводить сокультивирование моделей различных органов и тканей, таким образом, моделируя транспорт веществ между различными органами и тканями организма.
В целом, моделирование микроциркуляции in vitro требует решения ряда сложных не связанных напрямую задач, принадлежащих к различным областям знания. Исходя из вышесказанного, можно выделить в качестве актуальной независимой задачи моделирование in vitro в микрофлюидном чипе с замкнутым контуром циркуляции гидродинамической составляющей микроциркуляции, а именно: постоянной составляющей разности давлений на участке ткани между кровеносным и лимфатическим сосудами и обусловленного деятельностью сердца пульсирующего движения крови в кровеносном сосуде, в частности пульсирующего изменения давления и адвективного массопереноса веществ в кровеносном сосуде и упомянутом участке ткани.
Несмотря на активное развитие техники в этой области, из уровня техники не известно систем, обеспечивающих воспроизведение в микрофлюидном чипе с замкнутой циркуляцией питательной среды сочетания постоянной составляющей разности гидродинамических давлений и пульсирующего характера течения питательной среды и разности давлений. При этом все известные системы обладают рядом недостатков, не позволяющих их широко применять на практике.
Из уровня техники известно устройство для механической стимуляции клеток (US 4851354), позволяющее изучать клетки в культуре в условиях, воспроизводящих механические воздействия, наблюдаемые in vivo. Устройство содержит герметичную ячейку, имеющую оптически прозрачное эластичное основание из биосовместимого материала, на котором упомянутые клетки могут выращиваться, и оптически прозрачную съемную крышку, а также находящийся под основанием встроенный герметичный прозрачный резервуар, заполненный жидкостью с возможностью циклического изменения гидростатического давления, деформирующего эластичное основание, и, следовательно, создающего равномерное напряжение на прикрепленным к этому основанию клеткам.
Существенный недостатком описанной конструкции является тот факт, что она не позволяет создавать разность давлений на клеточной модели, а, следовательно, не позволяет моделировать разность давлений и адвективный транспорт веществ в участке ткани.
Также известен аппарат для культивирования клеток, содержащий двумерную плашку, имеющую эластичные газопроницаемые мембраны на двух противоположных стенках, предназначенные для культивирования клеток под давлением, и два располагаемых на соответствующих противоположных сторонах плашки приспособления, имеющие зеркально-симметричную форму и включающие в себя рамки с жесткой структурой, поддерживающие мембраны плашки, предотвращая их избыточное деформирование (US 7422893). Плашка фиксируется между приспособлениями посредством соединений шип-паз. Аппарат содержит порт для подачи переменного или постоянного гидростатического давления. Возможен вариант выполнения, при котором аппарат содержит второй порт, например для организации течения питательной среды через плашку. Возможен вариант, при котором аппарат содержит компьютеризированное устройство для генерации переменного гидростатического давления в одной или нескольких плашках, включающее двунаправленный плунжерный насос с цифровым управлением и контроллер, запрограммированный на управление движением плунжера насоса. Недостатком описанного аппарата является отсутствие возможности моделирования разности давлений и адвективного транспорта веществ в участке ткани, поскольку применяемые мембраны непроницаемы для жидкости.
Известен аппарат, состоящий из плашки, содержащей несколько заполненных питательной средой лунок с мембранами, закрепленной под ней перфорированной пластины, а также крышки, создающей давление посредством пробок со скошенным основанием (US 7435587). Пробки могут иметь различную длину или завинчиваться в крышку для регулирования величины создаваемого давления, а также могут иметь уплотнительное кольцо и прорезь для удаления воздуха при установке в лунки плашки.
Основным недостатком данного аппарата является отсутствие возможности моделирования разности давлений и адвективного транспорта веществ также по причине того, что применяется непроницаемая для жидкости мембрана. Другим существенным недостатком является отсутствие движения питательной среды (адвекции) в лунках.
Наиболее близкой к предлагаемому техническому решению является система для тестирования лекарственных препаратов US 2013/0295601 (А1), моделирующая микроокружение трехмерных клеточных структур, например опухолей. Система состоит из нижней панели, включающей емкость для культивирования клеточной модели, имеющую отверстия для прокачивания через нее жидкости (питательной среды), и как минимум один боковой канал, моделирующий сосуд лимфатической системы, частично проходящий вдоль упомянутой емкости, и соединенный с ней отверстиями, позволяющими моделировать интерстициальный транспорт в/из лимфатического канала; мембраны с нанопорами, закрывающей упомянутую емкость сверху и позволяющей моделировать транспорт через эндотелий сосуда; верхней панели, расположенной над мембраной и содержащей канал, моделирующий сосуд кровеносной системы, по крайней мере, частично проходящий вдоль емкости для культивирования. Все перечисленные каналы и емкость для культивирования позволяют осуществлять подключение чего-либо к их противоположным концам, например, емкостей или насосов, тем самым позволяя организовать в них течение жидкости. Мембрана может быть покрыта слоем эндотелиальных клеток. Система позволяет проводить оценку количества живых и мертвых клеток с помощью наблюдения оптическими методами.
В одном из вариантов осуществления данного изобретения к входу каждого канала подключен насос или емкость, создающие давление, позволяя в зависимости от канала моделировать давление в ткани, кровеносной или лимфатической системе, соответственно, а выходы каналов подключены к емкости для отработанной жидкости. Возможен вариант, при котором к выходу одного или нескольких каналов вместо емкости для отработанной жидкости также подключен насос или емкость, создающие определенное давление. Система в первую очередь предназначена для моделирования транспорта (доставки) препаратов химиотерапии, основанного на применении наночастиц.
Существенным недостатком данной системы является ее проточный характер, т.е. отсутствие замкнутого контура циркуляции среды, вследствие чего, в отличие от статических систем или систем с замкнутым контуром циркуляции, из-за низких концентраций невозможно исследование стандартными методами молекулярной биологии множества продуцируемых клеточной моделью метаболитов. По этой же причине усложняется исследование в данной системе фармакокинетики и фармакодинамики лекарственных препаратов.
Другой недостаток данной системы обусловлен тем, что загрузка клеток в емкость и извлечение из нее может производиться только через соответствующий канал, поскольку конструкция не предусматривает возможности непосредственного доступа к модели, в т.ч. применения стандартных сменных вставок с мембранами (например, Transwell производства Corning, или подобных), что делает систему существенно менее удобной в работе. По этой же причине невозможно осуществить подготовку клеточной модели вне системы с последующим переносом ее в систему, что увеличивает стоимость проведения исследования, поскольку на практике значительный процент подготавливаемых клеточных моделей могут иметь дефекты.
Раскрытие изобретения
Задачей изобретения является создание микрофлюидного чипа для культивирования клеточных моделей in vitro с замкнутой циркуляцией питательной среды, позволяющего более полно и точно моделировать in vitro условия существования (микроокружение) клеток in vivo, что позволяет при проведении экспериментов на культивируемых в чипе клеточных моделях получать результаты более точно и полно предсказывающие реакцию моделируемого организма.
Технический результат изобретения заключается в возможности моделировать в микрофлюидном чипе для культивирования клеточных моделей in vitro в замкнутом контуре циркуляции питательной среды гидродинамическую составляющую микроциркуляции in vivo, а именно: постоянную составляющую разности давлений на участке ткани между кровеносным и лимфатическим сосудами и обусловленное деятельностью сердца пульсирующее движение крови в кровеносном сосуде, и, как следствие, пульсирующее механическое воздействие на упомянутый участок ткани, а также пульсирующее изменение давления и адвективный перенос веществ в упомянутом участке ткани и кровеносном сосуде.
Кроме того, дополнительными техническими результатами заявляемого изобретения являются: моделирование системного ответа организма благодаря возможности сокультивирования нескольких клеточных моделей, удобство работы и возможность предварительного культивирования модели в планшете в статических условиях вследствие применения вставок, высокая надежность и технологичность за счет применения многослойной конструкции, включающей верхнюю пластину, обеспечивающую механическую прочность.
Поставленная задача решается тем, что микрофлюидный чип для культивирования клеток включает корпус, выполненный из соединенных, по крайней мере, двух, верхней и нижней, пластин, в котором расположены: микрофлюидные каналы, снабженные, по крайней мере, первым и вторым клапанами, выполненными с возможностью перекрытия каналов; по крайней мере, одна ячейка для культивирования, выполненная с возможностью герметичного размещения в ней вставки с клеточной моделью, делящей ячейку на входную и выходную части; рабочая камера, образованная частью микрофлюидного канала между первым и вторым клапанами по ходу движения питательной среды, и снабженного мембраной, выполненной с возможностью изменения объема рабочей камеры, при этом первый клапан, рабочая камера, второй клапан, входная часть ячейки для культивирования соединены микрофлюидными каналами с образованием замкнутого контура циркуляции питательной среды, а клапаны, рабочая камера и микрофлюидные каналы выполнены с возможностью создания пульсирующего течения питательной среды; средство создания постоянного давления в замкнутом контуре циркуляции, подключенное к контуру циркуляции на участке между вторым и первым клапанами по ходу движения питательной среды.
Микрофлюидный чип дополнительно может содержать размещенную в корпусе, по крайней мере, одну емкость сбора фильтрата, подключенную к выходной части ячейки для культивирования клеточной модели. Емкость сбора фильтрата может быть выполнена сообщающейся с атмосферой посредством выполненного в корпусе канала, в котором может быть размещен фильтрующий элемент. Емкость сбора фильтрата представляет собой полость в корпусе, которая может быть снабжена мембраной, выполненной с возможностью изменения объема расположенной под мембраной полости. Емкость сбора фильтрата может содержать датчик, выполненный с возможностью оценки объема фильтрата. Кроме того, емкость сбора фильтрата может быть соединена с рабочей камерой посредством отдельного микрофлюидного канала.
В предпочтительном варианте выполнения средство создания постоянного давления содержит мембрану, размещенную в выполненной в корпусе полости, соединенной с контуром циркуляции, при этом мембрана выполнена с возможностью изменения объема полости, расположенной под мембраной, которое может быть реализовано различными средствами, например, размещенным на мембране грузом соответствующей массы, или средством пневматического или гидравлического воздействия на мембрану, или с помощью соленоида, закрепленного на корпусе, с размещением его якоря на мембране, или с помощью магнита и ферромагнетика, или двух притягивающихся или отталкивающихся магнитов, размещенных на мембране и корпусе. В другом варианте исполнения средство создания постоянного давления выполнено в виде расположенной вертикально трубки с размещенной в ней жидкостью с требуемой высотой столба, нижняя часть которой выполнена сопряженной с микрофлюидным каналом контура циркуляции, а верхняя - сообщающейся с атмосферой.
Средство создания постоянного давления может быть подключено к контуру циркуляции до или после ячейки для культивирования по ходу движения питательной среды. При реализации первого варианта, микрофлюидные каналы имеют геометрию, обеспечивающую отношение гидродинамического сопротивления каналов на участке контура циркуляции между первым клапаном по ходу движения среды и ячейкой для культивирования к гидродинамическому сопротивлению каналов между ячейкой для культивирования и средством создания постоянного давления в диапазоне от 10:1 до 200:1. Для второго варианта подключения средства создания постоянного давления данное соотношение должно выполняться для участка контура циркуляции между вторым клапаном по ходу движения среды и ячейкой для культивирования, и участка контура между ячейкой для культивирования и средством создания постоянного давления, соответственно. Предпочтительно средство создания постоянного давления выполнено с возможностью создания постоянного давления в контуре циркуляции в диапазоне от 0 до 7 кПа.
Микрофлюидный чип может содержать дополнительное средство создания постоянного давления - постоянного давления в выходной части ячейки, размещаемое в емкости сбора фильтрата которое выполнено по аналогии основным, конструктивные особенности которого перечислены выше.
Микрофлюидный чип может дополнительно содержать емкость для «исходной» питательной среды и емкость для сбора «отработанной» среды, размещенные за пределами корпуса и подключенные к рабочей камере через отдельные микрофлюидные каналы, снабженные клапанами для подключения или отключения упомянутых емкостей.
Предпочтительно верхняя пластина корпуса выполнена из полистирола, полидиметилсилоксана или поликарбоната, а нижняя пластина выполнена из полистирола или стекла.
Корпус микрофлюидного чипа может содержать дополнительную эластичную пластину, расположенную между верхней и нижней пластинами, при этом клапаны, мембрана рабочей камеры, микрофлюидные каналы могут быть выполнены в эластичной пластине с обеспечением герметизации каналов посредством нижней пластины. В другом варианте осуществления изобретения микрофлюидные каналы выполнены в верхней и/или нижней пластине, а функцию клапанов и мембраны рабочей камеры выполняют фрагменты эластичной пластины. Возможен также вариант реализации изобретения, в котором микрофлюидные каналы выполнены в верхней и/или нижней пластине, а мембрана рабочей камеры и клапаны выполнены в виде отдельных эластичных элементов, установленных между пластинами, причем соединение упомянутых пластин и эластичных элементов выполнено с обеспечением герметичности микрофлюидных каналов. Предпочтительно мембрана рабочей камеры и клапаны выполнены из полидиметилсилоксана или других эластомеров и имеют толщину, выбранную из диапазона от 0.01 до 1 мм, с возможностью гидравлического или пневматического управления.
Ячейка для культивирования образована выполненным в корпусе отверстием и снабжена крышкой. Крышка может быть выполнена с возможностью введения через нее различных растворов и отбора проб циркулирующей питательной среды или фильтрата. Кроме того, микрофлюидный чип может содержать, по крайней мере, одну соединенную с контуром циркуляции дополнительную ячейку для культивирования.
Заявляемый микрофлюидный чип помимо первого и второго может содержать несколько дополнительных клапанов, например, один из которых может быть расположен в контуре циркуляции питательной среды между средством создания постоянного давления и ячейкой для культивирования для предотвращения вытекания питательной среды из ячейки при установке, либо извлечении вставки из ячейки. В другом варианте средство создания постоянного давления может быть подключено к контуру циркуляции через отдельный микрофлюидный канал, снабженный дополнительным клапаном для подключения или отключения упомянутого средства. Другой дополнительный клапан может быть расположен в микрофлюидном канале, соединяющем емкость сбора фильтрата с рабочей камерой. Кроме того, при отсутствии емкости сбора фильтрата, выходная часть ячейки для культивирования может быть соединена с рабочей камерой посредством отдельного микрофлюидного канала, также снабженного еще одним дополнительным клапаном.
Помимо перечисленных датчиков, предпочтительно, чтобы микрофлюидный чип содержал датчик давления в контуре циркуляции.
Микрофлюидный чип может дополнительно содержать порт для забора образцов питательной среды или внесения растворов препаратов, подключенный к контуру циркуляции или рабочей камере посредством микрофлюидного канала.
Микрофлюидные каналы, клапаны и рабочая камера в наилучшем варианте реализации изобретения выполнены с возможностью создания течения питательной среды в контуре циркуляции со значением среднего объемного расхода, выбранного из диапазона от 0 до 50 мкл/мин., а также создания пульсирующего течения питательной среды с пульсациями давления в ячейке для культивирования в диапазоне от 0 до 500 Па.
Поставленная задача решается также созданием способа культивирования клеточной модели в микрофлюидном чипе, согласно которому заполняют микрофлюидные каналы и ячейки для культивирования питательной средой, размещают вставку с клеточной моделью в ячейке для культивирования, после чего клеточную модель культивируют в условиях циркуляции питательной среды по замкнутому контуру, при этом в контуре циркуляции создают постоянное давление, моделирующее постоянную составляющую разности давлений на участке ткани между кровеносным и лимфатическим сосудами in vivo с помощью средства создания постоянного давления с обеспечением фильтрации питательной среды из входной части ячейки через клеточную модель в выходную часть ячейки, и пульсирующее течение питательной среды, моделирующее пульсирующее течение крови в кровеносном сосуде in vivo посредством открытия и закрытия первого и второго клапанов и изменения объема рабочей камеры.
Для моделирования в клеточной модели in vitro гидродинамической составляющей микроциркуляции солидной опухоли in vivo, дополнительно создают давление в выходной части ячейки от 0 до 2 кПа относительно атмосферного.
В одном из вариантов выполнения изобретения постоянное давление в контуре циркуляции создают с обеспечением превышения давления во входной части ячейки над давлением в выходной части на величину в интервале значений от 0 до 7 кПа в зависимости от моделируемого давления в капилляре in vivo. Пульсирующее течение питательной среды в замкнутом контуре обеспечивают с переменной составляющей давления во входной части ячейки для культивирования, с амплитудой импульсов из интервалов значений от 10 до 500 Па и длительностью от 50 до 1500 мс, которые выбирают в зависимости от моделируемой переменной составляющей давления в капилляре in vivo, посредством подачи соответствующих управляющих импульсов на первый и второй клапаны и мембрану рабочей камеры. Средняя скорость движения среды во входной части ячейки для культивирования лежит в интервале значений от 0.01 до 2.0 мм/с. Открытие и закрытие первого и второго клапанов, а также изменение объема рабочей камеры проводят циклически по алгоритму: ЗЗМ, ОЗМ, ОЗБ, ЗЗБ, ЗОБ, ЗОМ, соответственно, где З - клапан закрыт, О - клапан открыт, М - объем рабочей камеры снижен, Б - объем рабочей камеры увеличен.
Краткое описание чертежей
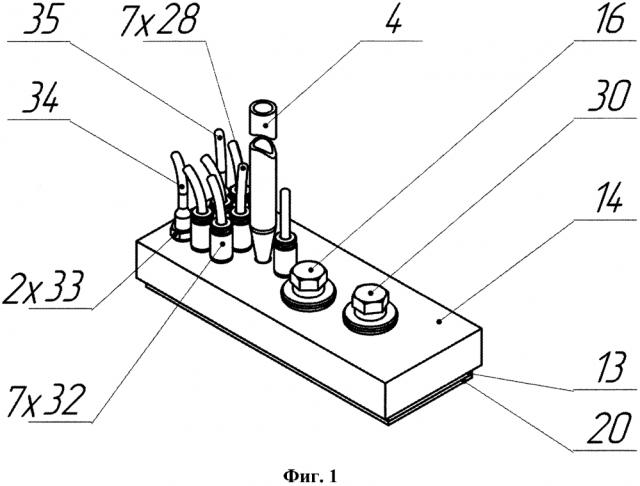
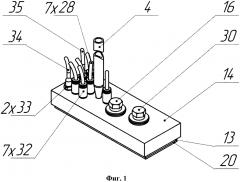
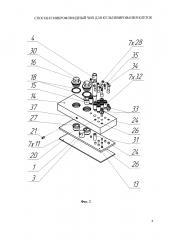
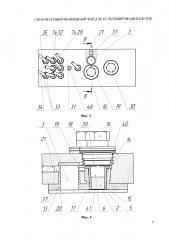
Изобретение поясняется чертежами, где на фиг. 1 и 2 представлен вариант выполнения микрофлюидного чипа - общий вид и схема сборки, соответственно; на фиг. 3 представлен вид сверху на заявляемое устройство, где на местном разрезе представлен фрагмент, показывающий канал в верхней пластине, соединяющий емкость сбора фильтрата с ячейкой для культивирования клеточных моделей; на фиг. 4 представлено детализированное изображение фрагмента фиг. 3 в поперечном разрезе по линии В-В, где можно видеть устройство ячейки с установленной в ней мембранной вставкой с клеточной моделью; на фиг. 5 схематично представлен вариант конструктивного исполнения системы микрофлюидных каналов, выполненных в эластичной пластине (в планарном представлении), причем позиции 1, 3, 24, 26, 27, 48 показаны условно в местах проекций соответствующих элементов; на фиг. 6 изображен поперечный разрез одного из вариантов выполнения дополнительной ячейки (поз. 27 на фиг. 2); на фиг. 7 представлен поперечный разрез клапанов 25 и 10 и отверстия 26 для подключения емкости сбора среды; на фиг. 8 показан увеличено разрез клапана 25 с камерой управления и полостью микрофлюидного канала в закрытом (а) и открытом (б) состоянии; на фиг. 9 представлена временная диаграмма работы насоса (в каждой строке диаграммы схематично изображены сверху вниз: верхняя пластина, эластичная пластина с выполненными в ней клапанами/мембранами, микрофлюидный канал, в котором черной заливкой обозначено движение порции жидкости (питательной среды), нижняя герметизирующая пластина -предметное стекло), где T1-Т6 такты работы насоса; на фиг. 10 а) и б) показаны два варианта мембранной вставки: без фланца и с фланцем, соответственно; на фиг. 11 представлен в разрезе вариант конструкции средства создания постоянного давления на основе эластичной мембраны и груза; на фиг. 12 представлена гидравлическая принципиальная схема микрофлюидного чипа, где стрелками показано направление движения питательной среды, а пунктирным прямоугольником обозначены компоненты, в совокупности составляющие насос-маршрутизатор; на фиг. 13 показаны емкость с питательной средой и емкость сбора среды, на фиг. 14 представлен в разрезе вариант конструктивного решения средства создания постоянного давления на основе трубки; на фиг. 15 представлен вариант конструкции емкости сбора среды на основе деформируемой мембраны.
Позициями на чертежах обозначены:
1 - ячейка,
2 - модель, представленная, например, гидрогелем с клетками,
3 - емкость сбора фильтрата,
4 - трубка средства создания постоянного давления,
5 - входная часть ячейки,
6 - выходная часть ячейки,
7 - микрофлюидные каналы,
8 - первый клапан контура циркуляции,
9 - рабочая камера,
10 - второй клапан контура циркуляции,
11 - камеры управления клапанами и мембраной рабочей камеры,
12 - перегородка клапана,
13 - эластичная пластина корпуса (слой ПДМС),
14 - верхняя пластина корпуса,
15 - мембранная вставка,
16 - крышка ячейки,
17 - эластичный выступ ячейки,
18 - эластичное кольцо,
19 - канал, соединяющий ячейку и емкость сбора фильтрата,
20 - нижняя (герметизирующая) пластина корпуса,
21 - фильтр емкости сбора фильтрата,
22 - клапан емкости сбора фильтрата,
23 - клапан емкости с питательной средой,
24 - отверстие в корпусе для подключения емкости с питательной средой,
25 - клапан емкости сбора среды,
26 - отверстие в корпусе для подключения емкости сбора среды,
27 - дополнительная ячейка,
28 - трубки пневматического управления,
29 - мембрана средства создания постоянного давления,
30 - крышка дополнительной ячейки,
31 - манжета для герметизации трубки средства создания постоянного давления,
32 - быстросъемные фитинги для подключения трубок пневматического управления,
33 - миниатюрные штуцеры,
34 - трубка-капилляр к емкости с питательной средой,
35 - трубка-капилляр к емкости сбора среды,
36 - мембрана клапана,
37 - отверстие, соединяющее емкость сбора фильтрата с атмосферой,
38 - клапан средства создания постоянного давления,
39 - выступ на крышке,
40 - верхний эластичный выступ ячейки,
41 - мембрана мембранной вставки,
42 - емкость с питательной средой,
43 - емкость сбора среды,
44 - резиновая пробка стеклянного пузырька,
45 - полая игла с установленным в нее фильтром,
46 - груз средства создания постоянного давления,
47 - мембрана емкости сбора фильтрата,
48 - полость устройства поддержания давления.
Осуществление изобретения
В общем виде микрофлюидный чип для культивирования клеток включает корпус, выполненный из соединенных, по крайней мере, двух, верхней 14 и нижней (герметизирующей) 20, пластин с образованием многослойной структуры (фиг. 1, 2). В корпусе расположены микрофлюидные каналы 7, снабженные, по крайней мере, двумя клапанами 8, 10 выполненными с возможностью перекрытия каналов и, по крайней мере, одна рабочая камера 9 с мембраной, выполненной с возможностью изменения объема рабочей камеры (фиг. 5, 12). При выполнении корпуса из двух пластин каналы могут быть расположены в верхней и/или нижней пластине, при этом мембрана рабочей камеры 9 и клапаны 8, 10 и др. могут быть выполнены в виде отдельных эластичных элементов, закрепленных в корпусе между верхней 14 и нижней 20 пластинами, при выполнении корпуса из трех пластин - верхней 14, средней 13 из ПДМС (или другого эластомера) и нижней 20, каналы, клапаны и мембрана могут быть расположены в средней эластичной пластине 13 (фиг. 1, 2, 5, 7, 8).
Также чип содержит, по крайней мере, одну ячейку 1, выполненную с возможностью герметичного размещения в ней вставки 15, предназначенной для клеточной модели 2, делящей ячейку на входную 5 и выходную 6 части (фиг. 2, 4). К выходной части 6 ячейки подключена емкость сбора фильтрата 3 (фиг. 4).
Рабочая камера 9 соединена посредством микрофлюидных каналов 7 с клапанами 8 и 10 и с входной частью 5 ячейки 1 с образованием по крайней мере одного замкнутого контура циркуляции питательной среды (фиг. 5).
Чип также может содержать соединенные с контуром циркуляции дополнительные ячейки, например, ячейку 27 (фиг. 2, 6), не подключенные к емкости сбора фильтрата 3 (фиг. 4).
Также чип содержит средство создания постоянного давления (фиг. 11 или фиг. 14), соединенное полостью 48 с контуром циркуляции (фиг. 5). Соединение средства с контуром циркуляции может быть реализовано посредством отдельного микрофлюидного канала, причем для обеспечения удобства работы с клеточными моделями в упомянутом микрофлюидном канале или на участке между полостью 48 и ячейками 1, 27 может быть размещен клапан 38 средства создания постоянного давления.
Емкость сбора фильтрата 3 (фиг. 4) выполнена с возможностью подключения через клапан 22 к рабочей камере 9 (фиг. 5).
К рабочей камере 9 может быть подключена через клапан 23 емкость с питательной средой 42 (фиг. 5, 12, 13). К рабочей камере 9 также может быть подключена через клапан 25 емкость сбора среды 43 (фиг. 5, 12, 13).
Также к контуру циркуляции или рабочей камере 9 может быть подключен порт для забора образцов питательной среды или внесения растворов препаратов (на чертежах не показан). Подключение может производиться микрофлюидным каналом, в том числе через отдельный клапан.
Рабочая камера 9 в совокупности с подключенными к ней клапанами 8, 10, 22, 23 и 25 представляет собой насос-маршрутизатор, обеспечивающий перекачивание жидкостей в заданном направлении между любой парой упомянутых клапанов (фиг. 12).
В заявляемом устройстве микрофлюидный канал контура циркуляции, проходящий через входную часть ячейки 5, моделирует мелкий кровеносный сосуд. Формируемая средством создания постоянного давления постоянная составляющая давления и обусловленные работой насоса-маршрутизатора пульсирующее движение питательной среды и пульсации давления, соответственно, моделируют в чипе гидродинамические условия существования клеток в живом организме - постоянную составляющую давления в кровеносном сосуде, пульсирующее течение крови и пульсации давления, обусловленные деятельностью сердца. Выходная часть 6 ячейки 1, емкость сбора фильтрата 3 и соединяющий их канал 19 (см. фиг. 3, 4) в совокупности моделируют фрагмент лимфатической системы, обеспечивающий отвод интерстициальной жидкости из ткани под действием разности давлений.
Ниже представлены возможные варианты выполнения отдельных конструктивных элементов заявляемого микрофлюидного чипа.
Варианты решения корпуса микрофлюидного чипа и системы микрофлюидных каналов.
Для мелкосерийного производства предпочтителен вариант, в котором корпус представляет собой трехслойную структуру, включающую верхнюю