Пептиды mphosph1 и вакцины, включающие их
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к противоопухолевым вакцинам на основе эпитопных пептидов MPHOSPH1, и может быть использовано в медицине. Получают пептид состоящий из аминокислотной последовательности SEQ ID NO: 120. Пептид может содержать замены С- и/или N-концевой аминокислоты указанной последовательности на лейцин или метионин. Полученный эпитопный пептид обладает способностью индуцировать цитотоксические Т-лимфоциты (CTL) в присутствии антигенпредставляющей клетки (АРС), несущей HLA-A*0201 или HLA-А*0206. Изобретение позволяет индуцировать иммунный ответ против злокачественной опухоли, экспрессирующей MPHOSPH1 у индивидуума, HLA антиген которого представляет собой HLA-A*0201 или HLA-A*0206. 14 н.п. ф-лы, 6 ил., 3 табл., 1 пр.
Реферат
Область техники
Настоящее изобретение относится к области биологических наук, более конкретно к области терапии злокачественной опухоли. В частности, настоящее изобретение относится к новым пептидам, которые являются эффективными в качестве вакцин против злокачественной опухоли, а также к лекарственным средствам для любого или обоих из лечения и профилактики опухолей.
Приоритет
По настоящей заявке испрашивается приоритет временной заявки США № 61/522991, поданной 12 августа 2011 года, полное содержание которой включено в настоящее описание в качестве ссылки.
Уровень техники
Было показано, что цитотоксические T-лимфоциты (CTL) распознают эпитопные пептиды, происходящие из ассоциированных с опухолью антигенов (TAA), находящихся на молекуле главного комплекса гистосовместимости (MHC) класса I, а затем уничтожают опухолевые клетки. С момента открытия семейства антигенов меланомы (MAGE) с помощью иммунологических подходов было открыто множество других TAA (NPL 1, Boon T, Int J Cancer 1993 May 8, 54(2): 177-80; NPL 2, Boon T & van der Bruggen P, J Exp Med 1996 Mar 1, 183(3): 725-9). Некоторые из этих TAA в настоящее время находятся в клинической разработке в качестве иммунотерапевтических мишеней.
Для пролиферации и выживания злокачественных клеток необходимы способствующие TAA. Использование таких TAA в качестве мишеней для иммунотерапии может минимизировать хорошо описанный риск ускользания от иммунного ответа злокачественных клеток, присущего делеции, мутации или подавлению регуляции TAA, вследствие терапевтически обусловленной иммунной селекции. Таким образом, идентификация новых TAA, способных индуцировать мощные и специфичные противоопухолевые иммунные ответы, оправдывает дальнейшую разработку, и, таким образом, в настоящее время клинически применяются стратегии вакцинации пептидами от различных типов злокачественных опухолей (NPL 3, Harris CC, J Natl Cancer Inst 1996 Oct 16, 88(20): 1442-55; NPL 4, Butterfield LH et al., Cancer Res 1999 Jul 1, 59(13): 3134-42; NPL 5, Vissers JL et al., Cancer Res 1999 Nov 1, 59(21): 5554-9; NPL 6, van der Burg SH et al., J Immunol 1996 May 1, 156(9): 3308-14; NPL 7, Tanaka F et al., Cancer Res 1997 Oct 15, 57(20): 4465-8; NPL 8, Fujie T et al., Int J Cancer 1999 Jan 18, 80(2): 169-72; NPL 9, Kikuchi M et al., Int J Cancer 1999 May 5, 81(3): 459-66; NPL 10, Oiso M et al., Int J Cancer 1999 May 5, 81(3): 387-94). На настоящий момент описано несколько клинических испытаний с использованием этих пептидов, происходящих из опухолевых антигенов. К сожалению, многие из текущих испытаний вакцин против злокачественной опухоли продемонстрировали только низкий уровень объективных ответов (NPL 11, Belli F et al., J Clin Oncol 2002 Oct 15, 20(20): 4169-80; NPL 12, Coulie PG et al., Immunol Rev 2002 Oct, 188: 33-42; NPL 13, Rosenberg SA et al., Nat Med 2004 Sep, 10(9): 909-15). Таким образом, в данной области остается потребность в новых TAA в качестве иммунотерапевтических мишеней.
MPHOSPH1 (фосфопротеин 1 M-фазы; номер доступа GenBank № NM_016195 и NP_057279, SEQ ID NO: 125 и 126), был идентифицирован в качестве одного из белков, специфически фосфорилируемых при переходе G2/M, и его характеризуют как белок, родственный направленному на плюс-конец кинезину (NPL 14, Abaza A et al., J Biol Chem 2003, 278: 27844-52.). Более конкретно, было описано, что MPHOSPH1 является направленным на плюс-конец молекулярным мотором, который играет ключевую роль в цитокинезе и накапливается в средней зоне веретена в клетках HeLa в процессе от анафазы до телофазы (NPL 14, Abaza A et al., J Biol Chem 2003, 278: 27844-52; NPL 15, Kamimoto T et al., J Biol Chem 2001, 276: 37520-8). В ходе анализов профиля экспрессии генов с использованием полногеномных кДНК-микрочипов, содержащих 23040 генов, MPHOSPH1 был идентифицирован в качестве новой молекулы, активируемой при раке мочевого пузыря (NPL 16, Kanehira M et al., Cancer Res. 2007 Apr 1;67(7):3276-85.; PTL 1, WO2006/085684). Более того, с помощью нозерн-блот анализа было выявлено, что экспрессия продуктов гена MPHOSPH1 ограничена семенником и отсутствует в нормальных жизненно-важных органах.
Ранее были идентифицированы некоторые пептидные фрагменты, происходящие из MPHOSPH1, имеющие способность индуцировать цитотоксические T-лимфоциты (CTL) (PTL 2, WO2008/047473). Эти пептидные фрагменты продемонстрировали способность индуцировать CTL против клеток, стимулированных распознаваемыми ими пептидными фрагментами. Однако в предшествующих исследованиях не было подтверждено, обладают ли пептидные фрагменты способностью индуцировать CTL, нацеленные на опухолевые клетки, экспрессирующие ген MPHOSPH1 и антиген HLA-A2.
Список ссылок
[Патентная литература]
[PTL 1] WO2006/085684
[PTL 2] WO2008/047473
[Непатентная литература] [NPL 1] Boon T, Int J Cancer 1993 May 8, 54(2): 177-80
[NPL 2] Boon T & van der Bruggen P, J Exp Med 1996 Mar 1, 183(3): 725-9
[NPL 3] Harris CC, J Natl Cancer Inst 1996 Oct 16, 88(20): 1442-55
[NPL 4] Butterfield LH et al., Cancer Res 1999 Jul 1, 59(13): 3134-42
[NPL 5] Vissers JL et al., Cancer Res 1999 Nov 1, 59(21): 5554-9
[NPL 6] van der Burg SH et al., J Immunol 1996 May 1, 156(9): 3308-14
[NPL 7] Tanaka F et al., Cancer Res 1997 Oct 15, 57(20): 4465-8
[NPL 8] Fujie T et al., Int J Cancer 1999 Jan 18, 80(2): 169-72
[NPL 9] Kikuchi M et al., Int J Cancer 1999 May 5, 81(3): 459-66
[NPL 10] Oiso M et al., Int J Cancer 1999 May 5, 81(3): 387-94
[NPL 11] Belli F et al., J Clin Oncol 2002 Oct 15, 20(20): 4169-80
[NPL 12] Coulie PG et al., Immunol Rev 2002 Oct, 188: 33-42
[NPL 13] Rosenberg SA et al., Nat Med 2004 Sep, 10(9): 909-15
[NPL 14] Abaza A et al., J Biol Chem 2003, 278: 27844-52.
[NPL 15] Kamimoto T et al., J Biol Chem 2001, 276: 37520-8
[NPL 16] Kanehira M et al., Cancer Res. 2007 Apr 1; 67(7):3276-85.
Сущность изобретения
Настоящее изобретение основано, по меньшей мере частично, на открытии новых пептидов, которые могут служить в качестве подходящих мишеней для иммунотерапии. Поскольку TAA, главным образом, воспринимаются иммунной системой как "свое" и, таким образом, часто не обладают иммуногенностью, открытие подходящих мишеней является крайне важным. Как указано выше, MPHOSPH1 (например, SEQ ID NO: 126, кодируемый геном с номером доступа в GenBank № NM_016195 (SEQ ID NO: 125)) был идентифицирован в качестве активированного в злокачественных опухолях, примеры которых включают, но не ограничиваются ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, хронический миелоидный лейкоз (CML), рак ободочной и прямой кишки, рак желудка, немелкоклеточный рак легкого (NSCLC), лимфому, остеосаркому, рак предстательной железы, рак почек и рак мягких тканей. Таким образом, настоящее изобретение сфокусировано на MPHOSPH1 в качестве мишени-кандидата для иммунотерапии злокачественной опухоли/опухоли, более конкретно на новых эпитопных пептидах MPHOSPH1, которые могут служить в качестве подходящих иммунотерапевтических мишеней.
В связи с этим, настоящее изобретение относится, по меньшей мере частично, к идентификации определенных эпитопных пептидов, которые обладают способностью индуцировать CTL, специфичные к MPHOSPH1, среди пептидов, происходящих из MPHOSPH1. Как более подробно рассмотрено ниже, мононуклеарные клетки периферической крови (PBMC), полученные от здорового донора, стимулировали с использованием пептидов-кандидатов, связывающих HLA-A*0201, происходящих из MPHOSPH1. Затем получали клеточные линии CTL со специфической активностью против положительных по HLA-A2 клеток-мишеней, обрабатываемых каждым из пептидов-кандидатов. Результаты, представленные в настоящем описании, демонстрируют, что эти пептиды представляют собой ограниченные по HLA-A2 эпитопные пептиды, которые могут индуцировать мощные и специфические иммунные ответы против клеток, экспрессирующих MPHOSPH1. Кроме того, эти результаты указывают на то, что MPHOSPH1 является высоко иммуногенными и его эпитопы являются эффективными мишенями для иммунотерапии злокачественной опухоли/опухоли.
Таким образом, задачей настоящего изобретения является предоставление выделенных пептидов, которые связывают антиген HLA и индуцируют CTL, где пептиды включают иммунологически активный фрагмент MPHOSPH1 (SEQ ID NO: 126). Такие пептиды можно использовать для индукции CTL in vitro или ex vivo, или для введения прямо индивидууму, так чтобы индуцировать in vivo иммунные ответы против злокачественных опухолей, примеры которых включают, но не ограничиваются ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, CML, рак ободочной и прямой кишки, рак желудка, NSCLC, лимфому, остеосаркому, рак предстательной железы, рак почек и опухоль мягких тканей.
Пептиды по настоящему изобретению обычно имеют длину менее 15, 14, 13, 12, 11 или 10 аминокислот. Предпочтительными пептидами по настоящему изобретению являются нонапептиды или декапептиды. Особенно предпочтительные пептиды имеют аминокислотную последовательность, выбранную из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120, поскольку показано, что эти пептиды связываются с антигеном HLA-A2 и индуцируют CTL.
Таким образом, в некоторых вариантах осуществления пептиды по настоящему изобретению представляют собой пептиды длиной менее 15, 14, 13, 12, 11 или 10 аминокислот, которые имеют аминокислотную последовательность, выбранную из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120. В типичных вариантах осуществления пептиды по настоящему изобретению представляют собой нонапептиды или декапептиды, имеющие аминокислотную последовательность, выбранную из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120. Более того, как продемонстрировано в настоящем описании, было подтверждено, что пептид, имеющий аминокислотную последовательность SEQ ID NO: 120, индуцирует CTL, нацеленные на опухолевые клетки, экспрессирующие MPHOSPH1 и антиген HLA-A2. Таким образом, в предпочтительных вариантах осуществления пептиды по настоящему изобретению представляют собой пептиды, имеющие аминокислотную последовательность SEQ ID NO: 120.
При контактировании с антигенпредставляющими клетками (APC) in vitro, ex vivo или in vivo, пептиды по настоящему изобретению связываются с антигенами HLA-A2 на APC и представляются на APC в качестве комплексов с антигенами HLA-A2. Альтернативно пептиды по настоящему изобретению могут захватываться в APC, процессироваться до фрагментов, состоящих из аминокислотной последовательности, выбранной из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120 в APC, и представляться на APC в качестве комплексов с антигенами HLA-A2. Следовательно, индуцируются CTL, специфичные к таким пептидам, и такие CTL считаются элементами настоящего изобретения.
Также настоящее изобретение относится к модифицированным пептидам, имеющим аминокислотную последовательность, в которой одна, две или несколько аминокислот заменены, удалены, вставлены и/или добавлены в аминокислотной последовательности, выбранной из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120, при условии, что модифицированные пептиды сохраняют способность индуцировать CTL, эквивалентную способности индуцировать CTL исходного немодифицированного пептида. В связи с этим, настоящее изобретение относится к выделенному пептиду длиной менее 15, 14, 13, 12, 11 или 10 аминокислот, который обладает способностью индуцировать CTL и содержит аминокислотную последовательность, выбранную из группы, состоящей из:
(i) аминокислотной последовательности, где 1, 2 или несколько аминокислота(аминокислот) заменены в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 14 и 64, и
(ii) аминокислотной последовательности согласно (i), где аминокислотная последовательность имеет одну или обе из следующих характеристик:
(a) вторая аминокислота с N-конца указанной SEQ ID NO выбрана из группы, состоящей из лейцина и метионина; и
(b) C-концевая аминокислота указанной SEQ ID NO выбрана из группы, состоящей из валина и лейцина.
Более того, настоящее изобретение также относится к выделенному пептиду длиной менее 15, 14, 13, 12 или 11 аминокислот, который обладает способностью индуцировать CTL и содержит аминокислотную последовательность, выбранную из группы, состоящей из:
(i') аминокислотной последовательности, где 1, 2 или несколько аминокислота(аминокислот) заменены в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 73, 77, 79, 97, 103 и 120, и
(ii) аминокислотной последовательности согласно (i), где аминокислотная последовательность имеет одну или обе из следующих характеристик:
(a) вторая аминокислота с N-конца указанной SEQ ID NO выбрана из группы, состоящей из лейцина и метионина; и
(b) C-концевая аминокислота указанной SEQ ID NO выбрана из группы, состоящей из валина и лейцина.
Как продемонстрировано в настоящем описании, такие пептиды могут связываться с антигенами HLA-A2 на APC и могут быть представлены на APC в качестве комплексов с антигенами HLA-A2. Альтернативно такие пептиды могут захватываться в APC, процессироваться до фрагментов, состоящих из аминокислотной последовательности, выбранной из (i), (ii), (i') и (ii') в APC, и представляться на APC в качестве комплексов с антигенами HLA-A2, когда эти пептиды контактируют с APC. Следовательно, индуцируются CTL, специфичные к таким пептидам, и такие CTL считаются элементами настоящего изобретения.
Кроме того, настоящее изобретение охватывает выделенные полинуклеотиды, которые кодируют любые из пептидов по настоящему изобретению. Эти полинуклеотиды можно использовать для индукции или получения APC, имеющих способность индуцировать CTL. Подобно описанным выше пептидам по настоящему изобретению, такие APC можно вводить индивидууму для индукции иммунных ответов против злокачественных опухолей.
При введении индивидууму пептиды по настоящему изобретению представляются на поверхности APC, чтобы индуцировать нацеливание CTL на соответствующие пептиды. Таким образом, одной из задач настоящего изобретения является предоставление средств или композиций, которые включают один или несколько пептид(ов) или полинуклеотид(ов), предусмотренный согласно настоящему изобретению, для индукции любой или обеих из APC или CTL. Такие средства или композиции также можно использовать для одной или более цели(ей), выбранной из лечения злокачественной опухоли, профилактики злокачественной опухоли или предупреждения послеоперационного рецидива злокачественной опухоли. Примеры злокачественных опухолей-мишеней включают, но не ограничиваются ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, CML, рак ободочной и прямой кишки, рак желудка, NSCLC, лимфому, остеосаркому, рак предстательной железы, рак почек и опухоль мягких тканей. Таким образом, другой задачей настоящего изобретения предоставление фармацевтических средств или композиций для любого или обоих из лечения злокачественной опухоли и профилактики злокачественной опухоли, причем такие фармацевтические средства или композиции составлены так, чтобы они включали один или несколько пептидов или полинуклеотидов по настоящему изобретению. Вместо или в дополнение к пептидам или полинуклеотидам по настоящему изобретению, фармацевтические средства или композиции по настоящему изобретению могут включать в качестве активных ингредиентов APC или экзосомы, которые представляют любой из пептидов по настоящему изобретению.
Пептиды или полинуклеотиды по настоящему изобретению можно использовать для индукции APC, которые представляют на поверхности комплекс антигена HLA и пептида по настоящему изобретению, например, при контактировании APC с пептидом по настоящему изобретению или введении полинуклеотида, кодирующего пептид по настоящему изобретению, в APC. Такие APC способны индуцировать CTL, которые специфично распознают клетки, которые представляют пептиды-мишени на их поверхности и применимы в иммунотерапии злокачественной опухоли. Таким образом, настоящее изобретение охватывает способы индукции APC, имеющих способность индуцировать CTL, а также APC, полученных такими способами. Кроме того, настоящее изобретение также охватывает средства или композиции для применения в индукции APC, причем такие средства или композиции включают любые пептиды или полинуклеотиды по настоящему изобретению.
Следующей задачей настоящего изобретения является предоставление способа индукции CTL, причем такой способ включает стадию совместного культивирования CD8-положительных T-клеток с APC или экзосомами, представляющими пептид по настоящему изобретению на их поверхности, или стадию введения полинуклеотида, кодирующего обе субъединицы T-клеточного рецептора (TCR), или полинуклеотидов, кодирующих каждую из субъединиц TCR, где TCR может связываться с комплексом пептида по настоящему изобретению и антигена HLA, представленного на клеточной поверхности. CTL, полученные такими способами, могут быть применимы в любом или обоих из лечения злокачественной опухоли и профилактики злокачественной опухоли. Примеры злокачественных опухолей включают, но не ограничиваются ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, CML, рак ободочной и прямой кишки, рак желудка, NSCLC, лимфому, остеосаркому, рак предстательной железы, рак почек и опухоль мягких тканей.
Другой задачей настоящего изобретения является предоставление выделенных APC, которые представляют на поверхности комплекс антигена HLA и пептида по настоящему изобретению. Кроме того, настоящее изобретение относится к выделенным CTL, которые нацелены на пептиды по настоящему изобретению. Эти APC и CTL применимы в контексте иммунотерапии злокачественной опухоли.
Другой задачей настоящего изобретения является предоставление способов индукции иммунного ответа против злокачественной опухоли у индивидуума, нуждающегося в этом, причем такие способы включают стадию введения средства или композиции, которые включают по меньшей мере один компонент, выбранный из пептидов по настоящему изобретению, полинуклеотидов, кодирующих такие пептиды, экзосом или APC, представляющих такие пептиды и CTL, которые распознают клетки, представляющие такие пептиды на их поверхности.
Применимость настоящего изобретения распространяется на любое из ряда заболеваний, связанных с сверхэкспрессией MPHOSPH1 или обусловленных ей, таких как злокачественная опухоль, примеры которой включают, но не ограничиваются ими, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярную карциному, CML, рак ободочной и прямой кишки, рак желудка, NSCLC, лимфому, остеосаркому, рак предстательной железы, рак почек и опухоль мягких тканей.
Более конкретно, настоящее изобретение относится следующим: [1] Выделенный пептид согласно следующим ниже (a) или (b):
(a) пептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120;
(b) пептид, содержащий аминокислотную последовательность, где 1, 2 или несколько аминокислота(аминокислот) заменена, удалена, вставлена и/или добавлена в аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120, и где пептид обладает способностью индуцировать цитотоксические T-лимфоциты (CTL),
[2] Выделенный пептид согласно [1], где пептид имеет одну или обе из следующих характеристик:
(a) вторая аминокислота с N-конца аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120, выбрана из группы, состоящей из лейцина и метионина; и
(b) C-концевая аминокислота аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 14, 64, 73, 77, 79, 97, 103 и 120, выбрана из группы, состоящей из валина и лейцина,
[3] Выделенный пептид согласно [1] или [2], где пептид представляет собой нонапептид или декапептид,
[4] Выделенный полинуклеотид, кодирующий пептид согласно любому из [1]-[3],
[5] Композиция для индукции CTL, где композиция содержит один или несколько пептид(ов) согласно любому из [1]-[3], или один или несколько полинуклеотид(ов) согласно [4],
[6] Композиция для индукции APC, имеющих способность индуцировать CTL, где композиция содержит один или несколько пептид(ов) согласно любому из [1]-[3], или один или несколько полинуклеотид(ов) согласно [4],
[7] Фармацевтическая композиция, содержащая по меньшей мере один активный ингредиент, выбранный из группы, состоящей из:
(a) одного или более пептидов согласно любому из [1]-[3];
(b) одного или более полинуклеотидов, кодирующих пептид согласно любому из [1]-[3];
(c) одной или более APC или экзосом, которые представляют комплекс пептида согласно любому из [1]-[3] и антигена HLA на их поверхности; и
(d) одна или несколько CTL, которые распознают клетку, представляющую комплекс пептида согласно любому из [1]-[3] и антигена HLA на ее поверхности,
[8] Фармацевтическая композиция согласно [7] для применения в любом или обоих из лечения и профилактики злокачественной опухоли, или для индукции иммунного ответа против злокачественной опухоли у индивидуума,
[9] Фармацевтическая композиция согласно [7] или [8], где фармацевтическая композиция составлена для введения индивидууму, антигеном HLA которого является HLA-A2,
[10] Способ индукции антигенпредставляющей клетки (APC), обладающей способностью индуцировать CTL, причем указанный способ включает стадию, выбранную из группы, состоящей из:
(a) контактирования APC с пептидом согласно любому из [1]-[3] in vitro, ex vivo или in vivo, и
(b) введения полинуклеотида, кодирующего пептид согласно любому из [1]-[3], в APC,
[11] Способ индукции CTL, причем указанный способ включает стадию, выбранную из группы, состоящей из:
(a) совместного культивирования CD8-положительной T-клетки с APC, которая представляет на ее поверхности комплекс антигена HLA и пептида согласно любому из [1]-[3];
(b) совместного культивирования CD8-положительной T-клетки с экзосомой, которая представляет на ее поверхности комплекс антигена HLA и пептида по любому из [1]-[3]; и
(c) введения полинуклеотида, кодирующего обе субъединицы T-клеточного рецептора (TCR), или полинуклеотидов, кодирующих каждую из субъединиц TCR, в CD8-положительную T-клетку, где TCR может связываться с комплексом антигена HLA и пептида согласно любому из [1]-[3], представленным на клеточной поверхности,
[12] Выделенная APC, которая представляет на ее поверхности комплекс антигена HLA и пептида согласно любому из [1]-[3],
[13] APC согласно [12], которая индуцируется способом согласно [10],
[14] Выделенная CTL, которая распознает клетку, представляющую на ее поверхности комплекс антигена HLA и пептида согласно любому из [1]-[3],
[15] CTL согласно [14], где указанная CTL индуцируется способом согласно [11],
[16] Способ любого или обоих из лечения и профилактики злокачественной опухоли у индивидуума, где способ включает стадию введения индивидууму (a) фармацевтически эффективного количества(количеств):
(a) одного или более пептидов согласно любому из [1]-[3];
(b) одного или более полинуклеотидов, кодирующих пептид согласно любому из [1]-[3];
(c) одной или более APC или экзосом, которые представляют комплекс пептида согласно любому из [1]-[3] и антигена HLA на их поверхности; или
(d) одной или более CTL, которые распознают клетку, представляющую комплекс пептида согласно любому из [1]-[3] и антигена HLA на ее поверхности,
[17] Способ индукции иммунного ответа против злокачественной опухоли у индивидуума, нуждающегося в этом, причем указанный способ включает стадию введения индивидууму композиции, содержащей пептид согласно любому из [1]-[3] или полинуклеотид, кодирующий пептид,
[18] Антитело или его иммунологически активный фрагмент против пептида согласно любому из [1]-[3],
[19] Вектор, содержащий нуклеотидную последовательность, кодирующую пептид согласно любому из [1]-[3],
[20] Клетка-хозяин, трансформированная или трансфицированная вектором согласно [19], и
[21] Диагностический набор, содержащий пептид согласно любому из [1]-[3], полинуклеотид согласно [4] или антитело согласно [18].
Задачи и признаки изобретения станут более понятными при прочтении следующего описания вместе с прилагаемыми фигурами и примерами. Следует понимать, что как в вышеуказанном описании сущности настоящего изобретения, так и в нижеследующем подробном описании проиллюстрированы варианты осуществления, и они не ограничивают настоящее изобретение или другие альтернативные варианты осуществления настоящего изобретения. В частности, хотя изобретение описано в настоящем описании применительно к ряду конкретных вариантов осуществления, следует понимать, что описание иллюстрирует изобретение и его не следует истолковывать, как ограничивающее изобретение. Специалисты в данной области способны осуществить различные модификации и применения без отклонения от сущности и объема изобретения, как описано в прилагаемой формуле изобретения. Аналогично, другие задачи, признаки, польза и преимущества настоящего изобретения будут очевидны из этого описания сущности изобретения и определенных вариантов осуществления, описанных ниже, и будут хорошо понятны специалистам в данной области. Такие задачи, признаки, польза и преимущества будут понятны из представленного выше описания совместно с прилагаемыми примерами, данными, фигурами и всеми обоснованными выводами, сделанными на их основе, отдельно или с учетом ссылок, включенных в настоящее описание.
Краткое описание чертежей
Различные аспекты и применения настоящего изобретения станут очевидными квалифицированному специалисту с учетом краткого описания чертежей и подробного описания настоящего изобретения и его предпочтительных вариантов осуществления, которые следуют.
[Фиг.1]
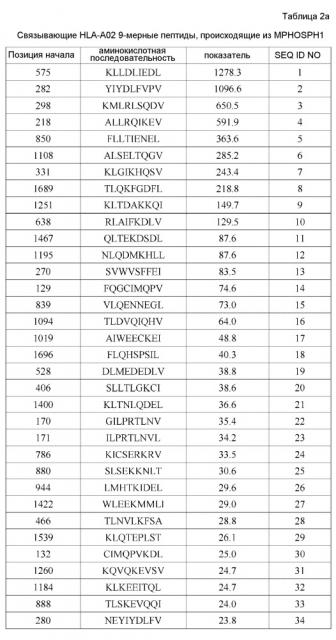
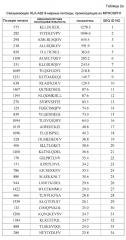
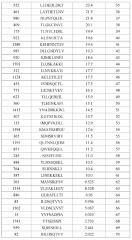
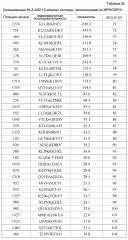
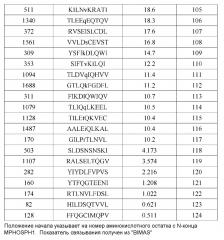
На фиг.1 представлена серия фотографий (a)-(j), на которых представлены результаты анализа с помощью ELISPOT IFN-гамма на CTL, которые индуцировали пептидами, происходящими из MPHOSPH1. CTL в лунке номер #7, стимулированные MPHOSPH1-A02-9-850 (SEQ ID NO: 5) (a), в лунке #5, стимулированные MPHOSPH1-A02-9-129 (SEQ ID NO: 14) (b), в лунке #5, стимулированные MPHOSPH1-A02-9-846 (SEQ ID NO: 64) (c), в лунке #2, стимулированные MPHOSPH1-A02-10-460 (SEQ ID NO: 73) (d), в лунке #1, стимулированные MPHOSPH1-A02-10-770 (SEQ ID NO: 77) (e), в лунке #1, стимулированные MPHOSPH1-A02-10-407 (SEQ ID NO: 79) (f), в лунке #4, стимулированные MPHOSPH1-A02-10-923 (SEQ ID NO: 97) (g), в лунке #5, стимулированные MPHOSPH1-A02-10-1484 (SEQ ID NO: 103) (h) и в лунке #8, стимулированные MPHOSPH1-A02-10-282 (SEQ ID NO: 120) (i) показали высокую продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих изображениях указывает на то, что клетки из соответствующей лунки увеличивали в количестве для получения линий CTL. Напротив, как типично для отрицательных данных, специфическое продуцирование IFN-гамма из CTL, стимулированных MPHOSPH1-A02-9-575 (SEQ ID NO: 1) (j), не показано. На фигурах "+" указывает на продуцирование IFN-гамма против клеток-мишеней, обработанных соответствующим пептидом, и "-" указывает на продуцирование IFN-гамма против клеток-мишеней, не обработанных никакими пептидами.
[Фиг.2a-f]
Фигура 2a-f состоит из серии линейных графиков, (a)-(f), на которых представлены результаты анализа ELISA IFN-гамма, демонстрирующего продукцию IFN-гамма в линиях CTL, стимулированных MPHOSPH1-A02-9-850 (SEQ ID NO: 5) (a), MPHOSPH1-A02-9-129 (SEQ ID NO: 14) (b), MPHOSPH1-A02-9-846 (SEQ ID NO: 64) (c), MPHOSPH1-A02-10-460 (SEQ ID NO: 73) (d), MPHOSPH1-A02-10-770 (SEQ ID NO: 77) (e), и MPHOSPH1-A02-10-407 (SEQ ID NO: 79) (f). Количество IFN-гамма, который продуцировали линии CTL, измеряли с помощью твердофазного иммуноферментного анализа (ELISA) IFN-гамма. Результаты демонстрируют, что линии CTL, полученные путем стимуляции каждым пептидом, демонстрируют мощную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" указывает на продукцию IFN-гамма против клеток-мишеней, обработанных соответствующим пептидом, и "-" указывает на продукцию IFN-гамма против клеток-мишеней, не обработанных никакими пептидами. Соотношение R/S указывает на соотношение количества отвечающих клеток (линия CTL) и стимулирующих клеток.
[Фиг.2g-i]
Фигура 2g-i состоит из серии графиков, (g)-(i), на которых представлены результаты анализа ELISA IFN-гамма, демонстрирующего продукцию IFN-гамма в линиях CTL, стимулированных MPHOSPH1-A02-10-923 (SEQ ID NO: 97) (g), MPHOSPH1-A02-10-1484 (SEQ ID NO: 103) (h) и MPHOSPH1-A02-10-282 (SEQ ID NO: 120) (i). Количество IFN-гамма, который продуцировали линии CTL, измеряли с помощью твердофазного иммуноферментного анализа (ELISA) IFN-гамма. Результаты демонстрируют, что линии CTL, полученные путем стимуляции каждым пептидом, демонстрируют мощную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" указывает на продукцию IFN-гамма против клеток-мишеней, обработанных соответствующим пептидом, и "-" указывает на продукцию IFN-гамма против клеток-мишеней, не обработанных никакими пептидами. Соотношение R/S указывает на соотношение количества отвечающих клеток (линия CTL) и стимулирующих клеток.
[Фиг.3]
Фигура 3 состоит из серии линейных графиков, (a)-(e), на которых представлена продукция IFN-гамма клонами CTL, полученными путем ограниченных разведений из линий CTL, стимулированных MPHOSPH1-A02-9-850 (SEQ ID NO: 5) (a), MPHOSPH1-A02-9-846 (SEQ ID NO: 64) (b), MPHOSPH1-A02-10-460 (SEQ ID NO: 73) (c), MPHOSPH1-A02-10-770 (SEQ ID NO: 77) (d) и MPHOSPH1-A02-10-282 (SEQ ID NO: 120) (e). Результаты демонстрируют, что клоны CTL, полученные стимуляцией каждым пептидом, демонстрируют высокую продукцию IFN-гамма по сравнению с контролем. На фигуре "+" указывает на продуцирование IFN-гамма против клеток-мишеней, обработанных соответствующим пептидом, и "-" указывает на продуцирование IFN-гамма против клеток-мишеней, не обработанных никакими пептидами. Соотношение R/S указывает на соотношение количества отвечающих клеток (линия CTL) и стимулирующих клеток.
[Фиг. 4]
На фиг.4 представлен линейный график, на котором представлена специфическая активность CTL против опухолевых клеточных линий. Клетки J82, которые экспрессируют как MPHOSPH1, так и HLA-A*0201, клетки HT1376, которые экспрессируют MPHOSPH1, но не HLA-A*0201, и клетки T2, которые экспрессируют HLA-A*0201, но не MPHOSPH1, использовали в качестве стимулирующих клеток. Клон CTL, полученный с помощью MPHOSPH1-A02-10-282 (SEQ ID NO: 120), продемонстрировал специфическую активность CTL против клеток J82. С другой стороны не было выявлено специфической активности CTL против клеток HT1376 и T2. Соотношение R/S указывает на соотношение количества отвечающих клеток (линия CTL) и стимулирующих клеток.
[Фиг.5]
На фиг.5 представлен линейный график, на котором изображена цитотоксическая активность CTL против опухолевых клеточных линий. Клетки UMUC-3, которые экспрессируют как MPHOSPH1, так и HLA-A*0201, клетки MKN4, которые экспрессируют MPHOSPH1, но не HLA-A*0201, и T2, которые экспрессируют HLA-A*0201, но не MPHOSPH1, использовали в качестве клеток-мишеней. Клон CTL, полученный с помощью MPHOSPH1-A02-10-282 (SEQ ID NO: 120), продемонстрировал мощную цитотоксическую активность против клеток UMUC-3. С другой стороны, не было выявлено значительной специфической активности CTL против клеток MKN45 и T2. Соотношение E/T указывает на соотношение количества эффекторных клеток (клон CTL) и клеток-мишеней.
[Фиг.6]
На фиг.6 представлен линейный график, на котором изображена цитотоксическая активность CTL против клеток-мишеней, которые экспрессируют MPHOSPH1 и HLA-A*0206. В качестве контроля получали клетки COS7, трансфицированные HLA-A*0206 или полноразмерным геном MPHOSPH1. Линия CTL, полученная с MPHOSPH1-A02-10-282 (SEQ ID NO: 120), показала специфическую активность CTL против клеток COS7, трансфицированных как MPHOSPH1, так и HLA-A*0206 (черный ромб). С другой стороны, не было выявлено значительной специфической активности CTL против клеток-мишеней, экспрессирующих либо HLA-A*0206 (треугольник), либо MPHOSPH1 (круг).
Описание вариантов осуществления
Хотя для осуществления на практике или испытания вариантов осуществления настоящего изобретения можно использовать любые способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем описании, предпочтительные способы, устройства и материалы описаны в настоящем описании. Однако до описания материалов и способов по настоящему изобретению, следует понимать, что эти описания являются только иллюстративными и не предполагается, что они являются ограничивающими. Также следует понимать, что настоящее изобретение не ограничивается конкретным и размерами, формами, форматами, материалами, методологиями, протоколами и т.д., описанными в настоящем описании, поскольку они могут варьировать в соответствии с общепринятым экспериментированием и/или оптимизацией. Более того, терминология, используемая в описании, предназначена только для описания конкретных версий или вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который ограничивается только прилагаемой формулой изобретения.
Описание каждой публикации, патента и патентной заявки, упомянутых в этом описании, конкретно включено в настоящее описание в качестве ссылок в полном объеме. Однако ничто в настоящем документе не следует истолковывать как допущение того, что настоящее изобретение дает право на противопоставление факта создания изобретения с более ранним приоритетом.
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. В случае противоречий, настоящее описание, включая определения, будет решающим.
Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
I. Определения
Форма единственного числа, как используют в рамках изобретения, означает "по меньшей мере один", если конкретно не указано иное.
Термины "выделенный" и "очищенный", используемые применительно к веществу (например, пептиду, антителу, полинуклеотиду и т.д.), указывают на то, что вещество по существу свободно по меньшей мере от одного вещества, которое также может быть включено в природный источник. Таким образом, выделенный или очищенный пептид относится к пептиду, который по существу свободен от клеточного материала, такого как углевод, липид или другие загрязняющие белки из клеточного или тканевого источника, из которого происходит пептид, или по существу свободен от химических предшественников или других химических веществ, когда он химически синтезирован. Термин "по существу свободен от клеточного материала" включает препараты пептида, в которых пептид отделен от клеточных компонентов клеток, из которых он выделен или рекомбинантно продуцирован. Таким образом, пептид, который по существу свободен от клеточного материала, включает препараты полипептида, имеющие менее чем приблизительно 30%, 20%, 10% или 5% (по массе сухого вещества) гетерологичного белка (также называемого в настоящем описании "загрязняющим белком"). Когда пептид продуцирован рекомбинантными способами, он также предпочтительно по существу свободен от культуральной среды, которая включает препараты пептида с культуральной средой, составляющей менее чем приблизительно 20%, 10% или 5% от объема пептидного препарата. Когда пептид продуцируют химическим синтезом, он предпочтительно по существу свободен от химических предшественников или других химических веществ, которые включают препараты пептида, причем химические предшественники или другие химические вещества, вовлеченные в синтез пептида, составляют менее чем приблизительно 30%, 20%, 10%, 5% (по массе сухого вещества) от объема пептидного препарата. То, что конкретный пептидный препарат содержит выделенный или очищенный пептид, может быть показано, например, по появлению единичной полосы после полиакриламидного гель-электрофореза с додецилсульфатом натрия (SDS) белкового препарата и по окрашиванию геля кумасси бриллиантовым синим или сходными с ним. В предпочтительном варианте осуществления пептиды и полинуклеотиды по настоящему изобретению являются выделенными или очищенными.
Термины "полипептид", "пептид" и "белок" используют в настоящем описании взаимозаменяемо для обозначения полимера из аминокислотных остатков. Термины применимы к аминокислотным полимерам, в которых один или несколько аминокислотный остаток(ов) может представлять собой модифицированный остаток(и) или не встречающийся в природе остаток(и), такой как искусственный химический миметик(и) соответствующей встречающейся в природе аминокислоты(аминокислот), а также к встречающимся в природе полимерам аминокислот.
Термин "олигопептид" иногда используют в настоящем описании для обозначения пептидов по настоящему изобретению, которые имеют длину 20 остатков или менее, как правило, 15 остатков или менее и, как правило, состоят из от приблизительно 8 до приблизительно 11 остатков, часто 9 или 10 остатков. Последние называют в настоящем описании "нонапептидами" и "декапептидами", соответственно.
Термин "аминокислота", как используют в рамках изобретения, относится к встречающимся в природе и синтетическим аминокислотам, а также к аналогам аминокислот и миметикам аминокислот, которые функционируют сходным образом со встречающимися в природе аминокислотами. Аминокислота может представлять собой либо L-аминокислоту, либо D-аминокислоту. Встречающиеся в природе аминокислоты представляют собой аминокислоты, кодируемые генетическим кодом, а также аминокислоты, модифицированные после трансляции в клетках (например, гидроксипролин, гамма-карбоксиглутамат и O-фосфосерин). Выражение "аналог аминокислоты" относится к соединениям, которые имеют ту же основную химическую структуру (альфа-углерод, связанный с водородом, карбоксигруппа, аминогруппа и R-группа), как и встречающаяся в природе аминокислота, однако имеют одну или несколько модифицированную R-группу(групп) или модифицированную основную цепь (н