Система культивирования клеток
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложена система культивирования клеток, система для оценки эффекторных агентов кишечника, содержащая систему культивирования клеток, также предложены способы культивирования клеток, получения кишечного органоида и оценки лечения эффекторных агентов кишечника. Система культивирования клеток содержит устройство с жидкостным каналом, источник жидкости, мембрану в канале, эпителиальные клетки кишечника на поверхности мембраны и прилипшие к клеткам кишечника бактериальные клетки. Способ культивирования клеток включает обеспечение устройства эпителиальными клетками кишечника и бактериальными клетками, снабжение его культуральной средой при скорости потока, достаточной для очистки от органических кислот и несвязанных бактериальных клеток. Способ получения кишечного органоида включает подачу культуральной среды в систему и культивирование эпителиальных клеток кишечника и бактериальных клеток in vitro. Способ оценки лечения кишечника включает контактирование эпителиальных клеток кишечника или бактериальных клеток в системе с предполагаемым эффекторным агентом кишечника и измерение отклика клеток. Изобретение обеспечивает развитие in vitro модели, имитирующей механические, структурные, поглощающие, транспортные и патофизиологические свойства кишечника. 5 н. и 36 з.п. ф-лы, 23 ил., 1 табл.
Реферат
Перекрестные ссылки на родственные заявки
[0001] Настоящая заявка испрашивает приоритет в соответствии с 35 U.S.С. 119(e) США по предварительной заявке на патент №61/447,540, поданной 28 февраля 2011, содержание которой включено посредством ссылки в полном объеме.
Государственная поддержка
[0002] Настоящее изобретение создано при поддержке Правительства США в соответствии с грантом ES 016665-01 A1 Национального Института гигиены окружающей среды. Правительство США имеет некоторые права на это изобретение.
Область техники
[0003] Системы и способы изобретения, описанные здесь, относятся к культивированию и поддержанию in vitro кишечных органоидов.
Уровень техники
[0004] Разработка лекарственных препаратов была затруднена, поскольку опиралась на использование животных моделей, которые являются дорогостоящими, трудоемкими, времязатратными и сомнительны с точки зрения этики.1 Еще больше беспокоит то, что животные модели часто не предсказывают результаты, получаемые на людях,2-3 это является особой проблемой при решении проблем, связанных с метаболизмом, транспортом и пероральным поглощением лекарственных препаратов и питательных веществ.4-5 По этим причинам все больше возрастает интерес к развитию in vitro моделей функции кишечника человека, в том числе к системах культивирования клеток, использующих вставки Transwell фильтра6-7, которые позволяют исследовать транс-эпителиальный барьер и транспорт, и миниатюрных микрожидкостных моделей, которые также поддерживают долгосрочное культивирование.10-14 Другие исследователи ранее пытались воссоздать нормальную трехмерную (3D) архитектуру слизистой оболочки кишечника in vitro при культивировании человеческих кишечных эпителиальных (например, Caco-2) клеток на гидрогелевых субстратах, которые были сконструированы на микроуровне, имитируя форму, размер и плотность ворсинок кишечника человека.11 Тем не менее, ни одна из существующих in vitro моделей кишечника механически не воспроизводит активную микросреду живого кишечника (перистальтические движения и поток жидкости внутри просвета), что является критическим для нормальной физиологии органа,15 а также для развития болезни Крона и других кишечных заболеваний.16-17 Другим недостатком существующих in vitro моделей кишечника является то, что ранее не удавалось вырастить живых микробов на поверхности просвета культивированного кишечного эпителия в течение длительного периода, как обычно происходит в живом кишечнике. Это ключевая проблема, поскольку микробные симбионты обычно вносят значительный вклад в функцию кишечного барьера, метаболизм и всасывание лекарственных препаратов и химических веществ, а также многие заболевания.18-22 Развитие in vitro модели на основе живой клетки, которая имитирует механические, структурные, поглощающие, транспортные и патофизиологические свойства кишечника человека вместе с его важными микробными симбионтами, могло бы ускорить фармацевтическое развитие и, вероятно, заменить тестирование на животных.
Сущность изобретения
[0005] Здесь описаны системы и способы, относящиеся к клеточно-культуральным системам для поддержания и/или культивирования кишечных органоидов и/или эпителиальных клеток кишечника in vitro. Варианты осуществления изобретения, описанные здесь, основаны на открытии авторов данного изобретения того, что обеспечение потока жидкости, напряжения сдвига и/или механического напряжения позволяет более физиологически значимое воспроизведение кишечной среды. Системы и способы, описанные здесь, могут быть использованы в целях исследования или тестирования в фармакологии, токсикологии, разработки лекарственного средства, доставки лекарственного средства, метаболизма лекарственного средства, взаимодействий лекарственных средств, биодоступности лекарственного средства, клиренса лекарственного средства, полиорганных взаимодействий, диагностике, терапии, применении различных режимов питания, физиологии кишечного барьера, моделей желудочно-кишечных (ЖК) заболеваний и их механизма, этиологии заболевания в ЖК тракте, заживления ран, регенерации тканей, тканевой инженерии, кишечного гомеостаза, исследований кишечных стволовых клеток, взаимодействий хозяин-микробы, микробных сообществ в ЖК тракте, микробной биопленки в слизистом слое и пробиотической терапии.
[0006] В одном из аспектов изобретение, описанное здесь, относится к системе культивирования клеток, содержащей (i) жидкостное устройство, имеющее жидкостной канал, соединенный с источником жидкости, где источник жидкости подает жидкость в жидкостной канал; (ii) мембрану, расположенную внутри канала между опорными элементами мембраны, где по меньшей мере часть мембраны является гибкой, (iii) механизм деформации мембраны, соединенный с опорными элементами мембраны, способный перемещать опорные элементы мембраны и вызывать растяжение мембраны вдоль по меньшей мере одного измерения мембраны, и (iv) по меньшей мере один слой эпителиальных клеток кишечника, прикрепленный по меньшей мере к одной поверхности мембраны; в которой напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет менее 1,0 дин/см2.
[0007] В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет от 0,008 до 0,08 дин/см2. В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет приблизительно 0,018 дин/см2. В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться с течением времени. В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться с течением времени от 0 до 1000 дин/см2. В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться с течением времени от 0,008 до 0,08 дин/см2.
[0008] В некоторых вариантах осуществления вызывают растяжение мембраны от 0% до 50%. В некоторых вариантах осуществления вызывают растяжение мембраны от 5% до 15%. В некоторых вариантах осуществления вызывают растяжение мембраны примерно на 10%. В некоторых вариантах осуществления вызывают растяжение мембраны более чем на 15%, для создания аномального условия/состояния эпителиальных клеток кишечника.
[0009] В некоторых вариантах вызывают растяжение мембраны циклическим образом с частотой в диапазоне от 0,01 Гц до 2 Гц. В некоторых вариантах осуществления вызывают растяжение мембраны циклическим образом с частотой в диапазоне от 0,05 Гц до 0,25 Гц. В некоторых вариантах осуществления вызывают растяжение мембраны циклическим образом с частотой 0,15 Гц. В некоторых вариантах осуществления вызывают растяжение мембраны циклическим образом с частотой более чем 0,2 Гц, для создания аномального условия/состояния эпителиальных клеток кишечника. В некоторых вариантах осуществления вызывают растяжение мембраны нерегулярным или прерывистым образом.
[0010] В некоторых вариантах осуществления жидкость протекает через жидкостной канал при скорости потока менее чем 500 мкл/ч. В некоторых вариантах осуществления жидкость протекает через жидкостной канал при скорости потока менее чем 100 мкл/ч. В некоторых вариантах осуществления жидкость протекает через жидкостной канал при скорости потока от 0 до 50 мкл/ч. В некоторых вариантах осуществления жидкость протекает через жидкостной канал при скорости потока примерно 30 мкл/ч.
[0011] В некоторых вариантах осуществления система дополнительно содержит по меньшей мере один тип молекулы прикрепления, которая способствует адгезии множества живых клеток, покрывающих по меньшей мере одну сторону мембраны. В некоторых вариантах осуществления по меньшей мере одна молекула прикрепления выбрана из группы, состоящей из: коллагена, коллагена I типа; MATRIGEL™; внеклеточного матрикса; ламинина; протеогликана; витронектина; фибронектина; поли-D-лизина; полипептидов; олигонуклеотидов; ДНК и полисахарида.
[0012] В некоторых вариантах эпителиальные клетки кишечника представляют собой клетки млекопитающего или человека. В некоторых вариантах осуществления эпителиальные клетки кишечника выбраны из группы, состоящей из: Caco2 клеток; HT-29 клеток; первичных эпителиальных клеток тонкого кишечника; первичных эпителиальных клеток толстого кишечника; iPS клеток; ESC клеток; стволовых клеток; клеток Панета; клеток крипт и секретирующих слизь клеток. В некоторых вариантах осуществления эпителиальные клетки кишечника системы дополнительно составляют структуры ворсинок. В некоторых вариантах осуществления система дополнительно содержит по меньшей мере один слой эндотелиальных клеток по меньшей мере на второй поверхности мембраны.
[0013] В некоторых вариантах осуществления мембрана расположена так, что она разделяет жидкостной канал на первый клеточно-культуральный канал и второй клеточно-культуральный канал. В некоторых вариантах осуществления первый клеточно-культуральный канал содержит эпителиальные клетки кишечника. В некоторых вариантах осуществления второй клеточно-культуральный канал содержит клетки, выбранные из группы, состоящей из: эндотелиальных клеток, иммунных клеток и клеток соединительной ткани.
[0014] В некоторых вариантах осуществления система дополнительно содержит микробные клетки или патогены. В некоторых вариантах осуществления микробные клетки поддерживаются в системе по меньшей мере в течение 1 дня. В некоторых вариантах осуществления микробные клетки выбраны из группы, состоящей из: Lactobacillus; Bactericides; Ruminococcus; Peptococcus; Peptostreptococcus; Bifidobacterium; Escherichia; Achromobacter; Acidaminococcus fermentans; Acinetobacter cacoaceticus; Aeromonas; Alcaligenes faecalis; Bacillus; Butyriviberio fibrosolvens; Camplyobacter; Campylobacter coli; Clostridium difficile; Clostridium sordelli; Enterobacter cloacae; Enterococcus faecalis; Enterococcus faecium; Escherichia coli; Flavobacterium; Mycobacterium; Mycoplasma; Plesiomonas shigelloides; Propionibacterium acnes; Pseudomonas aeruginosa; Ruminococcus bromii; Sarcina; Staphylococcus aureus; Streptococcus anginosus; Veillonella; Vibrio; Yersinia enterocolitica; Lactobacillus rhamnosus; Lactobacillus rhamnosus GG; Bifidobacterium breve; Bifidobacterium longum; Bifidobacter ium infantis; Lactobacillus acidophilus; Lactobacillus plantarum; Lactobacillus paracasei; Lactobacillus bulgaricus и Streptococcus thermophilus. В некоторых вариантах осуществления микробные клетки являются патогенными. В некоторых вариантах осуществления патогены выбраны из группы, состоящей из: энтеротоксигенной Escherichia coli; Bilophila wadsworthia; Shigella; Yersinia; Pleisiomonas; Vibrio; Aeromonas; Campylobacter; Crytosporidia; Coccidosis; Salmonella; Helicobacter pylori; Clostridium difficile; Salmonella kedougou; Bacteroides; Clostridium; Firmicutes; Shigellia dysenteriae; Salmonella enterica; Salmonella typhi; Listeria; Listeria monocytogenes; Vibrio parahaemolyticus; Proteus; Vibrio cholerae; Enterococcus faecalis; Yersinia enterocolitica и Campylobacter jejuni; ротавируса; норуолк-подобных вирусов; аденовирусов; астровирусов; саппоро-подобных вирусов; торовирусов; коронавирусов; пикорнавирусов; вирусов герпеса; норовирусов; Candida; Aspergillus; Candida albicans; одноклеточных паразитов; многоклеточных паразитов; амеб; червей; ленточных червей; простейших; трематод; круглых червей; остриц; анкилостоматид; Giradia lamblia; криптоспоридия; и Entamoeba histolytica. В некоторых вариантах осуществления микробные клетки являются аэробными. В некоторых вариантах осуществления микробные клетки являются анаэробными. В некоторых вариантах осуществления система содержит аэробные и анаэробные микробные клетки. В некоторых вариантах осуществления микробные клетки находятся в первом клеточно-культуральном канале.
[0015] В некоторых вариантах система дополнительно содержит анаэробную газовую камеру, связанную по меньшей мере с частью первого клеточно-культурального канала. В некоторых вариантах осуществления в жидкости, протекающей через первый клеточно-культуральный канал, устанавливается градиент кислорода.
[0016] В некоторых вариантах осуществления мембрана является по меньшей мере частично пористой. В некоторых вариантах осуществления по меньшей мере одно отверстие поры в мембране составляет от 0,5 до 10 мкм по ширине. В некоторых вариантах осуществления мембрана содержит PDMS. В некоторых вариантах осуществления мембрана подвергается растяжению посредством вакуумного давления.
[0017] В некоторых вариантах осуществления система дополнительно содержит: (i) первую стенку камеры устройства, расположенную смежно по меньшей мере с одним жидкостным каналом, где мембрана прикреплена к первой стенке камеры; (ii) первый рабочий канал, смежный по меньшей мере с одним жидкостным каналом на противоположной стороне первой стенки камеры, где перепад давления, приложенный между первым рабочим каналом и по меньшей мере одним жидкостным каналом, вызывает сгибание первой стенки камеры в первом требуемом направлении, обеспечивая растяжение или сокращение вдоль плоскости, определяемой мембраной; и (iii) вакуумную систему, обеспечивающую перепад давления между по меньшей мере одним жидкостным каналом и по меньшей мере одним из рабочих каналов, где мембрана растягивается вдоль плоскости в ответ на перепад давления. В некоторых вариантах осуществления система дополнительно содержит вторую стенку камеры устройства, расположенную смежно по меньшей мере с одним жидкостным каналом, где противоположный край мембраны прикреплен ко второй стенке камеры, и второй рабочий канал, расположенный смежно по меньшей мере с одним жидкостным каналом на противоположной стороне второй стенки камеры, при этом перепад давления между вторым рабочим каналом и по меньшей мере одним жидкостным каналом вызывает сгибание второй стенки камеры во втором требуемом направлении, обеспечивая растяжение или сокращение вдоль плоскости, определяемой мембраной.
[0018] В некоторых вариантах осуществления гидродинамическое устройство содержит микрожидкостной чип.
[0019] В некоторых вариантах осуществления система подключена или соединена со второй системой культивирования клеток, содержащей клетки или ткани не-кишечного происхождения. В некоторых вариантах осуществления вторая система культивирования клеток содержит клетки или ткани печени.
[0020] В одном из аспектов изобретение, описанное здесь, относится к способу получения кишечного органоида, включающему: предоставление жидкости для поддержания эпителиальных клеток кишечника в системе культивирования клеток, как описано здесь, таким образом, что жидкость контактирует с эпителиальными клетками кишечника; и культивирование эпителиальных клеток кишечника in vitro. В некоторых вариантах осуществления способ дополнительно включает культивирование клеток по меньшей мере до тех пор, пока обнаруживаются структуры ворсинок.
[0021] В одном из аспектов изобретение, описанное здесь, относится к системе оценки эффекторных агентов кишечника, содержащей систему культивирования клеток, описанную здесь.
[0022] В одном из аспектов изобретение, описанное здесь, относится к способу оценки лечения кишечника, включающий контактирование клетки в системе культивирования клеток, как описано здесь, по меньшей мере с одним предполагаемым эффектором лечения кишечника; и измерение ответа клеток в системе для определения эффекта по меньшей мере одного предполагаемого эффекторного агента кишечника.
Краткое описание чертежей
[0023] На фиг.1 изображена структурная схема ворсинок кишечника человека. Пористая мембрана окружена кишечным эпителием и капиллярным эндотелием.
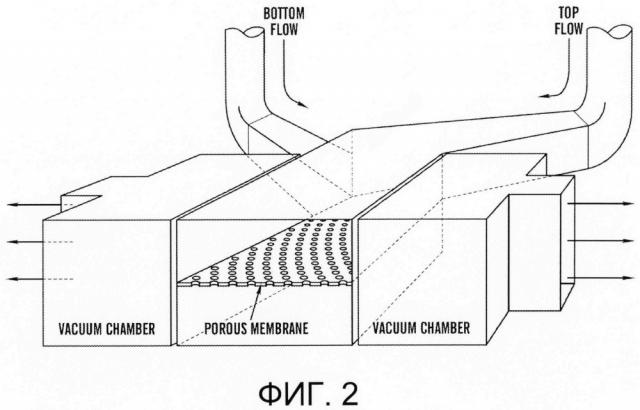
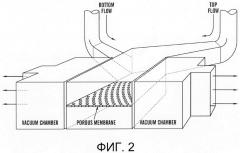
[0024] На фиг.2 изображена схема структуры одного из вариантов системы 'Gut-on-a-Chip' ('Кишка-на-чипе'), на которой выделены двухслойный клеточно-культуральный микроканал в верхней части (фиолетовый) и нижней части (розовый), разделенных пористой PDMS мембраной, и две вакуумные камеры (небесно-голубой) рядом с двухслойным клеточно-культуральным каналом.
[0025] На фиг.3A-3D изображен ряд схем, демонстрирующих механическое растяжение в одном варианте системы 'Gut-on-a-Chip' с изменениями в течение времени от фиг.3A до фиг.3D. В 'Gut-on-a-Chip' было применено циклическое растяжение, обеспечивающее определенное механическое напряжение клеточного монослоя, методом вакуум-управляемого негативного давления на вакуумные каналы.
[0026] На фиг.4A-4B изображены увеличенные изображения образования Caco-2 монослоя в микроканале. После инокуляции Caco-2 клеток в микроканале (фиг.4A) клетки оставляли для прикрепления на поверхности пористой мембраны в микроканале в течение 1,5 часов (фиг.4B), затем культуральную среду перфузировали при постоянной скорости потока 30 мкл/ч в течение 48 часов. Слитый монослой образуется в микроканале примерно через 48 часов (фиг.4C). Увеличенное изображение Caco-2 монослоя на пористой мембране показано на фиг.4D. Повторяющиеся поры составляют 10 мкм в диаметре с 30 мкм интервалом.
[0027] На фиг.5 изображена схема одного варианта осуществления устройства 'Gut-on-a-Chip' для совместного культивирования кишечного эпителия на одной стороне и капиллярного или лимфатического эндотелия на другой стороне гибкой пористой мембраны (поры 10 мкм в диаметре с 30 мкм интервалом, толщиной 30 мкм).
[0028] На фиг.6A-6C изображены схемы для эксперимента по анализу транспорта в 'Gut-on-a-Chip'. На фиг.6A изображена схема "динамического состояния", представляющего механические деформации с постоянным потоком. На фиг.6B изображена схема "жидкостного состояния", без механических деформаций с постоянным потоком. На Фиг.6C изображена схема "статического состояния", показывающая обычную Transwell систему, без механических деформаций и потока.
[0029] На фиг.7 изображен график коэффициента кажущейся проницаемости (Papp) параклеточного маркера, FITC-декстрана (FD20, 20 кДа), в устройстве 'Gut-on-a-Chip', содержащем Caco-2 монослой на поверхности пористой мембраны в верхнем микроканале. Экспериментальные схемы для статических, динамических и жидкостных состояний разъяснены на фиг.6A-6C. В динамическом состоянии (N=4) применяли циклическое растяжение с 20% удлинением при постоянной скорости перфузнойного потока 30 мкл/ч в течение 12 часов до эксперимента FD20 транспорта. В жидкостном состоянии (N=4) постоянный перфузионный поток 30 мкл/ч применяли без каких-либо растягивающих движений (т.е. только напряжения сдвига). Как в динамическом, так и жидкостном состоянии образцы были собраны примерно в течение 1 часа с выхода нижнего микроканала, затем аликвоту (10 мкл) разбавляли для измерения флуоресценции, которая была представлена в линейном режиме зависимости интенсивности флуоресценции от FD20 концентрации. В статическом состоянии (N=4) эксперимент по анализу транспорта проводили в системе Transwell. Отметки ошибок указывают стандартные ошибки.
[0030] На фиг.8 изображен график коэффициента кажущейся проницаемости (Papp) параклеточного маркера, Lucifer желтого (LY), в устройстве 'Gut-on-a-Chip', содержащем Caco-2 монослой на поверхности пористой мембраны в верхнем микроканале. Экспериментальные схемы для статических, жидкостных и динамических состояний описаны на фиг.6A-6C. В динамическом состоянии применяли циклическое растяжения либо с 5% (N=1), либо с 15% (N=1) относительным удлинением при постоянной перфузии 30 мкл/ч в течение 12 часов до эксперимента LY транспорта. В жидкостном состоянии (N=2) постоянный перфузионный поток при 30 мкл/ч применяли без растягивания (т.е. только напряжений сдвига). В обоих динамических и жидкостных состояниях образцы были собраны примерно в течение 1 часа с выхода нижнего микроканала, затем аликвоту (10 мкл) разбавляли для измерения флуоресценции, которая была представлена в линейном режиме зависимости интенсивности флуоресценции от LY концентрации. В статическом состоянии (N=4) эксперименты по анализу транспорта проводились в системе Transwell. Отметки ошибок указывают стандартные ошибки. Y - ось имеет разрыв шкалы для возобновления полного диапазона гистограммы на графике.
[0031] На фиг.9 изображен график коэффициента кажущейся проницаемости (Papp) FD20 в устройстве 'Gut-on-a-Chip', содержащем Caco-2 монослой на поверхности пористой мембраны в верхнем микроканале и HMVEC монослой на противоположной поверхности пористой мембраны в нижнем микроканале. Экспериментальные схемы для статических, жидкостных и динамических состояний показаны на фиг.6A-6C. В динамическом состоянии применяли циклическое растяжения с 15% (N=1) удлинением при постоянном перфузионном потоке 30 мкл/ч в течение 12 часов до эксперимента FD20 транспорта. В жидкостном состоянии (N=5) постоянный перфузионный поток при 30 мкл/ч использовали без растягивающих движений (т.е. только напряжений сдвига). В обоих динамических и жидкостных состояниях образцы были собраны примерно в течение 1 часа с выхода нижнего микроканала, а затем аликвоту (10 мкл) разводили для измерения флуоресценции, которая была представлена в линейном режиме зависимости интенсивности флуоресценции от FD20 концентрации. В статическом состоянии (N=3) эксперимент по анализу транспорта проводился в системе Transwell. Отметки ошибок указывают стандартные ошибки. Y-ось имеет разрыв шкалы для возобновления полного диапазона гистограммы на графике.
[0032] На фиг.10 изображен график коэффициента кажущейся проницаемости (Papp) родамина 123 (Rho123), субстрата гликопротеинов проницаемости (P-gp) в Caco-2 клетках, полученный в Transwell, содержащей 21-дневный культивированный Caco-2 монослой на поверхности пористой мембраны (размер пор 0,4 мкм). Для ингибирования оттока в клетки Caco-2 в некоторых экспериментальных установках был применен верапамил, ингибитор P-gp. Схема эксперимента для этого статического анализа транспорта описана в фиг.6C. Для эксперимента по анализу транспорта Rho123 с апикальной стороны (AP) к базолатеральной стороне (BL) (N=6) на AP стороне Transwell заменяли Rho123, растворенный в культуральной среде (100 мкМ, конечная концентрация, 200 мкл), тогда как на сторону BL Transwell добавляли свежую культуральную среду (700 мкл). Для эксперимента оттока Rho123 от BL стороны на AP сторону (N=6) Rho123, растворенный в культуральной среде (100 мкМ, конечная концентрация, 700 мкл), заменяли на BL стороне Transwell и свежую культуральную среду (200 мкл) помещали на AP сторону Transwell. Чтобы протестировать влияние ингибирования P-gp, верапамил, растворенный в культуральной среде (300 мкМ, конечная концентрация), наносили на обе AP и BL стороны Transwell, а затем выполняли эксперименты по анализу транспорта в направлении либо с AP на BL (N=6), либо с BL на AP (N=6). Отметки ошибок указывают стандартные ошибки.
[0033] На фиг.11 изображен график коэффициента кажущейся проницаемости (Papp) Rho123, субстрата P-gp в Caco-2 клетках, в микрожидкостном 'Gut-on-a-Chip' устройстве. Экспериментальные схемы для жидкостных и динамических условий показаны на фиг.6A и 6B. Для эксперимента по анализу транспорта Rho123 от АР стороны на BL сторону либо в жидкостном (N=1), либо в динамическом (N=1,15% удлинение) состоянии пропускали при 30 мкл/ч в верхний микроканал Rho123, растворенный в культуральной среде (100 мкМ, конечная концентрация), тогда как в нижний микроканал перфузировали свежую культуральную среду при 30 мкл/ч. Для эксперимента транспорта Rho123 от BL стороны на AP сторону либо в жидкостном (N=1), либо в динамическом (N=1,15% удлинение) состоянии Rho123, растворенный в культуральной среде (100 мкМ, конечная концентрация), подавали при 30 мкл/ч в нижний микроканал, тогда как в верхней микроканал перфузировали свежую культуральную среду при 30 мкл/ч. В обоих динамическом и жидкостном состояниях образцы собирали на выходе из верхнего и нижнего микроканалов примерно в течение 1 часа, а затем аликвоту (10 мкл) разбавляли для измерения флуоресценции, которая была представлена в линейном режиме зависимости интенсивности флуоресценции от Rho123 концентрации. Для динамического состояния до экспериментов было применено механическое напряжение с 15%-ным удлинением.
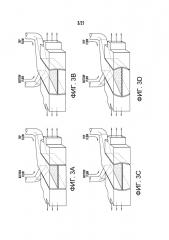
[0034] На фиг.12A-12E изображен один вариант осуществления человеческого 'Gut-on-a-Chip' устройства. На фиг.12A изображена схема 'Gut-on-a-Chip' устройства, показывающая гибкую пористую ECM-покрытую мембрану, выстланную эпителиальными клетками кишечника, пересекающую горизонтально центральный микроканал по середине, и вакуумные камеры по всей высоте с обеих сторон. На фиг.12B изображено фотографическое изображение 'Gut-on-a-Chip' устройства, состоящего из прозрачного PDMS эластомера. Шприцевой насос был использован для перфузии (направление, указанное стрелками) синего и красного красителей через систему трубок к верхнему и нижнему микроканалам, соответственно, для визуализации этих каналов. На фиг.12C изображено поперечное сечение верхнего и нижнего каналов (оба 150 мкм высотой) устройства 'Gut-on-a-Chip'; вставка показывает вид сверху участка пористой мембраны (поры 10 мкм; отметка, 20 мкм). На фиг.12D изображена схема (наверху) и фазово-контрастное изображение (внизу) кишечных монослоев, культивированных в 'Gut-on-a-Chip' в отсутствии (слева) или в присутствии (справа) механического напряжения (30%; стрелкой указано направление), оказанного путем применения всасывания в вакуумных камерах. Красные и синие контуры показывают форму одной Сасо-2 клетки до (красный) и после (синий) применения механического напряжения (отметка, 20 мкм). Следует отметить, что клетки деформируются в направлении приложенного напряжения. На фиг.12E изображен график количественного определения механического напряжения, производимого в ECM-покрытой гибкой пористой PDMS мембране (полые кружки) и в прилипших кишечных эпителиальных клетках (закрашенные кружки) в зависимости от давления, прикладываемого вакуумным регулятором.
[0035] На фиг.13 изображена схема микротехнологического процесса одного из вариантов осуществления устройства, описанного в настоящем документе. 'Gut-on-a-Chip' микроустройство может быть изготовлено из трех PDMS слоев (верхний слой, пористая мембрана и нижний слой), которые последовательно соединялись и модифицировались для создания центрального клеточно-культурального канала с верхним (синий) и нижним (оранжевый) каналами и двух боковых вакуумных камер. Области пористой PDMS мембраны, которая натянута вакуумными камерами (серый), могут быть физически отделены при создании камер по всей высоте.
[0036] На фиг.14A-14D изображена морфология Caco-2 эпителиальных клеток в различных клеточно-культуральных устройствах. На фиг.14A изображена морфология Caco-2 эпителиальных клеток, культивированных в статической Transwell системе в течение 21 дней. На фиг.14B-14C изображена морфология Caco-2 эпителиальных клеток в 'Gut-on-a-Chip' с микрожидкостным потоком (30 мкл/ч; μF) без (фиг.14B) или с (фиг.14C) применением циклического механического напряжения (10%; 0,15 Гц; μF+St) в течение 3 дней. Схемы (слева) показывают модель системы; флуоресцентные изображения (в центре) показывают распределение белка плотного контакта, окклюдина, в эпителиальных слоях, а конфокально-флуоресцентное изображение (справа) показывает вертикальное сечение эпителия с обозначенными формами и полярностью клеток (ядра синим и F-актин зеленым). Регулярная сетка небольших белых кругов (фиг.14B) и (рис.14C) представляет поры, видимые под эпителиальным монослоем; пунктирная белая линия указывает верхнюю часть прикрепления подложки (отметка, 20 мкм). На фиг.14D изображен график средней высоты Caco-2 клеток, выращенных в статических Transwell культурах или микрожидкостном 'Gut-on-а-Chip' без (μF) или с (μF+St) механическим напряжением (*p<0,001).
[0037] На фиг.15A-15B показано спонтанное образование кишечных ворсинок Caco-2 клетками, культивированных в 'Gut-on-a-Chip'. На фиг.15A показано фазово-контрастное изображение Caco-2 клеточного монослоя после 58, 132 и 170 часов культивирования в присутствии потока и циклических деформаций (30 мкл/ч, 10% деформации, 0,15 Гц). Следует отметить, что плоский вид эпителиального монослоя на ранних этапах приобретает волнообразный характер с областями в и вне фокуса на более поздних этапах, что позволяет предположить образование ворсинок. На фиг.15B изображен конфокально-флуоресцентный вид вертикального сечения области волнообразного эпителия после 170 ч, подтверждающий наличие кишечных ворсинок, выстланных последовательно поляризованными столбчатыми эпителиальными клетками, меченными F-актином (зеленый) с базальными ядрами (синий) и апикальной экспрессией муцина (пурпурный), разделенных криптой. Регулярная сетка маленьких белые кругов представляет поры, видимые под эпителиальным монослоем; отметка, 20 мкм.
[0038] На фиг.16A-16C изображена оценка функций кишечного барьера и дифференцировки Caco-2 монослоя, культивированного в Transwell (статический) или микрожидкостной 'Gut-on-a-Chip' в отсутствие (μF) или в присутствии (μF+St) циклического напряжения. На фиг.16А изображена целостность плотного соединения эпителия, количественно измеренная по ТЭЭС Caco-2 монослоя. На фиг.16B изображена кажущаяся параклеточная проницаемость (Papp), измеренная количественно по транспорту флуоресцентного декстрана через Caco-2 монослой, культивированный в статических условиях в течение 5 или 21 дней, или в микрожидкостном 'Gut-on-a-Chip' в отсутствии (μF) или присутствии (μF+St) циклического напряжения в течение 5 дней (*** p<0,05). На фиг.16C изображена дифференцировка кишечных клеток, которую оценивали путем измерения активности аминопептидазы в щеточной каемке в Caco-2 клетках, культивированных в статических условиях в течение 5 или 21 дней или в микрожидкостном 'Gut-on-a-Chip' в отсутствии (μF) или в присутствии (μF+St) циклического напряжения в течение 5 дней (* p<0,001, ** p<0,01).
[0039] На фиг.17A-17E приведены результаты долгосрочного совместного культивирования с микробами на монослое кишечного эпителия человека в 'Gut-on-a-Chip'. Бактерию, исходно выделенную из кишечника человека, Lactobacillus Rhamnosus GG (LGG), культивировали на поверхности Caco-2 монослоя, выращенного в 'Gut-on-a-Chip'. На фиг.17A изображен фазо-контрастный вид сверху на LGG и Caco-2 клетки, совместно культивированные в течение 96 часов и показанных при малом (слева) и большом (справа) увеличении, который показывает микроколонии LGG клеток (белые стрелки), которые остаются плотно соединенными с апикальной поверхностью Caco-2 клеточного монослоя после воздействия непрерывного жидкостного потока (отметка, 20 мкм во всех изображениях). На фиг.17B показано одновременное окрашивание живых/мертвых клеток Caco-2 монослоя, совместно культивированного с LGG в течение 96 часов, демонстрирующее, что практически все эпителиальные клетки остаются жизнеспособными (зеленый). На фиг.17C изображены барьерные функции Caco-2 клеточного монослоя, выращенного в отсутствие (полые кружки) или в присутствии (закрашенные кружки) LGG клеток в Transwell (статическом) или микрожидкостном 'Gut-on-a-Chip' устройстве с циклической деформацией (μF+St; 40 мкл/ч, 10% клеточного штамма, 0,15 Гц). Следует отметить, что отметки ошибок были меньше, чем размеры символов (* p<0,01, ** p<0,05). На фиг.17D показана оценка функциональности жизнеспособных LGG клеток, совместно культивированных с Caco-2 клетками в течение 96 часов, проведенная путем измерения каталитической активности β-галактозидазы в LGG клетках, совместно культивированных с Caco-2 клетками в 'Gut-on-a-Chip' с механической деформацией (+LGG; 40 мкл/ч, 10% клеточного штамма, 0,15 Гц), либо в Caco-2 клетках, культивированных отдельно в качестве контроля (* p<0,01). На фиг.17E представлен график количества флуоресценции, меры расщепления кальцеина AM, обнаруживаемой в различных условиях, показывая, что флуоресцентное окрашивание на фиг.17B обеспечивается жизнеспособными Caco-2 клетками, а не является артефактом жизнеспособных LGG клеток.
[0040] На фиг.18A-18C показано, что поток жидкости является критическим фактором для контроля клеточной формы и полярности в Caco-2 клетках. Конфокально-флуоресцентное изображение в вертикальном разрезе Caco-2 монослоя, культивированного в 'Gut-on-a-Chip' с использованием скорости потока 10 мкл/ч (фиг.18A) или 100 мкл/ч (фиг.18B) в течение 20 часов в отсутствии циклического напряжения, подтверждает, что более высокие скорости потока (30-100 мкл/ч) специфично индуцируют поляризацию и формирование эпителия. На фиг.18C показано количественное определение средней высоты Caco-2 клеток, культивированных при скорости 10 мкл/ч или 100 мкл/час без механического напряжения (* p<0,0001; отметка, 20 мкм).
[0041] На фиг.19 показана оценка активности β-галактозидазы в живых LGG клетках и Caco-2 клетки, культивированных раздельно. Живые LGG клетки активно расщепляли субстрат β-галактозидазы, ONPG, и обеспечивали продолжительное увеличение оптической плотности O-нитрофенол продукта (заштрихованные кружки), тогда как человеческие Caco-2 эпителиальные клетки не показали какой-либо специфической β-галактозидазы (закрашенные квадраты). Различия в активности, проявляемой LGG клетками в сравнении с Caco-2, были значимыми (p<0,001) во всех временных точках.
[0042] На фиг.20 показана схема компьютерных систем для автоматизированного управления систем, описанных в данном документе.
[0043] На фиг.21 показан схематический вид одного варианта осуществления системы, описанной здесь.
[0044] На фиг.22A-22D показаны некоторые примеры альтернативных механизмов, которые могут быть использованы для применения напряжения на мембране системы, описанной в данном документе.
[0045] На фиг.23 показана схема одного варианта осуществления системы, описанной здесь. Числа в пунктирных кружках, представляют собой измерения указанных характеристик в мкм.
Подробное описание изобретения
[0046] Для удобства некоторые термины, используемые в данном документе, в описании, примерах и формуле изобретения, собраны здесь. Если иное не указано или явно не следует из контекста, следующие термины и фразы имеют значения, приведенные ниже. Если явно не указано иное или не следует из контекста, термины и фразы, указанные ниже, не исключают, что значение термина или фразы приобретает значение из области, к которой он относится. Определения приведены для того, чтобы помочь в описании конкретных вариантов осуществления и не предназначены для ограничения заявленного изобретения, так как объем настоящего изобретения ограничен только формулой. Если не определено иное, все технические и научные термины, используемые здесь, имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится данное изобретение.
[0047] При использовании здесь термин "содержащий" или "содержит" используется по отношению к композициям, способам и соответствующему(им) им компоненту(ам), который(ые) является(ются) необходимым(и) для способа или композиции, допускающим включение неуказанных элементов, как необходимых, так и нет.
[0048] При использовании здесь термин "состоящий по существу из" означает элементы, необходимые для данного варианта осуществления. Этот термин допускает присутствие элементов, которые существенно не влияют на основные и новые или функциональную(ые) характеристику(и) этого варианта осуществления.
[0049] Термин "состоящий из" относится к композициям, способам и соответствующим им компонентам, как описано здесь, которые исключают любые элементы, не перечисленные в этом описании варианта осуществления.
[0050] Как использовано в данном описании и прилагаемой формуле изобретения, формы единственного числа включают указания множественного числа, если из контекста явно не следует иное. Таким образом, например, указание на "способ" включает один или более способов и/или этапов этого типа способа, описанного здесь и/или которые станут очевидными для специалистов в данной области техники после прочтения данного раскрытия и т.д. Кроме того, слово "или" предназначено для включения "и", если из контекста явно не следует иное. Хотя способы и материалы, подобные или эквивалентные описанным здесь, можно использовать в практике или при проверке данного раскрытия, подходящие способы и материалы описаны ниже. Аббревиатура "e.g. является производной от латинского exempli gratia и используется здесь для указания неограничивающего примера. Таким образом, аббревиатура "e.g. является синонимом термина "например".
[0051] Определения терминов, общепринятых в клеточной биологии и молекулярной биологии, могут быть найдены в "The Merck Manual of Diagnosis and Therapy", 19-oe издание, опубликовано Merck Research Laboratories, 2006 (ISBN 0-911910-19-0); Robert S. Porter et al. (eds.), "The Encyclopedia of Molecular Biology", опубликована Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); "The ELISA guidebook" (Methods in molecular biology 149) Crowther J.R. (2000). Определения общепринятых терминов в молекулярной биологии могут быть также найдены в Benjamin Lewin, "Genes X", опубликовано Jones & Bartlett Publishing, 2009 (ISBN-10:0763766321); Kendrew et al. (eds.), "Molecular Biology and Biotechnology: a Comprehensive Desk Reference", опубликовано VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
[0052] Если не указано иное, настоящее изобретение было выполнено с использованием стандартных процедур, как описано, например, в патентах США №№4,965,343, и 5,849,954; Sambrook et al., Molecular Cloning: A Laboratory Manual (3ed.), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., USA (2001); Davis et al., Basic Methods in Molecular Biology, Elsevier Science Publishing, Inc., New York, USA (1995); Current Protocols in Cell Biology (CPCB) (Juan S. Bonifacino et. al. ed., John Wiley and Sons, Inc.); Culture of Animal Cells: A Manual of Basic Technique by R. Ian Freshney, Publisher: Wiley-Liss; 5th edition (2005);