Способ получения 1-адамантилацетальдегида
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения 1-адамантилацетальдегида, который служит ценным промежуточным продуктом для получения биологически активных веществ и функциональных органических материалов. Способ заключается в катализируемой реакции 1-адамантанола с непредельным соединением, в качестве которого используют винилацетат, взятый в 2,5-кратном мольном избытке по отношению к 1-адамантанолу, реакцию ведут в течение 2 часов в среде дихлорэтана при температуре его кипения, а катализ осуществляют 5 мольными процентами трибромида индия. Предлагаемый способ позволяет получить целевой продукт при использовании простой технологии из доступного сырья. 2 табл., 1 пр.
Реферат
Изобретение относится к органической химии, а именно к способу получения 1-адамантилацетальдегида, соединения, которое служит ценным промежуточным продуктом для получения биологически активных веществ и функциональных органических материалов.
Подавляющее большинство известных на сегодняшний день способов синтеза 1-адамантилацетальдегида [I] основано на окислении 1-адамантанэтанола в соответствии со схемой:
Для этого могут применяться различные окислители, например:
- реактив Кори-Суггса в среде дихлорметана (выход 65-72%) [В. Gopalan, Т. Ponpandian, V. Kachhadia, К. Bharathi mohan, R. Vignesh, V. Sivasudar, S. Narayanan, B. Mandar, R. Praveen, N. Saranya, S. Rajagopal, S. Rajagopal. Discovery of adamantane based highly potent HDAC inhibitors. Bioorganic & Medicinal Chemistry Letters, 2013, 23(9), 2532-2537];
- оксалилхлорид - ДМСО в дихлорметане при - 60°C (выход 85%) [J.R. Lilly, J.F. Dellaria, J.J. Planner, J.L. Soderquist, Nwe Yi.A Synthesis of Protected Aminoalkyl Epoxides from α-Amino Acids. Journal of Organic Chemistry, 1987, 52(8) 1487-1492];
- реактив Десс-Мартина (выход 52-84%) [S.-K. Anandan, Zung N.Do, H.K. Webb, D.V. Patel, R.D. Gless. Non-urea functionality as the primary pharmacophore in soluble epoxide hydrolase inhibitors. Bioorganic & Medicinal Chemistry Letters, 2009, 19(4), 1066-1070];
- кислород воздуха в присутствии катализатора, содержащего наночастицы золота (выход 70%) [Daisuke Saio, Toru Amaya, Toshikazu Hirao. Redox-Active Catalyst Based on Poly(Anilinesulfonic Acid)-Supported Gold Nanoparticles for Aerobic Alcohol Oxidation in Water. Advanced Synthesis and Catalysis, 2010, 352(13), 2177-2182.].
К недостаткам этих способов относится труднодоступность исходного 1-адамантилэтанола и дороговизна используемых окислителей.
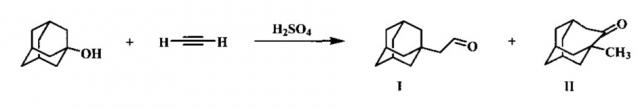
Наиболее близким аналогом к предлагаемому способу является получение 1-адамантилацетальдегида по реакции 1-адамантанола с непредельным соединением - ацетиленом в присутствии серной кислоты.
При этом целевой продукт I образуется наряду с 1-метилгомоадамантаноном II, их соотношение определяется концентрацией используемой серной кислоты. Наилучшее соотношение наблюдается при концентрации серной кислоты 98% - 89,1 : 10,9 [D.R. Kell, F.J. McQuillin. Reactions of the 1-Adamantyl-vinil Cation in Sulphuric Acid. Journal of the Chemical Society. D. Chemical Communications. 1970, 10, p. 599-600].
Недостатком способа является необходимость применения колоночной хроматографии для отделения целевого продукта в чистом виде, а также сложности, связанные с использованием газообразного ацетилена.
Техническим результатом является упрощение способа получения 1-адамантилацетальдегида с использованием коммерчески доступных исходных соединений.
Технический результат достигается путем реакции 1-адамантанола с винилацетатом в присутствии кислоты Льюиса в качестве катализатора. Реакцию между 1-адамантанолом и винилацетатом осуществляют в среде 1,2-дихлорэтана в присутствии 5 мольных процентов трибромида индия при температуре кипения растворителя в соответствии со схемой:
Контролируя ход реакции с помощью хромато-масс спектрометрии, было установлено, что максимальная степень конверсии исходного 1-адамантанола в продукт достигается за 2 часа при кипении реакционной массы. Проведение реакции без нагревания при комнатной температуре не приводит к образованию I, а при 50°C не достигается полная конверсия 1-адамантанола. Для обеспечения полной конверсии 1-адамантанола в целевой продукт необходимо использовать 2,5 эквивалента винилацетата (таблица 1).
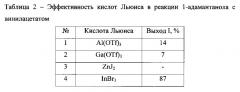
Экспериментально установлено, что использование в качестве катализатора, вместо трибромида индия, других кислот Льюиса оказалось не эффективно (таблица 2).
Полученный продукт может быть выделен с выходом 87% из реакционной смеси после отделения катализатора и удаления окрашенных примесей кипячением гексанового раствора с активированным углем или вакуумной перегонкой.
Пример получения 1-адамантилацетальдегида.
В круглодонную колбу, снабженную магнитным перемешивающим элементом и обратным холодильником, в атмосфере аргона вносят 30 мл 1,2-дихлорэтана, 1 г (0,00657 моль) 1-адамантанола, 1,5 мл (0,0164 моль) винилацетата и 0,117 г (0,000329 моль) трибромида индия. Реакционную массу нагревают при интенсивном перемешивании и кипении растворителя в течение 2 ч. Затем реакционную массу фильтруют через слой целита, растворитель упаривают на ротационном испарителе, остаток растворяют 30 мл гексана и осветляют кипячением в течение 3 мин с активированным углем, который отделяют фильтрованием. Фильтрат упаривают, остаток представляет собой желтоватое масло, содержащее по данным газовой хроматографии 97% целевого вещества. Выход 1,17 г (87%).
ИК-спектр (KBr), ν/см-1: 2901, 2846 (Csp3-H), 1711 (C=O).
Спектр ЯМР 1H (399.78 МГц, CDCl3, δ, м.д.): 1.55-1.75 (м, 12Н, СН2), 1.95-2.03 (м, 3H, CH), 2.13 (д, J=3 Гц, СН2), 9.87 (т, 1H, CH).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 178 (16, M+), 149 (12), 135 (100), 107 (12).
Способ получения 1-адамантилацетальдегида катализируемой реакцией 1-адамантанола с непредельным соединением, отличающийся тем, что в качестве непредельного соединения используют винилацетат, взятый в 2,5-кратном мольном избытке по отношению к 1-адамантанолу, реакцию ведут в течение 2 часов в среде дихлорэтана при температуре его кипения, а катализ осуществляют 5 мольными процентами трибромида индия.