Способы улучшения функции печени
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для лечения субъекта с конечной стадией заболевания печени (MELD). Используют композицию, содержащую комбинацию токотриенолов. Композиция включает d-α-токотриенол - примерно 29,56; d-β-токотриенол - примерно 3,90; d-γ-токотриенол - примерно 54,20; и d-δ-токотриенол - примерно 12,34 масс. % от общей массы токотриенолов. Способ позволяет повысить концентрацию токотриенолов в тканях и повысить эффективность лечения. 15 з.п. ф-лы, 5 ил., 11 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины и касается способов улучшения функции печени, использующих токотриенолы.
Уровень техники
Встречающееся в природе семейство витамина Е состоит из восьми членов, поровну разделенных на два класса: токоферолы (TCP) и токотриенолы (ТЕ). TCP характеризуются наличием насыщенной фитильной боковой цепи с тремя хиральными углеродными атомами, в то время как ТЕ содержат фарнезильную боковую цепь с двойными связями при углеродных атомах 3, 7 и 11. В каждом классе изомеры различаются индексами α, β, γ и δ в соответствии с их положением и степенью метилирования в головной хроманольной группе. TCP представляют первичную форму витамина Е в зеленых листовых овощах, тогда как ТЕ можно обнаружить в наибольшей концентрации в семенах монокотиледонов, которые включают пшеницу, рис, овес, ячмень и пальмы.
На сегодняшний день большая часть клинических испытаний витамина Е показала малозначимые или отрицательные результаты по ряду заболеваний. Хотя эти испытания адресовались витамину Е в целом, они были сфокусированы, главным образом, на тестировании только одного из восьми членов встречающегося в природе семейства витамина Е - α-ТСР (альфа-токофероле). При огромном массиве литературы, демонстрирующей уникальные биологические свойства менее охарактеризованных членов семейства витамина Е, неправильное утверждение, что α-ТСР и витамин Е синонимы, является белым пятном в исследованиях витамина Е в настоящее время. Члены семейства витамина Е регулируют специфические сигнальные пути клеток независимо от их антиоксидантных свойств. α-ТЕ подавляет активность HMG-CoA(3-гидрокси-3-метилглутарил-кофермент А) редуктазы - печеночного фермента, ответственного за синтез холестерина.
Токоферол-переносящий белок (ТТР) избирательно транспортирует α-ТСР пищи в ткани. Обычно считается, что ТТР-аффинность является критической детерминантой биологической активности восьми членов встречающегося в природе семейства витамина Е. Аффинность ТТР к связыванию и транспортировке α-ТЕ составляет 12% аффинности α-ТСР, что привело к убеждению, что биологическая активность токотриенолов незначительна. Перорально введенные токотриенолы транспортировались в жизненно важные органы и восстанавливали фертильность у мышей с дефицитом ТТР, что позволило предположить наличие независимых от ТТР механизмов транспорта ТЕ. Поскольку биологическая важность ТЕ доказывается все больше и больше, существует потребность в научно обоснованных композициях и способах введения ТЕ для оптимизации здоровья и помощи в управлении ходом течения заболевания.
Заболевание печени - это серьезное состояние, которое может возникнуть по многим причинам и привести к серьезным осложнениям, включая летальный исход. Заболевания печени могут включать, например, гепатит, цирроз и гепатоцеллюлярную карциному. Система оценки модели конечной стадии заболевания печени (MELD) используется в клинических условиях для определения степени тяжести хронического заболевания печени и оценки приоритетности и необходимости распределения трансплантатов печени. Шкала MELD имеет диапазон от 6 до 40, причем самые высокие оценки указывают на недостаточную функцию печени и необходимость неотложного проведения операции по трансплантации. Уровень смертности в 3-месячный период среди пациентов с конечной стадией заболевания печени (ESLD) при оценках MELD в диапазоне 10-19, 20-29, 30-39 и более 40 баллов составляет соответственно 6,0%, 19,2%, 52,6% и 71,3%. Существует потребность в фармацевтических или нутрацевтических агентах, замедляющих прогрессирование ESLD: любое улучшение скорости повышения оценки MELD или понижение оценки MELD предоставляет больше времени кандидату на трансплантацию печени для получения совместимой печени.
Раскрытие изобретения
В описании изобретения раскрываются способы улучшения функции печени у субъекта с патологией печени, предусматривающие: а) введение субъекту с патологией печени по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) улучшение функции печени у субъекта, измеряемое с помощью панель-теста функции печени.
Предлагаются также способы замедления повышения оценок MELD у субъекта с патологией печени, включающие: а) введение субъекту с патологией печени по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) замедление повышения оценок MELD у субъекта.
Предлагаются также способы улучшения прогноза субъекта с патологией печени, предусматривающие: а) введение субъекту с патологией печени по меньшей мере одного токотриенола, выбранного из группы, состоящей из d-альфа-токотриенола; d-бета-токотриенола; d-гамма-токотриенола и d-дельта-токотриенола; и б) улучшение прогноза субъекта с патологией печени, измеряемого оценкой модели конечной стадии заболевания печени (MELD).
Предлагаются также способы замедления прогрессирования болезни у субъекта с патологией печени, включающие: а) введение субъекту с патологией печени по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) замедление прогрессирования болезни у субъекта.
Предлагаются также способы облегчения симптомов конечной стадии заболевания печени у субъекта с конечной стадией заболевания печени, предусматривающие: а) введение субъекту с конечной стадией заболевания печени по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) облегчение симптомов конечной стадии заболевания печени у субъекта.
Предлагаются также способы лечения субъекта с заболеванием печени, включающие введение по меньшей мере одного токотриенола субъекту с заболеванием печени.
Предлагаются также способы повышения в тканях субъекта концентрации по меньшей мере одного токотриенола, предусматривающие: а) введение субъекту по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) повышение в тканях субъекта концентрации по меньшей мере одного токотриенола.
Предлагаются также способы повышения в крови субъекта концентрации по меньшей мере одного токотриенола, включающие: а) введение субъекту по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) повышение в крови субъекта концентрации по меньшей мере одного токотриенола.
Предлагаются также способы повышения в коже субъекта концентрации по меньшей мере одного токотриенола, предусматривающие: а) введение субъекту по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) повышение в коже субъекта концентрации по меньшей мере одного токотриенола.
Предлагаются также способы повышения в жировой ткани субъекта концентрации по меньшей мере одного токотриенола, включающие: а) введение субъекту по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) повышение в жировой ткани субъекта концентрации по меньшей мере одного токотриенола.
Предлагаются также способы повышения в головном мозге субъекта концентрации по меньшей мере одного токотриенола, предусматривающие: а) введение субъекту по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) повышение в головном мозге субъекта концентрации по меньшей мере одного токотриенола.
Предлагаются также способы повышения в сердечной мышце (миокарде) субъекта концентрации по меньшей мере одного токотриенола, включающие: а) введение субъекту по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) повышение в сердечной мышце субъекта концентрации по меньшей мере одного токотриенола.
Предлагаются также способы повышения в печени субъекта концентрации по меньшей мере одного токотриенола, предусматривающие: а) введение субъекту по меньшей мере одного токотриенола, выбранного из группы, состоящей из альфа-токотриенола, бета-токотриенола, гамма-токотриенола и дельта-токотриенола; и б) повышение в печени субъекта концентрации по меньшей мере одного токотриенола.
Предлагаются также способы, в соответствии с которыми субъект не переносит стандартные терапевтические процедуры.
Заявляются также способы, в которых патология печени выбрана из группы, состоящей из цирроза, гепатита и холангита.
Предлагаются также способы, в которых патология печени выбрана из группы, состоящей из вирусного цирроза, алкогольного цирроза, инфекционного цирроза, аутоиммунного цирроза, декомпенсированного цирроза.
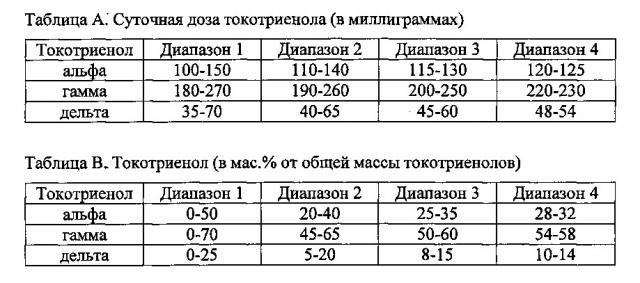
Предлагаются также способы, в которых токотриенол вводится в соответствии с таблицей А.
Предлагаются также способы, в которых токотриенол вводится в соответствии с таблицей В.
Предлагаются также способы, в которых токотриенол вводится в соответствии с таблицей С.
Предлагаются также способы, в которых токотриенол вводится в соответствии с таблицей D.
Предлагаются также способы, в которых токотриенол вводится в соответствии с таблицей Е.
Предлагаются также способы, которые предусматривают введение дополнительной фармацевтической композиции.
Предлагаются также способы, которые включают введение композиции, выбранной из группы, состоящей из пегинтерферона-альфа-2b и рибавирина.
Предлагаются также способы, которые предусматривают измерение концентрации токотриенолов в ткани субъекта, при этом ткань выбрана из группы, состоящей из крови, кожи, жировой ткани, головного мозга, сердечной мышцы и печени.
Предлагаются также способы, в которых концентрация в ткани по меньшей мере одного токотриенола повышается на множитель, выбранный из группы, состоящей из примерно 1,2х; 1,3х; 1,4х; 1,5х; 1,6х; 1,7х; 1,8х; 1,9х; 2х; 3х; 4х; 5х; 6х; 7х; 8х; 9х; 10х; 11х; 12х; 13х; 14х и 15х.
Предлагаются также способы, в которых вводимый токотриенол содержит токоферол (мас. % общей массы) в количестве менее чем процентное количество, выбранное из группы, состоящей из 50%; 40%; 30%; 20%; 15%; 10%; 5% и 1%.
Предлагаются также способы, в которых токотриенол в основном не содержит токоферола.
Предлагаются также способы, в которых концентрация в ткани по меньшей мере одного токотриенола после его введения выбрана из группы, состоящей из примерно: от по меньшей мере примерно 0,5 микромолей (мкМ)/л до по меньшей мере примерно 50 мкМ/л; от по меньшей мере примерно 1 мкМ/л до по меньшей мере примерно 40 мкМ/л; от по меньшей мере примерно 2 мкМ/л до по меньшей мере примерно 30 мкМ/л; от по меньшей мере примерно 3 мкМ/л до по меньшей мере примерно 25 мкМ/л; от по меньшей мере примерно 4 мкМ/л до по меньшей мере примерно 20 мкМ/л и от по меньшей мере примерно 5 мкМ/л до по меньшей мере примерно 15 мкМ/л.
Предлагаются также способы, в которых концентрация в жировой ткани по меньшей мере одного токотриенола после его введения выбрана из группы, состоящей из примерно: от по меньшей мере примерно 4 мкМ/л до по меньшей мере примерно 25 мкМ/л; от по меньшей мере примерно 5 мкМ/л до по меньшей мере примерно 25 мкМ/л; от по меньшей мере примерно 6 мкМ/л до по меньшей мере примерно 20 мкМ/л; от по меньшей мере примерно 7 мкМ/л до по меньшей мере примерно 15 мкМ/л; от по меньшей мере примерно 8 мкМ/л до по меньшей мере примерно 15 мкМ/л и от по меньшей мере примерно 9 мкМ/л до по меньшей мере примерно 15 мкМ/л.
Предлагаются также способы, в которых концентрация в ткани головного мозга по меньшей мере одного токотриенола после его введения выбрана из группы, состоящей из примерно: от по меньшей мере примерно 0,2 мкМ/л до по меньшей мере примерно 1,9 мкМ/л; от по меньшей мере примерно 0,25 мкМ/л до по меньшей мере примерно 1,8 мкМ/л; от по меньшей мере примерно 0,3 мкМ/л до по меньшей мере примерно 1,7 мкМ/л; от по меньшей мере примерно 0,4 мкМ/л до по меньшей мере примерно 1,6 мкМ/л; от по меньшей мере примерно 0,5 мкМ/л до по меньшей мере примерно 1,5 мкМ/л и от по меньшей мере примерно 0,6 мкМ/л до по меньшей мере примерно 1,5 мкМ/л.
Предлагаются также способы, в которых концентрация в ткани сердца по меньшей мере одного токотриенола после его введения выбрана из группы, состоящей из примерно: от по меньшей мере примерно 0,3 мкМ/л до по меньшей мере примерно 15 мкМ/л; от по меньшей мере примерно 0,3 мкМ/л до по меньшей мере примерно 14 мкМ/л; от по меньшей мере примерно 0,4 мкМ/л до по меньшей мере примерно 12 мкМ/л; от по меньшей мере примерно 0,5 мкМ/л до по меньшей мере примерно 10 мкМ/л; от по меньшей мере примерно 0,7 мкМ/л до по меньшей мере примерно 9 мкМ/л и от по меньшей мере примерно 0,8 мкМ/л до по меньшей мере примерно 7 мкМ/л.
Предлагаются также способы, в которых концентрация в ткани печени по меньшей мере одного токотриенола после его введения выбрана из группы, состоящей из примерно: от по меньшей мере примерно 0,01 мкМ/л до по меньшей мере примерно 5 мкМ/л; от по меньшей мере примерно 0,25 мкМ/л до по меньшей мере примерно 2 мкМ/л; от по меньшей мере примерно 0,03 мкМ/л до по меньшей мере примерно 1 мкМ/л; от по меньшей мере примерно 0,1 мкМ/л до по меньшей мере примерно 0,8 мкМ/л; от по меньшей мере примерно 0,2 мкМ/л до по меньшей мере примерно 0,7 мкМ/л и от по меньшей мере примерно 0,3 мкМ/л до по меньшей мере примерно 0,6 мкМ/л.
Предлагаются также способы, в которых токотриенол получен из по меньшей мере одного растения, выбранного из группы, состоящей из пшеницы, риса, ячменя и пальмы.
Предлагаются также способы, в которых токотриенол получен из пальмового масла.
Предлагаются также способы, в которых токотриенолом является Tocovid SupraBio.
Предлагаются также способы лечения конечной стадии заболевания печени у пациента с конечной стадией заболевания печени, предусматривающие: а) введение по меньшей мере одной суточной дозы токотриеноловой композиции пациенту с конечной стадией заболевания печени, в котором токотриеноловая композиция содержит примерно 123 мг d-альфа-токотриенола; примерно 16 мг d-бета-токотриенола; примерно 225 мг d-гамма-токотриенола и примерно 51 мг d-дельта-токотриенола; и б) лечение конечной стадии заболевания печени у пациента.
Предлагаются также способы лечения цирроза у пациента с циррозом, включающие: а) введение по меньшей мере одной суточной дозы токотриеноловой композиции пациенту с циррозом, в котором токотриеноловая композиция содержит примерно 123 мг d-альфа-токотриенола; примерно 16 мг d-бета-токотриенола; примерно 225 мг d-гамма-токотриенола и примерно 51 мг d-дельта-токотриенола; и б) лечение цирроза у пациента.
Предлагаются также способы лечения вирусного гепатита у пациента с вирусным гепатитом, предусматривающие: а) введение по меньшей мере одной суточной дозы токотриеноловой композиции пациенту с вирусным гепатитом, в котором токотриеноловая композиция содержит примерно 123 мг d-альфа-токотриенола; примерно 16 мг d-бета-токотриенола; примерно 225 мг d-гамма-токотриенола и примерно 51 мг d-дельта-токотриенола; и б) лечение вирусного гепатита у пациента.
Предлагаются также способы лечения первичного склерозирующего холангита у пациента с первичным склерозирующим холангитом, включающие: а) введение по меньшей мере одной суточной дозы токотриеноловой композиции пациенту с первичным склерозирующим холангитом, в котором токотриеноловая композиция содержит примерно 123 мг d-альфа-токотриенола; примерно 16 мг d-бета-токотриенола; примерно 225 мг d-гамма-токотриенола и примерно 51 мг d-дельта-токотриенола; и б) лечение первичного склерозирующего холангита у пациента.
Предлагаются также способы лечения гепатита С у пациента с гепатитом С, предусматривающие: а) введение по меньшей мере одной суточной дозы токотриеноловой композиции пациенту с гепатитом С, при этом токотриеноловая композиция содержит примерно 123 мг d-альфа-токотриенола; примерно 16 мг d-бета-токотриенола; примерно 225 мг d-гамма-токотриенола и примерно 51 мг d-дельта-токотриенола; и б) лечение гепатита С у пациента.
Предлагаются также способы лечения гепатита В у пациента с гепатитом В, включающие: а) введение по меньшей мере одной суточной дозы токотриеноловой композиции пациенту с гепатитом В, в котором токотриеноловая композиция содержит примерно 123 мг d-альфа-токотриенола; примерно 16 мг d-бета-токотриенола; примерно 225 мг d-гамма-токотриенола и примерно 51 мг d-дельта-токотриенола; и б) лечение гепатита В у пациента.
Краткое описание чертежей
Фиг. 1А и 1В. Концентрация α-ТЕ (фиг. 1А) и α-ТСР (фиг. 1B) в цельной крови участников испытания после перорального введения ТЕ. Данные представляют индивидуальные значения (для мужчин n=6, для женщин n=10) и среднее ± SD (стандартная ошибка среднего) на исходном уровне (0 недель), спустя 6 недель и 12 недель. Внутри каждой лечебной группы уровни без общей буквы отличаются, P<0,05.
Фиг. 2А и 2В. Концентрация α-ТЕ (фиг. 2А) и α-ТСР (фиг. 2В) в коже участников испытания после перорального введения ТЕ. Данные представляют индивидуальные значения (для мужчин n=6, для женщин n=10) и среднее ± SD на исходном уровне (0 недель) и спустя 12 недель. В каждой лечебной группе уровни без общей буквы отличаются, P<0,05.
Фиг. 3А-3С. Подогнанные (аппроксимирующие) оценки MELD у пациентов, которым вводился TCP (фиг. 3А), у пациентов, которым вводился ТЕ (фиг. 3В), и средние значения подогнанных оценок MELD у пациентов после введения TCP и ТЕ (фиг. 3С) в течение временного периода введения витамина Е. Данные показывают динамику оценок MELD во времени. Не обнаружено значимых различий в изменениях среднего значения подогнанных оценок MELD (характеризуемых параметром slope = угол наклона линии линейной регрессии) до введения. Внутри каждой группы после введения добавок slopes средних значений подогнанных оценок MELD без общей буквы отличаются, Р<0,05.
Фиг. 4А-4С. Концентрация α-ТЕ, γ-ТЕ и α-ТСР в крови участников испытания после перорального введения ТЕ.
Фиг. 5А-5С. Концентрация ТЕ и TCP в коже участников испытания после перорального введения ТЕ.
Осуществление изобретения
Настоящее изобретение основано (частично) на том открытии, что пероральное введение ТЕ повышает концентрацию α-ТЕ в каждом из исследуемых жизненно важных органов, включая печень. Пероральное введение ТЕ повышает его уровни в тканях до значения, превышающего терапевтические уровни, показывая, что потребление ТЕ с пищей и его дополнительное введение играют важную роль в здоровье человека.
Что касается других жизненно важных органов, то первоначальной целью сбора печени от пациентов, перенесших трансплантацию, было определение содержания ТЕ в тканях после его длительного перорального введения. Основываясь на результатах обратной связи в клинической практике, показавших, что у пациентов, получавших ТЕ, наблюдался замедленный рост количества баллов по шкале MELD (модель конечной стадии заболевания печени) по сравнению с пациентами, получавшими TCP, авторы изобретения исследовали значимость ТЕ в результатах оценки по шкале MELD пациентов с конечной стадией заболевания печени (ESLD).
Оценочная шкала MELD была введена в 1999 г. для количественной оценки прогноза пациентов с циррозом печени после трансюгулярного внутрипеченочного портосистемного шунтирования. Шкала MELD колеблется 6 до 40, причем самые высокие оценки указывают на недостаточность функции печени и повышенную необходимость проведения операции по трансплантации. MELD использует показатели билирубина в сыворотке крови, креатинина в сыворотке крови пациента и международное нормализованное отношение протромбинового времени (INR) для прогнозирования выживаемости. Уровень смертности в трехмесячный период у ESLD-пациентов с оценками MELD в диапазоне 10-19, 20-29, 30-39 и более 40 составляет соответственно 6,0%, 19,2%, 52,6% и 71,3%.
Конечная стадия заболевания печени. В проводимом в настоящее время исследовании 50% участников с ESLD, получавшие перорально вводимую добавку ТЕ, показали снижение оценки MELD. В противоположность этому, исследование авторов Huo et al. продемонстрировало, что участники, получавшие стандарт лечения, показали лишь 16% снижение оценки MELD во времени.
Результаты стандартного лечения. Обзор опубликованной в последнее время литературы по ESLD (конечная стадия заболевания печени) позволил выявить потенциальное клиническое действие настоящего изобретения. Из 124 пациентов с ESLD, наблюдавшихся в ходе исследования по оценке вариабельности оценки MELD на протяжении одного года перед трансплантацией, только один пациент показал снижение оценки MELD больше чем на 5 баллов. Оценка MELD является надежным показателем смертности.
Вирусный цирроз печени. Действие перорального введения ТЕ на замедление зависимого от времени повышения оценки MELD было наиболее очевидным у пациентов с вирусным циррозом печени.
Вирусный гепатит. Пероральное введение ТЕ показало свое действие у пациентов с вирусным гепатитом. Среди пациентов с ESLD в группе, получавшей ТЕ, только у 4 из 6 участников с гепатитом С и единственного субъекта с гепатитом В наблюдалось понижение оценки MELD после лечения.
Результаты стандартного лечения. Значимость настоящего изобретения подтверждается исследованием, сравнивающим оценки MELD у пациентов с циррозом печени, обусловленным вирусом гепатита С, получавших и не получавших установленного стандарта терапии. Из 129 подходящих пациентов 66 получали пегинтерферон-альфа-2b и рибавирин в течение 24 недель, в то время как 63 пациента не получали лечения. Оценки MELD у получавших лечение пациентов значительно понизились после 24 недель лечения (14,1+/-2,9 против 10,5+/-2,3), в то время как пациенты в контрольной группе без лечения показали повышение оценки MELD (14,5+/-3, против 16,7+/-3,2). Однако только 27 пациентов в лечебной группе выдержали лечение; 26 пациентам назначенная им доза была снижена из-за интоксикации и 13 пациентов прервали лечение по причине непереносимости. Несмотря на такие неблагоприятные результаты, клиренс среди пациентов с декомпенсированным циррозом печени, обусловленным вирусом гепатита C, является жизнеспасающим методом лечения и замедляет прогрессирование болезни.
Вспомогательная (адъювантная) терапия. Применение ТЕ при вспомогательной терапии либо для замедления прогрессирования болезни, либо для сокращения лечения пациентов, не переносящих стандартные терапевтические процедуры, включено в объем настоящего изобретения.
Доступность ТЕ в тканях и органах. Настоящее изобретение раскрывает доступность ТЕ в тканях жизненно важных органов взрослых субъектов после перорального введения ТЕ и характеризует многие уровни концентрации TCP в жизненно важных органах взрослых субъектов. Пациенты, получавшие ТЕ в течение даже самого короткого периода времени, имели поддающиеся обнаружению уровни ТЕ в тканях. То, что ТЕ доставлялся и накапливался в жизненно важных органах человека, доказывает, что пероральное введение ТЕ обогащает его концентрацию в цельной крови, жировой ткани, коже, головном мозге, сердечной мышце и печени.
Примеры
Пример 1. Экспериментальные методы
Участники исследования
Протокол исследования был рассмотрен и одобрен Институциональным наблюдательным советом по вопросам этики университета штата Огайо. Все пациенты дали письменное информированное согласие. Вследствие ограниченной возможности получения ткани от здоровых взрослых субъектов образцы цельной крови и биопсии кожи отбирались в группе здоровых участников, в то время как ткань жизненно важных органов была получена от группы хирургических пациентов.
Группа здоровых участников
Концентрацию витамина Е в цельной крови и коже сравнивали на исходном уровне (до введения добавки) с образцами, собранными спустя 12 недель от начала введения ТЕ (токотриенола). Здоровые участники (n=16) получали по 400 мг ТЕ ежедневно. У взрослых волонтеров отбирали два образца биопсии кожи и три образца крови. Биопсию кожи брали с внутренней стороны правого (1-я биопсия на исходном уровне (0 недель)) и левого (2-я биопсия спустя 12 недель) бедра. Цельную кровь брали спустя 0, 6 и 12 недель. Здоровые участники были выбраны для этого исследования по той причине, что им можно было вводить ТЕ в течение определенного периода времени (они не были связаны с графиком проведения операций, как группа хирургических пациентов). Это позволило авторам изобретения собрать исходные образцы до дополнительного введения ТЕ. В этой группе участники не получали TCP (токоферолы), поскольку каждый участник не имел представления о ТЕ и выступал в качестве собственного контроля. Критериями включения в группу здоровых участников служили: возраст от 21 года до 40 лет, хорошее состояние здоровья, отсутствие привычки курения, отсутствие беременности или кормления грудью и неприменение добавок, содержащих витамин Е, в прошлом (в предыдущие 6 месяцев) или в настоящее время. Критериями невключения в группу здоровых участников служили наличие диабета или ВИЧ-инфекции, получение иммуносупрессивной терапии, неврологические заболевания и употребление алкоголя или лекарственных средств.
Группа хирургических пациентов
Взрослые хирургические пациенты были рандомизированы для ежедневного введения либо 400 мг TCP, либо 400 мг ТЕ. Жизненно важные органы для исследования включали: сердечную мышцу, полученную от реципиентов с пересаженным сердцем по поводу конечной стадии сердечной недостаточности (TCP: n=3, ТЕ: n=5); печень - от реципиентов с пересаженной печенью по поводу конечной стадии болезни печени (TCP: n=3, ТЕ: n=4); жировую ткань, полученную из жировой ткани брюшной полости пациентов, страдающих патологическим ожирением, подвергающихся восстановительной пластической хирургии (TCP: n=4, ТЕ: n=5), и ткань головного мозга - от пациентов с не поддающейся лечению эпилепсией, требующей резекции (ТЕ: n=4). Контрольные образцы головного мозга были отобраны при вскрытии тел пациентов, пожертвовавших свои тела для науки, и представляют концентрации витамина Е в общей популяции без потребления добавки ТЕ к рациону питания (n=4). Критериями невключения служили неупотребление в настоящее время или в недавнем прошлом добавки витамина Е в рацион питания и возраст хирургических пациентов младше 21 года. Группы, которым вводились TCP или ТЕ, получали сравнимые диеты, предписанные врачом, которые не включали дополнительных пищевых добавок.
Режим введения добавок и его соблюдение
Для описываемого исследования капсулы с витамином Е поставлялись Carotech Inc., 21 Balmoral Court, Talmadge Village, Edison, New Jersey 08817, USA. Все исследование проводилось с применением гелевых капсул с витамином Е, изготовленных одной партией и сразу же отгруженных авторам изобретения. Подлинность содержимого капсул проверялась с помощью чувствительного кулонометрического метода детекции с использованием электродов, разработанного лабораторией авторов изобретения.
Участники группы хирургических пациентов были рандомизированы для получения либо 400 мг ТЕ (200 мг препарата Tocovid SupraBio b.i.d. (=дважды в день)), либо 400 мг TCP (200 мг b.i.d.). Группа здоровых участников получала только 400 мг ТЕ (200 мг b.i.d.). Одна мягкая гелевая капсула с 200 мг препарата Tocovid SupraBio содержала 61,52 мг d-альфа-токотриенола, 8,11 мг d-бета-токотриенола, 112,8 мг d-гамма-токотриенола и 25,68 мг d-дельта-токотриенола. Гелевые капсулы с TCP содержали 200 мг d-альфа-токоферола. Гелевые капсулы с витамином Е были герметично запечатаны в блистерные упаковки. Для установления соблюдения режима участники исследования отправляли пустые упаковки назад в клинику каждые две недели. Уровень соблюдения режима потребления добавки участниками исследования составил >90%.
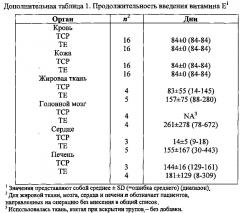
Продолжительность введения добавки для хирургических групп определялась, начиная с первого дня введения витамина Е и кончая днем перед запланированной операцией. Для всех хирургических пациентов, желательно, принимать добавку в течение минимум 4 недель. Однако в некоторых случаях указание врача о необходимости проведения операции не позволяло полностью завершить 4-недельный прием. Тканеспецифичная средняя, минимальная и максимальная продолжительность приема добавки пациентами приводится в дополнительной таблице 1.
Экстракция витамина Е и анализы
Иссеченные ткани измельчали, прополаскивали в фосфатном буферном растворе для удаления крови и хранили в жидком азоте до проведения анализа. Экстракцию витамина Е проводили с помощью высокочувствительного ВЭЖХ-кулонометрического детектора с электродной матрицей (CoulArray Detector Model 5600 с 12 каналами; ESA Inc., Chelmsford, MA, USA).
Пример 2. Статистический анализ
Группа здоровых участников
Коробчатые диаграммы использовались для выявления выбросов (определяются как значения >75 перцентиля плюс в 1,5 раза больший интерквантильный размах или как значения <25 перцентиля минус в 1,5 раза больший интерквантильный размах). Было идентифицировано двенадцать выбросов и установлено, что причиной являются погрешности лабораторного метода измерения, поэтому они были удалены из анализа. Линейная регрессия со случайными эффектами использовалась для сравнения концентраций изоформ витамина Е как в образцах крови, так и в образцах кожи в зависимости от количества недель добавления ТЕ. Если общее P-значение было значимым на уровне 0,05, то авторы изобретения проводили последовательное сравнение 0 vs. 6 недель, 0 vs. 12 недель и 6 vs. 12 недель. P-значения регулировали согласно процедуре Холма (Holm), чтобы сохранить общую ошибку I типа в 5%. В случае образцов кожи авторы изобретения сравнивали 0 vs. 12 недель добавления ТЕ. Пол (тендер) был включен в качестве модификатора эффекта (взаимодействие с количеством недель добавления ТЕ). Если взаимодействие ковариат не было значимым, то тогда пол включался как главный эффект. Если же сам пол не был значимым, то он удалялся из регрессионной модели. Изоформы витамина Е преобразовывали с помощью натурального логарифма, чтобы нормализовать значения внутри групп и стабилизировать дисперсию (разброс) между группами. Это допущение является типичным в случае использования линейной регрессии со случайными эффектами. Данные представляют собой индивидуальные значения для мужчин, женщин, а также среднее ± SD для мужчин, женщин и общее для обоих полов. P<0,05 считался значимым.
Группа хирургических пациентов
Представлена суммарная статистика по концентрации витамина Е в жировой ткани, головном мозге, сердечной мышце и печени хирургических пациентов, соответствующая статистике группы, получавшей добавку (ТЕ или TCP). Критерий ранговой суммы Уилкоксона (Вилкоксона) использовался для анализа различий в зависимости от формы добавляемого витамина Е-5 поддающихся обнаружению изоформ витамина Е. Вследствие малых размеров выборки проводился непараметрический анализ (ранговая сумма Уилкоксона): между 2 и 5 наблюдениями. P<0,05 рассматривался как значимый. Принятые в США рекомендуемые суточные нормы (RDA) основаны на уровне нутриентов, который является достаточным для 97-98% населения, поэтому данные представлены в виде процентильных значений.
Оценочный анализ модели конечной стадии заболевания печени
Линейная регрессия со случайными эффектами использовалась для вычисления индивидуальных slope (угловой коэффициент наклона линии линейной регрессии; обозначает изменение уровня какого-либо признака во времени) и intercepts (отрезок, отсекаемый линией линейной регрессии на оси ординат; обозначает начальный уровень какого-либо признака) пре- и поствведения добавки на основе оценки по шкале MELD для каждого субъекта. Это выполнялось по отдельности для групп, получавших добавку TCP и ТЕ. Регрессия со случайными эффектами учитывает вариабельность среди участников за счет повторных измерений и вариабельность между участниками для вычисления стандартной ошибки. Вследствие прогностической способности шкалы оценок MELD продолжительность введения добавки не стандартизировалась между пациентами, ожидающими трансплантации печени. Шкала времени указывалась в днях (сутках) относительно начала введения добавки витамина Е пациентам. Вычисленные наклоны линии регрессии (slope), представленные в результатах, умножались на 10000, поскольку изменение оценки MELD было относительно малым по сравнению с изменением количества дней (суток) наблюдений (от 1000 до 1500 дней). Рассчитывалось процентное изменение slope от пре- до постпериода введения добавки. Представлена суммарная статистика по пре- и пост-slope и процентному изменению в группах, получавших добавки ТЕ и TCP. Критерий ранговой суммы Уилкоксона использовался для анализа различий slope и процентного изменения slope между добавками TCP и ТЕ. Критерий знаковых рангов Уилкоксона использовался для сравнения пре- и поствведения добавки. Величина P<0,05 считалась значимой. Все статистические анализы выполнялись с помощью программного обеспечения Stata 10.1 (Stata Corporation, College Station, Texas).
Пример 3. Результаты экспериментов
В периферийной цельной крови не получавших добавку участников базовые уровни ТЕ были незначительными. Введение ТЕ значительно повышало концентрацию ТЕ в периферийной крови как мужчин, так и женщин (фиг. 1А и фиг. 4А, 4В). Средняя концентрация α-ТЕ в цельной крови участников, получавших добавку ТЕ, была выше 1,5 микромолей/л спустя 6 недель и 2,5 микромолей/л спустя 12 недель получения добавки (фиг. 1А). Добавка ТЕ существенно увеличила также уровни α-ТСР в цельной крови испытуемых участников. Добавка ТЕ умеренно снижала уровни γ-ТСР9 в цельной крови после 6 недель потребления ТЕ. Однако спустя 12 недель концентрация не отличалась от исходной (базовой). Представленные данные свидетельствуют о том, что ежедневное пероральное добавление ТЕ в типичный рацион питания человека является весьма эффективным для повышения концентрации токотриенолов в периферийной крови.
Как и в цельной крови, в коже здоровых участников, не получавших добавки ТЕ, были обнаружены лишь следовые исходные количества α-ТЕ, γ-ТЕ и δ-ТЕ (фиг. 2А, 2В и фиг. 5А, 5В). После 12 недель добавления ТЕ концентрация α-ТЕ, γ-ТЕ и δ-ТЕ в коже значительно повысилась. Объединенные данные для мужчин и женщин показали значительное повышение всех трех изоформ спустя 12 недель. Пероральное введение ТЕ не оказало значимого действия на концентрацию α-ТСР или γ-ТСР в коже.
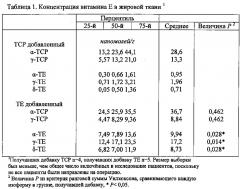
Жировая ткань выступила в качестве накопителя ТЕ у получавших добавку участников. Концентрация ТЕ в жировой ткани брюшной полости пациентов, получавших добавку ТЕ, была значительно выше, чем в других исследуемых жизненно важных органах (таблица 1). Концентрации α-ТЕ, γ-ТЕ и δ-ТЕ были примерно в 10 раз выше чем в контролях (Р<0,05). Отношение α-ТЕ к α-ТСР в жировой ткани участников, получавших добавку ТЕ, составило 1:4 по сравнению с 1:25 у пациентов, получавших только TCP. Добавление ТЕ не оказало заметного действия на концентрацию токоферола в жировой ткани (таблица 1).
П
Следовые уровни ТЕ были обнаружены в контрольной ткани головного мозга. Добавление ТЕ значительно повысило концентрации α-ТЕ, γ-ТЕ и δ-ТЕ в головном мозге живых участников (таблица 2). Участники, получавшие добавку ТЕ, показали значительно пониженный уровень α-ТСР, чем образцы головного мозга, взятые от трупов (таблица 2). В сердечной мышце уровни α-ТЕ, γ-ТЕ и δ-ТЕ были значительно выше у пациентов, получавших добавку ТЕ, по сравнению с участниками, получавшими только TCP (таблица 3). Не установлено статистически значимого различия в уровнях α-ТСР и γ-ТСР в сердечной мышце между лечебными группами (таблица 3). Добавление ТЕ значительно повышало концентрацию α-ТЕ, γ-ТЕ и δ-ТЕ в печени по сравнению с пациентами, получавшими добавку TCP (таблица 4). Однако аналогично результатам ранее проводившегося исследования на мелких животных, в котором изучалось влияние добавления ТЕ в рацион кормления, концентраци