Способ ослабления нарушения свертывания крови и связанные с этим материалы и методы
Иллюстрации
Показать всеНастоящая группа изобретений относится к медицине, а именно к терапии и коагулологии, и касается ослабления нарушений свертывания крови. Для этого вводят фармацевтическую композицию, включающую эффективное количество альфа-токотриеноловой изоформы природного витамина Е в количестве, достаточном для снижения агрегации тромбоцитов, опосредуемой арахидоновой кислотой. Это обеспечивает уменьшение риска развития тромбозов у больных с патологически повышенной агрегационной активностью тромбоцитов, в том числе у тех, кому противопоказана терапия другими антиагрегантами, в частности аспирином. 6 н. и 3 з.п. ф-лы, 36 ил., 2 табл., 4 пр.
Реферат
Отсылки к родственным заявкам
Данная заявка испрашивает приоритет по отношению к предварительной заявке на патент США номер 61/673500, представленной 19 июля 2012 г., содержание которой явным образом включается в настоящий документ путем отсылки.
Уровень техники
Природный витамин Ε представляет собой жирорастворимое вещество, существующее в восьми различных формах. Каждая из этих форм обладает своей биологической активностью, определяющей ее эффективность и пользу в организме. Витамин Ε - пищевой антиоксидант, участвующий в поддержании целостности клетки. В организм человека он поступает из таких продуктов, как растительные масла (подсолнечное, сафлоровое, рапсовое, оливковое), крупы, орехи, фрукты, а также из жирных частей мясных продуктов.
В природном витамине Ε два основных типа соединений: токоферолы (80%) и токотриенолы (20%). В структуру как тех, так и других входит хроманоловое кольцо. Токоферолы отличаются насыщенной боковой цепью, а в токотриенолах имеется изопреноидная боковая цепь с двойными связями при С-3, -7 и -11.
Клинические испытания, в которых изучалось действие природного витамина Ε при различных серьезных расстройствах здоровья, привели к выводу, что природный витамин Ε либо бесполезен, либо при некоторых состояниях может быть вредным.
Богатым источником природных токотриенолов служит пальмовое масло. Токотриенолы являются мощными нейропротекторами и антиоксидантами, обладают противораковым действием и понижают уровень холестерина в крови; эти их свойства биологически отличны от свойств токоферолов и независимы от антиоксидантной функции. Токотриенолы в микромолярных количествах подавляют активность печеночного фермента 3-гидрокси-3-метилглютарил-кофермент А-редуктазы, ответственной за синтез холестерина. Токотриенолы считаются более сильными антиоксидантами, чем токоферолы. Благодаря ненасыщенной боковой цепи токотриенолы лучше проникают в ткани, в которых есть слои насыщенных жиров, как в мозге и печени. Сравнительное изучение антиоксидантных свойств токоферолов и токотриенолов показало, что токотриенолы предпочтительны, потому что лучше распределяются в жировых слоях клеточной мембраны. Недавно сообщалось о том, что токотриенолы противодействуют ангиогенезу.
Как и в случае токоферолов, в отношении токотриенолов установлено наличие определенных функций, которые могут быть полезны для здоровья человека. Однако на долю токотриенолов приходится лишь небольшая доля исследований, посвященных витамину Е.
В США каждый год регистрируется приблизительно 795 тыс. случаев инсульта и более 200 тыс. случаев транзиторной ишемической атаки; эти нарушения имели место у 7 млн. человек. Для тех кто перенес инсульт, риск рецидива в первый год после инцидента составляет 11%, в первые пять лет - 26%. В течение 90 суток после транзиторной ишемической атаки риск инсульта составляет 9-11%.
В некоторых случаях рецидивных сердечно-сосудистых нарушений, в том числе инсульта, у лиц, страдающих сердечно-сосудистыми заболеваниями и принимающих аспирин и клопидогрел, могут быть связаны с неспособностью этих средств лечения поддавить агрегацию тромбоцитов in vitro. Частота случаев устойчивости к действию аспирина и клопидогрела оценивается в 20%.
По некоторым оценкам, в США около 30 млн. человек (9,5% населения) принимают аспирин и около 48 млн. человек (15,3% населения) принимают клопидогрел для защиты сердечно-сосудистой системы. При том что 20% населения устойчивы к этим средствам, миллионам людей нужно иное лечение.
После транзиторной ишемической атаки или инсульта аспирин снижает риск рецидивного инсульта, инфаркта миокарда и смерти от поражения сосудов на 13%, не летального ишемического инсульта - на 19%. Для предотвращения инсульта или комбинированного поражения сердечно-сосудистой системы препараты, противодействующие агрегации тромбоцитов, как клопидогрел и комбинированный препарат дипиридамола и аспирина замедленного высвобождения, несколько более эффективны, чем аспирин сам по себе; однако у больных с инсультом, обусловленным фибрилляцией предсердий, эти препараты не столь действенны, как варфарин в индивидуально подобранной дозировке, который снижает риск инсульта на 62%. У больных с инсультом аторвастатин снижает уровень холестерина в крови и риск рецидивного инсульта, но лишь на примерно 2% за период в пять лет. Также хронический прием клопидогрела (как альтернативы аспирину) и статинов не лишен вредных побочных эффектов, включая язвы желудка и кишечника, нейтропению, миалгию и повышенные показатели функции печени.
Раскрытие изобретения
Настоящим изобретением предлагаются способы ослабления свертывания крови у нуждающихся в том пациентов, включающие введение пациенту фармацевтически эффективной композиции, в которой содержится по меньшей мере одна изоформа токотриенола и которая ослабляет свертывание крови у этого пациента.
Также предлагаются такие способы, в которых указанная композиция содержит токотриенол в дозе, выбираемой из группы, состоящей из: от приблизительно 10 мг/сут до приблизительно 1000 мг/сут; от приблизительно 50 мг/сут до приблизительно 500 мг/сут; от приблизительно 100 мг/сут до приблизительно 500 мг/сут; от приблизительно 200 мг/сут до приблизительно 500 мг/сут; от приблизительно 300 мг/сут до приблизительно 500 мг/сут; до приблизительно 400 мг/сут.
Также предлагаются такие способы, в которых указанная композиция содержит токотриенол в дозе, выбираемой из группы, состоящей из: от приблизительно 200 мг 1 раз в неделю до приблизительно 1000 мг 1 раз в неделю; от приблизительно 300 мг 1 раз в неделю до приблизительно 1000 мг 1 раз в неделю; от приблизительно 400 мг 1 раз в неделю до приблизительно 500 мг 1 раз в неделю.
Также предлагаются такие способы, в которых указанная композиция вводится пациенту по схеме приема, выбираемой из группы, состоящей из: приблизительно через день; приблизительно 1 раз в 3 дня; приблизительно 1 раз в 4 дня; приблизительно 1 раз в 5 дней; приблизительно 1 раз в 6 дней; приблизительно 1 раз в 7 дней; приблизительно 1 раз в 2 недели; приблизительно 1 раз в месяц; приблизительно 2 раза в месяц; приблизительно 3 раза в месяц; приблизительно 4 раза в месяц; приблизительно 5 раз в месяц; приблизительно 6 раз в месяц; приблизительно 7 раз в месяц и приблизительно 8 раз в месяц.
Также предлагаются такие способы, в которых указанная композиция представляет собой добавку к пище, принимаемую перорально.
Также предлагаются такие способы, в которых указанную пероральную добавку к пище принимают в одной или более из следующих форм: капсулы, таблетки, коллоидный препарат, жевательная резинка, гель, напиток, компонент пищевого продукта, полоска тонкой растворимой пленки, эмульгированная съедобная паста, эмульсия, сироп, мясной пищевой продукт, молочный пищевой продукт, яйцо.
Также предлагаются такие способы, в которых указанного пациента выбирают из группы повышенного риска в отношении патологических состояний, связанных с нарушениями свертывания крови, выбираемых из группы, состоящей из транзиторной ишемической атаки, инсульта, эмболии и дисфункции сердца.
Также предлагаются такие способы, в которых указанного пациента выбирают из группы, состоящей из: лиц, у которых ранее было нарушение свертывания крови; лиц, перенесших инсульт; лиц, у которых было какое-либо острое или тяжелое состояние сердечно-сосудистой системы; лиц, перенесших транзиторную ишемическую атаку; лиц, у которых имела место эмболия; лиц, у которых имел место тромбоз; лиц с наследственным предрасположением к нарушениям свертывания крови; лиц, у которых имеются биологические маркеры, указывающие на нарушение свертывания крови, и лиц, принимающих противосвертывающие средства.
Также предлагаются такие способы, в которых указанного пациента выбирают из группы, состоящей из: космонавтов, летчиков, профессиональных автогонщиков, водолазов, альпинистов, пациентов перед хирургическим вмешательством, больных серповидно-клеточной анемией, пациентов с сонным апноэ, пациентов, проходящих лечение в связи со злоупотреблением наркотическими веществами, пожилых людей, старых животных и животных-компаньонов (домашних питомцев).
Настоящим изобретением также предлагается фармацевтическая композиция для лечения нарушений свертывания крови, включающая один или более агентов, противодействующих агрегации тромбоцитов, и одно или более токотриенольных соединений.
Также предлагаются такие композиции, в которых тромболитический агент выбирают из группы, состоящей из аспирина, клопидогрела и дипиридамола.
Настоящим изобретением также предлагаются способы снижения риска второго инсульта у нуждающихся в том больных, перенесших инсульт; эти способы включают введение нуждающемуся в том пациенту фармацевтически эффективной композиции, содержащей по меньшей мере одну изоформу токотриенола и снижающей риск повторения инсульта.
Также предлагаются такие способы, которые применяются к пациентам, устойчивым к действию аспирина или клопидогрела.
Также предлагаются такие способы, которые включают введение пациенту до 400 мг по меньшей мере одного токотриенола в течение по меньшей мере 30 дней и последующего введения фармацевтически эффективной дозы по меньшей мере одного токотриенола раз в неделю.
Настоящим изобретением также предлагаются способы снижения риска второго инсульта у нуждающихся в том больных, перенесших инсульт; эти способы включают введение нуждающемуся в том пациенту фармацевтически эффективной композиции, содержащей по меньшей мере одну изоформу токотриенола и снижающей риск повторения инсульта.
Также предлагаются такие способы, которые включают введение пациенту также фармацевтически эффективного количества аспирина или клопидогрела.
Также предлагаются такие способы, которые включают введение пациенту до 400 мг по меньшей мере одного токотриенола в течение по меньшей мере 30 дней и последующего введения фармацевтически эффективной дозы по меньшей мере одного токотриенола раз в неделю.
Настоящим изобретением также предлагается способ подавления агрегации тромбоцитов, опосредованной арахидоновой кислотой и связанной с 12-липоксигеназой (12-LOX), у нуждающихся в том пациентов, который включает введение указанному пациенту фармацевтически эффективного количества смеси токотриенолов раз в неделю.
Настоящим изобретением также предлагаются способы снижения риска или ослабления симптомов патологической агрегации тромбоцитов у нуждающихся в том пациентов, которым противопоказан аспирин; эти способы включают введение указанному пациенту фармацевтически эффективной смеси токотриенолов.
Также предлагаются такие способы, которые применяются в случаях, когда аспирин противопоказан по причинам, выбираемым из группы, состоящей из алкоголизма, патологических изменений печени, нарушений свертывания крови, аллергии, непереносимости салицилатов, астмы, бронхоспазма, пептических язв или язв кишечника, диабета, гастрита, гемофилии, недостаточности глюкозо-6-фосфат-дегидрогеназы, лихорадки денге, детского или подросткового возраста, заболеваний почек, гиперурикемии и подагры.
Настоящим изобретением также предлагаются способы снижения риска или ослабления симптомов патологической агрегации тромбоцитов у нуждающихся в том пациентов, которым противопоказан клопидогрел; эти способы включают введение указанному пациенту фармацевтически эффективной смеси токотриенолов.
Также предлагаются такие способы, которые применяются в случаях, когда аспирин противопоказан по причинам, выбираемым из группы, состоящей из алкоголизма, патологических изменений печени, аллергии, низкой скорости метаболизма субстратов цитохрома р450 из-за наличия его аллельного варианта CYP2C19, язв желудка или кишечника и поражений почек.
Настоящим изобретением также предлагаются способы снижения риска сердечного приступа у нуждающихся в том пациентов, включающие введение указанному пациенту фармацевтически эффективного количества смеси токотриенолов раз в неделю.
Настоящим изобретением также предлагаются способы снижения риска сердечного приступа у нуждающихся в том пациентов, включающие введение указанному пациенту фармацевтически эффективного количества смеси токотриенолов раз в неделю.
Краткое описании фигур
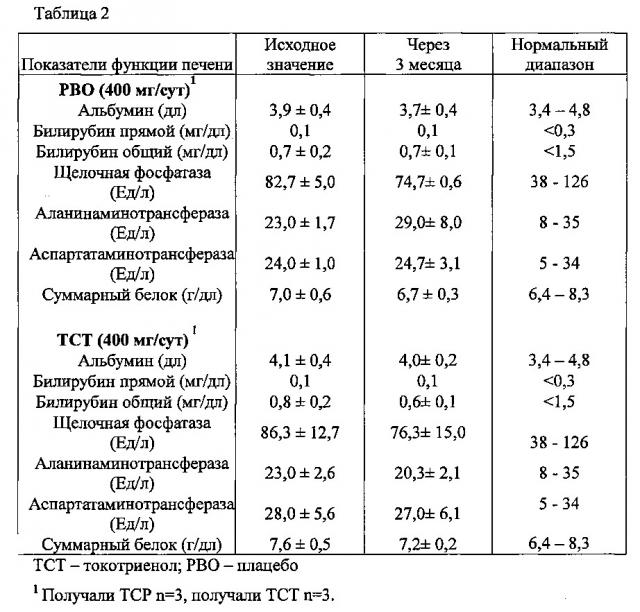
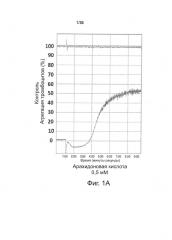
Фиг. 1. Противодействие токотриенола витамина Ε агрегации тромбоцитов в человеческой крови. Здоровые пациенты на протяжении 4 недель получали токотриенол витамина Ε (400 мг/сут) либо носитель в качестве плацебо (контроль). Функцию тромбоцитов определяли путем оптической агрегометрии, используя следующие агонисты: арахидоновую кислоту (АА; 0,5 мМ), аденозиндифосфат (ADP; 10 мкМ) и коллаген (2 мкг/мл). А. Примерные кривые изменения функции тромбоцитов у пациентов, получавших плацебо (контроль) и токотриенолы (ТСТ). В. Токотриенол (ТСТ) полностью подавлял опосредуемую арахидоновой кислотой (АА) агрегацию тромбоцитов по сравнению с контролем. Токотриенол (ТСТ) значительно ослаблял агрегацию тромбоцитов при использовании аденозиндифосфата (ADP) и коллагена по сравнению с контролем (42 и 37% соответственно).
Фиг. 2. Токотриенол природного витамина Ε защищает от связанного с инсультом повреждения мозга. (А и В) Влияние перорального приема токотриенола (ТСТ) либо плацебо (РВО) на концентрацию α-токоферола и α-токотриенола в коре головного мозга у собак. У животных, получавших плацебо, токотриенол в мозге не обнаруживался. Прием токотриенола существенно увеличивал концентрацию α-токотриенола в коре головного мозга. (С) Обусловленный инсультом объем очага инфаркта головного мозга. DTI = диффузионная тензорная визуализация, проведенная через 1 ч FLAIR = инверсия - восстановление с подавлением сигнала от воды, проводили через 24 ч. (D) Примеры изображения головного мозга, полученные путем магнитно-резонансной томографии во фронтальной проекции через 1 ч и через 24 ч после инсульта. *p<0,05.
Фиг. 3. Концентрация токотриенола в цельной крови у людей после ежедневного перорального приема токотриенола в дозе 400 мг. Уровни токотриенола (ТСТ) в крови определяли путем высокоэффективной жидкостной хроматографии, как сообщалось10. Представлены идивидуальные значения (мужчины n=6, женщины n=10) и средние значения ± стандартное отклонение (SD) на исходном уровне (0 недель), через 6 недель и через 12 недель. В каждый из указанных моментов времени уровни, обозначенные разными символами, различаются (p<0,05).
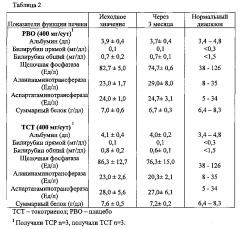
Фиг. 4. Имитирующее эффект аспирина противосвертывающее действие токотриенола природного витамина Е. Определяли функцию тромбоцитов у здоровых пациентов (n=3) в исходном состоянии и после перорального приема токотриенола (ТСТ) в дозировке 400 мг/сут либо плацебо (РВО) на протяжении 2 месяцев. (А) Определение агрегации (%) тромбоцитов путем оптической агрегометрии с арахидоновой кислотой в качестве агониста агрегации (АА, 0,5 мМ). Этот же агонист использовали для определения изменения функции тромбоцитов в ответ на аспирин. *p<0,05 для РВО по сравнению с ТСТ в данный момент времени. (В и С) Примеры регистрации светопропускания для пациентов, принимавших на протяжении 2 месяцев токотриенол либо плацебо.
Фиг. 5. Пероральный прием токотриенола вызывает снижение уровня триглицеридов и повышение уровня холестерина в составе липопротеинов высокой плотности (HDL) в крови у здоровых пациентов. Определяли уровень холестерина в крови у здоровых пациентов (n=3) - исходный и спустя 3 месяца, в течение которых испытуемые принимали ежедневно токотриенол в дозе 400 мг. Исходный средний уровень общего холестерина составлял 204,0±11,5. Через 3 месяца приема токотриенола было отмечено умеренное (-5,1%±4,5%), но не существенное снижение уровня общего холестерина; уровень триглицеридов уменьшился значительно - на 32,8%±10,5%, а уровень холестеринам в составе HDL значительно возрос - на 10,8%±1,4% по сравнению с исходными уровнями. *p<0,05 (парный t-критерий Стьюдента).
Фиг. 6. Агрегация тромбоцитов, 62-й день приема препарата (токотриенола либо плацебо).
Фиг. 7. Агрегация тромбоцитов, 2-й день после окончания приема препарата (токотриенола либо плацебо).
Фиг. 8. Агрегация тромбоцитов, 5-й день после окончания приема препарата (токотриенола либо плацебо).
Фиг. 9. Агрегация тромбоцитов, 10-й день после окончания приема препарата (токотриенола либо плацебо).
Фиг. 10. Агрегация тромбоцитов, 20-й день после окончания приема препарата (токотриенола либо плацебо).
Осуществление изобретения
Настоящее изобретение позволило идентифицировать конкретные механизмы, определяющие подобные эффекту аспирина свойства изоформы токотриенола природного витамина Е, называемой альфа-токотриенолом (ТСТ), а именно противодействие агрегации тромбоцитов. У человека ТСТ, принимаемый перорально, полностью подавляет опосредованную арахидоновой кислотой агрегацию тромбоцитов. ТСТ также подавляет агрегацию тромбоцитов, индуцированную другими агонистами, в том числе аденозиндифосфатом (ADP) и коллагеном (фиг. 1).
Аспирин обладает рядом побочных эффектов, включая гепатотоксичность и язвенный колит. Кроме того, этот препарат противопоказан при ряде состояний, в том числе при алкоголизме и аллергии на ибупрофен или напроксен. А альфа-токотриенол, будучи изоформой природного токотриенола, содержащейся в пищевых продуктах, в частности в кулинарных маслах (например, в пальмовом масле), одобрен Управлением по контролю качества пищевых продуктов, медикаментов и косметических средств США (FDA) для потребления людьми в качестве добавки к пище по категории GRAS (признан безопасным).
У 25% людей аспирин не оказывает антиагрегантного действия. Механизм действия аспирина состоит в ацетилировании активного центра циклооксигеназ СОХ-1 и СОХ-2, в результате чего подавляется метаболизм арахидоновой кислоты с участием этих ферментов. Мишенью альфа-токотриенола является другой фермент, участвующий в метаболизме арахидоновой кислоты, а именно 12-липоксигеназа (12-LOX). В данном изобретении впервые описывается эффект альфа-токотриенола, состоящий в противодействии агрегации тромбоцитов, с участием липоксигеназного пути. Поскольку механизм противодействия ТСТ агрегации тромбоцитов, опосредованной арахидоновой кислотой, иной, чем аспирина, токотриенол эффективен у тех пациентов, которые устойчивы к аспирину.
Применения данного изобретения в клинической практике и в коммерческих предприятиях включают использование альфа-токотриенола в качестве природного антиагрегантного агента, составляющего альтернативу аспирину и не обладающего замеченными побочными эффектами.
Альфа-токотриенол можно использовать вместо аспирина для противодействия агрегации тромбоцитов у пациентов, для которых аспирин не эффективен, и у тех, кому он противопоказан (например, при алкоголизме или аллергии).
Термины
Следует заметить, что изложенное выше общее описание и нижеследующее подробное описание носят лишь примерный и пояснительный характер, не ограничивая объем приведенных в настоящем документе утверждений. В данной заявке употребление единственного числа включает значение множественного числа, если не оговорено иного.
В настоящем документе при употреблении неопределенного артикля (а/ап) в сочетании с выражениями «содержащий/включающий» в формуле изобретения и/или в описании может подразумеваться значение «один», но также и значения «один или более», «по меньшей мере один» и «один или более чем один».
В настоящем документе слова «содержать», «включать» и их производные («содержащий», «включающий» и др.) не следует понимать как имеющие ограничительный характер. Оборот «и/или» означает, что указанное перед ним и после него можно объединить или рассматривать раздельно. Например, "X и/или Y" может означать "X либо Y" или же "X и Y" (данный пример не имеет ограничительного характера).
Выражение «их сочетания/комбинации» в настоящем документе относится ко всем перестановкам и сочетаниям объектов, перечисленных перед этим выражением. Например, фраза «А, В, С или их сочетания/комбинации» подразумевает, что в рассмотрение включен по меньшей мере один вариант из следующих: А, В, С, АВ, АС, ВС или ABC, а если в данном контексте имеет значение порядок объектов, то также ВА, СА, СВ, АСВ, СВА, ВСА, ВАС или CAB.
Пациент/индивид. В настоящем документе термин «пациент» включает человека и животных. Предпочтительно лечение применялось к пациентам-людям. Термины «пациент» и «индивид» употребляются в настоящем документе взаимозаменяемо.
Фармацевтически приемлемые носители/средства доставки. В настоящем изобретении используются обычные в данной области техники носители (средства доставки). В работе Remington's Pharmaceutical Sciences, by Ε.W. Martin, Mack Publishing Co., Easton, PA, 15th Edition (1975), описываются композиции и составы, пригодные для фармацевтической доставки одного или более лечебных субстанций, веществ или агентов.
Вообще говоря, природа взятого для композиции носителя зависит от того, какой конкретно используется путь введения препарата. Например, в составы для парентерального введения обычно в качестве носителя (средства доставки) входят жидкости, пригодные для инъекций, что включает фармацевтическим и физиологически приемлемые жидкости, например воду, физиологический солевой раствор, сбалансированные солевые растворы, водный раствор декстрозы, глицерин или другие подобные компоненты. Твердые композиции (например, порошки, пилюли, таблетки или капсулы) могут включать обычно применяемые нетоксичные твердые носители, например фармацевтически чистые маннит, лактозу, крахмал или стеарат магния. Помимо биологически нейтральных носителей фармацевтические композиции для введения в организм могут содержать небольшие количества нетоксичных вспомогательных веществ, например увлажняющие или эмульгирующие агенты, консерванты, забуферивающие агенты и проч., например ацетат натрия или сорбитан-монолаурат.
Предотвращение, лечение или ослабление заболевания. Термин «предотвращение/профилактика» заболевания относится к подавлению всего развития заболевания. Термин «лечение» относится к лечебному/терапевтическому вмешательству, ослабляющему симптомы/признаки/проявления заболевания или патологическое состояние, возникающее после начала развития заболевания. Термин «ослабление/облегчение» относится к снижению количества или тяжести симптомов/признаков/проявлений заболевания.
Терапевтический. Это обобщающий термин, который включает как диагностику, так и лечение.
Терапевтический агент. Под терапевтическим агентом понимается композиция, способная вызвать желаемый лечебный или профилактический эффект при адекватном введении пациенту. «Инкубация» подразумевает промежуток времени, достаточный для взаимодействия агента с клеткой или тканью. «Контактирование» подразумевает инкубацию агента в твердой или жидкой форме с клетками или тканями. «Обработка» клетки или ткани агентом подразумевает контактирование или инкубацию агента с клеткой или тканью.
Терапевтически эффективное количество. Количество конкретного фармацевтического или терапевтического агента, достаточное для достижения желаемого эффекта у пациента или в клетке при обработке данным агентом. Эффективное количество агента зависит от ряда факторов, включая (но не ограничиваясь перечисленным здесь) природу обрабатываемого объекта (пациент, клетка и проч.) и способ введения терапевтической композиции.
Фармацевтические препараты
Фармацевтические композиции по данному изобретению содержат эффективное количество соединения (соединений) или композиции (композиций), описанных в настоящем документе, и/или дополнительные агенты, растворенные или диспергированные в фармацевтически приемлемом носителе. Определения «фармацевтический» или «фармакологически приемлемый» относятся к веществам и композициям, которые будучи введены в организм человека или животного, не вызывают у него негативных, аллергических или иных нежелательных реакций. В свете настоящего описания и на примерах, приведенных в работе Remington's Pharmaceutical Sciences, 2003, включаемой в настоящий документ путем отсылки, получение фармацевтических композиций, содержащих по меньшей мере одно вещество или дополнительный активный ингредиент, должно быть ясно специалистам в данной области техники. Кроме того, препараты для введения человеку или животным должны отвечать требованиям стерильности, пирогенности и общей безопасности, а также стандартам чистоты, согласно установлениям Отдела стандартов и качества биологических препаратов FDA.
В настоящем документе понятие «фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, оболочки, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые агенты), агенты, обеспечивающие нужное осмотическое давление (изотонические), агенты, замедляющие абсорбцию, соли, консерванты, лекарственные вещества, агенты, стабилизирующие лекарственные вещества, гели, связующие агенты, дезинтегрирующие агенты, агенты, улучшающие скольжение, подсластители, ароматизаторы, красители и другие эксципиенты, а также подобные материалы и их комбинации, которые должны быть известны рядовым специалистам в данной области техники (см., например, работу Remington's Pharmaceutical Sciences, 995, pp. 1289-1329, включаемую в настоящий документ путем отсылки). За исключением тех случаев, когда обычно используемый носитель не совместим с активным ингредиентом, его применение в фармацевтических композициях подразумевается.
Композиция по данному изобретению может содержать носители различного типа в зависимости от того, в какой форме она должна быть введена пациенту - твердой, жидкой или аэрозольной, и есть ли необходимость в ее стерильности, как, например, при введении путем инъекций. Композиция по данному изобретению может быть введена внутривенно, внутрикожно, подкожно, интратекально, интраартериально, внутрибрюшинно, интраназально, интравагинально, интраректально, местно, внутримышечно, подкожно, в слизистую оболочку, перорально, местно, локально, путем вдыхания (например, путем вдыхания аэрозоля), путем инъекции, инфузии, непрерывной инфузии, локальной непосредственной перфузии клеток-мишеней, через катетер, путем лаважа, в составе крема, в составе липидной конструкции/композиции (например, в липосомах) или другим способом, или путем сочетания перечисленных выше способов, которые должны быть известны рядовому специалисту в данной области техники (см., например, работу Remington's Pharmaceutical Sciences, 2003, включаемую в настоящий документ путем отсылки).
Также по данному изобретению предлагаются композиции, пригодные для введения в фармацевтически приемлемом носителе с инертным разбавителем (или без него). Указанный носитель, включая жидкие, твердые и полужидкие (например, пасты) носители, должен быть усвояемым. За исключением тех случаев, когда какой-либо обычно используемый агент, разбавитель, среда или носитель вреден для данного пациента или снижает терапевтическую эффективность содержащей его композиции, допустимо применение указанных ингредиентов в композиции, подлежащей введению пациентам, при практическом осуществлении способа по данному изобретению. Примеры носителей или разбавителей включают жиры, масла, воду, солевые растворы, липиды, липосомы, смолы, связующие агенты, наполнители и проч. или их комбинации. Композиция по данному изобретению может также содержать различные антиоксиданты для замедления окисления одного или более ее компонентов. Кроме того, можно предотвратить воздействие микроорганизмов при помощи таких консервантов, как различные антибактериальные и противогрибковые агенты, включая (но не ограничиваясь перечисленным здесь) парабены (например, метилпарабены, пропилпарабены), хлорбутанол, фенол, сорбиновую кислоту, тимеросал или их комбинации.
Композицию по данному изобретению объединяют с носителем любым удобным и практичным способом, например, путем растворения, суспендирования, эмульгирования, подмешивания, заключения в капсулы, абсорбции и проч. Такие способы обычны для специалистов в данной области техники.
В одном из конкретных воплощений данного изобретения композицию объединяют или тщательно смешивают с твердым или полужидким носителем. Их смешивание может осуществляться любым удобным способом, например путем растирания. В процессе смешивания можно также добавлять стабилизирующие агенты, чтобы защитить композицию от потери терапевтической активности, например в результате денатурации в желудке. Примеры стабилизирующих агентов для использования в композициях по данному изобретению включают забуферивающие вещества, аминокислоты (например, глицин и лизин), углеводы (например, декстрозу, маннозу, галактозу, фруктозу, лактозу, сахарозу, мальтозу, сорбит, маннит и др.).
В других воплощениях данного изобретения фармацевтическая композиция может включать в небольших количествах фармакологически приемлемые хелатирующие агенты или коантиоксиданты. Примеры хелатирующих агентов включают этилендиаминтетрауксусную кислоту (EDTA) и этиленгликоль-бис(бета-аминоэтиловый эфир)-N,N,N',N'-тетрауксусную кислоту (EGTA). Примеры антиоксидантов включают эфиры галловой кислоты, аскорбиновую кислоту, витамин Ε (или другие токоферолы), бутилгидрокситолуол и/или бензойную кислоту. Эти хелатирующие агенты и/или коантиоксиданты можно использовать для стабилизации композиций по данному изобретению. В некоторых воплощениях данного изобретения эти хелатирующие агенты и/или антиоксиданты могут стабилизировать композиции по данному изобретению от разложения в результате самоокисления.
В других своих воплощениях данное изобретение касается применения фармацевтических липидных средств доставки, заключающих в себе композицию по данному изобретению, один или более липидов и водный растворитель. В настоящем документе термин «липид» включает любое из широкого спектра веществ, отличающихся тем, что они нерастворимы в воде и экстрагируются органическими растворителями. Специалистам в данной области техники должно быть ясно, о каких веществах идет речь, и в настоящем документе употребление термина «липид» не ограничено какой-либо конкретной структурой. Примеры липидов включают соединения, содержащие длинноцепочечные алифатические углеводороды, и их производные. Липиды могут быть природными или синтетическими (например, созданными или полученными человеком). Впрочем, под липидом обычно подразумевается биологическое вещество. Липиды биологического происхождения хорошо известны в данной области техники; они включают, например, нейтральные жиры, фосфолипиды, фосфоглицериды, стероиды, терпены, лизолипиды, гликосфинголипиды, гликолипиды, сульфатиды, эфиры жирных кислот, полимеризующиеся липиды и их комбинации. Как должно быть ясно специалистам в данной области техники, в композиции и способы по данному изобретению могут входить также другие соединения такого рода, не упомянутые конкретно в настоящем документе.
Рядовому специалисту в данной области техники знакомы различные методы, применяемые для включения композиции в липидное средство доставки. Например, композиция по данному изобретению может быть диспергирована в растворе, содержащем липиды, растворена в липиде, эмульгирована с липидом, смешана с липидом, объединена с липидом, ковалентно связана с липидом, взвешена в липиде, содержатся в липидной мицелле или липосоме, образовывать с ней комплекс или иным образом ассоциирована с липидом или липидной структурой любыми средствами, известными рядовому специалисту в данной области техники. Диспергирование может приводить (или не приводить) к образованию липосом.
На практике доза (вводимое количество) композиции по данному изобретению для конкретного пациента (животного) может определяться такими физическими и физиологическими факторами, как масса тела, степень тяжести патологического состояния, характер подлежащего лечению заболевания, предыдущие или текущие терапевтические вмешательства, идиопатичность заболевания/состояния у данного пациента и путь введения композиции. В зависимости от дозировки и пути введения число приемов предпочтительной дозы и/или эффективного количества может варьировать соответственно реакции пациента. На практике медицинский работник, осуществляющий введение препарата, в любом случае определяет концентрацию активного ингредиента (ингредиентов) в композиции и подходящую для данного пациента дозу (дозы).
Разумеется, количество активного ингредиента (ингредиентов) в каждой терапевтически полезной композиции может быть подобрано таким образом, чтобы с любой единичной дозой достигалась подходящая дозировка нужного вещества. При составлении таких фармацевтических композиций специалисту в данной области техники следует учитывать такие факторы, как растворимость, биологическая доступность, время полужизни, путь введения, срок хранения препарата, а также другие фармакологически значимые показатели; при этом могут быть желательны различные дозировки и схемы лечения.
Композиции для алиментарного применения и их состав
В некоторых воплощениях данного изобретения описываемые в настоящем документе композиции и/или дополнительные агенты составляют и получают таким образом, чтобы их введение в организм происходило алиментарным путем. Алиментарный путь введения включает всевозможные способы введения, при которых фармацевтическая композиция оказывается в непосредственном контакте с пищеварительным трактом. А именно, описываемые в настоящем документе фармацевтические композиции могут вводиться перорально, буккально, ректально или подъязычно. При этом в состав указанных композиций входит инертный разбавитель или усваиваемый съедобный носитель, или же композиция может быть заключена в жесткие или полужесткие желатиновые капсулы, или она может быть в виде прессованных таблеток, или же она может входить в состав пищевого продукта.
В некоторых воплощениях данного изобретения активные вещества могут быть включены вместе с теми или иными эксципиентами в состав таблеток, подлежащих проглатыванию или же рассасыванию в полости рта, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и проч. (Mathiowitz et al., 1997; Hwang et al., 1998; патенты США №5641515, №5580579 и №5792451; каждая из этих работ полностью включается в настоящий документ путем отсылки). Таблетки, пастилки, пилюли, капсулы и подобные лекарственные формы могут также содержать следующие компоненты: связующие агенты, например трагакантовую камедь, аравийскую камедь, кукурузный крахмал, желатин или их комбинации; другие эксципиенты, например двузамещенный фосфорнокислый кальций, маннит, лактозу, крахмал, стеарат магния, сахарин (сахаринат натрия), целлюлозу, карбонат магния или их комбинации; дезинтегрирующие агенты, например кукурузный крахмал, картофельный крахмал, альгиновую кислоту или их комбинации; агенты, улучшающие скольжение, например стеарат магния; подсластители, например сахарозу, лактозу, сахарин или их комбинации; ароматизирующие агенты, например перечную мяту, масло грушанки (винтергриновое), вишневый ароматизатор, апельсиновый ароматизатор и проч. Если лекарственной формой являются капсулы, то они могут содержать в дополнение к указанным выше веществам жидкий носитель. Могут использоваться также различные другие материалы для создания оболочки или иной физической модификации лекарственной формы. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или тем и другим вместе. Если лекарственной формой являются капсулы, то они могут содержать в дополнение к указанным выше веществам жидкий носитель. Желатиновые капсулы, таблетки или пилюли могут быть покрыты кишечнорастворимой оболочкой. Кишечнорастворимая оболочка предотвращает разложение композиции в желудке и в верхней части кишечника, где рН кислый (см., например, патент США №5629001). Когда препарат доходит до тонкого кишечника, где рН щелочной, оболочка растворяется, так что композиция высвобождается и поглощается специализированными клетками, например клетками эпителия кишечника и М-клетками пейеровых бляшек. Сироп или эликсир может содержать активное