Способ иммунологического определения антигенов анизакид в мышечной ткани рыб
Иллюстрации
Показать всеИзобретение относится к области ветеринарной и медицинской гельминтологии, в частности к иммунологическому методу обнаружения антигена личинок анизакид в мышечной ткани рыбы, и может быть рекомендовано для ветеринарно-санитарной экспертизы морепродуктов. Способ предусматривает приготовление белково-антигенного экстракта из личинок третьей стадии Anisakis simplex, контроль его на стерильность, определение содержания белка, получение гипериммунной сыворотки к белково-антигенному экстракту из личинок 3-й стадии A.simplex иммунизацией кроликов в комплексе с полным адъювантом Фрейнда; проведение реакции иммунодиффузии (РИД) в агаровом геле с полученной гипериммунной сывороткой и жидкостью, образующейся при разморозке морепродуктов. Проявление полосы преципитации между этой жидкостью и гипериммунной сывороткой к белково-антигенному экстракту A.simplex свидетельствует о присутствии в морепродуктах антигенов личинок. Способ эффективен в выявлении антигенов анизакид в жидкости, полученной при размораживании мышечной ткани рыб. 2 ил., 2 пр.
Реферат
Изобретение относится к области ветеринарной и медицинской гельминтологии, в частности к иммунологическому методу обнаружения антигена личинок анизакид в мышечной ткани рыбы, и может быть рекомендовано для ветеринарно-санитарной экспертизы морепродуктов.
Анизакидоз, вызванный личинками нематод семейства Anisakidae Skrjabin et Koroktin 1945, является опасным для здоровья человека и животных заболеванием [2, 4-6].
Человек и домашние плотоядные заражаются при употреблении в пищу морских рыб и морепродуктов, в которых содержатся жизнеспособные личинки паразита. В последние два десятилетия анизакидозная инвазия становится одной из важных проблем в медицинской паразитологии. Заболеваемость людей имеет стойкую тенденцию к росту в связи с увеличением потребления в пищу блюд из сырой или полусырой рыбы, ракообразных, кальмаров и других моллюсков. Личинки анизакид при попадании в желудочно-кишечный тракт человека или животных активно внедряются в слизистую и подслизистую оболочки, часто обнаруживаются в стенках желудка и тонкого кишечника. На месте их внедрения развивается воспаление, сопровождающееся эозинофильной инфильтрацией, отеком, изъязвлением и геморрагиями. В дальнейшем возможно формирование эозинофильных гранулем, некроза и перфорации кишечной стенки [16, 18].
Анизакидоз у морских млекопитающих проявляется образованием язв на стенках желудка, иногда им сопутствует гастрит. Экспериментальное заражение морских свинок личинками A. simplex сопровождалось образованием в желудке кратерообразных язв [20]. Личинки анизакид способны инвазировать свиней при скармливании им пораженных ими рыбных отходов [2].
Описаны случаи локализации личинок анизакид в глотке, поджелудочной железе, селезенке и лимфатических узлах [7, 14].
Возбудители анизакидоза человека - преимущественно личиночные стадии гельминтов рода Anisakis. В замороженной рыбе и других гидробионтах допускается наличие только нежизнеспособных личинок гельминтов [8]. Однако необходимо помнить, что соматические белки гельминтов и продукты их метаболизма могут оказывать токсическое и аллергенное действие.
Установлено, что в мышечной ткани морской рыбы с увеличением степени инвазии происходит снижение связанных аминокислот: тирозина, фенилаланина, лейцина, метионина, серина, а-аланина. В то же время происходит концентрация свободных аминокислот (в 4-9 раз), что свидетельствует о процессах распада белка, сопровождающегося выделением аммония. Помимо этого в мышечной ткани происходят процессы окисления с образованием альдегидов, эфиров, кетонов, карбоновых кислот, в частности масляной кислоты, а также накопление метанола [9]. Авторами доказано, что путассу, сельдь и хамса при интенсивности инвазии (ИИ) выше 20 экземпляров, минтай, мойва - более 7 экземпляров отличаются более низкими показателями качества и питательной ценности. В связи с тем, что в мышечной ткани рыбы могут присутствовать вызывающие патологические процессы антигенные компоненты личинок анизакид, возникает необходимость разработки методов их выявления в рыбопродуктах. Проблемой иммунологической диагностики анизакидоза у человека занималось большое число исследователей. В качестве диагностических методов использовали внутрикожную пробу [10, 17], реакцию связывания комплемента [17], иммунодиффузию [13, 15], иммунофлуоресценцию [17, 19, 23], иммуноэлетрофорез [12, 13], иммуноферментный анализ [19] и радио-аллергосорбентную реакцию [11, 12, 19].
Все перечисленные иммуноалергические реакции предназначались для диагностики зараженности анизакидами человека и основывались они в основном на обнаружении антител в сыворотке крови людей с подозрением на анизакидоз. Имеются также экспериментальные доказательства, что антигены и аллергены анизакид диффундируют в мышечную ткань рыб и могут вызывать аллергические реакции у сенсибилизированных пациентов [21].
Наиболее близким к заявляемому техническому решению является метод иммунодиффузии, использованный в качестве диагностического Kobayashi A. et al [13] и Mudry J. et al [15], который, как и в нашей разработке, проводится в агаровом геле, но с использованием сыворотки крови пациентов с подозрением на заболеваемость антизакидозом и антигена из анизакид. В этом случае исход реакции зависит от уровня специфических антител в кровотоке инвазированного пациента. Как правило, при низкой интенсивности инвазии уровень антител невысокий и реакция отрицательная. Метод в таком варианте постановки реакции с указанными реагентами не позволяет определить зараженность рыбной продукции анизакидами.
Сопоставительный анализ показывает, что заявляемое техническое решение отличается от прототипа тем, что оно позволяет в таком варианте используемых реагентов реакции определить зараженность рыбной продукции анизакидами и продуктами их жизнедеятельности, поэтому данное техническое решение отвечает критерию «новизна».
Цель изобретения сводится к выявлению антигенов анизакид в жидкости, полученной при размораживании мышечной ткани рыб, с помощью гипериммунной сыворотки кроликов к белково-антигенному экстракту личинок 3-й стадии A. simplex.
Предлагаемый способ включает следующие этапы:
1. Получение белково-антигенного экстракта из личинок 3-й стадии A. simplex, контроль его на стерильность и определение содержания белка.
2. Получение гипериммунной сыворотки к белково-антигенному экстракту из личинок 3-й стадии A.simplex.
3. Проведение реакции иммунодиффузии в агаровом геле.
Примеры конкретного исполнения
Получение белково-антигенного экстракта из личинок 3-й стадии A.simplex, контроль его на стерильность и определение содержания белка
Извлеченных из тушек рыбы личинок A.simplex 3-й стадии тщательно многократно промывали проточной водой, затем обрабатывали растворами антибиотиков и противогрибкового препарата из расчета 2000 ЕД/мл пенициллина, 1 мг/мл стрептомицина и 2500 ЕД/мл нистатина, промывали стерильным физиологическим раствором и замораживали. Белково-антигенный экстракт из личинок A. simplex готовили путем гомогенизации, многократного замораживания и оттаивания до получения однородной массы. Экстрагирование белков проводили в стерильном забуференном физиологическом растворе рН 7,2-7,4 в соотношении 1:10 при температуре +4°С в течение 18 часов. Белково-антигенный экстракт получали центрифугированием при 12 тыс. об/мин в течение 15-20 минут, хранили в замороженном состоянии при температуре -10°С и использовали для иммунизации животных.
Контроль на стерильность. Для обнаружения контаминации бактериями, грибами и микоплазмами пробу белково-антигенного экстракта из личинок анизакид высевали на МПА, МПБ и МППБ по одной пробирке, для выявления грибковой контаминации на агар Сабуро в две чашки Петри. На микоплазменную контаминацию пробу высевали на универсальной плотной среде для выделения микоплазм (ООО «Научно-производственная фирма Диагност-Мед») согласно инструкции в две чашки Петри.
Контроль вели в течение трех пассажей на этой же среде. Посевы на МПА, МПБ и МППБ выдерживали в течение 10 суток при +37°С, посевы на полужидком агаре - 14 дней при +37°С и на среде Сабуро - 15 дней при +23°С. При обнаружении хотя бы одного из контаминантов партию белково-антигенного экстракта считали нестерильной и в дальнейшем работе не использовали.
Определение содержания белка
Концентрацию белка в полученном белково-антигенном экстракте определяли на биохимическом полуавтоматическом анализаторе StatFax 1904+ (AWARENESS technology inc) с использованием набора реактивов Spinreact S.A. согласно инструкции при длине волны 540 нм. В качестве контроля использовали фосфатно-солевой буферный раствор.
Получение гипериммунной сыворотки к белково-антигенному экстракту из личинок 3-й стадии A.simplex.
Гипериммунную сыворотку получали иммунизацией кроликов белково-антигенным экстрактом из личинок 3-й стадии A.simplex. Кроликам породы серый великан живой массы 3 кг внутримышечно вводили возрастающие дозы указанного экстракта в комплексе с полным адъювантом Фрейнда (Диаэм, США) по методике Бережко В.К. и др. (1), по схеме три цикла трехдневной иммунизации с трехдневными перерывами. Затем через 28 дней проводили реиммунизацию для повышения активности гипериммуных сывороток. Общая доза введенного экстракта по белку составила 10,0 мг/животное. Кровь для приготовления сыворотки получали на 7-9-й день после реиммунизации и хранили при -10°С.
Проведение реакции иммунодиффузии в агаровом геле.
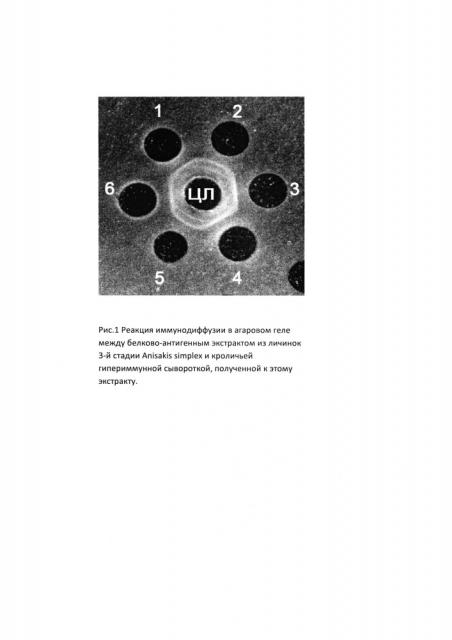
Перед проведением основного эксперимента проверяли активность полученных гипериммунных сывороток в реакции иммунодиффузии (РИД) в 1,2%-ном агаровом геле (Difco) на физиологическом растворе (3) в штампе «семерка» (Приложение), где в центральную лунку (ЦЛ) вносили белково-антигенный экстракт из личинок 3-й стадии A.simplex, в периферийные (лунки 1-6) гипериммунные сыворотки, полученные от иммунизированных кроликов. В результате, во всех случаях мы получили четкие полосы преципитации, свидетельствующие о достаточной активности полученных нами гипериммунных сывороток (рис. 1).
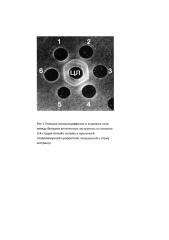
Пример 1. Для обнаружения антигена личинок анизакид в мышечной ткани рыб провели РИД в варианте «четверка» с использованием жидкости, полученной при размораживании мышечной ткани инвазированной анизакидами путассу (лунка 1) и гипериммунную сыворотку к белково-антигенному экстракту личинок 3-й стадии A.simplex (лунка ЦЛ). В результате между этими компонентами реакции проявилась четкая полоса преципитации (рис. 2). Полученный положительный результат подтверждает возможность попадания соматических и эксреторно-секреторных продуктов гельминтов в мышечную ткань рыбной продукции, что может вызвать патологические изменения желудочно-кишечного тракта при продолжительном употреблении такой продукции. В лунке 3 (рис. 2) находится жидкость незараженной анизакидами рыбной продукции, реакция между реагентами отрицательная.
Пример 2. Аналогичную реакцию провели с жидкостью, полученной при размораживании мышечной ткани инвазированного анизакидами минтая, (лунка 2) и той же гипериммунной кроличьей сывороткой (лунка ЦЛ) (рис. 2) В результате проявившаяся полоса преципитации между этими реагентами также показала идентичность с таковой, проявленной между гипериммунной кроличьей сывороткой и жидкостью, полученной от зараженной анизакидами путассу (лунка 1). Эти примеры являются убедительным доказательством возможности использования РИД с гипериммунной сывороткой к белково-антигенному экстракту личинок 3-й стадии A. simplex и жидкости, получаемой при размораживании рыбной продукции, для ветеринарно-санитарной экспертизы морепродуктов на пораженность анизакидами.
Источники информации
1. Бережко В.К. Иммунохимический анализ соматического экстракта из половозрелых Dirofilaria immitis / В.К. Бережко, К.А. Хайдаров, И.С. Дахно, Е.П. Шкурка // Матер. докл. научн. конф. «Теория и практика борьбы с паразитарными болезнями». - 2008. - вып. 9. - С. 69-73.
2. Горохов В.В., Сергиев В.П., Романенко Н.А. // Мед. паразитол. - 1998. - №4. - С. 50-54.
3. Гусев А.И. К технике постановки реакции микропреципитации в агаре. / А.И. Гусев, В.С. Цветков // Лаб. Дело. - 1961. - №2. - С. 43-45.
4. Добряков Е.Ю. Анизакидоз у людей в Приморском крае / Е.Ю. Добряков, А.В. Ермоленко // Мед. паразитол. и паразит. болезни. – 2008. - №4. - С. 11-14.
5. Довгалев А.С., Сергиев В.П., Коваленко И.М. и др. // Рыб. хоз-во. Сер.: Аквакультура: Информпакет. Рыбы как переносчики болезней человека и животных. - 1999. - Вып. 1. - С. 14-33.
6. Карманова И.В. О зараженности лососевых рыб водоемов Камчатки нематодами рода Anisakis / И.В. Карманова, Г.П. Линова // Мед. паразитол. и паразит, болезни - 2002. - №3. - С. 19-21.
7. Козлов С.С., Лобзин Ю.В. Руководство и атлас по паразитарным болезням человека (Multimedia resources on CD-ROM): (170 MБ). - Москва. - 2005.
8. Поздняковский B.M., Рязанова О.А., Каленик Т.К., Дацун В.М. Экспертиза рыбы, рыбопродуктов и нерыбных объектов водного промысла. Качество и безопасность. - Сибирское университетское издательство. - Новосибирск. - 2005. - 309 с.
9. Сапунов А.Я. Влияние свободных и связанных аминокислот, летучих органических компонентов на качество и безопасность рыбы разных видов при анизакидозе / А.Я. Сапунов, М.Е. Дубинина, Н.Н. Гугушвили, Т.А. Инюкина, О.Б. Петрик, К.В. Синецкий // Матер.докл. научн. конф. «Теория и практика борьбы с паразитарными болезнями», выпуск 11. - М. - 2010. - С. 401-405.
10. Asaishi К. Studies on the etiologic mechanism of anisakiasis / K. Asaishi, C. Nishino, M. Totsuka, H. Hayasaka, T. Suzuki // Gastroenterol. Jpn. - 1980. - Vol/15. - P. 128-134.
11. Deardorff T.L. Invasive anisakiasis. A case report from Hawaii / T.L. Deardorff, T. Fukumura, R.B. Raybourne // Gastroenterology. - 1986. - Vol. 90. - P. 1047-1050.
12. Desowitz R.S. The allergosorbent test (RAST) for the serological diagnosis of human anisakiasis. / R.S. Desowitz, R.B. Raybourne, H. Ishikura, M. Kliks // Trans. R. Soc. Trop. Med. Hyg. - 1985. - Vol. 79. - P. 256-259.
13. Kobayashi A. Probable pulmonary anisakiasis accompanying pleural effution / A. Kobayashi, M. Tsuji, D.L. Wilbur // Am. J. Trop. Med. Hyg. - 1985. - Vol. 34. - P. 310-313.
14. Castan B. Degestiv anisakiasis: clinical manifestations and diagnosis according to localization / B. Castan, F. Borda et al // Rev. Esp / Enferm Dig 2002 Aug: 94 (8). - 463-472.
15. Mudry J. Anisakiasis humaine: 5 cas dans le nord de la France. / J. Mudry, P. Lefebvre, E. Dei-Cas, A. Vernes, J. Poirriez, M. Debat, R. Marti, P. Binot, A. Cortot // Gastroenterol. Clin. Biol. - 1986. - Vol. 10. - P. 83-87.
16. Nawa Y. Sushi delights and parasites: the risk of fishborne and footborne parasitic zoonoses in Asia./ Y. Nawa, C.Hatz, J. Blum // Clin Infect. Dis. - 2005. - V. 41, №9. - P 1297-1303.
17. Oshima T. Anisakis and anisakiasis in japan and adjacent areas. / T. Oshima // Prog. Med. Parasitol. Jpn. - 1972. - Vol. 4. -P. 305-393.
18. Roland Samantha К. Is it safe to eat sushi? Bowel obstruction related to anisakiasis. / Samanta K. Roland, William B. Keeling, Sivaselvi Gunasekaran, David H. Shapiro // Clinicalobservations. - 2008.
19. Sakanari J.A. Intestinal anisakiasis. A case diagnosed by morphologic and immunologic methods. / J.A. Sakanari, H.M. Loinaz, T.L. Deardorff, R.B. Raybourne, J.H. McKerrow, J.G. Frierson // Am. J. Clin. Pathol. - 1988. - Vol. 90. - P. 107-113.
20. Smith J.W. Ulcers associated with larval Anisakis simplex В Nematoda: (Ascaridoidea) in the for stomach of harbor porpoises phocoena phocoena (L) // Can J. Zool. - 1989. - v. 67, №9. - p. 2270-2276.
21. Solas М.Т. / Anisakis antigens detected in fish muscle infested with Anisakis simplex L3. |/ Solas M.T, Garcia M.L., Rodriguez-Mahillo A.I., Gonzalez-Munoz., De Las Heras C., Tejada M. // Journal of Food Protection. - 2008. - Vol. 71. - №6. - P. 1273.
22. Sugimachi K. Acute gastric anisakiasis / K. Sugimachi, K. Inokuchi, T. Ooiwa, T. Fujino, Y. Ishii // J. Am. Med. Assoc. - 1985. - Vol. 253. - P. 1012-1013.
23. Suzuki T. Anisakiasis: preparation of a steble antigen for indirect fluorescent antibody test./ T. Suzuki, Y. Sato, T. Yamashita, M. Otsuru // Exp. Parasitol. - 1974. - Vol. 35. - P. 418-424.
Способ иммунологического определения антигенов анизакид в мышечной ткани рыб, включающий проведение реакции иммунодиффузии в агаровом геле, отличающийся тем, что реакцию, проявляющуюся в виде полосы преципитации, проводят между гипериммунной сывороткой к белково-антигенному экстракту из личинок 3-й стадии Anisakis simples и жидкостью, образующейся при разморозке мышечной ткани рыб.