Малые молекулы с ngf-подобной активностью, обладающие антидиабетическими свойствами
Иллюстрации
Показать всеГруппа изобретений относится к области фармакологии и медицины и касается применения оригинальных димерных дипептидов, созданных на основе структуры β-изгиба 4-й петли факторов роста нервов крысы и человека, соответственно ГК-2 Rat(r) (гексаметилендиамид бис-(N-моносукцинил-глутамил-лизина)) и ГК-2 Human(h) (гексаметилендиамид бис-(N-моносукцинил-глицил-L-лизина)), в качестве антидиабетических средств. Группа изобретений обеспечивает ослабление гипергликемии при лечении диабета как первого, так и второго типа. 2 н.п. ф-лы, 2 табл., 6 ил., 3 пр.
Реферат
Предложено применение оригинальных димерных дипептидов, созданных на основе структуры β-изгиба 4-й петли факторов роста нервов крысы и человека, соответственно ГК-2 Rat(r) (гексаметилендиамид бис-(N-моносукцинил-глутамил-лизина)) и ГК-2 Human(h) (гексаметилендиамид бис-(N-моносукцинил-глицил-L-лизина)), в качестве антидиабетических средств. Предполагаемый NGF-подобный механизм действия ГК-2(r) и ГК-2(h) подразумевает защиту бета-клеток поджелудочной железы и стимуляцию секреции инсулина в ответ на гипергликемию. Антидиабетических препаратов с NGF-подобным механизмом действия в настоящее время нет. Однако такие препараты могли бы быть использованы для лечения сахарного диабета как 1-го, так и 2-го типа. Показано, что введение крысам токсина стрептозотоцина в дозе 40 мк/кг (однократно внутрибрюшинно) ведет к развитию таких признаков диабета, как повышение содержания глюкозы в крови и потеря массы тела. Хроническое комбинированное (профилактическое и лечебное) внутрибрюшинное (в/б) введение ГК-2(r) в дозе 0,5 мг/кг или ГК-2(h) в дозе 0,1 мг/кг ослабляет выраженность перечисленных проявлений диабета. Кроме того, на модели стрептозотоцинового диабета было выявлено антикоагулянтное действие ГК-2(r), которое имеет большую значимость, поскольку при сахарном диабете отмечается нарушение микроциркуляции крови и повышена опасность тромбообразования. Полученные данные позволяют считать целесообразным применение ГК-2(r) и ГК-2(h) в качестве антидиабетических средств, а также в качестве молекулярных инструментов для изучения вовлеченности NGF в патогенез диабета.
Область изобретения
Изобретение относится к медицине, в частности к фармакологии, и касается средств для предупреждения и лечения диабета.
Уровень техники
Сахарный диабет (СД) занимает 3-е место среди основных причин смертности населения в большинстве стран мира. По оценкам ВОЗ в настоящее время диабетом страдает более 180 млн человек, а по статистике, приводимой Shaw J.Е., 220 млн человек во всем мире страдают данной патологией [Спасов А.А. и соавт. // Экспер. и клин. фармакол. 2011. V.74. №11. С.14-6]. Прогнозируется, что к 2030 г. этот показатель может удвоиться [Shaw J.E., Sicree R.A. and Zimmet P.Z. // Diabetes Research and Clinical Practice. 2011. V.87. №1. Р.4-14]. Темпы нарастания распространенности этого заболевания носят угрожающий характер. Число больных диабетом в России по данным официальной статистики с показателя 8 миллионов в 1994 г. может возрасти к 2020 г. до 18 млн.
В настоящее время предпочтение при лечении диабета отдается препаратам из групп производных сульфонилмочевины [Ashcrof F.M., Reimann F. // Проблемы эндокринологии. 2001. №6. С.43-47], бигуанидам [Salpeter S.R., Buckley N.S., Kahn J.A. and al. // Am J Med. 2008. №121. P.149-157], производным тиазолидиндиона [Аметов A.C., Сокарева Е.В. // РМЖ. 2008. №28. С.1858]. Все большее значение приобретают препараты из группы ингибиторов дипептидилпептидазы - 4 (ДПП - 4), действие которых основано на повышении концентрации инкретинов, способствующих синтезу инсулина [Pratley R.E., Salsali A. //Curr. Med. Res. Opin. 2007. V.23. №4. P.919-931; Havale S.H. // Bioorg. Med. Chem. 2009. V.17. №5. P.1783-802].
Широкий спектр побочных эффектов и абсолютных противопоказаний ограничивает использование этих препаратов в клинической практике. Применение производных сульфонилмочевины лимитировано развитием вторичной резистентности к ним у 5-10% больных сахарным диабетом [Александров А.А. // Сахарный диабет: Consilium medicum. 2001. Т.1. №10. С.2-7]. Ограничение использования бигуанидов определяется возможностью развития лактоацидоза, а производных тиазолидиндиона - выявленной гепатотоксичностью [Forman L.M., Simmons D.A., Diamond R.H. // Ann Intern Med. 2000. V.132. №2. P.118-21] и повышением риска развития кардио-васкулярной патологии [Rohatgi A., McGuire D.K. // Cardiovasc Drugs Ther. 2008. V.22. №3. Р233-4]. Применение ингибиторов ДПП-4 нередко сопровождается развитием артралгий на фоне увеличения содержания в крови мочевой кислоты, но основным фактором риска при их применении считается повышение частоты развития панкреатита и рака поджелудочной железы [Elashoff М., Matveyenko A.V., Gier В. et al. // Gastroenterology. 2011. V.141. №1 Р.50-6].
Все перечисленные факты свидетельствуют о необходимости создания новых высокоэффективных, безопасных противодиабетических препаратов, поскольку только расширение спектра антидиабетических средств позволит обеспечить максимальную компенсацию сахарного диабета с учетом индивидуальных особенностей каждого больного, улучшить качество жизни больных, снизить инвалидизацию, сохранить работоспособность больных диабетом, что имеет большое социальное и экономическое значение для общества.
Высоким терапевтическим потенциалом для лечения СД и его осложнений обладает фактор роста нервов (NGF - nerve growth factor). Известно, что NGF играет важную роль в дифференцировке и поддержке функционирования бета-клеток поджелудочной железы [Polak М., Scharfmann R., Seilheimer В. et al. // Prod. Natl. Acad. Sci. USA. 1993. V.90. №12. P.5781-85]. Бета-клетки поджелудочной железы синтезируют и секретируют NGF, который путем аутокринной регуляции стимулирует секрецию инсулина; синтез и секреция NGF бета-клетками усиливаются в ответ на повышение концентрации внеклеточной глюкозы [Rosenbaum Т., Sanches-Soto М.С., Hiriart М. // Diabetes. 2001. V.50. №8. P.1755-62]. NGF и инсулин, секретируемые бета-клетками, необходимы для их выживания. Эти свойства NGF - поддержание жизнеспособности и функционирования бета-клеток, а также способность стимулировать секрецию инсулина, определяют его возможный потенциал для лечения СД как 1-го, так и 2-го типа.
Дефицит нейротрофических факторов является одной из важных причин замедленной пролиферации P-клеток при диабете [Nielsen J.H., Galsgaard E.D., Moldrup А. et all. // Diabetes. 2001. V.50 №1. P.25-9]; с этим дефицитом связывают развитие таких осложнений диабета, как периферическая кардиопатия, нейропатия, ретинопатия, нефропатия и др [Han. Н.Е, Goss, Goins W.F., Lacomis D.et. all. //Diabetes. 2006. V.51. №7. P.2227-32]. На модели стрептозотоцинового диабета было показано, что генная терапия NGF препятствует развитию диабетической нейропатии у мышей [Goss J.R., Goins W.F., Lacomis D. et. al. // Diabetes. 2002. V.51. №7. P.2227-32], а при введении в форме глазных капель NGF препятствует диабетической дегенерации сетчатки глаза у крыс [Colafrancesco V., Coassin М., Rossi S., Aloe L. // Ann. 1st Super Sanita. 2011. V.47, №3: Р.284-9].
Клинические испытания NGF при его системном введении больным диабетической нейропатией были прекращены из-за развития значительных побочных эффектов (боль в месте введения) и слабой выраженности положительных эффектов такого лечения [Pittenger G., Vinik, А. // Experimental Diab. Res.2003. V.4. №4. P.271-85]. Применение нативной молекулы NGF в клинике ограничено широким спектром его биологической активности, неспособностью проникать через гематоэнцефалический барьер и фармакологической нестабильностью.
В ФГБУ «НИИ фармакологии имени В.В. Закусова» РАМН на основе структуры β-изгиба 4-й петли NGF крысы и человека были созданы оригинальные димерные дипептидные миметики, соответственно ГК-2(r) (гексаметилендиамид бис-(N-моносукцинил-L-глутамил-L-лизина)) [Середенин С.Б., Гудашева Т.А. // 2010. Патент РФ №2410392] и ГК-2(h) (гексаметилендиамид бис-(N-моносукцинил-глицил-L-лизина)).
Синтез ГК-2(h)
а) Синтез бис-(N-бензилоксикарбонил-Nε-трет-бутилоксикарбонил-лизил)-гексаметилендиамида, (Z-Lys(Boc)NH)2(CH2)6
Раствор 2,575 г (5.4 ммоль) Z-Lys(Boc)-OSu и 0.299 г (2.6 ммоль) гексаметилендиамина в 14 мл DMF перемешивали 4 ч при комнатной температуре, при этом образовывался мутный раствор. Реакционную смесь разбавляли 56 мл воды и оставляли на несколько часов. После затвердевания выпавший осадок отфильтровывали и промывали водой. После высушивания над P2O5 и получили 2,085 г (выход 96%) белого кристаллического продукта.
Rf 0.90(А), 0,93(Б), Тпл. 138-147, - 9,31 (с 0,29, этанол)
Спектр 1Н-ЯМР (ДМСО-d6): 1,05-1,69 (12H, м, 2 (CβН2, CγH2, CδH2) Lys; 8H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-; 1,35 18H, с,2 -С(СН3)3 Boc;), 2,87 (4Н, м, 2CεH2Lys), 3,01 (4H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 3,89 (2Н, м, 2CαHLys), 5,01 (4Н, с, 2OCH2, Z), 6,74 (2H, т, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 7,13-7,39 (10H, м, 2 C6H5 Z; 2Н, д, 2NНд Lys), 7,81 (2H, т, 2NHт Lys)
б) Синтез N-оксисукцинимидного эфира N-бензилоксикарбонил-глицина, Z-Gly-OSu.
К раствору 5,28 г (28 ммоль) Z-Gly-OH в 80 мл этилацетата добавляли 3,22 г (28 ммоль) HOSu и 6,36 г (28 ммоль) ДЦГК. Реакционную массу перемешивали при 10°C 2 ч. После исчезновения исходного вещества (ТСХ контроль) отфильтровали образовавшуюся дициклогексилмочевину. Растворитель удаляли в вакууме. Полученное масло перекристаллизовывали из смеси 3 мл петролейного эфира и 8 мл хлороформа. Получили 5,87 г (22,4 ммоль, 80%) продукта в виде белого кристаллического вещества. Физико-химические характеристики совпадают с описанными в литературе [Anderson G.W., Zimmerman J.Е. The use of esters of N-hydroxysuccinimide in peptide synthesis // J. Amer. Chem. Sco. - 1964. - 86, N9. - P.1839-1842].
в) Синтез бис-(Nε-трет-бутилоксикарбонил-лизил)-гексаметилендиамида, (Lys(Boc)NH)2(CH2)6
1,86 г (2,2 ммоль) (Z-Lys(Boc)NH)2(CH2)6 гидрировали в метаноле (25 мл) над 10% Pd/C (0,37 г) в течение 1 ч 25 мин при комнатной температуре. После исчезновения исходного вещества (ТСХ контроль) катализатор отфильтровывали, растворитель удаляли в вакууме. Полученное масло высушили над CaCl2 и парафином. Далее проводили высаживание смесью петролейного и диэтилового эфира (3:1) и отфильтровывали. Получили 0,99 г вещества в виде белого порошка (выход 78%).
Rf 0.48(A), 0,68(Б), Тпл. 70-75, 5,1 (с 1, этанол)
Спектр 1Н-ЯМР (ДМСО-d6): 1,11-1,65 (12Н, м,2 (CβH2, CγH2, CδH2) Lys; 8H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-; 18H, с, 2 -C(CH3)3 Boc;), 2,86 (4H, м, 2CεH2Lys), 3,04 (4Н, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 3,40 (2Н, м, 2CαH Lys), 6,73 (2H, т, 2NHт Lys), 7,78 (2H, т, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-)
г) Синтез гексаметнлендиамида бис-(N-бензилоксикарбонил-глицил-Nε-трет-бутилоксикарбонил-лизина), (Z-Gly-Lys(Boc)-NH-)2(CH2)6.
К раствору 0.90 г (1.6 ммоль) Lys(Boc)NH)2(CH2)6 в 6 мл DMF прикапывали при перемешивании раствор 1,103 г (3.8 ммоль) Z-Gly-OSu в 4 мл DMF и продолжали перемешивание 2 ч 10 мин при комнатной температуре (ТСХ контроль). Далее добавили 1,5 мл ДЭПДА и перемешивали еще 30 мин, после чего реакционную смесь разбавили 70 мл воды. Продукт и органические примеси экстрагировали хлороформом (3:1) и промывали поочередно 25 мл воды, 25 мл 2% H2SO4 и 25 мл 3% Na2CO3. Затем раствор сушили MgSO4 и отфильтровывали. После упаривания хлороформа получили продукт в виде смеси желтоватого масла с белыми кристаллами. Добавили 20 мл диэтилового эфира: при растирании шпателем продукт закристаллизовывался. Отфильтровывали эфир и получали 1,26 г (84%) белого порошка.
Rf 0.89(A), 0,95(Б), Тпл. 120-126, - 11,0 (с 0,1, этанол)
Спектр 1H-ЯМР (ДМСО-d6): 1,05-1,70 (12H, м, 2 (CβH2, CγH2, CδH2) Lys; 8H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-; 1,35 18Н, с, 2 -C(CH3)3Boc;), 2,85 (4Н, м, 2CεH2Lys), 3,00 (4H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 3,65 (4Н, д, 2CH2 Gly), 4,15 (2Н, м, 2CαH Lys), 5,03 (4H, с, 2OCH2, Z), 7,25 (2H, т, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 7,14-7,37 (10H, м, 2 C6H5 Z; 2Н, д, 2NHд Lys), 7,81 (2Н, т, 2NHт Lys)
д) Синтез бис-(глицил-Nε-трет-бутилоксикарбонил-лизил)-гексаметилендиамида, (Gly-Lys(Boc)NH)2(CH2)6
1,17 г (1,2 ммоль) (Z-Gly-Lys(Boc)NH)2(CH2)6 гидрировали в метаноле (20 мл) над 10% Pd/C (0,23 г) в течение 20 мин при комнатной температуре. После исчезновения исходного вещества (ТСХ контроль) катализатор отфильтровывали, растворитель удаляли в вакууме. Полученное масло высаживали диэтиловым эфиром (20 мл) и отфильтровывали. Вещество в виде белого порошка без дополнительной очистки отправляли на следующую стадию.
е) Получение гексаметилендиамида бис-(N-моносукцинил-глицил-Nε-трет-бутилоксикарбонил-лизина), (HOOC(CH2)2CO-Gly-Lys(Boc)-NH)2(CH2)6.
К раствору (Gly-Lys(Boc)NH)2(CH2)6 в 5 мл ДМФА добавили 0,24 г (2,4 ммоль) янтарного ангидрида. Реакционную смесь перемешивали при комнатной температуре 4 ч (ТСХ контроль). Реакционную смесь разбавляли 20 мл этилацетата и 15 мл H2O. При этом продукт переходил в водную фазу. К нему добавляли 5 мл 3% Na2CO3. Насыщали раствор 1,5 г Na2SO4 и прибавляли 15 мл бутанола и 10% H2SO4 до pH=3. Далее промывали 10% Na2SO4. Полностью упаривали растворитель. Остаток растирали с эфиром и отфильтровывали. Получили 0,872 г (0,984 ммоль) продукта в виде белого порошка (выход 82%).
Rf 0.80(A), 0,67(Б), Тпл. 86-92, - 10,4(с 1, этанол)
Спектр 1H-ЯМР (ДМСО-d6): 1,11-1,75 (12Н, м, 2 (CβH2, CγH2, CδH2) Lys; 8H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-; 1,35 18H, с, 2 -C(CH3)3Boc;), 2,36 (4H, м, 2 CH2 Suc), 2,72 (4H, м, 2CεH2 Lys), 2,96 (4H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 3,65 (4H, с, 2 CH2 Gly), 4,10 (2H, м, 2CαH Lys), 6,71 (2H, т, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 7,83 (2H, т, 2NHт Lys), 8,13 (2H, д, 2NHд Lys), 8,87 (2H, т, 2NHт Gly), 2 HOOC(CH2)2CO-обмениваются с HDO.
ж) Получение гексаметилендиамида бис-(N-моносукцинил-глицил-лизина), (HOOC(CH2)2CO-Gly-Lys-NH-)2(CH2)6).
Весь полученный (HOOC(CH2)2CO-GlyLys(Boc)-NH-)2(CH2)6 растворяли в уксусной кислоте и обрабатывали 3 мл 4M HCl/Dioxane. Через 40 мин растворитель декантировали, остаток промывали диэтиловым эфиром декантацией, растворяли в 5 мл воды и обрабатывали при перемешивании смолой Амберлит IRA-410 до стабилизации значения pH~5. Очистку проводили методом обращенно-фазовой С8 ВЭЖХ в градиенте 0-13% изопропанола в 0.1М уксусной кислоте. Соответствующие фракции собирали (ТСХ контроль), упаривали и сушили в вакууме. Лиофилизовали с помощью жидкого N2. перекристаллизовывали из смеси этилацетат-этанол (3:1). Получили 0,515 г (0,751 ммоль) (общий выход 29%) конечного продукта в виде белого порошка, Rf 0.14 (А), Rf 0.38 (Б), т.пл. 97-100°C, - 15.7° (с 1; вода).
Спектр 1H-ЯМР (ДМСО-d6): 1,06-1,85 (12H, м, 2 (CβH2, CγH2, CδH2) Lys; 8H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2- NH-; 1,35 18H, с, 2 -C(CH3)3Boc;), 2,26(4H, м, 2CH2 Suc), 2,84 (4H, м, 2CεH2 Lys), 3,05 (4H, м, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 3,69 (4H, с, 2 СН2 Gly), 4,10 (2H, м, 2CεH Lys), 7,65 (2H, т, -NH-CH2-CH2-CH2-CH2-CH2-CH2-NH-), 8,34 (2H, д, 2NHд Lys), 8,64 (2H, т, 2NHт Gly), 2 HOOC(CH2)2CO- обмениваются с HDO.
Пептид ГК-2 (r) продемонстрировал высокую NGF-подобную нейропротективную активность в наномолярных концентрациях в экспериментах in vitro [Гудашева Т.А., Антипова Т.А., Середенин СБ. // ДАН. 2010. Т.434, №4. С.549-52], а также проявил эффективность на in vivo модели инсульта мозга [Середенин С.Б., Силачев Д.Н., Гудашева Т.А. и др. Бюл. экспер. биол. 2011. Т.151. №5. С.518-521]. В экспериментах с использованием in vivo модели фокальной кортикальной ишемии выявлена также нейропротективная активность соединения ГК-2(h) [Гудашева Т.А., Романова Т.А., Шикова Ф.М., Котельникова СО. и др. // Экс и клин фарм. 2012 №10].
Было показано, что ГК-2(r), подобно нативной молекуле NGF, вызывает фосфорилирование специфических рецепторов TrkA и фосфорилирование Akt-киназы, участвующей в одном из внутриклеточных сигнальных каскадов, активируемых этими рецепторами [Gudasheva Т., Antipova Т., Seredenin S. // XXIInd International Symposium on Medicinal Chemistry. 2012. P.299]. Из литературы известно, что влияние NGF на поддержание жизнеспособности бета-клеток и секрецию ими инсулина опосредовано TrkA-рецепторами [Rosenbaum Т., Sanches-Soto М.С., Hiriart М. // Diabetes. 2001. V.50. №8. Р.1755-62; Navarro-Tableros, V., Sanches-Soto, М.С, Garcia, S., Hiriart, M. (2004). Autocrine regulation of single pancreatic beta-cell survival. Diabetes. Aug; 53(8): 2018-23]. Кроме того, известно, что в защите NGF бета-клеток от гибели участвует Akt-киназный сигнальный путь [Navarro-Tableros, V., Sanches-Soto, М.С., Garcia, S., Hiriart, M. (2004). Autocrine regulation of single pancreatic beta-cell survival. Diabetes. Aug; 53(8): 2018-23].
Таким образом, полученные данные позволяют предположить, что ГК-2(r) и ГК-2(h) действуют по NGF-подобному механизму и могут быть эффективны в качестве антидиабетических средств.
Сущность изобретения
Сущность изобретения состоит в применении ГК-2(r) и ГК-2(h) в качестве антидиабетических средств и в качестве инструментов изучения молекулярных механизмов вовлеченности NGF в патогенез сахарного диабета.
Цель изобретения - разработка препаратов для лечения сахарного диабета на основе NGF, способных замедлять прогрессирование данного заболевания. Эта цель была достигнута путем исследования эффектов ГК-2(r) и ГК-2(h) на модели стрептозотоцинового диабета.
Техническим результатом изобретения является антидиабетический и гипокоагулянтный эффекты ГК-2(r) и ГК-2(h).
Изобретение иллюстрируют следующие примеры
Известно, что в эксперименте развитие гипергликемии удается воспроизвести введением диабетогенных токсинов аллоксана и стрептозотоцина (СТЗ), оказывающих прямое цитотоксическое действие на β-клетки поджелудочной железы. Преимущество стрептозотоцина по сравнению с аллоксаном состоит в относительно более высокой метаболической устойчивости, большей длительности гипергликемии, менее выраженном ацидозе и летальности экспериментальных животных [Szkudelski Т. // Minireview Physiol. Res. 50: 536-546, 2001]. Стрептозотоциновый диабет, являясь общепринятой экспериментальной моделью сахарного диабета, позволяет смоделировать как постепенно развивающуюся дисфункцию бета-клеток поджелудочной железы, так и нарушение толерантности к глюкозе и развитие связанных с ним расстройств [Хейфец И.А., Спасов А.А., Воронкова М.П. и др. // Бюл. экспер. биол. 2012. Т. 153. №1. - С.62-4].
Опыты проведены на полученных из питомника «Столбовая» РАМН самцах белых крыс Вистар массой 300-380 г (в начале эксперимента). Животных содержали в условиях вивария ФГБУ «НИИ фармакологии имени В.В. Закусова» РАМН по 10 особей в клетке при свободном доступе к стандартизированному корму и воде. Исследования проводили с 1000 до 1400. Соблюдались этические правила гуманного обращения с животными, изложенные в директивах Совета Европейского сообщества 86/609/ЕЕС.
Пример 1. Эффект комбинированного (профилактического и лечебного) введения ГК-2(r) на модели стрептозотоцинового диабета.
Эксперимент выполнен на 38 крысах, разделенных случайным образом на 3 группы: 1-я - пассивный контроль (n=12), 2-я - активный контроль (n=13), 3-я - опытная группа (n=13). 1. Животным группы пассивного контроля (Контроль) ежедневно вводили дистиллированную воду (ДВ) в течение 14 дней, затем однократно физиологический раствор (ФР), далее продолжалось введение воды в течение последующих 28 дней. 2. Животным группы активного контроля (СТЗ) в течение 14 дней вводили ДВ, затем однократно СТЗ (Sigma) в дозе 40,0 мг/кг, растворенный в ФР, далее продолжалось введение ДВ в течение последующих 28 дней. 3. Животным опытной группы (СТЗ+ГК-2r) профилактически ежедневно вводили ГК-2(r) в дозе 0,5 мг/кг, растворенный ex tempore в ДВ, затем однократно был введен СТЗ, и далее в течение 28 дней продолжали введение ГК-2(r) в той же дозе. Все вещества вводили внутрибрюшинно из расчета 2 мл/кг.
Определение уровня глюкозы в крови, взятой из хвостовой вены (глюкометр One Touch Ultra, USA), проводили непосредственно до введения СТЗ, а также на 3-й, 17-е и 28-е сутки после введения СТЗ. Животных взвешивали каждые 3-4 дня.
Для оценки статистической значимости межгрупповых различий применяли тест Краскела-Уоллиса с последующим пост-хок сравнением выборок с использованием U теста Манна-Уитни и точный критерий Фишера. Результаты считались достоверными при p<0,05. Данные представляли в виде медиан выборок и интерквартильных интервалов.
Терапевтический эффект дипептида ГК-2 рассчитывали по формуле:
где гл. СТЗ - уровень глюкозы в крови в группе СТЗ, гл. (СТЗ+ГК-2r) - уровень глюкозы в крови в группе (СТЗ+ГК-2r), гл. вода - уровень глюкозы в крови в группе пассивного контроля.
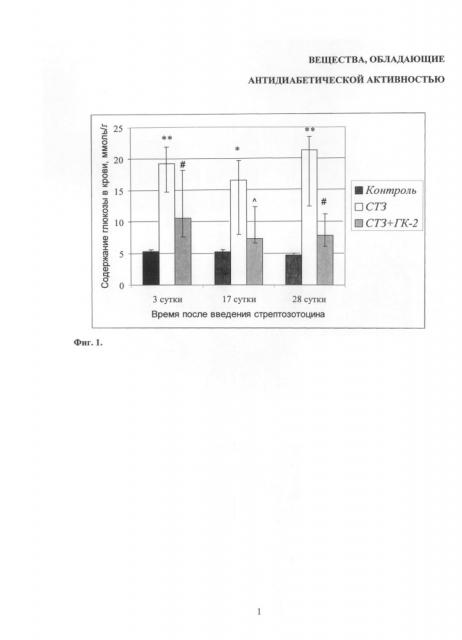
В течение 2-х недель до введения СТЗ межгрупповых различий по массе тела и содержанию глюкозы в крови не наблюдалось, то есть хроническое введение ГК-2(r) здоровым крысам не влияло на данные показатели.
Согласно литературным данным, содержание глюкозы более 13-15 ммоль/л рассматривается как показатель диабета [Kuhada A., Bishnoia М., Tiwaria V. et al. // Pharmacology Biochemistry and Behavior. 2009. V.92. №2. P.251-259]. В наших экспериментах через 3 дня после введения СТЗ отмечалось повышение содержания глюкозы в венозной крови до 19,3 ммоль/л (медиана выборки). При тестировании через 14 и 28 дней после введения СТЗ гипергликемия в группе активного контроля сохранялась (тестирование в более поздние сроки в данных экспериментах не проводилось). На 3-и сутки после введения СТЗ ГК-2(r) достоверно снижал содержание глюкозы в крови с терапевтическим эффектом 60%. На 17 сутки после введения СТЗ ГК-2(r) снижал уровень глюкозы в крови более выраженно - терапевтический эффект ГК-2(r) составлял 80%.
На 28-е сутки после введения СТЗ антигипергликемический эффект ГК-2(r) также составлял 80% (Фиг.1. Антигипергликемическое действие ГК-2r при комбинированном лечебно-профилактическом введении).
Сравнение ГК-2(r) с применяющимися в настоящее время антидиабетическими препаратами показало, что ГК-2(r) превосходит по эффективности гипогликемического действия некоторые из них, такие как глибенкламид, и сравним с эффектом гликлазида и диабенола [Erejuwa О.О., Sulaiman S.A., Wahab M.S. et. al. // International Journal of Applied Research in Natural Products. 2011. V.4. №2. P.1-10; Tahara A., Matsuyama-Yokono A., Nakano R. et. al, II Basic. Clin. Pharmacol. Toxicol. 2008. V.103. №6. P.560-8; Анисимова B.A., Балаболкин М.И., Вдовина Г.П. и др. // Патент РФ №2386634. 2010] (Табл.1).
| Таблица 1 | ||
| Сравнение гипогликемического действия дипептида ГК-2(r) и некоторых применяющихся в медицине антидиабетических препаратов на модели стрептозотоцинового диабета у крыс. Гипогликемическое действие оценивали на основе измерения содержания глюкозы в крови при хроническом лечебном введении препарата (А) или на основе теста толерантности к глюкозе при однократном введении препарата (Б). | ||
| Название препарата | Режим введения | Терапевтический эффект гипогликемического действия |
| ГК-2(r) | 0,5 мг/кг, в/б, ежедневно в течение 4 недель | 80% (А) |
| Глибенкламид | 0,6 мг/кг, per os, ежедневно в течение 4 недель | 32% (А) |
| (Erejuwa О.О., Sulaiman S.A., Wahab M.S. et. al. // International Journal of Applied Research in Natural Products. 2011. V.4. №.2. P.1-10) | ||
| Воглибоз | 1,0 мг/кг, per os, за 30 мин до геста | 40% (Б) |
| (Tahara A., Matsuyama-Yokono A., Nakano R. et. al. // Basic. Clin. Pharmacol. Toxicol. 2008. V. 103. №6. P.560-8) | ||
| Метформин | 1000,0 мг/кг, per os, за 30 мин до теста | 60% (Б) |
| (Tahara A., Matsuyama-Yokono A., Nakano R. et. al. // Basic. Clin. Pharmacol. Toxicol. 2008. V.103. №6. P.560-8) | ||
| Гликлазид | 50,0 мг/кг, per os, за 2 ч до теста | 70% (Б) |
| (Анисимова B.A., Балаболкин М.И., Вдовина Г.П. и др. // Патент РФ №2386634. 2010) | ||
| Диабенол | 25,0 мг/кг, per os, за 2 ч до теста | 85% (Б) |
| (Анисимова В.А., Балаболкин М.И., Вдовина Г.П. и др. // Патент РФ №2386634. 2010) |
Важным показателем диабетогенного эффекта СТЗ является потеря массы тела. Дипептид ГК-2(r) полностью препятствовал снижению прироста массы тела крыс (Фиг.2. Влияние ГК-2r на 4-недельный прирост массы тела крыс в условиях стрептозотоцинового диабета).
Таким образом, в этих экспериментах показана высокая эффективность ГК-2(r) при комбинированном лечебно-профилактическом введении.
Пример 2. Эффект комбинированного (профилактического и лечебного) введения ГК-2(h) на модели стрептозотоцинового диабета.
Эксперименты выполнены на 38 крысах, разделенных случайным образом на 3 группы: 1-я - пассивный контроль (n=12), 2-я - активный контроль (n=13), 3-я - опытная группа (n=13).
1. Животным группы пассивного контроля (Вода) ежедневно вводили ДВ в течение 14 дней, затем однократно ФР, далее продолжалось введение ДВ в течение последующих 28 дней.
2. Животным группы активного контроля (СТЗ) в течение 14 дней вводили ДВ, затем однократно СТЗ в дозе 40,0 мг/кг, растворенный в ФР, далее продолжалось введение ДВ в течение последующих 28 дней.
3. Животным опытной группы (СТЗ+ГК-2(h)) профилактически ежедневно вводили ГК-2(h) в дозе 0,1 мг/кг, растворенный ex tempore в дистиллированной воде, затем однократно был введен СТЗ, и далее в течение 28 дней продолжали введение ГК-2(h) в той же дозе. Все вещества вводили внутрибрюшинно из расчета 2 мл/кг.
Определение уровня глюкозы в крови, взятой из хвостовой вены (глюкометр One Touch Ultra, USA), проводили непосредственно до введения СТЗ, а также на 3-й, 17-е и 28-е сутки после введения СТЗ. Животных взвешивали каждые 3-4 дня.
Для оценки статистической значимости межгрупповых различий применяли тест Краскела-Уоллиса с последующим пост-хок сравнением выборок с использованием U теста Манна-Уитни. Данные на рисунках представлены в виде средних значений и стандартной ошибки средней (M±SEM). Результаты считались достоверными при p<0,05.
Для характеристики динамики антигипергликемического эффекта ГК-2(h) были рассчитаны средние значения выборок уровня глюкозы в группах и по ним вычислялся относительный показатель терапевтического эффекта (Тэ) по формуле:
где гл. СТЗ - уровень глюкозы в крови в группе СТЗ, гл. (СТЗ+ГК-2h) - уровень глюкозы в крови в группе (СТЗ+ГК-2h), гл. вода - уровень глюкозы в крови в группе пассивного контроля.
До введения СТЗ статистически значимых различий между группами по уровню глюкозы не наблюдалось, т.е. ГК-2(h) не влияет на содержание глюкозы в крови у здоровых животных. Введение СТЗ вызвало выраженное повышение глюкозы в крови. Статистически значимые различия между группами активного и пассивного контролей отмечались на всех сроках наблюдения: через 3 дня после введения СТЗ эти показатели составляли 17,9±1,6 ммоль/л при уровне глюкозы для крыс группы пассивного контроля 5,4±0,1 ммоль/л, p<0,05 (Фиг.3А. Антигипергликемическое действие ГК-2b при комбинированном лечебно-профилактическом введении, 3-й день после введения СТЗ); через 17 дней - 14,6±1,7 ммоль/л по сравнению с 5,3±0,3 ммоль/л, p<0,05 (Фиг.3Б. Антигипергликемическое действие ГК-2h при комбинированном лечебно-профилактическом введении, 17-й день после введения СТЗ). Содержание глюкозы в крови крыс на 17-й день после введения СТЗ) и через 28 суток - 19,±2,5 ммоль/л по сравнению с 4,8±0,1 ммоль/л; p<0,05 (Фиг.3В. Антигипергликемическое действие ГК-2h при комбинированном лечебно-профилактическом введении, 28-й день после введения СТЗ). Поскольку содержание глюкозы более 13-15 ммоль/л рассматривается как показатель диабета [Shaw J.Е., Sicree R.А. and Zimmet P.Z. // Diabetes Research and Clinical Practice. 2010. V.87. №1, P.4-14], можно заключить, что в этом эксперименте был воспроизведен известный гипергликемический эффект СТЗ.
Комбинированное (профилактическое и терапевтическое) введение ГК-2(h) снижало выраженность гипергликемии уже через 3 дня после введения СТЗ (14 дней профилактики), когда уровень глюкозы в крови составлял 14,0±1,9 ммоль/л; p<0,05 (Фиг.3А.). Оно имело место также через 17 дней (11,6±1,7 ммоль/л) (Фиг.3Б.) и 28 дней терапии (12,8±2,3 ммоль/л; p<0,05 по сравнению с группой СТЗ) (Фиг.3В). Расчет динамики относительного показателя антигипергликемического эффекта ГК-2 свидетельствует о постепенном нарастании его величины в течение срока наблюдения.
В полном соответствии с литературными данными [Han Н.Е., Goss J.R., Goins W.F., Lacomis D. et. all. // Diabetes. 2006. V.51. №7. P.2227-52; T. Skudelski // Physiol. Res. 2001. V.50. №6. P.536-46] введение СТЗ в экспериментах приводило к уменьшению массы тела крыс группы активного контроля, в то время как в группе пассивного контроля имело место ее постепенное нарастание на всех этапах измерения. Вычисление разницы массы тела, Δ(г), между таковой в день введения СТЗ и в последующие дни показало следующие результаты (Фиг.4. Влияние ГК-2h на 4-недельный прирост массы тела крыс в условиях стрептозотоцинового диабета): на 4-й день в группе пассивного контроля она составляла +6,2±1,8 г, в группе активного контроля -16,6±2,7 г (p<0,05); на 17-е сутки +23,6±11,9 г и -14,0±8,5 г соответственно (p<0,05); а на 28-е сутки +34,5±5,2 г и -6,5±11,3 г соответственно (p<0,05).
Введение ГК-2(h) ослабляло вызванное СТЗ снижение массы тела крыс: на 4-й день показатель Δ составлял -11,6±2,6 г (p<0,05 по сравнению с группой активного контроля), на 17-й день -3,2±1,7 г (p<0,05), а на 28-й день наблюдался противоположный эффект - крысы стали набирать вес, показатель Δ составил +7,8±2,3 г (Фиг.4).
Таким образом, показано антидиабетическое действие низкомолекулярных миметиков NGF крысы и человека: ГК-2(r) и ГК-2(h). Способность NGF поддерживать жизнеспособность бета-клеток, защищать их от повреждения и стимулировать секрецию инсулина в ответ на повышение концентрации глюкозы опосредована TrkA рецепторами [Rosenbaum Т., Sanches-Soto М.С., Hiriart М. // Diabetes. 2001. V.50. №8. P.1755-62]. Кроме того, известно, что в защите NGF бета-клеток от гибели участвует Akt-гкиназный сигнальный путь [Navarro-Tableros, V., Sanches-Soto, М.С., Garcia, S., Hiriart, M. (2004)]. Было показано, что ГК-2(r) активирует TrkA рецепторы [Гудашева Т.А., Антипова Т.А., Середепин СБ. // ДАН. 2010. Т.434, №4. С.549-52], а также стимулирует фосфорилирование Akt-киназы, вовлеченной в передачу сигнала от этих рецепторов [Gudasheva Т., Antipova Т., Seredenin S. // XXIInd International Symposium on Medicinal Chemistry. 2012. P.299]. Эти данные позволяют предположить, что ГК-2(r) оказывает антидиабетическое действие по NGF-подобному механизму. ГК-2(h), аналогично миметику крысиного NGF, ГК-2(r), ослабляет гипергликемию и препятствует снижению массы тела, вызванные введением СТЗ. Таким образом, можно предположить что ГК-2(h) также оказывает антидиабетическое действие по NGF-подобному механизму.
Таким образом, предполагаемый NGF-подобный механизм действия ГК-2(r) и ГК-2(h) подразумевает защиту бета-клеток поджелудочной железы и стимуляцию секреции инсулина в ответ на гипергликемию. Полученные результаты свидетельствуют о перспективности применения дипептидов ГК-2(r) и ГК-2(h) как антидиабетических препаратов, эффективных при СД как 1-го, так и 2-го типа.
Пример 3. Гипокоагуляционный эффект ГК-2(r)
Исследования выполнены на двух группах крыс-самцов Вистар весом 300-350 г, которым однократно внутрибрюшинно вводился СТЗ в дозе 40 мг/кг (группа активного контроля n=8), либо физиологический раствор (группа пассивного контроля, n=8). Эксперимент был проведен в условиях ex vivo: к плазме крови, взятой у животных обеих групп, добавляли ГК-2(r).
Кровь для исследования брали из яремной вены животных обеих групп при помощи шприца, содержащего 3,8% раствор цитрата натрия (соотношение 9:1) через 4, 10, 18 и 45 дней от начала эксперимента. С помощью глюкометра One touch Ultra (USA) измеряли концентрацию глюкозы, затем кровь центрифугировали в течение 10 минут при 2000 об/мин. Каждый образец полученной плазмы делили на 2 равные части (по 0,7 мл). К одной части плазмы крыс из группы активного контроля добавляли 0,035 мл дистиллированной воды (серия 1), к другой - 0,350 мл свежеприготовленного раствора пептида ГК-2(r) в дистиллированной воде в концентрации 10-5 М (серия 2). Аналогичным образом обрабатывали группу пассивного контроля (серии 3 и 4 соответственно). Все образцы инкубировали в течение 10 минут при 37°C. Затем в них определяли ряд показателей состояния гемостаза по расшифровке данных тромбоэластограммы (ТЭГ), записанной на тромбоэластографе фирмы Hellige. 0,735 мл плазмы крови, проинкубированной с водой или пептидом, помещали в кювету прибора, добавляли 0,030 мл 1,9%-го раствора хлорида кальция и производили запись. Полученные результаты позволяли оценить ряд параметров гемостаза (антикоагулянтную активность плазмы и свойства образующегося сгустка): r - время реакции, соответствующее тромбинообразованию, k - время начала образования сгустка, появления фибриновых нитей, ma - максимальная амплитуда и угол α (Фиг.5. Тромбоэластограмма). На основании этих параметров вычислялись следующие показатели: E - плотность сгустка , I и ci - индексы коагуляции, равные соответственно 160×tgα и ma/r+k. Фибринолитическую активность оценивали по времени лизиса сгустка эуглобулиновой фракции. Статистическая обработка полученных данных проводилась с помощью U теста Манна-Уитни.
Содержание глюкозы в крови у крыс группы пассивного контроля на протяжении всего эксперимента составляло 5,36±0,12 ммоль/л. У животных группы активного контроля через 4 дня после введения токсина уровень глюкозы был равным 20,0±1,6 ммоль/л, через 10 дней - 20,1±1,5 ммоль/л, через 18 дней - 20,8±1,3 ммоль/л, через 45 дней - 14,4±0,9 ммоль/л.
Ранее на модели диабета, вызванного введением СТЗ, было показано, что данный токсин вызывает гиперкоагуляцию [Hansen H.R., Wolfs J.L., Bruggemann L. et all. // Blood Coagul Fibrinolysis. Oct.; 18(7): 627-36 (2007)]. В нашем исследовании было обнаружено, что максимально выраженные изменения гемостаза (ускорение генерации тромбина, резкое возрастание индексов коагуляции при замедленном фибринолизе) развиваются через 10 дней после введения СТЗ, а к 45-му дню происходит постепенная нормализация показателей. На 4-й день эксперимента на фоне близких к норме показателей гемостаза добавление к плазме соединения ГК-2(r) вызывает лишь некоторое ускорение образования тромбина, которое нейтрализуется замедлением образования фибриновых нитей (Табл.2). На 10-й день эксперимента, в условиях ускоренного образования тромбина и, соответственно, повышения индексов коагуляции (ci и I) у диабетических крыс (серия 1), добавление к плазме соединения ГК-2(r) (серия 2) ведет к замедлению процесса тромбинообразования, снижению индексов коагуляции и ускорению фибринолиза. На 18-й день гипокоагуляционный эффект ГК-2(r) частично сохраняется и выражается в более медленном образовании тромбина и фибрина, почти в двухкратном снижении плотности сгустка и в полуторакратном - индекса коагуляции ci. Через 45 дней на фоне снижающейся гипергликемии гемостаз нормализуется и добавление к плазме соединения ГК-2(r) не сопровождается дополнительными изменениями показателей коагуляции (Фиг.6А. Влияние ГК-2h на индекс коагуляции плазмы крови крыс в условиях стрептозотоцинового диабета и в норме, группа активного контроля).
| Таблица 2 | |||||
| Сравнение показателей ТЭГ после добавления дистиллированной воды (серия 1) или ГК-2 (серия 2) к плазме, взятой у диабетических крыс. | |||||
| Сроки после СТЗ | R, мм | K, мм | E, ед | ci, ед | I, Ед |
| 4 дня | |||||
| Серия 1 | 6.33±0.88 | 2.67±1.67 | 157.80±33.22 | 7.98±2.05 | 282.70±101.80 |
| Серия 2 | 0.20±0.05* | 4.50±2.29 | 156.70±36.88 | 8.42±1.42 | 307.30±66.75 |
| 10 дней | |||||
| Серия 1 | 2.92±0,40 | 2.58±0.70 | 90,00±14.30 | 16.68±5.73 | 531.40±41.20 |
| Серия 2 | 4.29±0,80* | 2.58±0.92 | 80.16±14.37 | 7.11±1,00* | 329.50±34.95* |
| 18 дней | |||||
| Серия 1 | 2.33±0.75 | 4.08±0.90 | 149.10±28.30 | 9.19±1.18 | 328.90±21.60 |
| Серия 2 | 3.08±1.02 | 7.75±2.92* | 90.52±4.93* | 5.19±1.63* | 262.90±66.07* |
| 45 дней | |||||
| Серия 1 | 6,00±2.04 | 2.50±1.19 | 162.80 ± |