Способ идентификации и раздельного количественного определения танина и галловой кислоты при совместном присутствии в растительном сырье и фитопрепаратах без предварительного разделения
Иллюстрации
Показать всеИзобретение относится к области аналитической химии и касается способа идентификации и раздельного количественного определения танина и галловой кислоты при совместном присутствии в растительном сырье и фитопрепаратах без предварительного разделения. Сущность способа заключается в том, что навеску растительного сырья заливают нагретой до кипения водой, кипятят с обратным холодильником, извлечение процеживают, не дожидаясь охлаждения, в мерную колбу, доводят объем раствора, если необходимо, водой до метки. Далее измеряют оптическую плотность фильтрата, разведенного боратным буферным раствором с рН 9,0, относительно буфера при длинах волн 275±2 нм и 305±2 нм и рассчитывают содержание галловой кислоты и танина в пересчете на абсолютно сухое сырье в процентах. Использование способа позволяет повысить точность одновременного определения танина и галловой кислоты при совместном присутствии в растительном сырье и фитопрепаратах. 5 ил., 3 табл., 3 пр.
Реферат
Изобретение относится к аналитической химии, химико-фармацевтической промышленности, области фармакогнозии и фармацевтической химии и может быть использовано для контроля качества синтетических лекарственных препаратов, растительного сырья и фитопрепаратов на его основе.
Известен способ количественного определения суммы дубильных веществ (в том числе танина и галловой кислоты) в лекарственном растительном сырье методом перманганатометрии (метод Левенталя), включенный в ГФ XI издания и проект новой ОФС «Определение дубильных веществ в лекарственном растительном сырье» для ГФ XIII (Проект ОФС «Определение дубильных веществ в лекарственном растительном сырье»), основанный на способности дубильных веществ быстро окисляться в сильно разбавленном кислом растворе в присутствии индикатора - индигосульфокислоты. Однако метод имеет большое количество недостатков, таких как завышенность результатов определений (наряду с дубильными веществами происходит окисление и других групп биологически активных веществ); субъективность определения конца титрования по появлению золотисто-желтой окраски; сильная зависимость результатов от интенсивности перемешивания титруемого раствора и освещения; зависимость расхода перманганата калия от скорости титрования; неприемлемость применения единого пересчетного коэффициента для растительного сырья, содержащего танино-катехиновую смесь (показано, что в зависимости от исследуемых объектов он может составлять от 0,00416 до 0,00735). Метод Левенталя следует признать приблизительным и возможным для полуколичественного определения.
Существует способ потенциометрического титрования, позволяющий не только оценить количественное содержание суммы дубильных веществ в лекарственном растительном сырье, но и дифференцировать конденсированные и гидролизуемые группы танинов (Е.И. Рябинина, Е.Е. Зотова, Н.И. Понамарева. Потенциометрическое определение дубильных веществ в лекарственном растительном сырье. - Фармация. - 2012. - №2. - С. 8-10). Однако к недостаткам метода следует отнести невозможность раздельного определения представителей дубильных веществ в общей сумме, содержащейся в растительных объектах.
Известен способ кулонометрического определения дубильных веществ в пересчете на танин в лекарственном растительном сырье, основанный на окислении дубильных веществ гипоиодит-ионами в фосфатном буферном растворе с рН 9,5 (С.Г. Абдуллина, Н.М. Агапова, Г.К. Зиятдинова и др. Кулонометрическое определение дубильных веществ в лекарственном растительном сырье. - Фармация. - 2010. - №4. - С. 13-15). Недостатком данного способа является использование дорогостоящего оборудования, реактивов, а также невозможность дифференцированно определить дубильные вещества в сумме, содержащейся в растительных объектах.
Известен также способ определения содержания танина и производных галловой кислоты в чае методом кондуктометрии (Патент 2127878 от 20.03.1999 г. Способ раздельного определения танина и катехинов (в пересчете на галловую кислоту) в чае. Авторы: Коренман Я.И., Новикова Н.А., Нифталиев С.И. Патентообл.: Воронежская государственная технологическая академия. Класс МКП: G01N 31/16). Недостатком данного способа является применение токсичных органических растворителей (изобутиловый спирт), а также использование цветной реакции с Fe (III), продуктом которой является нестабильное по окраске во времени окрашенное соединение.
Известен также способ количественного определения дубильных веществ в пересчете на танин в листьях скумпии и сумаха методом комплексонометрии после осаждения дубильных веществ солями цинка (ГОСТ 4564-79. Лист скумпии. Технические условия). Недостатком данного способа является длительность проведения анализа и трудность определения точки эквивалентности.
Спектрофотометрические методы, несмотря на невысокую селективность, по-прежнему находят широкое применение в анализе лекарственных препаратов благодаря сравнительной доступности, дешевизне, простоте в сочетании с хорошей точностью. Большинство лекарственных веществ обладает собственным светопоглощением в УФ-области. Главным достоинством спектрофотометрического анализа является его применимость для определения двух и более активных компонентов препаратов сложного состава без их предварительного разделения. В случае перекрывающихся спектров поглощения индивидуальных соединений используют метод Фирордта, включенный в Государственную фармакопею РФ (И.В. Власова, А.В. Шилова, Ю.С.Фокина. Спектрофотометрические методы в анализе лекарственных препаратов (обзор). - Заводская лаборатория. Диагностика материалов. - 2011. - №1. - Т. 77. - С. 21-28).
Описан способ количественного определения дубильных веществ спектрофотометрическим методом после реакции с реактивом Фолина-Чокальтеу в пересчете на галловую кислоту (Руководство по методам контроля качества и безопасности биологически активных добавок к пище. Руководство. Р 4.1.1672-03. - М. - 2004 г. - С. 94-95). Известен спектрофотометрический метод после реакции с реактивом Фолина-Чокальтеу, позволяющий определять сумму дубильных веществ в пересчете на пирогаллол и сумму дубильных веществ, не адсорбируемых кожным порошком, в пересчете на пирогаллол (Проект ОФС «Определение дубильных веществ в лекарственном растительном сырье»). Описаны способы спектрофотометрического количественного определения дубильных веществ, основанные на образовании окрашенных комплексов дубильных веществ с железо-тартратным реактивом (Н.А. Данилова, Д.М. Попов. Количественное определение дубильных веществ в корнях щавеля конского методом спектрофотометрии в сравнении с методом перманганатометрии. - Вестник ВГУ. Сер.: Химия. Биология. Фармация. - 2004. - №2. - С. 179-182). Недостатком данных методов является невозможность раздельного определения низко- и высокомолекулярных дубильных веществ.
Наиболее близким к предлагаемому является способ, заключающийся в том, что дубильные вещества определяют методом спектрофотометрии в пересчете на галловую кислоту (Руководство по методам контроля качества и безопасности биологически активных добавок к пище. Руководство. Р 4.1.1672-03. - М. - 2004 г. - С. 94-95). Недостатком данного способа является многократное разведение испытуемого образца, в результате которого концентрация дубильных веществ в растворе плохо определима. Также близким способом к предлагаемому является спектрофотометрический метод количественного определения дубильных веществ в пересчете на танин (К.Н. Разаренова, Е.В. Жохова. Сравнительная оценка содержания дубильных веществ в некоторых видах рода Geranium L. флоры северо-запада. - Химия растительного сырья. - 2011. - №4. - С. 187-192), заключающийся в измерении оптической плотности спирто-водной вытяжки из лекарственного растительного сырья при длине волны 275±2 нм. Данные способы не дают возможность раздельно определить содержание низкомолекулярных и высокомолекулярных дубильных веществ, что также можно отнести к недостаткам данных способов-аналогов.
Способом-прототипом является способ (Патент 2439568 от 12.10.2010 г. Способ определения дубильных веществ в растительном сырье. Авторы: Самылина И.А., Абоянц Р.К., Гринько Е.Н. Патентообл.: ГОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России. Класс МКЛ: G01N 33/52), в котором навеску сырья экстрагируют водой при кипячении, охлаждают, фильтруют, измеряют оптическую плотность аликвотной пробы при длине волны 277 нм и рассчитывают содержание суммы всех дубильных веществ по определенной формуле, далее к аликвотной пробе фильтрата добавляют 1% раствор коллагена в 1% уксусной кислоте, взбалтывают, фильтруют, измеряют оптическую плотность аликвотной пробы при длине волны 277 нм и рассчитывают содержание суммы всех дубильных веществ по определенной формуле. Способ позволяет получать более точные результаты определения дубильных веществ и дает возможность раздельного определения осаждаемых и не осаждаемых дубильных веществ в растительном сырье. Недостатком способа является невозможность определения дубильных веществ во всех видах лекарственного растительного сырья, так как водные извлечения некоторых видов не дают выраженного осадка при обработке раствором коллагена.
В научно-фармацевтической, медицинской и патентной литературе способов, позволяющих проводить идентификацию и количественное определение танина и галловой кислоты при совместном присутствии без предварительного разделения методом прямой спектрофотометрии с применением расчетного метода Фирордта, не обнаружено.
Задача изобретения: заключается в разработке спектрофотометрического способа идентификации и раздельного количественного определения танина и галловой кислоты при совместном присутствии без предварительного разделения с применением расчетного метода Фирордта, так как максимумы данных биологически активных веществ накладываются, в лекарственном растительном сырье и фитопрепаратах на его основе.
Технический результат - повышение точности, а также возможность одновременного количественного определения танина и галловой кислоты, присутствующих в лекарственном растительном сырье без предварительного разделения, достигается тем, что навеску измельченного сырья помещают в коническую колбу, заливают нагретой до кипения водой и кипятят с обратным холодильником при периодическом перемешивании. Извлечение процеживают через несколько слоев марли, не дожидаясь охлаждения, так, чтобы частицы сырья не попали в колбу. Измеряют оптическую плотность аликвотной части фильтрата, разведенного боратным буферным раствором с рН 9,0, относительно буфера при длинах волн 275±2 нм и 305±2 нм (максимумы поглощения танина и галловой кислоты в боратном буфере). Содержание галловой кислоты (Хгк) и танина (Хт) в пересчете на абсолютно сухое сырье в процентах вычисляют по формулам:
; .
; .
где Аλ1 - оптическая плотность исследуемого извлечения при длине волны 275±2 нм; Аλ2 - оптическая плотность исследуемого извлечения при длине волны 305±2 нм; а - масса сырья, г; W - потеря в массе при высушивании сырья, %; W1 и W2 - объем мерных колб, взятых для разведения, мл; Va - объем аликвоты извлечения, взятой на анализ, мл; E1λ1 - величина удельного показателя поглощения галловой кислоты при 275 нм; E1λ2 - величина удельного показателя поглощения галловой кислоты при 305 нм; Е2λ1 - величина удельного показателя поглощения танина при 275 нм; Е2λ2 - величина удельного показателя поглощения танина при 305 нм.
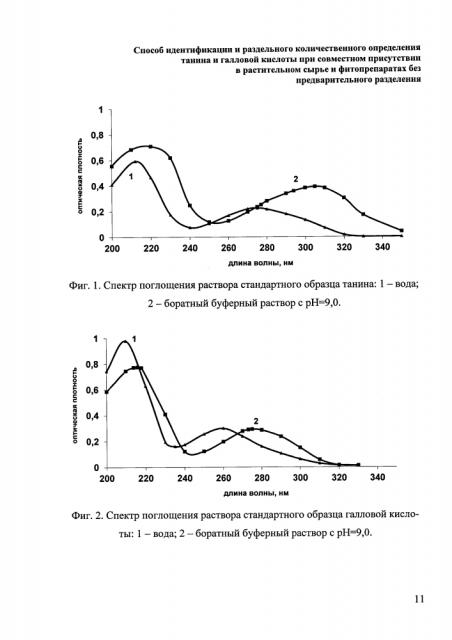
Изобретение проиллюстрировано графиками, чертежами, схемами, таблицами, где на фиг. 1 показан спектр поглощения раствора стандартного образца танина в воде и боратном буферном растворе с рН 9,0. На фиг. 2 - спектр поглощения раствора стандартного образца галловой кислоты в воде и боратном буферном растворе с рН 9,0. На фиг. 3 - спектр поглощения смеси растворов стандартных образцов галловой кислоты и танина (1:1) в воде и боратном буферном растворе с рН 9,0. Спектры поглощения смеси растворов стандартных образцов галловой кислоты и танина в боратном буферном растворе с рН 9,0 приведены в различных соотношениях на фиг. 4. Фиг. 5 демонстрирует спектр поглощения водного извлечения из листьев крапивы двудомной в воде и боратном буферном растворе с рН 9,0. В таблице 1 приведены экспериментально вычисленные величины удельных показателей поглощения галловой кислоты и танина в боратном буфере при длинах волн 275 и 305 нм. Метрологическая оценка результатов определения танина и галловой кислоты (на примере листьев крапивы двудомной) представлена таблице 2. Результаты количественного определения галловой кислоты и танина в различных растительных объектах (в пересчете на абсолютно сухое сырье) приведены в таблице 3.
Способ идентификации и раздельного количественного определения танина и галловой кислоты при совместном присутствии в растительном сырье и фитопрепаратах без предварительного разделения реализуется следующим образом.
Точную навеску (около 2,0 г) измельченного сырья помещают в коническую колбу вместимостью 500 мл, заливают нагретой до кипения водой в количестве 250 мл и кипятят с обратным холодильником при периодическом перемешивании в течение 30 минут. Извлечение процеживают через несколько слоев марли из конической колбы, не дожидаясь охлаждения, в мерную колбу вместимостью 250 мл так, чтобы частицы сырья не попали в колбу, доводят объем раствора, если необходимо, водой до метки. Измеряют оптическую плотность 1-5 мл фильтрата, разведенного боратным буферным раствором с рН 9,0 в мерной колбе вместимостью 25 мл, относительно буфера при длинах волн 275±2 нм и 305±2 нм (фиг. 1 и 2). Данные спектров поглощения лекарственного растительного сырья (фиг. 5) свидетельствуют о присутствии в извлечениях галловой кислоты и танина в различных соотношениях с максимумом поглощения в диапазоне 275-305 нм, что соответствует наличию максимумов поглощения растворов смеси стандартных образцов танина и галловой кислоты в боратном буферном растворе в различных соотношениях (фиг. 3 и 4). Т.е. в извлечениях присутствует сумма данных веществ в определенном соотношении, максимумы которых накладываются (фиг. 3 и 4). Содержание галловой кислоты и танина в пересчете на абсолютно сухое сырье в процентах в растительном сырье рассчитывают с применением метода Фирордта. Значения величин удельных показателей поглощения галловой кислоты и танина в боратном буфере при длинах волн 275 и 305 нм (максимумы поглощения индивидуальных веществ) представлены в табл. 1.
Способ позволяет проводить идентификацию и раздельное количественное определение галловой кислоты и танина в растительном сырье при совместном присутствии и стандартизировать лекарственное растительное сырье и лекарственные фитопрепараты по содержанию данных дубильных веществ и отличается достаточной чувствительностью (1×10-6 г/мл), экономичностью, доступностью и экспрессностью.
Способ иллюстрируется следующими конкретными примерами.
Пример 1. Разработанный способ был апробирован на лекарственном растительном сырье листьев крапивы двудомной.
Получение извлечения: Около 2,0 г (точная навеска) измельченного сырья, проходящего через сито с размером отверстий 0,5 мм, помещают в коническую колбу вместимостью 500 мл, заливают 250 мл нагретой до кипения воды и кипятят с обратным холодильником в течение 30 мин при периодическом перемешивании. Жидкость процеживают через несколько слоев марли в мерную колбу 250 мл, не дожидаясь охлаждения, так, чтобы частицы сырья не попали в колбу. Доводят раствор водой до метки и перемешивают. Отбирают 1 мл полученного извлечения в мерную колбу вместимостью 25 мл и доводят до метки боратным буферным раствором с рН 9,0. Измеряют оптическую плотность полученного раствора относительно буфера при длинах волн 275±2 нм и 305±2 нм. Максимум поглощения для извлечения из листьев крапивы двудомной в боратном буферном растворе находится при 294±2 нм (фиг. 5). Результаты количественного определения танина и галловой кислоты в листьях крапивы двудомной представлены в табл. 3. Метрологическая оценка результатов определения представлена табл. 2.
Пример 2. Разработанный способ был апробирован на лекарственном растительном сырье коре дуба обыкновенного.
Получение извлечения: Около 2,0 г (точная навеска) измельченного сырья, проходящего через сито с размером отверстий 0,5 мм, помещают в коническую колбу вместимостью 500 мл, заливают 250 мл нагретой до кипения воды и кипятят с обратным холодильником в течение 30 мин при периодическом перемешивании. Жидкость процеживают через несколько слоев марли в мерную колбу 250 мл, не дожидаясь охлаждения, так, чтобы частицы сырья не попали в колбу. Доводят раствор водой до метки и перемешивают. Отбирают 1 мл полученного извлечения в мерную колбу вместимостью 25 мл и доводят до метки боратным буферным раствором с рН 9,0. Измеряют оптическую плотность полученного раствора относительно буфера при длинах волн 275±2 нм и 305±2 нм. Результаты количественного определения танина и галловой кислоты в коре дуба обыкновенного представлены в табл. 3.
Пример 3. Разработанный способ был апробирован на лекарственном растительном сырье плодов облепихи крушиновидной.
Получение извлечения: Около 2,0 г (точная навеска) высушенного до остаточной влажности не более 20% измельченного сырья помещают в коническую колбу вместимостью 500 мл, заливают 250 мл нагретой до кипения воды и кипятят с обратным холодильником в течение 30 мин при периодическом перемешивании. Жидкость процеживают через несколько слоев марли в мерную колбу 250 мл, не дожидаясь охлаждения, так, чтобы частицы сырья не попали в колбу. Доводят раствор водой до метки и перемешивают. Отбирают 5 мл полученного извлечения в мерную колбу вместимостью 25 мл и доводят до метки боратным буферным раствором с рН 9,0. Измеряют оптическую плотность полученного раствора относительно буфера при длинах волн 275±2 нм и 305±2 нм. Результаты количественного определения танина и галловой кислоты в плодах облепихи крушиновидной представлены в табл. 3.
Источники информации
1. Сорокина, А.А. Потенциометрия как метод контроля качества лекарственного растительного сырья, содержащего дубильные вещества, и препаратов на его основе / А.А. Сорокина, А.И. Марахова // Фармация. - 2014. - №2. - С. 49-53.
2. Марахова, А.И. Разработка и валидация методики потенциометрического определения суммы дубильных веществ в траве зверобоя / А.И. Марахова, Я.М. Станишевский, В.И. Потапов, А.А. Сорокина // Разработка и регистрация лекарственных средств. - 2014. - №3(8). - С. 138-141.
3. ГОСТ 4565-79. Лист сумаха. Технические условия.
4. Беликов, В.Г. Анализ лекарственных веществ фотометрическими методами. Опыт работы отечественных специалистов / В.Г. Беликов // Рос. жим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева). - 2002. - Т. XLVI. - №4. - С. 52-56.
5. Власова, И.В. Новые подходы к спектрофотометрическому анализу многокомпонентных смесей / И.В. Власова, А.В. Шилова // Вiсник Харкiвського нацiонального унiверситету. - 2007. - №770. - Вип. 15(38). - С. 141-146.
6. Боровикова, Н.А. Спектрофотометрическое количественное определение дубильных веществ в коре дуба, соплодиях ольхи и в водных извлечениях из данного сырья / Н.А. Боровикова, Н.Г. Селезенев, Д.М. Попов // Вопросы биологической, медицинской и фармацевтической химии. - 2010. - №11. - С. 19-23.
7. Мальцева, А.А. Количественное определение дубильных веществ в траве горца почечуйного / А.А. Мальцева, А.С. Чистякова, А.А. Сорокина и др. // Вестник ВГУ. Сер.: Химия. Биология. Фармация. - 2013. - №2. - С. 203-205.
Способ идентификации и раздельного количественного определения танина и галловой кислоты при совместном присутствии в растительном сырье и фитопрепаратах без предварительного разделения, характеризующийся тем, что навеску исследуемого измельченного сырья помещают в коническую колбу вместимостью 500 мл, заливают нагретой до кипения водой в количестве 250 мл, кипятят с обратным холодильником при периодическом перемешивании в течение 30 минут, извлечение процеживают через несколько слоев марли из конической колбы, не дожидаясь охлаждения, в мерную колбу вместимостью 250 мл так, чтобы частицы сырья не попали в колбу, доводят объем раствора, если необходимо, водой до метки; измеряют оптическую плотность 1-5 мл фильтрата, разведенного боратным буферным раствором с рН 9,0 в мерной колбе вместимостью 25 мл, относительно буфера при длинах волн 275±2 нм и 305±2 нм, а содержание галловой кислоты (Хгк) и танина (Хт) в пересчете на абсолютно сухое сырье в процентах вычисляют по формулам:
; .
; .
где Аλ1 - оптическая плотность исследуемого извлечения при длине волны 275±2 нм; Аλ2 - оптическая плотность исследуемого извлечения при длине волны 305±2 нм; а - масса сырья, г; W - потеря в массе при высушивании сырья, %; W1 и W2 - объем мерных колб, взятых для разведения, мл; Va - объем аликвоты извлечения, взятой на анализ, мл; Е1λ1 - величина удельного показателя поглощения галловой кислоты при 275 нм; E1λ2 - величина удельного показателя поглощения галловой кислоты при 305 нм; E2λ1 - величина удельного показателя поглощения танина при 275 нм; Е2λ2 - величина удельного показателя поглощения танина при 305 нм.