Конъюгаты белок-активное вещество и способ их получения
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и медицины и касается конъюгата белок-активное вещество, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы, где активное вещество ковалентно связано посредством по меньшей мере одного линкера с изосубстратом, где изосубстрат содержит по меньшей мере одну изопреноидную единицу и является распознаваемым изопреноид-трансферазой, которая присоединена к цистеиновому остатку аминокислотного мотива. Изобретение также относится к композиции, содержащей конъюгаты, а также к способам получения конъюгатов и композиций. Группа изобретений обеспечивает использование конъюгатов для доставки активного вещества в клетки-мишени с высокой селективностью. 8 н. и 8 з.п. ф-лы, 27 ил., 5 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка испрашивает приоритет предварительной заявки США № 61/483, 698, поданной 8 мая 2011 г., содержание данной ссылки включено в настоящее изобретение посредством ссылки во всей ее полноте.
УРОВЕНЬ ТЕХНИКИ
(a) Область техники
Настоящее изобретение относится к конъюгату белок-активное вещество. Белок (например, олигопептид, полипептид, антитело или подобное) имеет субстратную специфичность к желаемой мишени, и активное вещество (например, лекарственное вещество, токсин, лиганд, детекторный зонд и т.п.) имеет определенную функцию или активность. Настоящее изобретение также обеспечивает способы получения конъюгата. Настоящее изобретение, кроме того, обеспечивает способы применения конъюгата для доставки активного вещества к клетке-мишени у субъекта, а также способы лечения субъекта, нуждающегося в активном веществе (например, у субъекта, имеющего рак).
(b) Уровень техники
Были предложены способы ингибирования роста раковых клеток посредством направленной доставки противоопухолевых агентов. Например, было показано, что направленная доставка конъюгата антитело-лекарственное вещество может убить конкретно раковую клетку. Так как антитело (или фрагмент антитела) специфически связывается с раковой клеткой, препарат поступает в раковую клетку-мишень. Направленная доставка лекарственного вещества гарантирует, что препарат оказывает действие на раковую клетку-мишень вместо нормальных клеток-хозяев, тем самым сводя к минимуму побочные эффекты в результате повреждения нормальных клеток.
Конъюгаты антител могут быть использованы для доставки химических и/или биологических молекул. Типичные химические и/или биологические молекулы включают лекарственные вещества, обычно используемые для лечения синтетическими молекулами, бактериальный белковый токсин (например, дифтерийный токсин), растительный белковый токсин (например, рицин), низкомолекулярный токсин (например, ауристатин, гельданамицин, майтансиноид, калихеамицин, дауномицин, метотрексат, виндезин и тубулизин), аффинный лиганд, детекторный зонд (например, флуоресцентный зонд, радиоактивный зонд) и тому подобное (в том числе их комбинации).
Конъюгаты антитело-лекарственное вещество, которые были предложены до сих пор, получали путем связывания лекарственного фрагмента с множеством лизиновых групп антитела. Альтернативно, конъюгаты антитело-лекарственное вещество получали путем восстановления всех или части межцепочечных дисульфидных связей антитела или восстановления всех межцепочечных дисульфидных связей с последующим частичным окислением с получением таким образом свободных тиольных групп цистеина, и затем связыванием свободных тиольных групп цистеина с фрагментом лекарственного вещества.
Существующие методы получения, однако, имеют некоторые проблемы. Например, общий способ получения осложняется тем, что конъюгаты антитело-лекарственное вещество, полученные посредством существующих способов получения, не являются одинаковыми (гомогенными). Когда конъюгаты антитело-лекарственное вещество получали посредством связывания фрагмента лекарственного вещества с лизиновыми группами, получались различные типы и формы конъюгатов антитело-лекарственное вещество в связи с наличием многих групп лизина в молекуле антитела (например, 100 лизиновых групп на антитело). Аналогичным образом, когда получали конъюгаты антитело-лекарственное вещество посредством связывания тиольных групп с молекулой лекарственного вещества, получали смесь диастереомеров за счет связывания между тиоловыми группами и малеимидными группами. Например, если конъюгируется n молекул лекарства, получается смесь 2n стереоизомеров. Таким образом, когда распределение количества молекул лекарства равно 0-8 (например, когда восстанавливаются межцепочечные дисульфидные связи), получается смесь из стереоизомеров. Кроме того, если i молекул лекарства конъюгируются с q сайтами, получается смесь из различных соединений.
Кроме того, при получении конъюгатов антитело-лекарственное вещество посредством связывания лизиновых групп с молекулой лекарственного вещества, электрический заряд лизиновых групп может исчезнуть, в результате чего антитело потеряет свою уникальную антигенную специфичность. Аналогично, третичная или четвертичная структура антитела не может поддерживаться при получении конъюгатов антитело-лекарственное вещество при восстановлении дисульфидных связей, в результате чего антитело может инактивироваться или стать неспецифическим антителом. При получении конъюгатов антитело-лекарственное вещество с использованием связывания тиолов с малеимидом, лекарственное вещество может отщепиться (не специфически) от конъюгатов через, например, обратную реакцию.
Для преодоления проблем, связанных с известными способами получения, был предложен альтернативный метод, в котором аминокислотные группы в некоторых положениях антитела заменяются цистеиновыми группами. Хотя этот метод показывает лучший результат, чем предыдущие методы получения с точки зрения токсичности, активности и безопасности, этот способ еще включает связывание тиолов с малеимидом и, таким образом, он страдает из-за проблем с диастереомерами и неустойчивости, связанных со связыванием тиолов с малеимидом. Был предложен другой альтернативный метод, в котором селеноцистеиновые группы присоединялись к карбоксильным концам антитела.
В дополнение к использованию цистеиновых замен для контроля сайта конъюгации Ambrx Technology (http://www.ambrx.com) работает в направлении включения неприродных аминокислот в антитело, чтобы обеспечить функциональные группы, которые могут быть использованы для химии линкеров. Системы экспрессии Ambrx содержат синтетазы тРНК, которые аминоацилируют оригинальную тРНК неприродной аминокислотой, тем самым включая неприродную аминокислоту каждый раз, когда встречается амбер-стоп кодон.
Технология Redwood Bioscience в (http://www.redwoodbioscience.com) использует генетически закодированные альдегидные теги и предназначена для использования специфической последовательности, которая посттрансляционно узнается и модифицируется посредством фермента, т.е. фермента, образующего формилглицин, чтобы продуцировать так называемую альдегидную «химическую ручку». Включение последовательности CxPxR в определенных положениях в антитело обеспечивает средство для получения реакционноспособного альдегида способного к конъюгации с лекарственным веществом.
Тем не менее, ввиду вышеупомянутых проблем в этой области техники, относящихся к созданию конъюгатов антитело-лекарственное вещество, новые конъюгаты антитело-лекарственное вещество и новые способы получения конъюгатов антитело-лекарственное вещество весьма желательны.
Указанная информация представлена в данном разделе описания только для улучшения понимания уровня техники изобретения и, следовательно, она может содержать информацию, которая не образует предшествующий уровень техники, который уже является известным специалисту в данной области техники.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Как описано ниже, настоящее изобретение в общем представляет собой пример конъюгатов белок-активное вещество и способов изготовления конъюгатов белок-активное вещество. Изобретение также включает способы доставки конъюгата белок-активное вещество к клетке-мишени у субъекта, а также способы лечения субъекта, нуждающегося в активном веществе. Конъюгаты белок-активное вещество в соответствии с настоящим изобретением могут быть получены гомогенными и преимущественно используемыми для таргетного лечения заболевания.
В аспектах изобретение обеспечивает конъюгаты белок-активное вещество. В вариантах выполнения белок имеет аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы. В вариантах выполнения активное вещество ковалентно связано с белком в аминокислотном мотиве.
В вариантах выполнения белок имеет делецию на карбоксильном конце белка. В родственных вариантах выполнения модификация присоединяется к аминокислотному мотиву.
В вариантах выполнения белок имеет олигопептидную или полипептидную вставку на карбоксильном конце белка. В родственных вариантах выполнения модификация присоединяется к аминокислотному мотиву.
В вариантах выполнения белок имеет делецию на карбоксильном конце белка и олигопептидную или полипептидную вставку на карбоксильном конце белка. В родственных вариантах выполнения модификация присоединяется к аминокислотному мотиву.
В вариантах выполнения белок представляет собой антитело или фрагмент антигенного полипептида. В родственных вариантах выполнения белок представляет собой моноклональное антитело. В родственных вариантах выполнения по меньшей мере одна легкая цепь и/или по меньшей мере одна тяжелая цепь моноклонального антитела включает в себя аминокислотную область, имеющую аминокислотный мотив.
В любом из указанных выше аспектов или вариантов, изопреноид-трансфераза представляет собой FTase или GGTase.
В любом из указанных выше аспектов или вариантов выполнения активное вещество представляет собой лекарственное вещество, токсин, аффинный лиганд, детекторный зонд или их комбинацию.
В любом из указанных выше аспектов или вариантов выполнения, аминокислотный мотив представляет собой СААХ, ХХСС, ХСХС или СХХ, где С представляет собой цистеин, А представляет собой алифатическую аминокислоту и X представляет собой аминокислоту, которая определяет субстратную специфичность изопреноид-трансферазы.
В любом из указанных выше аспектов или вариантов выполнения аминокислотный мотив ковалентно связан с активным веществом через по меньшей мере один линкер. В родственных вариантах выполнения линкер представляет собой изопренильное производное, которое может быть распознано изопреноид-трансферазой.
В родственных вариантах выполнения линкер представляется следующей формулой (I):
где P1 и Υ независимо представляют собой группу, содержащую первую функциональную группу (FG1), FG1 выбирается из группы, состоящей из: ацетилена, азида, альдегида, гидроксиламина, гидразина, кетона, нитробензофуразана (NBD), дансила, флуоресцеина, биотина и родамина,
L1 представляет собой (CH2)rXq(CH2)p,
X представляет собой кислород, серу, -NR1-, -C(O)NR1-, -NR1C(O)-, -NR1SO2-, -SO2NR1-, -(СН=СН)-, или ацетилен,
R1 представляет собой водород, С1-6-алкил, C1-6-алкил арил, или С1-6-алкил гетероарил,
r и p независимо представляют собой целое число от 0 до 6,
q представляет собой целое число от 0 до 1, и
n представляет собой целое число от 1 до 4.
В вариантах выполнения активное вещество присоединяется к группе, содержащей вторую функциональную группу (FG2), которая может реагировать с FG1. В родственных вариантах выполнения FG2 является ацетиленом, гидроксиламином, азидом, альдегидом, гидразином, кетоном или амином. В других родственных вариантах выполнения активное вещество присоединяется к группе, содержащей FG2 через -(CH2)rXq(CH2)p- или -[ZCH2CH2O(CH2CH2O)wCH2CH2Z]-, в которых
X представляет собой кислород, серу, -NR1-, -C(O)NR1-, -NR1C(O)-, -NR1SO2- или -SO2NR1-,
Ζ представляет собой кислород, серу или NR1,
R1 представляет собой водород, C1-6-алкил, C1-6-алкил арил, или C1-6-алкил гетероарил,
r и p независимо представляют собой целое число от 0 до 6,
q представляет собой целое число от 0 до 1, и
m представляет собой целое число от 0 до 6.
В еще дополнительных родственных вариантах выполнения -(CH2)rXq(CH2)p- или -[ZCH2CH2O(CH2CH2O)wCH2CH2Z]- присоединяется к (i) пептиду(ам), которые могут быть расщеплены катепсином В или (ii) а глюкурониду, который может быть расщеплен β-глюкуронидазой.
В вариантах выполнения пептид, который может быть расщеплен катепсином В, представляет собой
В вариантах выполнения глюкуронид, который может быть расщеплен β-глюкуронидазой представляет собой
В аспектах изобретение обеспечивает способы получения любого из конъюгатов белок-активное вещество, описанных в настоящем изобретении. В вариантах выполнения способы включают экспрессию белка, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы. В вариантах выполнения способы включают ферментативное взаимодействие с изопреноид-трансферазой экспрессированного белка и по меньшей мере одного изосубстрата, имеющего первую функциональную группу (FG1), с получением таким образом функционализированного белка. В вариантах выполнения способы включают присоединение второй функциональной группы (FG2) к активному веществу, с получением таким образом функционализированного активного вещества. В вариантах выполнения способы включают взаимодействие функционализированного белка с функционализированным активным веществом, с получением таким образом конъюгата белок-активное вещество.
В родственных вариантах выполнения аминокислотный мотив находится на карбоксильном конце белка.
В родственных вариантах выполнения аминокислотный мотив представляет собой СААХ, ХХСС, ХСХС или СХХ, где С представляет собой цистеин, А представляет собой алифатическую аминокислоту и X представляет собой аминокислоту, которая определяет субстратную специфичность изопреноид-трансферазы.
В родственных вариантах выполнения аминокислотный мотив представляет собой СААХ, и где способ дополнительно включает удаление ААХ из аминокислотного мотива после стадии (b).
В родственных вариантах выполнения FG2 присоединяется к активному веществу посредством по меньшей мере одного линкера.
В родственных вариантах выполнения реакция между функциональным белком и функционализированным активным веществом представляет собой реакцию клик-химии или образование гидразона и/или оксима. В вариантах выполнения FG1 представляет собой азидную группу, a FG2 представляет собой ацетиленовую группу. В вариантах выполнения FG1 представляет собой ацетиленовую группу, а FG2 представляет собой азидную группу. В вариантах выполнения FG1 представляет собой альдегидную или кетонную группу, a FG2 представляет собой гидразин или гидроксиламин. В вариантах выполнения FG1 представляет собой гидразин или гидроксиламин, a FG2 представляет собой альдегид или кетон.
В аспектах изобретение обеспечивает способы получения любого из конъюгатов белок-активное вещество, описанных в настоящем изобретении, и способы включают экспрессию белка, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы. В вариантах выполнения способы включают присоединение изосубстрата изопреноид-трансферазы в качестве активного вещества. В вариантах выполнения способы включают ферментативное взаимодействие с изопреноид-трансферазой экспрессированного белка и активного вещества, присоединенного к изосубстрату.
В родственных вариантах выполнения аминокислотный мотив находится на карбоксильном конце белка.
В родственных вариантах выполнения аминокислотный мотив представляет собой СААХ, ХХСС, ХСХС или СХХ, где С представляет собой цистеин, А представляет собой алифатическую аминокислоту и X представляет собой аминокислоту, которая определяет субстратную специфичность изопреноид-трансферазы.
В родственных вариантах выполнения изосубстрат присоединяется к активному веществу по меньшей мере посредством одного линкера.
В аспектах изобретение обеспечивает композиции, содержащие любой из конъюгатов белок-активное вещество, описанных в настоящем изобретении. В вариантах выполнения композиция представляет собой гомогенную смесь из конъюгата белок-активное вещество. В вариантах выполнения белок представляет собой антитело или фрагмент антигенного полипептида.
В аспектах изобретение предусматривает способы доставки активного вещества к клетке-мишени в субъекте. В вариантах выполнения способы включают введение по меньшей мере одного конъюгата белок-активное вещество или композиции, описанных в настоящем изобретении. В вариантах выполнения клетка-мишень представляет собой раковую клетку.
В аспектах изобретение обеспечивает способы лечения субъекта, нуждающегося в этом (т.е. который нуждается в активном веществе). В вариантах выполнения способы включают введение по меньшей мере одного из конъюгатов белок-активное вещество или композиции, описанных в настоящем изобретении. В вариантах выполнения субъект имеет рак. В вариантах выполнения субъект имеет инфекцию с патогенным агентом. Патогенный агент может быть вирусом, бактерией, грибком или паразитом.
В описанных выше конъюгатах белок-активное вещество, композициях и способах в некоторых вариантах выполнения активное вещество может быть иммуномодулирующим соединением, противоопухолевым средством, противовирусным средством, антибактериальным средством, противогрибковым средством или противопаразитарным средством.
Вышеуказанные и другие аспекты, признаки и преимущества настоящего изобретения будут очевидны из или описаны более подробно в прилагаемых чертежах, которые включены в и составляют часть этого описания, а также последующего подробного описания, которые вместе служат для объяснения в качестве примера принципов настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-GCVIM), полученного путем вставки GCVIM на С-конец тяжелой цепи Herceptin.
Фиг. 2 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-GCVIM), полученного путем вставки GCVIM на С-конец легкой цепи Herceptin.
Фиг. 3 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-G5CVIM), полученного путем вставки G5CVIM на С-конец тяжелой цепи Herceptin.
Фиг. 4 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-G5CVIM), полученного путем вставки G5CVIM на С-конец легкой цепи Herceptin.
Фиг. 5 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-G7CVIM), полученного путем вставки G7CVIM на С-конец тяжелой цепи Herceptin.
Фиг. 6 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-G7CVIM), полученного путем вставки G7CVIM на С-конец легкой цепи Herceptin.
Фиг. 7 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-G10CVIM), полученного путем вставки G10CVIM на С-конец тяжелой цепи Herceptin.
Фиг. 8 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-G10CVIM), полученного путем вставки G10CVIM на С-конец легкой цепи Herceptin.
Фиг. 9 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-G10CVLL), полученного путем вставки G10CVLL на С-конец тяжелой цепи Herceptin.
Фиг. 10 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-G10CVLL), полученного путем вставки G10CVLL на С-конец легкой цепи Herceptin.
Фиг. 11 показывает SDS-PAGE гель, анализирующий модифицированное анти-сМЕТ антитело (анти-cMET-HC-G7CVIM), полученное посредством вставки G7CVIM на С-конец тяжелой цепи антитела анти-сМЕТ, модифицированное анти-сМЕТ антитело (анти-cMET-LC-G7CVIM), полученное посредством вставки G7CVIM на С-конец легкой цепи анти-сМЕТ антитела, модифицированное анти-сМЕТ антитело (анти-сМЕТ HC-G10CVIM), полученное посредством вставки G10CVIM на С-конец тяжелой цепи анти-сМЕТ антитела и модифицированное анти-сМЕТ антитело (анти-cMET-LC-G10CVIM), полученное посредством вставки G10CVIM на С-конец легкой цепи анти-сМЕТ антитела.
Фиг. 12 показывает SDS-PAGE гель, анализирующий пренилирование Herceptin-HC-GnCVIM с помощью FTase и NBD-GPP.
Фиг. 13 показывает SDS-PAGE гель, анализирующий пренилирование Herceptin-LC-GnCVIM с помощью FTase и NBD-GPP.
Фиг. 14 показывает SDS-PAGE гель, анализирующий пренилирование сМЕТ-НС-GnCVIM с помощью FTase и NBD-GPP.
Фиг. 15 показывает SDS-PAGE гель, анализирующий пренилирование cMET-LC-GnCVIM с помощью FTase и NBD-GPP.
Фиг. 16 показывает SDS-PAGE гель, анализирующий пренилирование Herceptin-HC-G10CVLL и Herceptin-LC-G10CVLL с помощью FTase/NBD-GPP или GGTase I/NBD-FPP.
Фиг. 17 показывает результаты ЖХ/МС анализа пренилированного Herceptin-LC-G7CVIM.
Фиг. 18 показывает результаты ЖХ/МС анализа пренилированного Herceptin-LC-G10CVIM.
Фиг. 19 показывает результаты ЖХ/МС и деконволиционного анализа масс-спектров LCB14-0104 (Herceptin-LC-G7CVIM-NC-MMAF-OMe).
Фиг. 20 показывает HIC-ВЭЖХ хроматограммы Herceptin-LC-G7CVIM, пренилированных Herceptin-LC-G7CVIM и LCB14-0101 (Herceptin-LC-G7CVIM-BG-MMAF).
Фиг. 21 показывает результаты из анти-пролиферативного анализа LCB14-0101 (Herceptin-LC-G7CVIM-BG-MMAF) с клеточными линиями рака молочной железы MCF-7, MDA-MB-468 и SK-BR-3.
Фиг. 22 показывает результаты анти-пролиферативного анализа LCB14-0102 (Herceptin-LC-G7CVIM-VC-MMAF-OMe) с клеточными линиями рака молочной железы MCF-7 и SK-BR-3.
Фиг. 23 показывает результаты анти-пролиферативного анализа LCB14-0103 (Herceptin-LC-G7CVIM-BG-MMAE) с клеточными линиями рака молочной железы MCF-7 и SK-BR-3.
Фиг. 24 показывает процесс посттрансляционной модификации белка (С-концевой CVIM).
Фиг. 25 показывает механизм высвобождения активных лекарственных веществ (за исключением нерасщепляемого линкера).
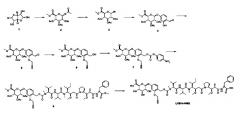
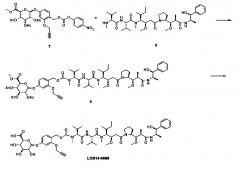
Фиг. 26 показывает химические структуры конъюгатов антитело-лекарственное вещество LCB14-0101, LCB14-0102, LCB14-0103 и LCB14-0104.
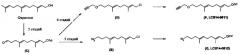
Фиг. 27 показывает схему, изображающую способ получения конъюгата белок-активное вещество с использованием изопреноид-трансферазы и ее изосубстрата, в котором алкилируется цистеин в мотиве СААХ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее будут подробно описаны варианты выполнения настоящего изобретения, примеры которых проиллюстрированы на прилагаемых чертежах далее, на которых одинаковые ссылочные позиции относятся к одинаковым элементам. Варианты выполнения описаны ниже для того, чтобы объяснить настоящее изобретение со ссылками на чертежи.
Определения
Посредством "агент" или "активное вещество" обозначаются любые низкомолекулярные химические соединения, антитела, молекулы нуклеиновой кислоты или полипептиды или их фрагменты. Примеры включают, но не ограничиваются этим, лекарственное вещество, токсин, аффинный лиганд, детекторный зонд или их комбинации.
Посредством "аналог" подразумевается молекула, которая не идентична, но имеет аналогичные функциональные или структурные особенности. Например, полипептидный аналог сохраняет биологическую активность, соответствующую природному полипептиду, в то же время обладая некоторыми биохимическими модификациями, которые улучшают функцию аналога по отношению к природному полипептиду. Такие биохимические модификации могут увеличить устойчивость аналога к протеазам, проницаемость через мембрану или период полураспада, не изменяя, например, связывание с лигандом. Аналог может включать в себя неприродную аминокислоту.
В настоящем изобретении "содержит", "содержащий", "включающий" и "имеющий" и т.п. могут иметь значение, указанное для них в патентном законодательстве США и могут обозначать «включает», «включающий» и тому подобное; «состоящий в основном из» или «в основном состоит» также имеет значение, описанное в патентном законодательстве США, и термин носит открытый характер, допуская присутствие большего, чем то, о чем рассказано, пока основные или новые особенности того, о чем рассказано, не изменены присутствием большего, чем то, о чем рассказано, но исключает варианты выполнения предшествующего состояния техники.
«Контактирование с клеткой» понимается в настоящем изобретении как доставка вещества к клетке, например, к клетке, подлежащей обработке в культуре, ex vivo или у животного, так чтобы вещество смогло бы взаимодействовать с клеткой (например, с клеткой, подлежащей лечению), потенциально могло быть поглощено клеткой, и оказывать воздействие на клетку. Вещество (например, адъювант) может быть доставлено в клетки непосредственно (например, путем добавления вещества в культуральную среду или путем инъекции в клетку или ткань, представляющих интерес), или путем доставки в организм с помощью местного или парентерального пути введения для доставки в клетку посредством сосудистого, лимфатического или другими способами. Специалист в данной области техники легко поймет, что введение конъюгатов белок-активное вещество в соответствии с настоящим изобретением субъекту включает контактирование конъюгата белок-активное вещество с клеткой субъекта.
«Болезнь» понимается как любое состояние или расстройство, которое повреждает или мешает нормальной функции клеток, тканей или органов.
Термины «эффективное количество», «терапевтически эффективное количество», «эффективная доза» или «терапевтически эффективная доза» относятся к такому количеству вещества, которое производит намеченный фармакологический, терапевтический или профилактический результат. Например, фармакологически эффективное количество приводит к предотвращению или задержке начала болезни, либо у индивидуума, либо что касается частоты заболевания в популяции. Более одной дозы может потребоваться, чтобы обеспечить эффективную дозу. Понятно, что эффективная доза в одной популяции может или не может быть достаточной во всех популяций. Таким образом, в связи с введением вещества или иммуногенной композиции, вещество или иммуногенная композиция является «эффективными против» заболевания или состояния, если введение в клинически приемлемым способом приводит к благотворному эффекту на по меньшей мере статистически значимой доли субъектов, такому как предотвращение начала заболевания, улучшение симптомов, лечение, сокращение признаков заболевания или симптомов, продление жизни, улучшение качества жизни или к другому эффекту, обычно рассматриваемому как положительный, врачами, знакомыми с лечением конкретного типа заболевания или состояния.
Под «усиливает» понимается положительное изменение по меньшей мере на 10%, 25%, 50%, 75%, 100% или любое число между ними.
"Фрагмент" означает часть молекулы полипептида или нуклеиновой кислоты. Эта часть содержит, предпочтительно по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% от всей длины молекулы сравнения нуклеиновой кислоты или полипептида. Фрагмент может содержать 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 нуклеотидов или аминокислот.
"Гибридизация" означает образование водородных связей, которые могут быть водородными связями Уотсона-Крика, Хугстина или обратными связями Хугстина между комплементарными нуклеотидными основаниями. Например, аденин и тимин являются комплементарными нуклеотидными основаниями этой пары через образование водородных связей.
"Получение" понимается в настоящем изобретении как изготовление, приобретение, синтезирование, выделение, очистка, или иным образом достижения обладания.
Выражение "фармацевтически приемлемый носитель, вспомогательное средство или разбавитель" является признанным в данной области техники и включает фармацевтически приемлемый материал, композицию или основу, пригодные для введения соединений в соответствии с настоящим изобретением млекопитающим. Как используется в настоящем изобретении, термин "фармацевтически приемлемый" означает, что будучи утвержденными регулирующими ведомствами федерального правительства или правительства штата или перечисленными в Фармакопеи США, Европейской Фармакопеи или другой общепризнанной Фармакопеи для применения у млекопитающих, например, людей.
"Уменьшает" означает отрицательное изменение по меньшей мере на 10%, 25%, 50%, 75%, 100% или любое число между ними.
"Эталон" подразумевает стандартные или контрольные условия.
«Образец», как используется в настоящем изобретении, относится к биологическому материалу, который выделен из окружающей среды (например, крови или ткани от животного, клетки или кондиционированных сред из тканевой культуры). В вариантах выполнения образец предположительно содержит, или известно, что содержит аналит, такой как белок, представляющий интерес (например, антитело, цитокин, и тому подобное). Образец также может быть частично очищенной фракцией из ткани или жидкости организма. Референтный образец может быть "нормальным" образцом, жидкостью от донора, не имеющего заболевания или состояния, или из нормальной ткани у субъекта, имеющего заболевание или состояние, или нелеченного субъекта (например, субъекта, нелеченного вакциной). Референтный образец также может быть взят в "нулевой момент времени", до контактирования клетки или субъекта, которые должны быть протестированы, с веществом или терапевтическим вмешательством.
«Специфически связывается» означает узнавание и связывание с мишенью (например, полипептидом, клеткой и т. п.), но который по существу не узнается и связывается другими молекулами в образце, например, в биологическом образце.
"Субъект", как используется в настоящем изобретении, относится к живому организму. В вариантах выполнения живой организм представляет собой животное. В вариантах выполнения субъектом является млекопитающее. В вариантах выполнения субъектом является одомашненное млекопитающее или примат, включая приматов, не являющихся человеком. Примеры субъектов включают, но не ограничиваются этим, человека, обезьян, собак, кошек, мышей, крыс, коров, лошадей, свиней, коз, овец и птиц. Субъект может также упоминаться как пациент.
Субъект «страдающий от или подозревается, как страдающий от» конкретного заболевания, состояния или синдрома имеет достаточное количество факторов риска или представляет достаточное количеством или комбинацию признаков или симптомов заболевания, состояния, или синдрома таких, что компетентный специалист будет в состоянии диагностировать или подозревать, что субъект страдает от заболевания, состояния или синдрома. Методы идентификации субъектов, страдающих или подозреваемых в страдании от заболевания или состояния, находится в пределах способности специалиста в данной области техники. Субъектов, страдающих и подозреваемых в страдании от конкретного заболевания, состояния или синдрома, не обязательно разделяются на две различные группы. Специалисту в данной области техники также легко понять, что субъект, нуждающийся в активном веществе, также может быть субъектом, страдающим от или предположительно страдающим от конкретного заболевания, состояния или синдрома.
Как используется в настоящем изобретении, термины "лечить", "лечение", "лечение", и т.п. относятся к сокращению или облегчению расстройства и/или симптомов, связанных с ними (например, рак или симптомы, связанные с раком). Следует иметь в виду, что, хотя это не исключается, лечение расстройства или состояния не требует, чтобы расстройство, состояние или симптомы, связанные с ним, полностью устранялись.
Диапазоны, обеспечиваемые в настоящем изобретении, понимаются как подразумевающие для всех значений в этом диапазоне. Например, диапазон от 1 до 50 понимается как включающий любое число, комбинации чисел или поддиапазон из группы, включающей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45,46, 47, 48, 49 или 50.
Если специально не оговорено или не очевидно из контекста, как используется в настоящем изобретении, термин "или" понимается включительно.
Если специально не оговорено или не очевидно из контекста, как это используется в настоящем изобретении, термины "a", "an" и "the" понимаются как в единственном, так во множественном числе.
Если специально не оговорено или не очевидно из контекста, как это используется в настоящем изобретении, термин "около" понимается как в диапазоне нормального предела допускаемой погрешности в данной области техники, например в интервале 2 стандартных отклонений от среднего значения. «Около» можно понимать как в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05% или 0,01 % от указанной величины. Если иное не ясно из контекста, все числовые значения, представленные в настоящем изобретении, не могут быть изменены термином «около».
Перечисление списка химических групп в любом определении переменной в настоящем изобретении, включает определения этой переменной как и любой единственной группы, так и комбинации перечисленных групп. Перечисление варианта выполнения для переменной или аспекта в настоящем изобретении включает этот вариант выполнения как любого единственного варианта выполнения, так и в комбинации с любыми другими вариантами выполнения или их частей.
Любые композиции или способы, представленные в настоящем изобретении, могут быть комбинированы с одним или более любыми другими композициями и способами, представленными в настоящем изобретении.
1. Способы получения конъюгатов белок-активное вещество
Способы получения конъюгатов белок-активное вещество в соответствии с настоящим изобретением и их варианты очевидны любому специалисту в данной области техники на основе раскрытия в соответствии с настоящим изобретением.
Ниже приводятся примеры способов, которые обеспечиваются посредством иллюстрации и не предназначены для ограничения настоящего изобретения.
Вариант выполнения 1
Способ получения конъюгата белок-активное вещество в соответствии с одним вариантом выполнения настоящего изобретения включает: (а) экспрессию белка, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы; (b) ферментативное взаимодействие с применением изопреноид-трансферазы, экспрессированного белка и по меньшей мере одного изосубстрата, имеющего первую функциональную группу (FG1), с получением, таким образом, функционализированного белка; (с) присоединение второй функциональной группы (FG2) к активному веществу с получением таким образом функционализированного активного вещества; и (d) взаимодействие функционализированного белка с функционализированным активным веществом, с получением таким образом конъюгата белок-активное вещество.
Термин «белок», используемый в настоящем изобретении, понимается как две или более независимо выбранными природных или неприродных аминокислоты, соединенные ковалентной связью (например, пептидной связью). Пептид может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более природных или неприродных аминокислот, соединенных пептидными связями. Полипептиды, как описано в настоящем изобретении, включают белки полной длины (например, процессированные белки), а также более короткие аминокислотные последовательности (например, фрагменты природных белков или синтетические полипептидные фрагменты).
Белок относится к олигопептидам или полипептидам, содержащим по меньшей мере один С-конец и по меньшей мере один N-конец. Используемый в настоящем изобретении термин включает интактный олигопептид или полипептид, модифицированную их форму, их фрагмент, а также их аналоги. Например, термин может относиться к олигопептиду или полипептиду, или олигопептиду или полипептиду, модифицированным путем присоединения к ним аминокислотной последовательности, которая может быть распознана с помощью изопреноид-трансферазы. Термин «фрагмент», используемый в настоящем изобретении, относится к части аминокислотной последовательности, состоящей из олигопептида или полипептида. Используемый в настоящем изобретении термин включает часть аминокислотной последовательности, имеющей субстратную специфичность олигопептида или полипептида. Термин «аналог» относится к олигопептиду или полипептиду, имеющим последовательность, идентичную по меньшей мере на 70% или 75%, по меньшей мере на 80% или 85%, по меньшей мере на 90%, 91%, 92%, 93%, 94% или 95% или по меньшей мере на 96, 97%, 98% или 99% с референтным олигопептидом или полипептидом.
Термин «белок», используемый