Штаммы bifidobacterium adolescentis 150 и bifidobacterium angulatum gt 102, синтезирующие гамма-аминомасляную кислоту
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии и касается штаммов бактерий B.adolescentis 150 и B.angulatum GT 102. Штаммы бактерий B.adolescentis и B.angulatum депонированы во Всероссийской Коллекции Промышленных Микроорганизмов под регистрационными номерами ВКПМ Ас-1974 и ВКПМ Ас-1973 и обладают способностью синтезировать гамма- аминомасляную кислоту (ГАМК). Эти штаммы могут быть использованы для получения пробиотических препаратов. Изобретение позволяет расширить ассортимент продуцентов гамма-аминомасляной кислоты. 2 ил., 5 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к фармакологии и медицине, в частности неврологии, и касается штаммов бифидобактерий, способных продуцировать гамма-аминомасляную кислоту, известную как релаксирующее средство. Штаммы могут быть использованы для получения пробиотических препаратов, используемых в комплексном лечении депрессии, тревожности и других пограничных неврологических расстройств.
Уровень техники
γ-Аминомасляная кислота (ГАМК, GABA; C4H9NO2) является монокарбоновой альфа-аминокислотой, широко распространенной в природе. ГАМК - важнейший нейромедиатор, участвующий в процессах торможения центральной нервной системы млекопитающих. Под влиянием ГАМК активируются энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение. ГАМК обладает гипотензивным, седативным и мочегонным действием и снимает боль (Mody et al., 1994. Bringing the effect at GABA synapses in the brain. Neuroscience 17:517-525), снижает артериальное давление, оказывает транквилизационный эффект (Jakobs et al., 1993, Inherited disorders of GABA metabolism. J. Inherit. Metab. Dis., 16, 704-715; Wong et al., 2003, GABA, gamma-hydroxybutyric acid, and neurological disease. Ann. Neurol, 54, suppl 6, S3-S12). Гамма-аминомасляная кислота предотвращает развитие диабета посредством стимуляции секреции инсулина (Hagiwara et al., 2004. The effect of pre-germinated brown rice intake on blood glucose and PAI-1 levels in streptozotocin-induced diabetic rats. Biosci Biotechnol Biochem 68:444-447; Adeghate, Ponery, 2002, GABA in the endocrine pancreas: cellular localization and function in normal and diabetic rats. Tussue Cell, 34, 1-6). ГАМК стимулирует переднюю долю гипофиза, которая вырабатывает гормон роста и регулирует скорость синтеза белка в мозге (Tujioka et al., 2009. Dietary gamma-aminobutyric acid affects the brain protein synthesis rate in ovariectomized female rats. J Nutr Sci Vitaminol 55:75-80; Cavagnini et al., 1980. Effect of acute and repeated administration of gamma aminobutyric acid (GABA) on growth hormone and prolactin secretion in man. Acta Endocrinol (Copenh). Feb; 93(2): 149-54). ГАМК ингибирует образование аденокарциномы легкого (Schuller et al., 2008. Gamma-aminobutyric acid, a potential tumor suppressor for small airway-derived lung adenocarcinoma. Carcinogenesis 29: 1979-1985). Низкий уровень или снижение ГАМК связывают с некоторыми психиатрическими и неврологическими расстройствами, включая тревожность, депрессию (Distler et al., 2012. Glyoxalase 1 increases anxiety by reducing GABA a receptor agonist methylglyoxal. J Clin Invest 122:2306-2315; Padgett et al., 2012. Methamphetamine-evoked depression of GABA receptor signaling in GABA neurons of the VTA. Neuron 73:978-989), бессонницу (Gotesmann, 2002. GABA mechanisms and sleep.Neuroscience 111:231-239) и эпилепсию (Czapinski et al., 2005. Mechanisms of action of antiepileptic drugs. Curr Top Med Chem 5:3-14). Дисфункция сигналинга ГАМК может привести к нарушению синаптогенеза и когнитивных расстройств, включая болезнь Альцгеймера (БА).
Действие ГАМК в ЦНС осуществляется путем ее взаимодействия со специфическими ГАМКергическими рецепторами (подразделяются на ГАМК-А- и ГАМК-Б-рецепторы), приводящего к ингибированию нервного импульса. За пределами нервной системы ГАМКергическая система была описана в различных тканях и органах тела человека (кишечнике, желудке, поджелудочной железе, почках, легких, печени и других).
Гамма-аминомасляная кислота в организме образуется из другой аминокислоты, L-глутамата, с помощью фермента глутаматдекарбоксилазы (GAD, ЕС 4.1.15) в ходе необратимой реакции альфа-декарбоксилирования; кофактором является пиридоксаль 5'-фосфат (активная форма витамина В6).
Способность к образованию ГАМК обнаружена у животных, растений и микроорганизмов (бактерий, грибов, дрожжей).
Бифидобактерии являются важными представителями кишечной микробиоты человека. Благодаря положительному влиянию на здоровье человека бифидобактерии относят к пробиотическим микроорганизмам. Их считаются безопасными (GRAS - generally regaded as safe) и широко используются в функциональных пищевых продуктах, биологически активных добавках, лекарственных средствах. Пробиотики на основе бифидобактерий все чаще используются в комбинированном лечении начальных стадий различных заболеваний. Преимуществами использования пробиотиков в качестве лекарственных средств является их относительная безвредность и физиологичность по сравнению с химическими препаратами и возможность подбора конкретного препарата - вплоть до индивидуальной терапии - для лечения одного и того же заболевания у разных пациентов.
Активный синтез ГАМК был выявлен у ряда штаммов бифидобактерий, относящихся к видам: Bifidobacterium adolescents, B.dentium, B.longum (Barrett et al., 2012. γ-Aminobutyric acid production by culturable bacteria from the human intestine». J Appl Microbiol. 113(2):411-417; патент WO 2013107913 A1, Stanton et al., 2013, Gaba-producing culturable bacteria derived from the human gastrointestinal tract). Эти штаммы были выделены из кишечной микробиоты человека и авторы полагают, что синтез ГАМК происходит в естественных условиях не менее эффективно, чем в культурах клеток. В 2005 г. Park с соавторами опубликовали результаты работы по созданию высокопродуктивного рекомбинантного штамма В. longum, обладающего повышенной экспрессией гена глутаматдекарбоксилазы. Произвели трансформацию гена риса OsGADC в геном В.longum. В результате продукция ГАМК существенно возросла в группе рекомбинантов по сравнению с контрольной группой (Park et al., 2005. Expression of rice glutamate decarboxylase in Bifidobacterium longum enhances gamma-aminobutyric acid production. Biotechnol Lett. 2005; 27(21): 1681-4).
В ряде работ было показано, что введение бифидобактерий перорально животным (мышам и крысам) снимает симптомы тревожного состояния и депрессивно-подобного поведения, а так же снижает уровень стрессовых гормонов (Desbonnet et al., 2008. The probiotic B.infanlis: An assessment of potential antidepressant properties in the rat. J Psychiatr Res. 2008; 43(2): 164-174; Desbonnet et al, 2010, Effects of the probiotic B.infantis in the maternal separation model of depression; Sudo et al., 2004. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol.; 558(Pt 1):263-275).
Способность отдельных штаммов бифидобактерий продуцировать ГАМК и оказывать психотропное действие позволяет отнести их к психобиотикам. Психобиотики - это бактерии, которые в достаточных количествах способны оказывать благоприятное воздействие на здоровье пациентов, страдающих психическими заболеваниями (Dinanet al., 2013. Psychobiotics: a novel class of psychotropic. Biol Psychiatry. 2013; 74(10):720-726.). Доклинические оценки показывают, что определенные психобиотики обладают активностью, снижающей симптомы депрессии и тревожного состояния. Эффекты могут быть опосредованы через блуждающий нерв, спинной мозг и нейроэндокринную систему. Полагаем, что разработка психобиотиков (штаммов и препаратов на их основе) очень своевременна и необходима. В России желательно использовать препараты на основе российских штаммов бифидобактерий, адаптированных для российской популяции, с учетом происхождения штамма (т.е. выделенные из ЖКТ людей - жителей России). Патентуемые штаммы выделены из ЖКТ жителей центрального региона России и имеют высокую продуктивную способность. На данный момент российские лекарственные препараты на основе бифидобактерий, направленные на комплексное лечение нейродепрессивных состояний (тревоги, нарушений сна, депрессии и др.), отсутствуют.
Сущность изобретения
Штамм Bifidobacterium adolescentis ВКПМ Ас-1974 продуцент гамма-аминомасляной кислоты.
Штамм Bifidobacterium angulatum ВКПМ Ас-1973 продуцент гамма-аминомасляной кислоты.
Раскрытие изобретения
Задачей настоящего изобретения является поиск и отбор штаммов бифидобактерий продуцентов гамма-аминомасляной кислоты.
Отбор штаммов.
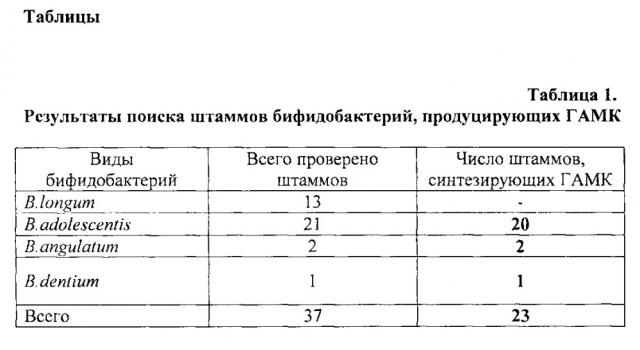
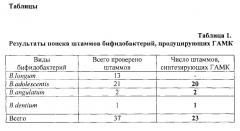
При изучении штаммов бифидобактерий видов B.longum, B.adolescentis, B.angulatum, B.dentium из коллекции лаборатории генетики микроорганизмов Института общей генетики им. Н.И. Вавилова РАН, у 37 штаммов выявили способность продуцировать ГАМК в культуральной среде. Штаммы выращивали в ростовой среде для бифидобактерий Bifidobacterium Broth (ВВ, HiMediaJndia) с 1% глютамата натрия в анаэробных условиях в анаэростате Hi Anaerobic System (ХайМедиа) при 37°С в течение 24-48 часов.
Наличие ГАМК определяли методом тонкослойной хромотографии на пластинах на стеклянной подложке (Silica gel 60 F254, Merck). Количество образуемой ГАМК определяли методом двумерного сканирования пластинок на денситометре Shimadzu. Синтез ГАМК был установлен у ряда штаммов представленных видов, кроме B.longum. Были отобраны два штамма разных видов, имеющие достаточно высокий уровень синтеза ГАМК: B.adolescentis 150 (5,6 г/л) и B.angulatum GT 102 (3,46 г/л).
Штамм B.adolescentis 150 выделен в 2014 г., штамм B.angulatum GT 102 выделен в 2013 г. из фекалий здоровых людей. Штаммы охарактеризованы в соответствии с требованиями по биобезопасности, опубликованными в Фармакопейной статье «Пробиотики для медицинского применения» Министерства здравоохранения Российской Федерации (Государственный стандарт качества лекарственных средств).
В соответствии с требованиями по характеристике пробиотических культур штаммы были депонированы в ВКПМ (г. Москва) в 2015 г. Коллекционные номера: B.adolescentis 150 - Ас-1974, B.angulatum GT 102 - Ас-1973.
Геномы патентуемых штаммов были секвенированы с использованием технологий нового поколения (Roche 454). Была дана аннотация и характеристика основных параметров секвенированных геномов.
ДНК генома штамма B.adolescentis 150 депонирована в GenBank под № LBHQ00000000, ДНК генома штамма B.angulatum GT 102 депонирована в GenBank под № LAHN00000000.
Определение видовой принадлежности патентуемых штаммов.
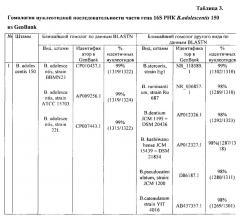
Определение видовой принадлежности штамма B.adolescentis 150 было проведено по нуклеотидной последовательности гена 16S РНК, расположенного в контиге 00020. Длина анализируемого фрагмента гена 16S рРНК составила 1321 п. н. Последовательности фрагмента гена 16S рРНК различных штаммов следующих видов: B.stercoris, В. ruminantium, B.dentium, B.kashiwanohense, B.pseudocatenulatum, B.catenulatum также были высокогомологичны целевой последовательности (таблица 3). В качестве дополнительного подтверждения принадлежности анализируемого штамма к виду В. adolescentis был проведен анализ последовательности гена серин-треониновой протеинкиназы РкЬ2, являющейся специфической для данного вида (Nezametdinova et al., 2014. Identification and characterization of the serine/threonine protein kinases in Bifidobacterium. Archives of Microbiology. 196:125-136). Нуклеотидная последовательность pkhl гена расположена в контиге 00015. Длина анализируемого фрагмента составляла 1422 п. н. В таблице 4 указана гомология нуклеотидной последовательности части гена серин-треониновой протеинкиназы Pkb2 B.adolescentis 150 к гомологам из GenBank. Штамм был идентифицирован как Bifidobacterium adolescentis.
Определение видовой принадлежности штамма B.angulatum GT 102 проводили по нуклеотидной последовательности гена 16S рибосомной РНК, расположенного в контиге 00011. Длина анализируемого фрагмента гена 16S рРНК составляла 1520 п. н. В таблице 5 указана гомология нуклеотидной последовательности части гена 16S РНК B.angulatum GT 102 с другими генами из GenBank. Последовательность фрагмента гена 16S рРНК штамма B.mericicum КСТС 3369 оказалась высокогомологичной целевой последовательности. Однако, данный вид бифидобактерий выделен из рубца крупного рогатого скота, следовательно, анализируемый штамм, выделенный из фекалий человека, принадлежит к виду Bifidobacterium angulatum.
Культурально-морфологические особенности штаммов:
По данным свойствам оба штамма неотличимы друг от друга.
Морфологические и тинкториальные свойства: грамположительные бесспоровыед гранулированные палочки с утолщениями на концах или бифуркациями.
Выросшие колонии имели следующие культуральные свойства: колонии S-формы диаметром 0,5-1,5 мм, круглые, выпуклые, гладкие, светло-бежевого или белого цвета с ровными краями. При культивировании в жидкой среде MRS в течение 24 ч происходит равномерное помутнение среды по всему ее объему, кроме зоны аэробиоза, с образованием осадка.
Способ, условия и состав сред для размножения штаммов.
Штаммы культивировали на жидкой и агаризованной средах MRS (Himedia) в течении 24-48 час. Состав среды MRS на 1 литр в граммах: протеозопептон - 10,0; мясной экстракт - 10,0; дрожжевой экстракт - 5,0; глюкоза - 20,0; полисорбат 80-1,0; цитрат аммония - 2,0; ацетат натрия - 5,0; сульфат магния - 0,1; сульфат марганца - 0,05; фосфат калия двузамещенный - 2,0. рН (при 25°С) 6,5 с добавлением стерильного 0.05% L-cysteine-HCl. Продукцию ГАМК определяли в ростовой среде для бифидобактерий Bifidobacterium Broth (ВВ) (HiMedia, India). Состав среды ВВ на 1 литр в граммах: пептон - 10,0; гидролизат казеина - 20,0; дрожжевой экстракт - 10,0; глюкоза - 20,0; порошок томатного сока - 16,65; полисорбат 80 - 2,0. Культивирование осуществляли в анаэробных условиях с использованием анаэростата и системы GasPak+. Температура инкубации 37°С. В MRS-бульоне продуктивность штаммов достигала 109 кл/мл.
У обоих штаммов не выявлена гемолитическая, протеолитическая, летициназная, ДНК-ная и РНК-ная активности.
Устойчивость (чувствительность) к антибиотикам.
Штамм В.adolescents 150 устойчив к следующим антибиотикам: полимиксину, амикацину, неомицину, гентамицину, канамицину, стрептомицину, бацитрацину; штамм чувствителен к следующим антибиотикам: хлорамфениколу, эритромицину, рифампицину, линкомицину, ванкомицину, ампициллину, тетрациклину.
Штамм B.angiilatum GT 102 устойчив к следующим антибиотикам: полимиксину, аминацину, неомицину, гентамицину, канамицину, стрептомицину, бацитрацину; штамм чувствителен к следующим антибиотикам: хлорамфениколу, эритромицину, рифампицину, линкомицину, ванкомицину, ампициллину, тетрациклину.
Устойчивость не связана с генами, расположенными на мобильных генетических элементах.
Продукты, синтезируемые штаммами:
При выращивании в ростовой среде для бифидобактерий Bifidobacterium Broth (ВВ, HiMedia, India) с 1% глутамата натрия патентуемые штаммы синтезируют и секретируют в среду ГАМК. Максимальное количество ГАМК в этих условиях обнаруживается при 48 часах инкубации и достигает 5,6 г/л для B.adolescentis 150, что составляло 60% конверсии от количества глютамата натрия и 3,46 г/л для B.angulatum 102 GT, что составляло 35% конверсии от количества глютамата натрия.
Гены глутамат декарбоксилазы у патентуемых штаммов.
В базе данных NCBI присутствует информация о последовательностях глутамат декарбоксилаз и соответствующих генов у 23 различных штаммов бифидобактерий (www.ncbi.nlm.nih.gov).
В секвенированных геномах обоих патентуемых штаммов было установлено наличие генов, которые участвуют в синтезе и транспорте (секреции) ГАМК: gadB кодирует фермент глутамат декарбоксилазу и gadC кодирует антипортер, который переносит глутамат и гамма-аминомасляную кислоту. Антипортер- часть мембранно-транспортной системы, которая обеспечивающая проход внутрь клетки через мембрану одного вещества и другого вещества в противоположном направлении (из клетки). Нуклеотидная последовательность gadB генов определялась в секвенированных геномах патентуемых штаммов. Выравнивание нуклеотидной последовательности gadB генов патентуемых штаммов с наиболее близкими по НП геномами штаммов видов B.adolescentis и B.angulatum показало наличие полиморфизма у исследуемых генов. Хотя генетическое окружение gadB генов патентуемых штаммов оказалось аналогичным gadB генам других геномов того же вида, также наблюдался полиморфизм как у соседних генов, так и для нуклеотидной последовательности между генами. Выявленный нуклеотидный полиморфизм может быть использован для генетического маркирования патентуемых штаммов.
Таким образом, способность штаммов B.adolescentis 150 и B.angulatum GT 102 активно продуцировать ГАМК, отсутствие генов вирулентности и резистентности к антибиотикам, а также отсутствие протеазной и др. активностей делают возможным использование штаммов по-отдельности и в составе различных смесей бактериальных штаммов при производстве лекарственных средств в виде лиофилизированных препаратов, капсул, жидких культур и других аналогичных средств для лечения вегето-сосудистых расстройств и депрессивных состояний. Штаммы отличны от всех описанных ранее штаммов B.adolescentis и B.angulatum, продуцирующих ГАМК, т.к. выделены из организма людей - жителей центрального региона Российской Федерации и имеют уникальную последовательность генов gad и геномов в целом.
Примеры по характеристике получения и свойствам штаммов B.adolescentis 150 и B.angulatum GT 102 по настоящему изобретению.
Пример 1.
Отбор штаммов, продуцирующих ГАМК.
Отбор штаммов, продуцирующих ГАМК проводили среди штаммов, геномы которых содержали ген gadB - глютаматдекарбоксилазы. С использованием сконструированных праймеров и ПЦР анализа проведен поиск gadB гена у 55 штаммов бифидобактерий из коллекции лаборатории генетики микроорганизмов Института общей генетики им. Н.И.Вавилова РАН, выделенных из гастро-энтерологического тракта практически здоровых людей Центрального региона России. Результаты ПЦР анализа показали наличие gadB гена у 25 штаммов, относящихся к различным видам. У 37 штаммов видов В.longum, B.adolescentis, B.angulatum, B.dentium была проверена способность продуцировать ГАМК из глютамата в культуральной среде. В таблице 1 представлено количество штаммов различных видов, способных к продукции ГАМК. В таблице 2 представлены данные по продукции ГАМК.
Пример 2.
Отбор штамма B.adolescentis 150 - продуцента ГАМК.
Опыт проводили в ростовой среде для бифидобактерий Bifidobacterium Broth (ВВ, HiMedia, India), в которую добавляли 1% глютамата натрия - предшественника ГАМК. Синтез и количество ГАМК определяли методом тонкослойной хроматографии на пластинах Silica gel 60 F254 (Merck) и двумерного сканирования пластинок на денситометре Shimadzu. Перед нанесением на пластинку пробы разводили в 10 раз. 2 мкл культуры наносили на пластинку, использовали смесь растворителей н-бутанол-уксусная кислота-вода 4:1:1; в общую смесь добавяля 0,2% нингидрина. После разделения фракций нагревали пластинку при 70°С в течении 10 минут для проявления пятен. Результаты представлены на рис. 1. В таблице 2 представлены данные по продукции ГАМК (количество образуемой ГАМК определяли методом двумерного сканирования пластинок на денситометре Shimadzu). Уровень синтеза ГАМК штамма B.adolescentis 150 был максимальный - 5,6 г/л после 48 часов инкубации, что составляло 60% конверсии от количества глютамата натрия.
Пример 3.
Синтез ГАМК штаммом B.angulatum GT 102.
Опыт проводили в обычной ростовой среде для бифидобактерий Bifidobacterium Broth (ВВ, HiMedia, India), в которую добавляли 1% глютамата натрия - предшественника ГАМК. Синтез и количество ГАМК определяли методом тонкослойной хроматографии на пластинах Silica gel 60 F254 (Merck) и двумерного сканирования пластинок на денситометре Shimadzu. Перед нанесением на пластинку пробы разводили в 10 раз. 2 мкл культуры наносили на пластинку, использовали смесь растворителей н-бутанол-уксусная кислота-вода 4:1:1; в общую смесь добавяля 0,2% нингидрина. После разделения фракций нагревали пластинку при 70°С в течении 10 минут для проявления пятен. Результаты представлены на рис. 2. В таблице 5 представлены данные по продукции ГАМК (количество образуемой ГАМК определяли методом двумерного сканирования пластинок на денситометре Shimadzu). Уровень синтеза ГАМК штамма B.angulatum GT 102 был -3,46 г/л после 48 часов инкубации, что составляло 35% конверсии от количества глютамата натрия.
Пример 4.
Нуклеотидная последовательность £яг/-генов (генов глютаматдекарбоксилазы) патентуемых штаммов и выравнивание с gad генами других геномов.
В секвенированных геномах обоих патентуемых штаммов было установлено наличие гена gadB, кодирующего фермент глутамат декарбоксилаза, участвующий в синтезе ГАМК. Нуклеотидная последовательность gadB гена штамма B.adolescentis 150 расположена в контиге 00015 (length = 49496 numreads = T739) секвенированного генома. Выравнивание нуклеотидной последовательности gadB гена штамма B.adolescentis 150 с наиболее близким по НП геномом штамма B.adolescentis L2-32 представлено в перечне последовательностей, которое указывает на наличие точечной нуклеотидной замены (см. перечень последовательностей).
Нуклеотидная последовательность gadB гена штамма В. angulation GT 102 расположена в контиге 00001 (length m= 775061 numreads = 34230) секвенированного генома. Выравнивание нуклеотидной последовательности gadB гена штамма В. angulatum GT 102 с наиболее близким по НП геномом штамма B.angulatum strain LMG 11039 представлено в перечне последовательностей, которое указывает на наличие многочисленных точечных нуклеотидных замен (см. перечень последовательностей).
Пример 5.
Генетическое окружение gatf-генов (генов глютаматдекарбоксилазы) патентуемых штаммов.
Ген gadB как правило расположен рядом с геном gadC, который кодирует антипортер, участвующий в переносе глутамат и гамма-аминомасляной кислоты в бактерии. Часто эти гены образуют оперон. В секвенированных геномах обоих патентуемых штаммов рядом с gadB геном также был обнаружен gadC ген. Генетическое окружение gadB- gadC генов патентуемых штаммов оказалось аналогичным для других геномов того же вида.
При выравнивании нуклеотидной последовательности генов и пространства между ними наблюдается полиморфизм (см. перечень последовательностей). Это также указывает на уникальность патентуемых штаммов и может быть использовано для дополнительного генетического маркирования.
Пример 6.
Характеристика основных параметров секвенированных геномов патентуемых штаммов
Геномы патентуемых штаммов были секвенированы с использованием технологий нового поколения (Roche 454). С помощью специальных программ дана характеристика основных параметров секвенированных геномов:
Геном В. adolescentis 150 размером 2316161 пар оснований содержит 1830 кодирующей последовательности. С помощью PGAAP программы в геноме были определены: 6 оперонов рРНК, 54 гена тРНК, 81 псевдогенов, 1 ген некодирующей РНК, 2 гена CRISPR систем и 20 генов со сдвинутыми рамками считывания, 4 IS элемента, принадлежащих к IS3 и IS256 семействам. В геноме отсутствуют гены патогенности и трансмиссивные гены устойчивости к антибиотикам.
Геном В. angulation GT 102 размером 2046935 пар оснований содержит 1520 кодирующей последовательности. С помощью PGAAP программы в геноме были определены: 3 оперона рРНК, 56 генов тРНК, 72 псевдогена, 1 ген декодирующей РНК, 3 гена CRISPR систем и 14 генов со сдвинутыми рамками считывания. В геноме отсутствуют гены патогенности и трансмиссивные гены устойчивости к антибиотикам.
Рис.1. Продукция ГАМК после 24 часов культивирования (А) и 48 часов культивирования (В). 1 - ГАМК (1 mg/ml); 2 - ГАМК (0,5 mg/ml); 3 - ГАМК (0,25 mg/ml); 4 - glutamate (1 mg/ml); 5 - glutamate (0,5 mg/ml); 6 - glutamate (0,25 mg/ml); 7 - В.longum 379; 8 - В.longum 2c; 9 - B.longum St2; 10 - B.longum CKB4; 11 - В.adolescentis 48-2; 12 - B.adolescentis 48; 13 - B.adolescentis 44; 14 - B.adolescentis 44-2; 15 - В.adolescentis 152; 16 - В.adolescentis 110; 17 - B.adolescentis 150; 18 - В.adolescentis 174; 19 - В.adolescentis 108.
Рис. 2. Продукция ГАМК после 24 часов культивирования (А) и 48 часов культивирования (В). 1 - ГАМК (1 mg/ml); 2 - ГАМК (0,5 mg/ml); 3 - ГАМК (0,25 mg/ml); 4 - glutamate (1 mg/ml); 5 - glutamate (0,5 mg/ml); 6 - glutamate (0,25 mg/ml); 7 - В.adolescentis Km5-1; 8 - В.adolescentis Km4; 9 - В.adolescentis Тв29; 10 - В.adolescentis 277; 11 - В.adolescentis 104; 12 - В.adolescentis 282; 13 - В.adolescentis 56; 14 - В.adolescentis 57; 15 - В.adolescentis 76; 16 - В.angulatum 102; 17 - В.dentium 9; 18 - В.adolescentis 191; 19 - В.angulatum 334-1.
1. Штамм Bifidobacterium adolescentis ВКПМ Ас-1974 продуцент гамма-аминомасляной кислоты.
2. Штамм Bifidobacterium angulatum ВКПМ Ас-1973 продуцент гамма-аминомасляной кислоты.