Штамм гриба из класса sordariomycetes - продуцент антибиотика эремоксиларина а.
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Штамм аскомицетного гриба из класса Sordariomycetes ИНА 01108 обладает способностью продуцировать антибиотик эремоксиларин А. Штамм аскомицетного гриба из класса Sordariomycetes депонирован во Всероссийской коллекции микроорганизмов Федерального государственного бюджетного учреждения науки Институт биохимии и физиологии микроорганизмов им. Г.К.Скрябина РАН под регистрационным номером ВКМ F-4676D и может быть использован в медицине. Изобретение позволяет повысить выход антибиотика эремоксиларина А. 4 ил., 2 табл., 1 пр.
Реферат
Настоящее изобретение относится к штамму - продуценту антибиотика эремоксиларина А.
Предшествующий уровень техники
Эремоксиларин А относится к природным сесквитерпенам эремофиланового типа (Овчинников Ю.А. Биоорганическая химия, М., 1987, с. 693-702). Соединения этой группы описаны преимущественно у растений, они содержатся в составе эфирных масел, живиц, скипидаров и зачастую обусловливают характерный для растения запах. Особенно богаты сесквитерпенами хвойные и цветковые растения, но также они встречаются у грибов и насекомых. Для медицины представляет интерес эффективность ряда сесквитерпенов в отношении простейших, гельминтов, насекомых, бактерий, в том числе микобактерий, а также в отношении злокачественных новообразований (А.В. Погребняк, В.В. Поройков, В.В. Старых, Д.А. Коновалов. Компьютерный прогноз противоопухолевой активности сесквитерпеновых лактонов, обнаруженных в представителях семейства Asteraceae. Растит. Ресурсы. 1998. Т. 34. №1. С. 61-64; J. Wen, K. You, S. Lee, С. Song, D. Kim. Oxidative stress-mediated apoptosis. The anticancer effect of the sesquiterpene lactone parthenolide. The J. of Biol. Chem. 2002. V. 277. №41. P. 38954-38964; L.A. McDonald, L.R. Barbieri, V.S. Bernan, J. Janso, P. Lassota, G.T. Carter. 07H239-A, a new cytotoxic eremophilane sesquiterpene from the marine-derived xylariaceous fungus LL-07H239. J. Nat. Prod. 2004. V. 67. P. 1565-1567. S. Zang, Y.K. Won, C.N. Ong, H.M. Shen. Anti-cancer potential of sesquiterpene lactones: bioactivity and molecular mechanisms. Curr. Med. Chem. Anticancer Agents. 2005. №5. P. 239-249; Y. Shiono, T. Murayama, K. Takahashi, K. Okada, S. Katohda, M. Ikeda. Three oxygenated cyclohexenone derivatives, produced by an endophytic fungus. Biosci Biotechnol Biochem 2005. V. 69. P. 287-292; J. Luna-Herrera, M.C. Costa, H.G. Gonzalez, A.1. Rodrigues, P.C. Castilho. Synergistic antimycobacterial activities of sesquiterpene lactones from Lauins spp. J. of antimicrobial chemother. 2007. №59. P. 548-552; M.C. Dolan, N.A. Panella, E.B.G. Dietrich, J.J. Karchesy, G.O. Maupin. Pest control compositions and methods for their use. 2007. Патент US 7230033 B2; J. Zhang, X. Jl, J. Liu, J. Zidichouski, Y. Wang. New eremophilane sesquiterpene lactones from senecio jacobaea. 2010. Патент WO 2011050481 A1; J.S. Toledo, S.R. Ambrosio, C.H.G Borges, V. Manfrim, D.G. Cerri, A.K. Cruz, F.B. Da Costa. In vitro leishmanicidal activities of sesquiterpene lactones from Tithonia diversifolia against Leishmania braziliensis promastigotes and amastigotes. Molecules. 2014. V. 19. P. 6070-6079).
Эремоксиларин А наряду с эремоксиларином В впервые описан в Японии в 2005 году как продукт аскомицетного плесневого гриба из рода Xylaria - эндофита растения (штамм YUA-026). Гриб культивируют в течение 3 недель на неочищенном рисе, используемом в качестве питательной среды. Из риса с выросшим мицелием гриба эремоксиларин А экстрагируют, выделяют и очищают. Из 1 кг риса получают в итоге 66 мг эремоксиларина A (Y. Shiono, Т. Murayama. New eremophilane-type sesquiterpenoids, eremoxylarins A and В from xylariaceous endophytic fungus YUA-026. Z. Naturforsch. 2005. V. 60. P. 885-890). Выделение и очистку проводят, ориентируясь на антибактериальную активность. Помимо антибактериального действия, показана другая биологическая активность - эремоксиларины А и В ингибируют кальциневрин не зависящим от иммунофилина образом (Y. Ogasawara, J. Yoshida, Y. Shiono, Т. Migakawa, К. Kimura. New eremophilane sesquiterpenoid compounds, eremoxylarins A and В directly inhibit calcineurin in a manner independent of immunophilin. J. Antibiot. 2008. V. 61. №8. P. 496-502).
Прототипом настоящего изобретения является указанная выше работа, в которой описан штамм YUA-026 и способ получения на его основе антибиотика эремоксиларина А, а также применение эремоксиларина А в качестве антибактериального антибиотика (Y. Shiono, Т. Murayama. New eremophilane-type sesquiterpenoids, eremoxylarins A and В from xylariaceous endophytic fungus YUA-026. Z. Naturforsch. 2005. V. 60. P. 885-890). Недостатком прототипа являются низкая продуктивность антибиотика эремоксиларина А у штамма YUA-026. Недостатки прототипа преодолеваются в настоящем изобретении.
Описание настоящего изобретения
Объектом настоящего изобретения является штамм гриба, который был выделен из природной среды и депонирован во Всероссийской коллекции микроорганизмов Федерального государственного бюджетного учреждения науки «Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН», уполномоченной на депонирование для целей патентной экспертизы, под номером ВКМ F-4676D (дата депонирования 16.07.2015), а также в Коллекции культур микроорганизмов Федерального государственного бюджетного научного учреждения «Научно-исследовательский Институт по изысканию новых антибиотиков имени Г.Ф. Гаузе» (ФГБНУ «НИИНА») под номером ИНА 01108 (дата депонирования 17.06.2015).
Морфологическая характеристика штамма гриба ВКМ F-4676D
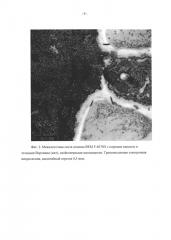
На агаризованной питательной среде с солодовым экстрактом (среда АССЭ; состав среды в %: солодовый экстракт - 2%, агар - 2%, вода водопроводная - 96%) при температуре 24°С штамм ВКМ F-4676D растет быстро, формируя на 5 сутки роста колонии диаметром 5 см. Вегетативный воздушный мицелий белый, войлоковидный, местами имеются скопления темноокрашенных гиф. Экзопигмент отсутствует. Обратная сторона желтоватая. Стромы (начальная телеоморфная стадия) образуются в культуре на 40-50 сутки роста, достигают высоты 2 см, цилиндрические в основании, неразветвленные, постепенно суживающиеся кверху. Незрелая телеоморфная строма представляет собой плотно прилегающие друг к другу гифы ярко-оранжевого цвета, с возрастом темнеющие до темно-коричневого цвета, внутренняя часть стромы не окрашена (фиг. 1а). Конидиеносцы (анаморфная стадия) развиваются на поверхности незрелой телеоморфной стромы. Поверхность стромы имеет неровный бугристый вид из-за полушаровидных выпуклых «подушечек», состоящих из плотного слоя дихотомически разветвленных несколько раз конидиеносцев. Конидиеносцы заканчиваются широкоовальными, иногда почти цилиндрическими конидиогенными клетками, расположенными палисадным слоем по поверхности стромы (фиг. 1в). Конидии образуются холобластически, места их прикрепления хорошо заметны на конидиогенной клетке (фиг. 1г). Конидии гиалиновые, одноклеточные, 7-10×3-5 мкм, с гладкой поверхностью, булавовидные, постепенно сужающиеся в базальной части, с усеченным основанием. В процессе длительного культивирования в течение 3-6 месяцев строма претерпевает изменения. Образуются темно-коричневые полушаровидные распростертые стромы (фиг. 1б), состоящие их плотного сплетения темноокрашенных гиф, из-за чего поверхность колонии приобретает бугристый характер. На основании вышеперечисленных признаков штамм ВКМ F-4676D предположительно относится к аскомицетам класса Sordariomycetes. С помощью электронной микроскопии было показано наличие простой поры и приуроченных к ней телец Воронина, что подтверждает принадлежность штамма ВКМ F-4676D к аскомицетам (фиг. 2).
Определение таксономического положения методом анализа гена рибосомальной РНК штамма гриба ВКМ F-4676D
Из-за отсутствия полового спороношения и невозможности на основании морфологических признаков провести видовую диагностику с целью уточнения таксономической принадлежности был проведен генетический анализ нуклеотидной последовательности области D1/D2 региона 26S (LSU) рДНК и внутреннего транскрибируемого района its1-5.8S-its2 штамма ВКМ F-4676D (фиг. 3). ДНК амплифицировали с использованием праймеров ITS1f (5'-СТТGGTCATТТАGAGGAAGTA) и NL4 (5'-GGTCCGTGTTTCAAGG). Последующее секвенирование осуществляли на генном анализаторе Applied Biosystems 3500 (США). Для сравнения использовали материалы базы данных NCBI (http://ncbi.nlm.nih.gov/). Установлено, что наиболее близкой последовательностью (совпадение 99%) обладают несколько штаммов аскомицетов - эндобионтов растений и лишайников из класса Sordariomycetes (J.М. U'Ren, F. Lutzoni, J. Miadlikowska, A.D. Laetsch, A.E. Arnold. Host and geographic structure of endophytic and endolichenic fungi at a continental scale. American Journal of Botany. 2012. V. 99. #5. P. 898-914), что также подтверждает принадлежность штамма ВКМ F-4676D к данному классу.
Физиолого-культуральные свойства штамма гриба ВКМ F-4676D
Утилизацию различных источников питания оценивали по образованию биомассы штаммом ВКМ F-4676D в условиях глубинного роста на среде Чапека-Докса. Наилучшими источниками питания является мальтоза (сухая биомасса принята за 100%), несколько хуже глюкоза, сахароза и крахмал (80-86%), глицерин (47%), лактоза, пшеничная мука (35-45%), отруби, этиловый спирт (18-20%). В разработанных для роста и биосинтеза средах использовали солодовый экстракт, содержащий в большом количестве мальтозу.
Приготовление партий посевного материала штамма ВКМ F-4676D
Штамм выращивают в пробирках на скошенном агаре АССЭ, состав которого указан выше, в течение 14-16 суток при температуре 24°С. Полученный посевной материал хранят при температуре +4°С и используют на протяжении года без снижения продуктивности.
Условия глубинного культивирования штамма ВКМ F-4676D
Глубинное культивирование штамма ВКМ F-4676D проводят в две стадии в колбах Эрленмейера объемом 750 мл со 150 мл среды в условиях интенсивного аэрирования на роторной качалке с 200 об/мин при температуре 28°С. На первой стадии используют среду №1 следующего состава (%): солодовый экстракт - 1-3, соевая мука - 0,1-0,2, вода водопроводная - 96,8-98,9. Для засева среды в колбы вносят агаровый блок площадью 1-2 см2 с посевным материалом штамма ВКМ F-4676D и выращивают 7 суток. Затем полученную на первой стадии глубинную культуру в количестве 2-7 об. % переносят в колбы со средой №2 следующего состава (%): солодовый экстракт - 1-2, вода водопроводная - 98-99 и выращивают на второй стадии в течение 7 суток.
Определение антимикробной активности глубинной культуры штамма BKM F-4676D
Антибиотическую активность полученной культуральной жидкости определяют методом диффузии в агар. Для этого в чашках среду АССЭ заражают суспензией тест-бактерии Staphylococcus aureus ИНА 00761 (метициллинрезистентный штамм золотистого стафилококка - MRSA), делают лунки диаметром 9 мм, в которые закапывают по 100 мкл культуральной жидкости. Установлено, что наибольшее количество эремоксиларина А содержится в культуральной жидкости штамма ВКМ F-4676D на седьмые сутки второй стадии глубинного культивирования, при этом диаметры зон задержки роста тест-штамма ИНА 00761 максимальны и составляют 28-30 мм.
Выделение, очистка и определение структуры эремоксиларина А из культуральной жидкости штамма ВКМ F-4676D
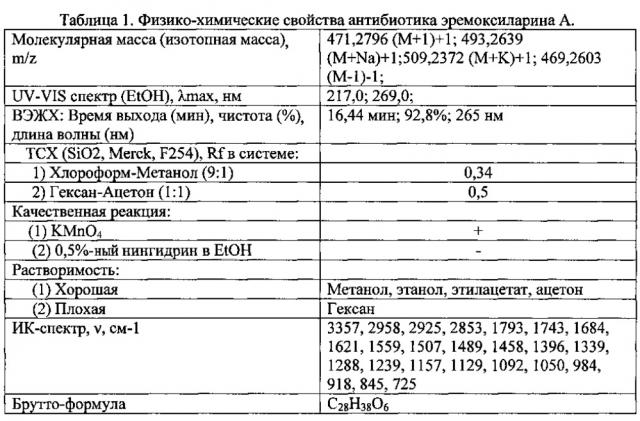
На 14 сутки двухстадийного культивирования штамма ВКМ F-4676D из культуральной жидкости мицелий осаждают центрифугированием и экстрагируют ацетоном. Полученный экстракт упаривают в вакууме досуха при 37°С, остаток растворяют в этаноле и дальнейшую очистку антибиотика проводят на колонках №1 и №2, заполненных силикагелем Kieselgel 60 (фирма Merck, США). На колонке №1 элюцию осуществляют смесью хлороформ-метанол (95:5). Фракции упаривают при 37°С досуха, растворяют в этаноле, вносят в колонку №2 и элюируют последовательно гексаном и смесью гексан:ацетон (8:2). Фракции, обладающие антибиотическим действием в отношении тест-штамма S. aureus ИНА 0076 (MRSA), объединяют и упаривают в вакууме досуха при 37°С. В полученном продукте структуру эремоксиларина А устанавливают методами элементного анализа, UV-VIS-спектрофотометрии, ВЭЖХ, ИК, ЯМР и масс-спектроскопии (табл. 1; фиг. 4).
Продуктивность штамма ВКМ F-4676D по эремоксиларину А
Продуктивность штамма означает содержание эремоксиларина А в единице объема культуральной жидкости, образовавшееся в результате биосинтеза при культивировании штамма ВКМ F-4676D. В результате двухстадийной ферментации на разработанных питательных средах продуктивность штамма ВКМ F-4676D составляет от 110 до 140 мг/л, что на 66-116% превышает уровень биосинтеза штамма-прототипа.
Спектр антимикробного действия и определение минимальной подавляющей концентрации (МПК) эремоксиларина А
Выделенный эремоксиларин А с чистотой более 99,5% используют для определения МПК в отношении ряда тест-бактерий. МПК определяют in vitro методом двукратных серийных разведений в диапазоне концентраций 32-0,125 мкг/мл. Из табл. 2 следует, что эремоксиларин А эффективен в отношении грамположительных бактерий, в том числе в отношении двух тест-штаммов MRSA, при величине МПК 0,25-1 мкг/мл.
Далее настоящее изобретение поясняется примером, который служит его иллюстрацией и не ограничивает области охвата настоящего изобретения, изложенной в формуле изобретения.
Пример
На первой стадии культивирования в колбу Эрленмейера объемом 750 мл со 150 мл среды следующего состава (%): солодовый экстракт «Maltax» (Финляндия) - 2, соевая мука - 0,1, вода водопроводная - 97,9 вносят посевной материал в виде агарового блока площадью 1 см2 с мицелием штамма ВКМ F-4676D. Колбу помещают на роторную качалку с 200 об/мин и инкубируют при температуре 28°С в течение 7 суток. Для второй стадии культивирования используют 18 колб Эрленмейера объемом 750 мл со 150 мл среды следующего состава (%): солодовый экстракт «Maltax» (Финляндия) - 1,5, вода водопроводная - 98,5. В колбы вносят в качестве посевного материала по 7,5 мл культуральной жидкости, полученной на первой стадии культивирования. Через 7 суток инкубирования на качалке с 200 об/мин при температуре 28°С культуральную жидкость из 18 колб объединяют. Общий объем культуральной жидкости составляет 2,430 л. Мицелий осаждают центрифугированием в режиме 4000 об/мин в течение 6 мин в центрифуге Rotina 420R (фирма Hettich, Германия). Массу мицелия, равную 410 г, экстрагируют 200 мл ацетона. Полученный экстракт упаривают в вакууме при 37°С, остаток растворяют в 4 мл ацетона и вносят в колонку №1 размером 14×180 мм, заполненную силикагелем Keiselgel 60 (фирма Merck, США). Элюцию проводят 200 мл смеси хлороформ-метанол (95:5), полученную фракцию упаривают досуха, растворяют в 2 мл этанола и вносят в колонку №2. Колонку №2 промывают 200 мл смеси гексан-ацетон (95:5), после чего элюируют эремоксиларин А 100 мл смеси гексан-ацетон (8:2) и полученный элюат упаривают досуха. Выход сухого продукта составляет 330 мг при содержании эремоксиларина А 92,8%. Расчет продуктивности штамма ВКМ F-4676D в описанных условиях производят по формуле:
П=(К×ЭК)/(100%×V)=(330×92,8)/(100×2,340)=130,9 мг/л
где:
П - продуктивность (мг/л);
К - вес сухого продукта (мг);
ЭК - содержание эремоксиларина А в сухом продукте (%);
V - объем культуральной жидкости (л).
Продуктивность штамма ВКМ F-4676D при описанном способе биосинтеза в данном примере составляет 130,9 мг/л эремоксиларина А.
Штамм аскомицетного гриба из класса Sordariomycetes - продуцент антибиотика эремоксиларина А, депонированный во Всероссийской коллекции микроорганизмов Федерального государственного бюджетного учреждения науки Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН под номером ВКМ F-4676D.