Остеотропный радиофармацевтический препарат для пэт-визуализации
Иллюстрации
Показать всеИзобретение относится к области ядерной медицины, в частности к радиофармацевтическим препаратам (РФП) для визуализации метастатических поражений костной ткани методами позитронно-эмиссионной томографии (ПЭТ) и планирования лучевой терапии. Поставленная задача решается тем, что в качестве препарата для ПЭТ-визуализации метастатических поражений костной ткани и планирования лучевой терапии предлагается композиция, представляющая собой раствор, содержащий галлий-68 в виде комплекса с окса-бис(этиленнитрило)тетраметиленфосфоновой кислотой, а также натрия хлорид, натрия гидроксид и фосфатный буфер, включающий фосфат натрия и гидрофосфат натрия. Препарат получают из лиофилизированной композиции при комнатной температуре в течение 1-2 мин, радиохимическая чистота препарата более 90%, диапазон значений рН от 4,5 до 8,0, максимальное накопление препарата в патологической костной ткани достигается через 1,5 ч после введения и составляет 40-45% от введенной активности, коэффициент дифференциального накопления костная мозоль/кровь составляет более 10, накопление препарата в крови не превышает 0,30%/г. 3 ил., 4 пр., 1 табл.
Реферат
Изобретение относится к области медицины, в частности к радиофармацевтическим препаратам (РФП) для визуализации метастатических поражений костной ткани методами позитронно-эмиссионной томографии (ПЭТ) и планирования лучевой терапии.
Известен широкий спектр радиофармацевтических препаратов, содержащих радионуклид (РН) технеция-99 м или индия-111, 113 м, применяемых для визуализации патологий костной ткани методами однофотонной эмиссионной томографии (ОФЭКТ).
Тем не менее в последнее время возрастает интерес к диагностике опухолевых заболеваний с помощью ПЭТ-технологий, которые обладают несравненными преимуществами перед ОФЭКТ.
ПЭТ имеет более высокую пространственную разрешающую способность, что позволяет выявлять очаги поражения размером от 2-8 мм на более ранних стадиях развития опухоли. Общепризнано, что с начала широкого применения ПЭТ в онкологии прогноз выживания пациентов увеличился в два раза. А в 30% случаев применения ПЭТ приводит к изменению тактики лечения онкологических больных.
Стоит отметить, что период полураспада радионуклидов, применяемых в ПЭТ, сравнительно меньше, чем у РН для ОФЭКТ. Это приводит к снижению дозовой нагрузки на организм пациента. Благодаря сравнительно высокой энергии аннигилляционных гамма-квантов (511 кэВ), которые образуются при взаимодействии испускаемых радионуклидами, применяемых в ПЭТ-технологиях, позитронов с электронами вещества, по отношению к энергии излучения радионуклидов, используемых в ОФЭКТ (100-200 кэВ), при обследовании более тучных пациентов, поглощение излучения в мягких тканях не влияет на качество получаемого изображения.
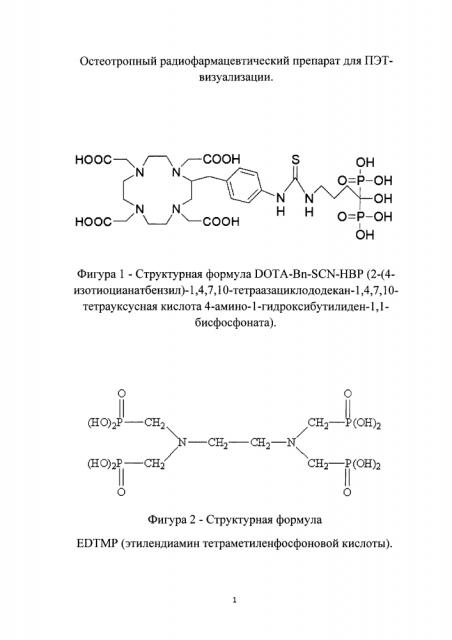
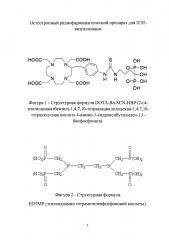
Из уровня техники известен ряд препаратов, применяемых для ПЭТ-визуализации метастатических поражений костной ткани и планирования лучевой терапии, содержащих позитрон-излучающие радионуклиды фтор-18 или галлий-68, например, [18F]F-FDG (2-фтор-2-дезокси-D-глюкоза), [18F]NaF (фторид натрия), DOTA-Bn-SCN-HBP (2-(4-изотиоцианатбензил)-1,4,7,10-тетраазациклодо декан-1,4,7,10-тетрауксусная кислота 4-амино-1-гидроксибутилиден-1,1-бисфосфонат), [68Ga]Ga-EDTMP (этилендиамин тетраметиленфосфоновая кислота).
[18F]F-FDG представляет собой биологический аналог глюкозы, в котором гидроксильная группа второго атома углерода замещена на атом фтора-18. Визуализация с помощью [18F]F-FDG возможна благодаря тому, что препарат захватывается клетками опухоли, фосфорилируется гексокиназой и накапливается в тканях с высокой метаболической активностью. Известны сведения о применении [18F]F-FDG для визуализации костных метастазов, образованных от рака простаты. Одним из недостатков является высокая вероятность получения ложно-отрицательных результатов при исследовании склеротических метастазов [1].
Препарат [18F]NaF эффективно связывается с гидроксиаппатитом (ГА), который является основным компонентом неорганического матрикса кости. В исследованиях pre-vivo отмечено, что [18F]NaF связывается с ГА практически на 60%. Тем не менее при исследованиях in-vivo, на мышах, накопление в пораженных костных тканях составляет около 39%. Недостатком, как и в случае с [18F]F-FDG, является низкая эффективность визуализации при исследовании склеротических метастазов [2].
Для РФП [18F]NaF и [18F]F- FDG характерна высокая вероятность получения ложно-положительных результатов при визуализации минимальных патологических изменений в костной ткани [2].
Основным недостатком описанных выше РФП является то, что радионуклид (РН) фтор-18 получают при облучении мишеней на циклотроне, который должен быть расположен непосредственно в медицинском центре и входить в единую технологическую линию синтеза радиофармпрепарата. Данный метод является дорогостоящим. Поэтому большой интерес представляют генераторные позитрон-излучающие радионуклиды, в частности галлий-68. В настоящее время коммерческое производство генераторов 68Ge/68Ga началось в нескольких странах мира. Большой период полураспада материнского 68Ge (Т1/2=270,9 сут) обеспечивает продолжительный срок эксплуатации генератора, а малый период полураспада 68Ga (Т1/2=67,7 мин) позволяет использовать радиофармпрепараты (РФП) необходимой активности, не создавая при этом значительной дозовой нагрузки на пациента.
Препараты галлия-68 в основном содержат бисфосфонаты (БФ), которые признаны новым эффективным классом лекарственных средств и на сегодняшний день являются препаратами выбора при лечении патологических состояний, характеризующихся повышением остеокласт-опосредованной костной резорбции, а именно болезни Педжета, остеопороза и опухолевых поражений костей.
В настоящее время представляют интерес разработки препаратов на основе производных макроциклов, например DOTA-Bn-SCN-HBP (фигура 1) [3]. Тем не менее отмечено более низкое накопление [68Ga] Ga-DOTA-Bn-SCN-HBP в бедренной кости, в сочетании с невысоким коэффициентом дифференциального накопления бедренная кость/кровь по сравнению с [99mTc]Tc-HMDP (гидроксиметилендифосфонат). Стоит отметить, что процесс мечения таких конъюгатов как DOTA-Bn-SCN-HBP радионуклидом галлий-68 достаточно длительный процесс, который проводят при нагревании смеси в течение длительного времени. Например, для получения меченного галлием-68 DOTA-Bn-SCN-HBP реакционную смесь нагревают в течение 30 минут при 95°C. Перед введением готовый препарат необходимо охладить. В результате активность готового препарата с момента начала синтеза снижается практически в два раза. Кроме того, стоимость исходных конъюгатов достаточно высока.
В качестве прототипа выбрано соединение галлияя-68 на основе ациклического фосфоната - [68Ga]Ga-EDTMP (фигура 2), который получают следующим образом [2]. Генератор 68Ge/68Ga элюируют 5 мл 0,1 М раствора соляной кислоты (HCl). Элюат, объемом 2 мл, смешивают с 0,9% раствором NaCl, объемом 3 мл. Смесь добавляют во флакон, содержащий 25 мг EDTMP в лиофилизированной форме (Multibone kit), и выдерживают в течение 30 минут при комнатной температуре. Значение рН доводят до значения 5,5-6 с помощью 1 М ацетатного буфера.
Радиохимическую чистоту (РХЧ) [68Ga]Ga-EDTMP определяют в системе ITLC/SG-метанол/ацетатный буфер (1:1). РХЧ составила около 99%.
Основными показателями для РФП, наряду с радиохимической чистотой, являются коэффициент дифференциального накопления скелет/кровь, накопление в патологической костной ткани, время максимального накопления.
При проведении экспериментов in-vivo накопление [68Ga]Ga-EDTMP в костях составило около 13%. При этом сведения о содержании препарата в крови не представлены.
Эти обстоятельства поставили перед авторами задачу разработки радиофармацевтического препарата для ПЭТ-визуализации метастатических поражений костной ткани и планирования лучевой терапии, представляющего собой физиологически приемлемый раствор 68Ga с высокой радиохимической чистотой, обладающего стабильностью при введении в организм, способностью повышенного накопления в воспалительных очагах костной ткани при низком коэффициенте дифференциального накопления скелет/кровь, синтез которого возможен при комнатной температуре с минимальными затратами времени.
Поставленная задача решается тем, что в качестве препарата для ПЭТ-визуализации метастатических поражений костной ткани и планирования лучевой терапии предлагается композиция, представляющая собой раствор, содержащий галлий-68 в виде комплекса с окса-бис(этиленнитрило)тетраметиленфосфоновой кислотой (фигура 3), а также натрия хлорид, натрия гидроксид и буферный раствор, в частности фосфатный буфер, включающий фосфат натрия и гидрофосфат натрия.
Препарат приготавливают следующим образом. Галлий-68 получают из генератора 68Ge/68Ga. Элюирование генератора проводят путем пропускания через генератор 0,1 М раствора HCl со скоростью ~1-5 мл/мин при помощи одноразового шприца. Объем элюата составляет от 5 до 7 мл.
Полученный элюат объемом от 1,5 до 2,5 мл вводят в лиофилизированную композицию, содержащую:
| окса-бис(этиленнитрило)тетраметиленфосфоновая | |
| кислота дигидрат | 10,3 мг |
| натрия гидроокиси | 11,2 мг |
| гидрофосфат натрия в пересчете на безводный | 4,2 мг |
| фосфат натрия в пересчете на безводный | 0,9 мг |
| натрия хлорида | 4,0 мг |
РФП готов сразу после растворения лиофилизата и не требует дополнительного нагревания. Радиохимическая чистота препарата, определяемая в системе ITLC - этанол:пиридин:вода (1:2:4), более 90%.
Активность полученного препарата по галлию-68 на время изготовления составляет от 37 до 1850 МБк. Допустимый объем для растворения лиофилизата определен экспериментальным путем, при этом предельные значения концентраций компонентов следующие:
| окса-бис(этиленнитрило)тетраметиленфосфоновая | |
| кислота | 0,008-0,013 ммоль/мл |
| натрия гидроокиси | 0,112-0,186 ммоль/мл |
| гидрофосфат натрия | 0,012-0,019 ммоль/мл |
| фосфат натрия | 0,002-0,004 ммоль/мл |
| натрия хлорида | 0,027-0,045 ммоль/мл |
Активность полученного препарата по галлию-68 на время изготовления составляет от 37 до 1850 МБк. Значение рН препарата лежит в диапазоне от 4,5 до 8,0.
Биологическое поведение (распределение по органам и системам) препаратов изучали на белых беспородных крысах-самках весом 120-150 г. Во время экспериментов животных содержали в стандартных условиях (специальное помещение, рекомендованный рацион, свободный доступ к питьевой воде, естественное освещение). Все процедуры, связанные с умерщвлением животных, выполняли согласно правилам проведения работ с использованием экспериментальных животных и европейской конвенцией по их защите, изложенной в директиве Европейского сообщества (86/609/ЕС).
Раствор препарата с объемной активностью 37 МБк/мл вводили в хвостовую вену животных в объеме 0,2-0,3 мл (3,7 МБк на животное). Через 30 мин, 1 ч, 2 ч и 3 ч после инъекций животных умерщвляли декапитацией в состоянии легкого эфирного наркоза. Затем отбирали пробы крови, мышечной и опухолевой тканей, а также все жизненно важные органы (сердце, легкие, печень, почки, кишечник, желудок). Содержание РФП в органах и системах определяли с помощью метода прямой радиометрии.
Описываемый радиофармпрепарат, содержащий позитрон-излучающий радионуклид, избирательно накапливается в пораженных костных тканях и позволяет применять для диагностики высокочувствительные ПЭТ-технологии. Получение корректных данных позволяет выбирать правильную тактику лечения.
Наличие в составе хлорида натрия, гидроксида натрия, фосфата натрия и гидрофосфата натрия позволяет получать конечный продукт (препарат) с приемлемым для введения в организм человека значением рН, с высоким значением радиохимической чистоты.
Максимальное накопление препарата в патологической костной ткани наблюдается через 1,5 ч и составляет 40-45% от введенной активности. Коэффициент дифференциального накопления костная мозоль/кровь составляет более 10. При этом накопление препарата в крови не превышает 0,30%/г.
Таким образом, при решении поставленной задачи достигается технический результат, заключающийся в получении радиофармацевтического препарата, представляющий собой раствор, содержащий галлий-68 в виде комплекса с окса-бис(этиленнитрило)тетраметиленфосфоновой кислотой, а также натрия хлорид, натрия гидроксид и фосфатный буфер, включающий фосфат натрия и гидрофосфат натрия, пригодный для ПЭТ-визуализации метастатических поражений костной ткани и планирования лучевой терапии, получение которого возможно из лиофилизированной композиции при комнатной температуре в течение 1-2 мин, радиохимическая чистота препарата более 90%, диапазон значений рН от 4,5 до 8,0, максимальное накопление препарата в патологической костной ткани достигается через 1,5 ч после введения и составляет 40-45% от введенной активности, коэффициент дифференциального накопления костная мозоль/кровь составляет более 10, накопление препарата в крови не превышает 0,30%/г.
Изобретение поясняется следующими примерами.
Пример 1. Галлий-68 получали из генератора 68Ge/68Ga производства. Элюирование генератора проводят путем пропускания через генератор 0,1 М раствора HCl со скоростью ~1-5 мл/мин при помощи одноразового шприца. Раствор HCl готовят из фиксанала или разбавлением концентрированной кислоты. В обоих случаях концентрацию HCl в готовом растворе подтверждают титрованием. Объем элюата составлял от 5 до 7 мл.
Пример 2. Препарат содержит:
| галлия-68 | 37 МБк |
| оксабифор-кислота | 0,008 ммоль/мл |
| натрия гидроокиси | 0,112 ммоль/мл |
| гидрофосфат натрия | 0,012 ммоль/мл |
| фосфат натрия | 0,002 ммоль/мл |
| натрия хлорида | 0,027 ммоль/мл |
Для приготовления препарата во флакон с лиофилизатом вводят 2,5 мл раствора галлия хлорида, 68Ga, получаемого из генератора 68Ge/68Ga, с необходимой объемной активностью путем прокола иглой шприца резиновой пробки. Полученный раствор перемешивают. Препарат готов к применению после полного растворения лиофилизата. Радиохимическая чистота препарата 97,0%. Значение рН равно 5,1.
Пример 3. Препарат содержит:
| галлия-68 | 370 МБк |
| оксабифор-кислота | 0,013 ммоль/мл |
| натрия гидроокиси | 0,186 ммоль/мл |
| гидрофосфат натрия | 0,019 ммоль/мл |
| фосфат натрия | 0,004 ммоль/мл |
| натрия хлорида | 0,045 ммоль/мл |
Для приготовления препарата во флакон с лиофилизатом вводят 1,5 мл раствора галлия хлорида, 68Ga, получаемого из генератора 68Ge/68Ga, с необходимой объемной активностью путем прокола иглой шприца резиновой пробки. Полученный раствор перемешивают. Препарат готов к применению после полного растворения лиофилизата. Радиохимическая чистота препарата 95,0%. Значение рН готового препарата равно 7,5.
Пример 4. Для проведения исследования функциональной пригодности применен препарат следующего состава:
| галлия-68 | 74 МБк |
| оксабифор-кислота | 0,010 ммоль/мл |
| натрия гидроокиси | 0,140 ммоль/мл |
| гидрофосфат натрия | 0,015 ммоль/мл |
| фосфат натрия | 0,003 ммоль/мл |
| натрия хлорида | 0,034 ммоль/мл |
Радиохимическая чистота препарата, определяемая в системе ITLC - этанол: пиридин: вода (1:2:4), 98,0%. Значение рН препарата равно 6,2.
В качестве тест-систем для оценки функциональной пригодности исследуемого РФП выбраны крысы белые, конвенциальные, самки, масса тела 120-140 г.
В качестве модели патологии был выбран закрытый перелом голени в стадии активного формирования костной мозоли на 9-10 сутки. Такой выбор сделан исходя из физиолого-биохимического сходства механизма формирования костной мозоли и остеолиза, спровоцированный экспрессией опухолевых паракринных факторов, вызывающих процесс деструкции кости, являющегося первичной мишенью для связывания фосфонатов.
Через 1,5 ч после введения препарата накопление в крови не превышает 0,30%/г, т.е. препарат почти не циркулирует по кровяному руслу, а попадает в результате интравазации в больших количествах в костную ткань и, особенно, в места повышенного уровня метаболизма, о чем говорят значения коэффициентов дифференциального накопления (КДН), представленные в таблице. Максимальное накопление препарата в патологической костной ткани наблюдается через 1,5 ч и составляет 40-45% от введенной активности.
Источники информации
1. Carmelo Cardarella et. al./ Cancer Management and Research 2013: 5 123-131.
2. M. Mitterhauser et.al./ Nuclear Medicine and Biology 34 (2007) 391-397.
3. K. Ogawa et.al./ Nuclear Medicine and Biology, URL: http://hdl.handle.net/2297/27077.
Радиофармацевтический препарат, применяемый для ПЭТ-визуализации метастатических поражений костной ткани и планирования лучевой терапии, включающий в состав радионуклид галлий-68 с активностью 37-1850 МБк в виде комплекса с ациклическим фосфонатным комплексоном, буферный раствор, хлорид натрия, отличающийся тем, что в качестве ациклического фосфонатного комплексона использована окса-бис(этиленнитрило)тетра-метиленфосфоновая кислота, а буферный раствор представляет собой фосфатный буфер, состоящий из фосфата натрия и гидрофосфата натрия, дополнительно содержит натрия гидроксид при следующем соотношении компонентов, ммоль/мл:
| окса-бис(этиленнитрило)тетраметилен | |
| фосфоновая кислота | 0,008-0,013 |
| натрия гидроокись | 0,112-0,186 |
| гидрофосфат натрия | 0,012-0,019 |
| фосфат натрия | 0,002-0,004 |
| натрия хлорид | 0,027-0,045, |
при этом рН радиофармацевтического препарата лежит в диапазоне от 4,5 до 8,0.