Стабильные жидкие фармацевтические препараты слитого белка tnfr:fc
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к стабильным фармацевтическим композициям слитого белка TNFR:Fc. Получают фармацевтические композиции, а также наборы для их применения, отличающиеся физической стабильностью TNFR:Fc за счет использования системы цитратного буфера в концентрации от 25 до 120 мМ и аминокислоты, выбранной из группы, включающей лизин и пролин и их фармацевтически приемлемых солей в концентрации от 15 до 100 мМ в качестве стабилизатора. Изобретение позволяет обеспечить стабильность фармацевтических композиций этанерцепта для длительного хранения. 4 н. и 10 з.п. ф-лы, 1 ил., 17 табл., 3 пр.
Реферат
Настоящее изобретение относится к стабильным жидким фармацевтическим препаратам слитого белка TNFR:Fc, содержащим различные буферные системы и стабилизаторы. При создании изобретения удалось, в частности, продемонстрировать, что физическая стабильность TNFR:Fc значительно улучшается при применении системы на основе цитратного буфера и лизина и/или пролина в качестве стабилизатора.
Предпосылки создания изобретения
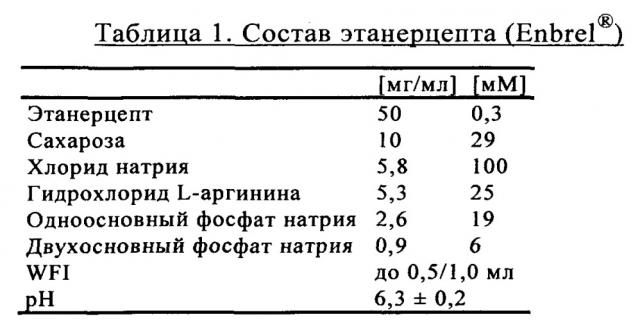
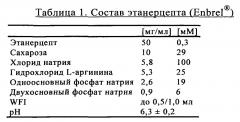
Поступающие в продажу препараты антител, как правило, приготавливают в фосфатном буфере. TNFR:Fc также, как правило, забуферивают в фосфате натрия (ЕР 1478394, WO 03/072060 А2). Например, содержащий белок TNFR:Fc этанерцепт, который в настоящее время поступает в продажу под товарным знаком Enbrel®, имеет состав, представленный в таблице 1.
Агрегацию содержащих антитело продуктов можно контролировать путем добавления небольших амфифильных молекул. Так, L-аргинин представляет собой аминокислоту, наиболее пригодную для подавления белковых взаимодействий в поступающих в продажу препаратах (Baynes и др., 44(12), 2005, cc.4919-4925; ЕР1478394). Представляя собой полярную добавку, она предотвращает агрегацию промежуточных продуктов при фолдинге белков.
Аналогично L-аргинину, L-лизин обладает способностью в значительной степени предупреждать индуцированную нагреванием и разбавлением агрегацию лизоцима (Shiraki и др., J Biochem, 132(4), 2002, cc.591-595).
L-пролин применяют в качестве стабилизатора в жидких препаратах иммуноглобулинов, таких как Sandoglobulin® или Privigen®. Являясь гидрофобной аминокислотой, он, вероятно, воздействует на гидрофобные белок-белковые взаимодействия и в результате защищает IgG от денатурации и агрегации. Кроме того, L-пролин обладает высокой безопасностью при введении пациентам с первичным иммунодефицитом, и, как установлено в опытах на животных, представляет собой малотоксичную аминокислоту (Bolli и др., Biologicals, 38(1), 2001, cc.150-157).
В современных исследованиях установлено, что цитратный буфер является ценным для препаратов моноклональных антител, поскольку он эффективно минимизирует расщепление, например, деаминирование аспарагина (Zheng и Janis, Int J Pharm, 308(1-2), 2006, cc.46-51). Другим преимуществом цитратного буфера является его способность стабилизировать значение рН в процессе замораживания, в то время как при применении общепринятой системы на основе фосфатного буфера обнаружено наибольшее изменение значения рН при снижении температуры с +25°С до -30°С (Kolhe и др., Biotechnol Prog, 26(3), 2010, cc.727-733).
Слитые белки могут образовывать различные продукты расщепления и агрегированные продукты, что в свою очередь может приводить к снижению активности и даже побочным действиям, таким как иммуногенность. Таким образом, все еще существует потребность в стабильном жидком препарате слитого белка TNFR:Fc.
Указанный препарат должен удовлетворять различным критериям. Он должен быть физиологически приемлемым и предпочтительно должен обеспечивать среду, гарантирующую стабильность биофармацевтического лекарственного средства в терапевтически эффективной концентрации. Кроме того, препарат должен обеспечивать удовлетворительный срок хранения лекарственного средства.
Таким образом, цель настоящего изобретения заключается в создании фармацевтических препаратов TNFR:Fc, которые можно применять в качестве альтернативы известным в данной области препаратам. Другая цель настоящего изобретения заключается в создании фармацевтических препаратов TNFR:Fc, которые имеют преимущество по сравнению с известными в данной области препаратами. И еще одна цель настоящего изобретения заключается в создании фармацевтических препаратов TNFR:Fc, которые обеспечивают меньшую агрегацию лекарственного средства по сравнению с известными в данной области препаратами.
При создании настоящего изобретения продемонстрировано, что путем замены, например, обычно применяемого фосфатного буфера на систему цитратного буфера и стабилизатора аргинина на лизин можно в значительной степени улучшать физическую стабильность TNFR:Fc. Предлагаемые буфер на основе лимонной кислоты и лизин в качестве стабилизатора защищают TNFR:Fc от расщепления, вызываемого механическим и температурным стрессом (при 25°С и 40°С), и установлено, что при рекомендуемой температуре хранения 2-8°С расщепление белка в предлагаемых препаратах существенно ниже, чем в обычно применяемых забуференных фосфатом препаратах. Таким образом, параметры качества, касающиеся физической стабильности продукта, можно улучшать. Повышенная физическая стабильность лекарственного продукта позволяет удлинять срок хранения по сравнению с общепринятыми содержащими продукт препаратами и гарантирует безопасность продукта.
Краткое изложение сущности изобретения
Первым объектом изобретения является фармацевтическая композиция, содержащая TNFR:Fc, цитратный буфер и аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли.
Вторым объектом изобретения является набор, содержащий композицию, которая представляет собой первый объект изобретения, и инструкции по применению указанной композиции.
Третьим объектом изобретения является способ получения фармацевтической композиции, который представляет собой первый объект изобретения, заключающийся в том, что объединяют TNFR:Fc, цитратный буфер и аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли.
И последним объектом изобретения является композиция, которая представляет собой первый объект изобретения, предназначенная для применения в медицине, в частности для лечения заболевания, выбранного из группы, включающей аутоиммунное заболевание, анкилозирующий спондилит, ювенильный ревматоидный артрит, псориаз, псориатический артрит, ревматоидный артрит, болезнь Вегенера (грануломатоз), болезнь Крона (или воспалительное заболевание кишечника), хроническое обструктивное заболевание легких (ХОЗЛ), гепатит С, эндометриоз, астму, кахексию, атонический дерматит, болезнь Альцгеймера и рак.
Подробное описание предпочтительных вариантов осуществления изобретения
Образование продуктов расщепления в процессе хранения TNFR:Fc, вероятно, является наиболее важным свойством молекулы. Когда TNFR:Fc входит в состав препаратов, содержащих цитрат, то он характеризуется в целом меньшей способностью к расщеплению, что может быть связано с более высоким чистым зарядом цитрата натрия по сравнению с фосфатом натрия и в результате возможным взаимодействием с заряженной молекулой TNFR:Fc.
Таким образом, первым объектом изобретения является фармацевтическая композиция, содержащая TNFR:Fc, цитратный буфер и аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли.
Фактор некроза опухоли альфа (TNF-альфа) является представителем группы цитокинов, которые стимулируют реакцию острой фазы и, таким образом, он представляет собой цитокин, участвующий в системном воспалении. TNF-альфа обладает способностью индуцировать воспаление, индуцировать гибель клеток в результате апоптоза и ингибировать онкогенез и репликацию вирусов. С нарушением производства TNF-альфа связаны различные болезни человека, такие как аутоиммунное заболевание, анкилозирующий спондилит, ювенильный ревматоидный артрит, псориаз, псориатический артрит, ревматоидный артрит, болезнь Вегенера (грануломатоз), болезнь Крона или воспалительное заболевание кишечника, хроническое обструктивное заболевание легких (ХОЗЛ), гепатит С, эндометриоз, астма, кахексия, атопический дерматит, болезнь Альцгеймера, а также рак.
Его молекулы-рецепторы включают TNFR1 (TNF-рецептор типа 1; CD120a; р55/60; человеческий: RefSeq (мРНК): NM_001065, RefSeq (белок): NP_001056 (SEQ ID NO:1)) и TNFR2 (TNF-рецептор типа 2; CD120b; p75/80; человеческий: RefSeq (мРНК): NM_001066, RefSeq (белок): NP_001057 (SEQ ID NO:2)). TNF-R1 экспрессируется в большинстве тканей и может полностью активироваться как связанной с мембраной, так и растворимой тримерной формой TNF, в то время как TNF-R2 обнаружен только в клетках иммунной системы и реагирует на связанную с мембраной форму гомотримера TNF. При контакте с TNF-альфа TNF-рецепторы образуют тримеры и тем самым инициируют внутриклеточную передачу сигналов.
Таким образом, растворимые молекулы TNFR или их фрагменты, которые обладают способностью связываться с TNF-альфа, можно применять в качестве конкурентного ингибитора TNF-альфа. Настоящее изобретение относится к указанным растворимым молекулам TNFR, слитым с Fc-областью человеческого иммуноглобулина (TNFR:Fc).
В контексте настоящего изобретения компонент TNFR слитого белка TNFR:Fc обозначает любой полипептид TNFR, который идентичен по меньшей мере на 90%, предпочтительно по меньшей мере на 91%, например, по меньшей мере на 92% или по меньшей мере на 93%, более предпочтительно по меньшей мере на 94%, например, по меньшей мере на 95% или по меньшей мере на 96%, еще более предпочтительно по меньшей мере на 97%, например, по меньшей мере на 98% или по меньшей мере на 99% и наиболее предпочтительно на 100% аминокислотной последовательности, которая содержит по меньшей мере 150-250, предпочтительно по меньшей мере 175-245 аминокислот TNFR1 или TNFR2, предпочтительно TNFR2, более предпочтительно 200-240 и наиболее предпочтительно 225-235 аминокислот внеклеточной области TNFR2, и все еще сохраняет способность связываться с TNF-альфа по данным ELISA или любого другого общепринятого анализа. Более предпочтительно, указанный TNFR обладает способностью связываться с TNF-альфа и лимфотоксином альфа (LT-альфа) по данным ELISA или любого другого общепринятого анализа. Указанные анализы хорошо известны специалисту в данной области.
В целом считается, что полипептид «идентичен по меньшей мере на х%» аминокислотной последовательности определенной длины другого полипептида, если рассматриваемую последовательность выравнивают с наиболее соответствующей ей последовательностью аминокислотной последовательности и идентичность последовательностей этих двух выровненных последовательностей составляет по меньшей мере х%. Указанный сравнительный анализ первичной структуры последовательностей можно осуществлять с помощью, например, публично доступных компьютерных программ определения гомологии, таких как программа «BLAST», например, «blastp», которая представлена на домашней странице NCBI http://www.ncbi.nlm.nih.gov/blast/blast.cgi, с использованием задаваемых по умолчанию параметров, которые указаны в этих программах. Другие методы расчета процентов идентичности наборов полипептидов известны в данной области.
Fc-область (область кристаллизующегося фрагмента) обозначает хвостовую область антитела, и в случае IgG состоит из второго и третьего константного домена двух тяжелых цепей антитела. В определенных вариантах осуществления изобретения Fc-полипептид содержит константную область тяжелой цепи класса IgG или ее фрагмент или вариант, а в других вариантах осуществления изобретения для создания указанных слияний TNFR:Fc можно применять константную область иммуноглобулинов других изотипов. Например, можно применять полипептид TNFR:Fc, содержащий константную область тяжелой цепи IgM-класса или ее фрагмент и/или вариант. Предпочтительно Fc-фрагмент выводят из IgG, более предпочтительно из IgG1, еще более предпочтительно из человеческого IgG1. Константная область тяжелых цепей иммуноглобулина, которая в качестве конкретного примера представляет собой константный домен тяжелой цепи человеческого иммуноглобулина IgG1-класса, представленная в SEQ ID NO:3, содержит СН1-домен (аминокислоты 1-98 SEQ ID NO:3), шарнирную область (аминокислоты 99-110 SEQ ID NO:3), СН2-домен (аминокислоты 111-223 SEQ ID NO:3) и СН3-домен (аминокислоты 224-330 SEQ ID NO:3). В контексте настоящего описания Fc-домен может содержать один или все указанные компоненты: СН1 тяжелой цепи, шарнирную область, СН2- и СН3-домены, описанные выше, или их фрагменты или варианты. Конкретным вариантом осуществления изобретения является TNFR:Fc, содержащий весь или часть внеклеточного домена TNFR1 (SEQ ID NO:1) или TNFR2 (SEQ ID NO:2), который/которая слит/слита со всей или с частью SEQ ID NO:3, необязательно с помощью линкерного полипептида между TNFR-компонентом и Fc-компонентом комплекса TNFR:Fc. Например, в молекуле могут присутствовать СН1, СН2 и полная шарнирная область. В других вариантах осуществления изобретения константная область тяжелой цепи, которая содержит по меньшей мере часть СН1, представляет собой Fc-компонент TNFR:Fc. В некоторых вариантах осуществления изобретения она может включать, например, всю шарнирную область или C-концевую половину шарнирной области для обеспечения образования дисульфидного мостика между цепями. Например, СН1 может присутствовать вместе с первыми семью аминокислотами шарнирной области (аминокислоты 99-105 SEQ ID NO:3). В некоторых вариантах осуществления настоящего изобретения полипептид TNFR ковалентно связан, необязательно через полипептидный линкер, с N-концом по меньшей мере одного участка СН1-области константного домена тяжелой цепи с образованием TNFR:Fc.
Если требуется димерный слитый белок TNFR:Fc, то важно, чтобы он включал часть шарнирной области, которая участвует в образовании дисульфидного мостика между тяжелыми цепями (например, участок, состоящий из аминокислот 99-110 SEQ ID NO:3, который включает аминокислоту 109 SEQ ID NO:3). В других вариантах осуществления изобретения TNFR:Fc может содержать участки СН3-домена, которые не включают C-концевой остаток лизина (аминокислота 330 SEQ ID NO:3), поскольку, как установлено, этот остаток должен удаляться при посттрансляционном процессинге полипептидов тяжелых цепей IgG. Fc-слияния и Fc-фрагменты хорошо известны в данной области.
Предпочтительно слитый белок TNFR:Fc практически идентичен/подобен этанерцепту, более предпочтительно TNFR:Fc представляет собой этанерцепт.
Этанерцепт представляет собой димер двух молекул внеклеточной области рецептора TNF-альфа р75, каждая молекула состоит из 235 аминокислот выведенного из TNFR полипептида, который слит с состоящей из 232 аминокислот Fc-областью человеческого IgG1. Аминокислотная последовательность мономерного компонента этанерцепта представлена в SEQ ID NO:4. В димерной форме этой молекулы два из указанных слитых полипептидов (или «мономеров») удерживаются вместе с помощью трех дисульфидных мостиков, которые образованы между иммуноглобулиновыми областями двух мономеров. Таким образом, димер этанерцепта состоит из 934 аминокислот и имеет кажущуюся молекулярную массу примерно 150 кДа. В Северной Америке этанерцепт поступает в продажу от фирм Amgen и Pfizer под товарным знаком Enbrel® в виде двух различных препаратов, один в форме порошка, а другой в форме предварительно смешанной жидкости. Фирма Wyeth также поставляет на рынок Enbrel® вне пределов Северной Америки, исключая Японию, где лекарственное средство поступает в продажу от фирмы Takeda Pharmaceuticals.
Понятие «практически идентичен/подобен этанерцепту» в контексте настоящего изобретения означает, что аминокислотная последовательность TNFR:Fc идентична по меньшей мере на 95% аминокислотной последовательности, представленной в SEQ ID NO:4, более предпочтительно идентична по меньшей мере на 96%, например, идентична на 97%, и наиболее предпочтительно идентична на 98%, например, идентична на 99% аминокислотной последовательности, представленной в SEQ ID NO:4. В альтернативном или дополнительном варианте TNFR:Fc может отличаться от этанерцепта (лишь) пост-трансляционными модификациями, например, гликозилированием. Приемлемые методы изменения схемы гликозилирования, например, путем интродукции или делеции сайта гликозилирования, и анализы, предназначенные для оценки схемы гликозилирования, хорошо известны специалисту в данной области.
TNFR:Fc можно получать рекомбинантно, предпочтительно с помощью основанной на клетках млекопитающих экспрессионной системы. Предпочтительно указанная основанная на клетках млекопитающих экпрессионная система представляет собой по меньшей мере систему, выбранную из группы, включающей клеточные почки детеныша хомяка (например, BHK21); клеточные линии яичника китайского хомячка (например, СНО-K1, CHO-DG44, CHO-DXB или CHO-dhfr-); клеточные линии мышиной миеломы (например, SP2/0); клеточные линии мышиной миеломы (например, NSO); клеточные линии почки человеческого эмбриона (например, HEK-293); клеточные линии, выведенные из человеческой сетчатки (например, PER-C6), и/или линии клеток амниоцитов (например, CAP). Предпочтительно применяют экспрессионные системы на основе клеток хомяков. BHK21-клетки (клетки почки детеныша хомяка») принадлежат к квазидиплоидной созданной линии клеток сирийского хомяка, которые выведены из клона, характеризующегося необычно большой скоростью роста первичной культуры почечной ткани новорожденного хомяка. Примерами клеточных линий BHK-21 являются (но не ограничиваясь только ими) поступающие в продажу линии, и в контексте настоящего изобретения можно применять клеточные линии хомяка BHK-21 (С-13); BHK21-pcDNA3.1-HC; BHK570; Flp-In-BHK и/или BHK 21 (клон 13).
Клетки яичника китайского хомячка (СНО) представляют собой клеточную линию, выведенную из яичника китайского хомячка. Их часто используют в биологических и медицинских исследованиях, и они нашли коммерческое применение при производстве терапевтических белков. Их начали применять в 1960-х годах и исходно выращивали в виде монослойной культуры. В настоящее время СНО-клетки представляют собой наиболее широко применяемые клетки млекопитающих-хозяев для промышленного производства рекомбинатных терапевтических белков и их, как правило, выращивают в суспензионной культуре.
Примерами линий СНО-клеток, которые поступают в продажу и которые можно применять в контексте настоящего изобретения являются (но не ограничиваясь только ими) FreeStyle CHO-S-клетки; клеточная линия ER-CHO; СНО 1-15 500 CHINESE НАМ; CHO-DXB, CHO-dhfr-, CHO DP-12 клон №1934; CHO-CD36; CHO-ICAM-1; CHO-K1; Ovary; HuZP3-CHOLec3.2.8.1; xrs5; CHO-K1/ВВ2-клетки; CHO-K1/ВВ3-клетки; СНО-K1/EDG8/Galpha15-клетки; СНО-K1/М5-клетки; CHO-K1/NK1-клетки; CHO-K1/NK3-клетки; CHO-K1/NMUR1-клетки; CHO-K1/NTSR1-клетки; CHO-K1/OX1-клетки; CHO-K1/PAC1/Gα15-клетки; CHO-K1/PTAFR-клетки; CHO-K1/TRH1-клетки; CHO-K1/V1B-клетки; клеточная линия 5НТ1А Galpha-15-NFAT-BLA CHO-K1; клеточная линия AVPR2 CRE-BLA CHO-K1; CHO-S-клетки, адаптированные к SFMd; DG44-клетки; клеточная линия Flp-In-CHO; клеточная линия GeneSwitch-CHO; клеточная линия NFAT-bla CHO-K1; клеточная линия T-REx-CHO; стабильная клеточная линия GenoStat CHO K-1; набор, включающий стабильную клеточную линию GenoStat CHO K-1; клеточная линия хомячка CHO-K1, клеточная линия СНО-РЕРТ1, клеточная линия CHO SSF3 и/или СНО-НРТ1. В наиболее предпочтительном варианте осуществления изобретения экспрессионная система на основе клеток китайского хомячка представляет собой клеточную линию CHO-dhfr.
Фармацевтическая композиция может содержать TNFR:Fc в концентрации от 0,1 до 0,7 мМ, например, 0,2 или 0,6 мМ, предпочтительно в концентрации от 0,15 до 0,5 мМ, например 0,4 или 0,45 мМ, более предпочтительно в концентрации от 0,25 до 0,35 мМ, например, примерно 0,3 мМ.
Нитратный буфер может представлять собой любой приемлемый нитратный буфер. Например, цитратный буфер может содержать или состоять из цитрата натрия, цитрата калия, лимонной кислоты или их смесей. Цитратный буфер, вероятно, оказывает наибольшее влияние на стабильность препарата. В примерах продемонстрирована более высокая стабильность препарата, содержащего 50 мМ цитратный буфер, по сравнению с препаратом, содержащим 25 мМ цитратный буфер. Повышение концентрации по меньшей мере вплоть до 120 мМ может приводить к еще более существенным воздействиям. Вероятно, для стабилизации необходимо присутствие минимум 25 мМ цитратного буфера. Таким образом, фармацевтическая композиция может содержать цитратный буфер в концентрации от 25 до 120 мМ, например, от 30 до 115 мМ, предпочтительно в концентрации от 40 до 110 мМ, например, от 45 до 105 мМ, более предпочтительно в концентрации от 50 до 100 мМ, например, в концентрации 55, 60, 65, 70, 75, 80, 85, 90 или 95 мМ. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит цитратный буфер в концентрации, которая указана для композиций, описанных в разделе «Примеры».
Значение рН предпочтительно составляет от 5 до 7,5, например, от 5,5 до 7, еще более предпочтительно от 6 до 6,6, например, от 6,1 до 6,5, более предпочтительно от 6,2 до 6,4, например, примерно 6,3. Установлено, что хотя предпочтительным значением рН является значение от 5 до 7,5, в альтернативном варианте можно применять также более низкие значения рН вплоть до 2,8, например, составляющие от 2,8 до 4,0.
Фармацевтическая композиция содержит аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли, такие как гидрохлориды. Аминокислота может находиться в D-, L- или DL-конфигурации, предпочтительно в L-конфигурации.
При добавлении основной аминокислоты лизина в концентрации примерно 25 мМ имеет место выраженное аддитивное действие комбинации. По-видимому, добавление лизина, в концентрации вплоть до 100 мМ должно характеризоваться аддитивным действием. Таким образом, фармацевтическая композиция может содержать аминокислоту в концентрации от 15 до 100 мМ, предпочтительно в концентрации от 20 до 90 мМ, более предпочтительно в концентрации от 25 до 75 мМ. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит аминокислоту в концентрации, которая указана для композиций, описанных в разделе «Примеры». В наиболее предпочтительном варианте осуществления изобретения аминокислота представляет собой лизин или ее фармацевтически приемлемые соли.
Кроме того, фармацевтическая композиция может содержать также по меньшей мере один модификатор тоничности, В контексте настоящего описания подразумевается, что понятие «модификатор тоничности» относится к молекуле, отличной от цитрата, лизина, или пролина, которая влияет на осмотическое давление раствора. Предпочтительно осмотическое давление фармацевтической композиции регулируют для стабилизации действующего вещества и минимизации дискомфорта пациента при введении. Как правило, предпочтительно, чтобы фармацевтическая композиция была изотоничной сыворотке, т.е. имела такое же или сходное осмотическое давление, а именно, осмотическое давление примерно от 180 до 480 мОсмоль/кг. Предпочтительно по меньшей мере один модификатор тоничности выбирают из группы, включающей хлорид натрия, цистеин, гистидин, глицин, хлорид калия, сахарозу, глюкозу и маннит, более предпочтительно модификатор тоничности представляет собой хлорид натрия и/или сахарозу. Фармацевтическая композиция может содержать по меньшей мере один модификатор тоничности в общей концентрации от 5 до 200 мМ, например, от 10 до 190 мМ, от 15 до 180 мМ, от 20 до 170 мМ, от 25 до 160 мМ, от 30 до 150 мМ, от 35 до 140 мМ, от 40 до 130 мМ или от 45 до 120 мМ, например, 110 мМ, но предпочтительно в концентрации от 50 до 100 мМ. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит модификатор(ы) тоничности в концентрации, которая указана для композиций, описанных в разделе «Примеры».
Кроме того, фармацевтическая композиция может содержать по меньшей мере один эксципиент. В контексте настоящего описания понятие «эксципиент» относится к фармакологически неактивной субстанции, которую применяют в фармацевтической композиции в качестве носителя действующего вещества. В некоторых случаях введение «активной» субстанции может оказаться затруднительным и она может плохо абсорбироваться в организме человека. В таких случаях рассматриваемую субстанцию можно смешивать с эксципиентом или растворять в растворе эксципиента. Эксципиенты можно применять также для увеличения объема препаратов, которые содержат очень активные действующие вещества, для обеспечения удобства и точного дозирования. Помимо их применения в количестве, необходимом для получения однодозовой композиции, эксципиенты можно применять также в процессе производства для оптимизации обработки, связанной с активной субстанцией. В зависимости от пути введения и формы фармацевтической композиции можно применять различные эксципиенты. Так, эксципиенты могут содержать среди прочего антиадгезивы, связующие вещества, красители и консерванты, такие как антиоксиданты.
Например, по меньшей мере один эксципиент можно выбирать из группы, включающей лактозу, глицерин, ксилит, сорбит, маннит, мальтозу, инозит, трегалозу, глюкозу, бычий сывороточный альбумин (БСА), декстран, поливинилацетат (ПВА), гидроксипропилметилцелюлозу (ГПМЦ), полиэтиленимин (ПЭИ), желатин, поливинилпирролидон (ПВП), гидроксиэтилцеллюлозу (ГЭЦ), полиэтиленгликоль (ПЭГ), этиленгликоль, диметилсульфоксид (ДМСО), диметилформамид (ДМФ), L-серин, глутамат натрия, аланин, глицин, саркозин, гамма-аминомасляную кислоту (ГАМК), полиоксиэтиленсорбитанмонолаурат (Твин-20), полиоксиэтиленсорбитанмоноолеат (Твин-80), додецилсульфат натрия (ДСН), полисорбат, сополимер полиоксиэтилена, фосфат калия, ацетат натрия, сульфат аммония, сульфат магния, сульфат натрия, N-оксид триметиламина, бетаин, ионы цинка, ионы меди, ионы кальция, ионы магния, CHAPS, монолаурат сахарозы и 2-O-бета-манноглицерат. В предпочтительном варианте осуществления изобретения эксципиент можно выбирать из числа субстанций, указанных в разделе «Примеры».
Фармацевтическая композиция может содержать по меньшей мере один эксципиент в общей концентрации, составляющей по меньшей мере 0,1 мМ, например, от 0,1 до 0,7 мМ, например, в концентрации 0,6 мМ, предпочтительно в концентрации от 0,15 до 0,5 мМ, например, от 0,2 до 0,4 мМ, более предпочтительно в концентрации от 0,24 до 0,34 мМ. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит эксципиент в концентрации, которая указана для композиций, описанных в разделе «Примеры».
Предпочтительно композиция является жидкой. Однако в другом варианте осуществления изобретения фармацевтическая композиция может быть лиофилизированной и ее можно восстанавливать, например, путем добавления воды с получением жидкой композиции. Таким образом, фармацевтическая композиция может содержать также фармацевтически приемлемый растворитель. В предпочтительном варианте осуществления изобретения фармацевтически приемлемый растворитель представляет собой воду. Указанные в настоящем описании концентрации компонентов относятся к жидкому препарату, а также к уже готовому лиофилизату или препарату, подлежащему лиофилизации.
Эксципиенты могут оказывать защитное действие в процессе замораживания лиофилизированных препаратов, т.е. обладать так называемыми криозащитными свойствами. Кроме того, можно добавлять металлхелатирующие агенты и поверхностно-активные вещества. Некоторые агенты могут обладать двойным действием, например, некоторые сахара или сахарные спирты могут служить, например, в качестве эксципиента, криопротектанта и/или модифицирующего тоничность агента.
Препарат, предлагаемый в настоящем изобретении, в виде водного раствора готов к применению, в то время как препарат, предлагаемы в настоящем изобретении, в лиофилизированном состоянии можно превращать в жидкие препараты, например, путем добавления воды для инъекции.
Наиболее предпочтительные композиции содержат (или состоят из) TNFR:Fc, например, этанерцепт в количестве от 0,1 до 0,7 мМ, цитратный буфер, например, цитрат натрия, в количестве от 25 до 120 мМ, лизин, например, гидрохлорид лизина, в количестве от 15 до 100 мМ, сахарозу в количестве от 10 до 100 мМ и хлорид натрия в количестве 5 до 200 мМ, значение рН составляет примерно 6,3.
В альтернативном варианте фармацевтическая композиция может содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция может содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 88 мМ, значение рН составляет примерно 6,3.
Однако фармацевтическая композиция может также содержать (или состоять из) этанерцепт в количестве от 0,1 до 0,7 мМ, цитратный буфер, например, цитрат натрия, в количестве от 25 до 120 мМ, пролин в количестве от 15 до 100 мМ, сахарозу в количестве от 10 до 100 мМ и хлорид натрия в количестве от 5 до 200 мМ, значение рН составляет примерно 6,3.
И, наконец, фармацевтическая композиция может содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, пролин в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 51 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 22 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ и сахарозу в количестве 29 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ и хлорид натрия в количестве 36 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ и хлорид натрия в количестве 17 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 56 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 31 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 19 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ и хлорид натрия в количестве 59 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 48 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 88 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или с