Фосфороамидатные производные 5-фтор-2'-дезоксиуридина для применения для лечения рака
Иллюстрации
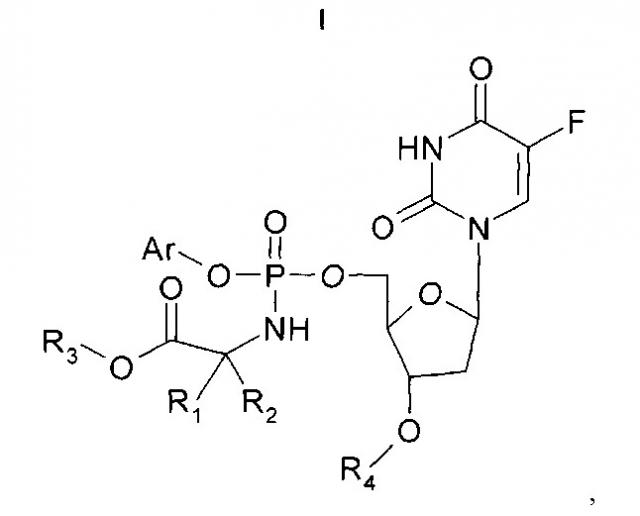
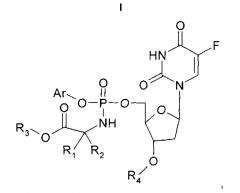
Показать всеИзобретение относится к применимым в онкологии соединениям формулы (I), их фармацевтически приемлемым солям и композициям на их основе:
где Ar представляет собой фенил или нафтил и необязательно замещен -NO2; R3 выбран из бензила, метила, этила, н-пропила, н-бутила, н-пентила, н-гексила, изопропила, циклогексила, 2-инданила, 3,3-диметил-1-бутила, циклобутила, циклопропилметила, циклопентила, тетрагидропиранила и 2,2-диметилпропила; R4 представляет собой атом Н; R1 и R2 выбраны из атома H и C1-C16алкила, необязательно замещенного фенилом, или один из R1 и R2 содержит C3-алкиленовую цепь, присоединенную к атому N так, что общее количество кольцевых атомов, включая N и атом C, составляет 5 атомов, атом Н, соединенный с атомом N, отсутствует и один из R1 и R2 содержит атом Н или C1-C16алкил; или фармацевтически приемлемая соль соединения Формулы I, при условии, что данное соединение не является соединением, содержащим, в комбинации, незамещенный фенил в качестве Ar, CH3 в качестве R3, H в качестве R4, H в качестве одного из R1 и R2 и CH3 в качестве одного из R1 и R2. Предложены новые эффективные противоопухолевые средства и способ их получения. 11 н. и 56 з.п. ф-лы, 11 ил., 8 табл., 8 пр.
Реферат
Настоящее изобретение относится к химическим соединениям, которые можно применять в лечении рака.
Противоопухолевая активность 5-фторурацила (5FU) была открыта в 1957 г. Уже прошло более пятидесяти лет с тех пор, как 5FU был впервые синтезирован, но до сих пор он продолжает широко использоваться, с одобрения FDA (Управления по контролю качества пищевых продуктов и лекарственных препаратов) в 1962 году, для лечения солидных опухолей, включая рак молочной железы, рак желудочно-кишечного тракта, злокачественное новообразование головы и шеи и рак яичника, в частности для лечения колоректального рака. Фторпиримидины 5-фторурацил (5FU) и 5-фтор-2'-дезоксиуридин (5-FdUrd) в комбинации с фолиевой кислотой используют в качестве стандартной терапии для лечения различных карцином, таких как карцинома желудка, толстой кишки и молочной железы. Кроме того, комбинация 5FU с лейковорином (leucovorin) (LV) считается стандартной химиотерапией рака толстой кишки. Лекарственные препараты 5FU обычно вводят путем внутривенной инъекции ударной дозы лекарства или путем непрерывной инфузии.
Противоопухолевая активность 5FU сравнима с противоопухолевой активностью его аналога 5-FdUrd, который отчасти действует как пролекарство 5FU. В 1970 5-FdUrd был одобрен FDA и с тех пор широко используется в клиническом лечении карцином яичника, молочной железы и желудочно-кишечного тракта. Кроме того, вследствие интенсивной деградации ферментами печени 5-FdUrd представляет собой лекарство, которое может быть использовано для химиотерапии метастазов печении путем введения через печеночную артерию, благодаря чему оно более эффективно метаболизируется в печени, чем 5FU.
Однако проблема заключается в том, что активность как 5FU, так и 5-FdUrd может быть ухудшена из-за развития устойчивости опухолевых клеток. Кроме того, было показано, что лечение рака с использованием 5FU вызывает нейротоксические и кардиотоксические побочные эффекты. Токсичность 5FU также обусловлена тем, что данное соединение не обладает опухолевой избирательностью.
Задача настоящего изобретения заключается в получении соединений, являющихся производными 5-фтор-2'-дезоксиуридина, которые обладают более высокой активностью и/или меньшей токсичностью при их использовании в лечении рака по сравнению с 5-фторацилом или 5-фтор-2'-дезоксиуридином per se.
Другая задача настоящего изобретения заключается в получении соединений, являющихся производными 5-фтор-2'-дезоксиуридина, которые характеризуются более низким уровнем устойчивости опухолевых клеток, в частности характеризуются более низким уровнем устойчивости опухолевых клеток по сравнению с 5FU или 5-FdUrd.
Согласно настоящему изобретению предложено соединение Формулы (I):
где
Ar представляет собой конденсированную бициклическую арильную группировку или моноциклическую арильную группировку, причем каждая из указанных арильных группировок является карбоциклической или гетероциклической и необязательно содержит заместители;
R3 представляет собой алкил, который необязательно содержит заместители;
R4 представляет собой атом H или алкоил; и
R1 и R2 независимо выбраны из группы, состоящей из атома H и алкила, или R1 и R2 вместе образуют алкиленовую цепь, которая вместе с атомом C, к которому присоединены R1 и R2, образует циклическую систему, или один из R1 и R2 содержит алкиленовую цепь, присоединенную к атому N, атом H, соединенный с атомом N, отсутствует и один из R1 и R2 содержит атом H или алкил, причем любая из указанных алкильных группировок или алкиленовых цепей может содержать заместители;
или фармацевтически приемлемое производное или метаболит соединения Формулы I,
при условии, что данное соединение не является соединением, содержащим, в комбинации, незамещенный фенил в качестве Ar, CH3 в качестве R3, H в качестве R4 и H в качестве одного из R1 и R2 и CH3 в качестве одного из R1 и R2.
Установлено, что соединения согласно настоящему изобретению обладают активностью, которая позволяет их использовать для профилактики или лечения рака у человека. В частности, соединения согласно настоящему изобретению обладают благоприятными свойствами, которые указывают на их способность лечить рак у пациентов, которые характеризуются более низким уровнем устойчивости опухолевых клеток. Примечательно, что соединения согласно настоящему изобретению могут обладать цитоактивностью, сравнимой с цитоактивностью 5-фторацила или более высокой, но при этом характеризуются устойчивостью, сравнимой с устойчивостью к 5-фторацилу и 5-фтор-2'-дезоксиуридину или более низкой.
ʺУстойчивостьʺ в контексте данной заявки означает низкий или сниженный уровень ответа на терапию. Устойчивость может быть врожденной или приобретенной. Врожденная устойчивость представляет собой пониженную ответную реакцию у данной особи или пациента по сравнению с другими особями или пациентами. Приобретенная устойчивость представляет собой снижение эффективности лекарства с течением времени в период проведения курса лечения у конкретного пациента не зависимо от того, наступило данное снижение эффективности в связи с терапией, включающей назначение пациенту схемы введения лекарства для лечения рака, например схемы введения лекарства, содержащего 5FU и/или 5-FdUrd, или вызвано другими причинами. Как врожденная устойчивость, так и приобретенная устойчивость могут соответствовать снижению уровня экспрессии или низкой активности белков-переносчиков, включая белки-переносчики нуклеозидов, или необходимых анаболических ферментов или повышению уровня экспрессии катаболических ферментов.
Вне связи с какой-либо теорией постулировано, что причинами устойчивости опухолевых клеток к действию 5FU и/или 5-FdUrd могут являться: а) деления активирующей киназы, например тимидинкиназы (TK), ключевого фермента, необходимого для начальной стадии фосфорилирования 5-FdUrd до 5-FdUMP, б) сверхсинтез тимидилатсинтазы (TS) и/или в) нарушение транспорта в клетки-мишени (см. более подробное обсуждение ниже).
Неожиданно было найдено, что соединения согласно настоящему изобретению могут обладать значительной цитостатической активностью в клетках с пониженным уровнем белков-переносчиков нуклеозидов, и/или в клетках, дефицитных по нуклеозидкиназе, и/или в клетках, инфицированных микоплазмой.
Благоприятное свойство соединений согласно настоящему изобретению сохранять значительную цитостатическую активность в клетках, дефицитных по нуклеозидкиназе, может давать in vivo клиническое преимущество в клеточном окружении, которое характеризуется отсутствием нуклеозидкиназ или снижением уровня нуклеозидкиназ и, соответственно, не способно эффективно активировать 5-FdUrd.
В клетках, инфицированных микоплазмой, активность нуклеозидов, таких как 5-FdUrd, значительно снижена, как считается, вследствие сверхсинтеза тимидилатсинтазы (TS). Таким образом, предложенное в настоящем изобретение применение соединений согласно настоящему изобретению в клетках, инфицированных микоплазмой, предположительно, обусловлено дополнительным благоприятным свойством соединений согласно настоящему изобретению, а именно способностью действовать в качестве TS-ингибитора, что позволяет соединениям согласно настоящему изобретению сохранять цитостатическую активность в клетках, инфицированных микоплазмой. Пролекарства, содержащие соединения согласно настоящему изобретению, вследствие их липофильной природы могут поглощаться клетками-мишенями, по меньшей мере частично, без использования переносчиков транспорта нуклеозидов, и, соответственно, могут обходить потенциальные механизмы устойчивости, обусловленные пониженным уровнем переносчиков транспорта нуклеозидов или нуклеооснований в мембране клеток-мишеней.
Кроме того, неожиданно найдено, что пролекарства, содержащие соединения согласно настоящему изобретению, являются нечувствительными к действию катаболического фермента тимидинфосфорилазы (TP), уровень экспрессии которой часто повышен в опухолевых клетках, и, соответственно, указанные пролекарства могли бы быть менее зависимы от присутствия данного катаболического фермента, чем 5-FdUrd.
Согласно наблюдениям инфицирование клеток микоплазмой может значительно уменьшить активность нуклеозидов, включая 5-FdUrd. Введение TP-ингибитора восстанавливает цитостатическую активность 5-FdUrd в клеточных культурах, инфицированных микоплазмой, что свидетельствует о негативном влиянии TP на итоговую цитостатическую активность 5-FdUrd. Это накладывает ограничение на использование нуклеозидов для лечения пациентов, инфицированных микоплазмой. В отличие от 5-FdUrd 5-FdUrd-пролекарства согласно настоящему изобретению могут сохранять высокую активность в клетках, инфицированных микоплазмой.
Соответственно, соединения согласно настоящему изобретению потенциально способны преодолеть многие из ограничений, свойственных 5-FU и 5-FdUrd.
5-Фторурацил (5FU) является одним из первых примеров противораковых лекарств. Создание 5-FU было основано на доступных биохимических данных: атом фтора и атом водорода имеют близкие размеры, однако связь углерод-фтор гораздо сильнее, чем связь углерод-водород. Тимидилатсинтаза катализирует образование тимидилата путем замещения 5-водорода дезоксиуридина монофосфата метильной группой метилентетрагидрофолата. 5FU осуществляет цитотоксическое действие, используя три разных механизма. Нуклеооснование 5FU и дезоксирибонуклеозид 5-FdUrd проникают в клетки с помощью систем облегченного переноса нуклеозидов. Одним из механизмов действия данных агентов является ингибирование фермента тимидилатсинтазы (TS). Превращение нуклеооснования 5FU в дезоксинуклеозид 5-фтор-2'-дезоксиуридин (5-FdUrd) катализируется тимидинфосфорилазой. Последующее фосфорилирование дезоксинуклеозида 5-FdURd тимидинкиназой приводит к образованию цитотоксичного нуклеотида 5-фтор-2'-дезоксиуридин-5'-монофосфата (5-FdUMP). В присутствии восстановленного фолата (5,10-метилен-тетрагидрофолата (mTHF)) данный нуклеотид (5-FdUMP) ингибирует тимидилатсинтазу (TS), так как этот фермент не способен удалить атом 5-фтора. Соответственно, первый и самый важный механизм действия 5FU и FDUR заключается в ингибировании фермента тимидилатсинтазы (TS). Тимидилатсинтаза (TS) имеет два субстрата (dUMP и mTHF), оба из которых связываются в каталитическом центре фермента для синтеза dTMP. 5-FdUMP образует ковалентный тройной комплекс с тимидилатсинтазой (TS), ингибируя активность данного фермента и вызывая истощение дезокситимидинтрифосфата, необходимого для синтеза ДНК. Альтернативно 5-FdUMP синтезируется в результате серии превращений: превращения 5FU в 5-FUMP, катализируемого OPRT (оротатфосфорибозилтрансферазой), последующего превращения в фторуридина дифосфат (FUDP) и затем в фтордезоксиуридина дифосфат (5-FdUDP) в результате действия рибонуклеотидредуктазы (RR), который в конечном итоге превращается в 5'-FdUMP. Отмечено, что после воздействия 5FU или 5-FdUrd у клеток развивается устойчивость к данным химиотерапевтическим агентам. Повышенная экспрессия тимидилатсинтазы (TS) вызывает уменьшение терапевтического эффекта TS-ингибирующих лекарств, что приводит к развитию устойчивости. Отмечено, что некоторые индивидуумы являются более устойчивыми к действию TS-направленной терапии, чем другие. Второй механизм действия заключается в том, что дезоксинуклеозид 5-фтор-2'-дезоксиуридин (5-FdUrd) может быть превращен в трифосфат 5-FdUTP, который, в свою очередь, может встраивается в ДНК, что вызывает повреждение клеток. Третий механизм действия 5FU состоит в том, что данное соединение может ингибировать также синтез РНК после его превращения в FUMP, катализируемого ферментом OPRT, и затем, в две стадии, в фторуридинтрифосфат (FUTP), который встраивается в РНК. Считается, что ингибирование синтеза РНК представляет собой другой возможный механизм действия 5FU.
Таким образом, молекулу 5FU нельзя считать оптимальным TS-ингибирующим лекарством ввиду того, что превращение 5FU в 5-FdUMP является неэффективным: для метаболической активации 5FU требуется несколько метаболических стадий. Кроме того, если клетка продуцирует избыточное количество dUMP, который конкурирует с данным лекарством за связывание с активным центром, может иметь место устойчивость.
5-FdUrd является относительно хорошим субстратом для тимидинкиназы, которая превращает 5-FdUrd сразу в 5-FdUMP. В in vitro исследованиях с использованием нескольких линий раковых клеток показано, что 5-FdURd приблизительно в 5000 раз сильнее ингибирует рост клеток, чем 5FU. Кроме того, при цитотоксических концентрациях пролекарство 5-FdURd не подвергается какому-либо значительному превращению в рибонуклеотидные метаболиты. В in vitro исследованиях показано, что значительное количество 5-FdUrd под действием тимидинфосфорилазы (фермента, характеризующегося высокой аффинностью к 5-FdUrd) деградирует с образованием своего родного основания 5FU. Быстрое фосфоролитическое расщепление 5-FdUrd до 5FU in vitro и in vivo является основным препятствием для доставки интактного 5-FdUrd к клеткам с целью повышения его цитотоксического действия. Кроме того, деградация 5-FdUrd в гомогенатах кишечника крыс и у человека, после перорального введения, дает возможность предположить, что 5-FdUrd почти не абсорбируется в виде интактного 5-FdUrd.
Другой аспект настоящего изобретения относится к применению соединения согласно настоящему изобретению в способе профилактики или лечения рака у человека. Соответственно, рак выбран из группы, включающей лейкемию, рак поджелудочной железы, предстательной железы, легкого, молочной железы и шейки матки.
В частности, предложено применение соединения согласно настоящему изобретению в способе профилактики или лечения рака у пациента, у которого развилась или может развиться устойчивость опухолевых клеток к действию 5-фторацила или 5-фтор-2'-дезоксиуридина в период профилактики или лечения рака. Например, соединение согласно настоящему изобретению можно применять в способе профилактики или лечения рака у пациента, клетки которого имеют пониженный уровень белков-переносчиков нуклеозидов, и/или клетки которого являются дефицитными по нуклеозидкиназе, и/или клетки которого инфицированы микоплазмой, в особенности, когда рак представляет собой лейкемию. Соединение согласно настоящему изобретению можно применять в способе профилактики или лечения рака у пациента, клетки которого имеют повышенный уровень тимидилатсинтазы (TS) или наряду с этим характеризуются по меньшей мере одной из перечисленных выше особенностей.
Согласно другому аспекту настоящего изобретения, предложен способ профилактики или лечения рака, включающий введение человеку, нуждающемуся в таком лечении, эффективной дозы соединения согласно настоящему изобретению. Соответственно, рак выбран из группы, включающей лейкемию, рак поджелудочной железы, предстательной железы, легкого, молочной железы и шейки матки.
В частности, настоящее изобретение включает способ лечения пациента, у которого развилась или может развиться устойчивость опухолевых клеток к действию 5-фторацила или 5-фтор-2'-дезоксиуридина в период профилактики или лечения рака. Например, способ согласно настоящему изобретению может включать лечение пациента, клетки которого имеют пониженный уровень белков-переносчиков нуклеозидов, и/или клетки которого являются дефицитными по нуклеозидкиназе, и/или клетки которого инфицированы микоплазмой, в особенности, когда рак представляет собой лейкемию. Способ согласно настоящему изобретению можно применять для лечения пациента, клетки которого имеют повышенный уровень тимидилатсинтазы (TS) или наряду с этим характеризуются по меньшей мере одной из перечисленных выше особенностей.
В контексте настоящей заявки термин ʺопухольʺ или ʺопухолевая клеткаʺ, если не указано иное, относится как к солидным опухолям и солидному раку, так как и к лейкемии.
Соединения согласно настоящему изобретению можно применять для лечения пациента, страдающего раком, либо самостоятельно de novo, либо в комбинации с другой противораковой терапией. Например, соединения согласно настоящему изобретению можно применять в схеме лечения рака в комбинации с другими противораковыми лекарствами, такими как 5-FU и/или 5-FdUrd в комбинации с лейковорином (leucovorin) (LV), или без него, и/или с другими противораковыми лекарствами. Альтернативно соединения согласно настоящему изобретению можно применять, когда у пациента уже отсутствует ответ на другие противораковые лекарства, такие как, например, 5FU и/или 5-FdUrd в комбинации с лейковорином (leucovorin) (LV) или без него, или когда у пациента уже развилась устойчивость к другим противораковым лекарствам, таким как, например, 5-FU и/или 5-FdUrd в комбинации с лейковорином (leucovorin) (LV) или без него.
Соединения согласно настоящему изобретению, у которых Ar представляет собой замещенный или незамещенный 1-нафтил, особенно подходят для применения в вышеупомянутых случаях и в способах согласно настоящему изобретению, в особенности для применения у пациента, у которого развилась или может развиться устойчивость опухолевых клеток, например, у пациента, клетки которого имеют пониженный уровень белков-переносчиков нуклеозидов, и/или клетки которого являются дефицитными по киназе, и/или клетки которого инфицированы микоплазмой, и/или у пациента, клетки которого имеют повышенный уровень тимидилатсинтазы (TS).
Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение согласно настоящему изобретению в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
Согласно другому аспекту настоящего изобретения, предложен способ получения фармацевтической композиции, включающий стадию комбинирования соединения согласно настоящему изобретению с фармацевтически приемлемым эксципиентом, носителем или разбавителем.
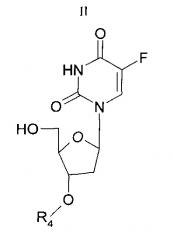
Другой аспект настоящего изобретения относится к способу получения соединения согласно настоящему изобретению, включающему взаимодействие соединения Формулы (II)
с соединением Формулы (III)
где Ar, R3, R4, R1 и R2 имеют значения, описанные выше и в п.1.
Группа Ar включает замещенную или незамещенную арильную группу, ʺарильная группаʺ и возможные заместители указанной группы являются такими, как определено в данном описании. Подходящий Ar представляет собой группировку 5-14-членных ароматических колец. Предпочтительно, когда Ar представляет собой карбоциклическое кольцо. Альтернативно одно или два кольца могут содержать 1, 2, 3 или 4 гетероатома, предпочтительно 1 гетероатом, независимо выбранные из атома О, S и N. Предпочтительно, когда Ar представляет собой конденсированную карбобициклическую арильную группировку. Более предпочтительно, когда Ar представляет собой нафтил, еще более предпочтительно 1-нафтил, то есть нафтил, связанный с атомом P через атом O, присоединенный в положении 1 нафталинового кольца. Альтернативно подходящий Ar может представлять собой фенил.
Ar может содержать один, два, три или четыре заместителя, которые могут быть одинаковыми или разными и выбраны из группы, включающей галоген, который может представлять собой -F, -Cl, -Br или -I; -NO2; -NH2; необязательно замещенный -С1-3алкил; необязательно замещенный -С1-3алкокси, предпочтительно метокси (-ОСН3); необязательно замещенный -SC1-3алкил; -CN; необязательно замещенный -COC1-3алкил и необязательно замещенный -CO2C1-3алкил; при этом указанные необязательно замещенные группы могут иметь от одного до шести заместителей, предпочтительно три заместителя, независимо выбранных из группы, включающей галоген, который может представлять собой F, Cl, Br и I, и NO2. Особенно предпочтительными заместителями у Ar являются электроноакцепторные группы, такие как атом галогена (предпочтительно атом хлора или фтора), тригалогенметил (предпочтительно трифторметил), циано- и нитро-группы.
Указанные заместители могут находиться на арильной группировке Ar в любом положении. Когда Ar представляет собой 1-нафтил, предпочтительно, чтобы единственный заместитель находился в любом из положений 2, 3, 4, 5, 6, 7 или 8. Когда Ar представляет собой фенил, предпочтительно, чтобы единственный заместитель находился в положении 2 (орто) или 4 (пара), более предпочтительно - в положении 4. Например, когда Ar представляет собой замещенный фенил, Ar может представлять собой 3,5-дихлор-фенил, пара-трифторметил-фенил, пара-циано-фенил или пара-нитро-фенил.
Подходящий R3 представляет собой первичную, вторичную или третичную C1-16 алкильную группу и может включать карбоциклические группировки; C5-7 циклическую алкильную группу или C1-6алкилC5-11арильную группу. Более предпочтительно, когда R3 представляет собой C1-10 алкильную группу или C1-3алкилC5-7арильную группу, такую как бензил (-CH2-C6H5). Циклическая алкильная группа может являться карбоциклической или может содержать в целом один, два или три кольцевых гетероатома, независимо выбранные из О, N и S. Предпочтительно, когда R3 является незамещенным. Когда R3 имеет заместители, заместители являются такими, как описано ниже.
Подходящий R4 представляет собой H или алкоил, то есть алкил-C(=O)-, где алкил представляет собой C1-C10алкил.
Когда R1 и/или R2 представляет собой алкил, каждый подходящий R1 и R2 независимо выбран из C1-C16алкила, более предпочтительно - из C1-C6алкила. Когда R1 и R2 вместе образуют алкиленовую цепь, подходящая алкиленовая цепь содержит от 1 до 6 атомов углерода (C1-C6) и может являться ненасыщенной и в целом содержать в цепи один, два или три гетероатома, независимо выбранные из О, N и S. Когда один из R1 и R2 соединен с N, подходящее общее количество кольцевых атомов, включая N и атом C, к которому присоединяются R1 и R2, составляет от 4 до 7 атомов, более предпочтительно - 5 атомов. Любая алкильная или алкиленовая цепь, содержащая R1 и/или R2, может быть замещенной и иметь один или более заместителей, описанных в данной заявке.
Когда R1 и R2 являются разными, атом C, к которому они присоединены, является хиральным. Предпочтительно, когда стереохимическая конфигурация около асимметрического центра -CR1R2 соответствует L-аминокислоте. Однако стереохимическая конфигурация около асимметрического центра -CR1R2 может соответствовать и D-аминокислоте. Альтернативно могут быть использованы смеси соединений, имеющих асимметрические центры, соответствующие L- и D-аминокислотам.
Подходящие R1 и R2 могут соответствовать группировкам, соединенным с атомом альфа-С в природной альфа-аминокислоте. Термин ʺприродная альфа-аминокислотаʺ означает аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, цистин, глицин, глутаминовую кислоту, глутамин, гистидин, гидроксилизин, гидроксипролин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин. Один из R1 и R2 может представлять собой, соответственно, H, и один из R1 и R2 может представлять собой, соответственно, H или алкил, выбранный из перечисленных ниже группировок, или R1 и R2 вместе могут образовывать алкиленовую цепь, выбранную из перечисленных ниже группировок:
СН3-, присутствующей в аланине;
H2NC(=NH)NH[CH2]3-, присутствующей в аргинине;
NH2C(O)CH2-, присутствующей в аспарагине;
HO2CH2-, присутствующей в аспарагиновой кислоте;
HSCH2-, присутствующей в цистеине;
HO2CH(NH2)CH2SSCH2-, присутствующей в цистине;
H-, присутствующей в глицине;
HO2CH2CH2-, присутствующей в глутаминовой кислоте;
H2N(O)CCH2CH2-, присутствующей в глутамине;
C3N2HCH2-, присутствующей в гистидине;
H2NCH2CH(OH)CH2CH2-, присутствующей в гидроксилизине;
-СН2СН(ОН)СН2-, присутствующей в гидроксипролине;
СН3СН2СН(СН3)-, присутствующей в изолейцине;
(СН3)2СНСН2-, присутствующей в лейцине;
H2NCH2(CH2)3-, присутствующей в лизине;
CH3SCH2CH2-, присутствующей в метионине;
PhCH2-, присутствующей в фенилаланине;
-СН2СН2СН2-, присутствующей в пролине;
ОНСН2-, присутствующей в серине;
СН3СН(ОН)-, присутствующей в треонине;
C8NH6CH2-, присутствующей в триптофане;
НОС6Н4СН2-, присутствующей в тирозине;
(СН3)2СН-, присутствующей в валине.
Термин ʺфармацевтически приемлемое производноеʺ означает любую фармацевтически приемлемую соль, сложный эфир, соль такого сложного эфира, гидрат, сольват, или кристаллическую форму, или метаболит, или любое другое соединение, которое при введении реципиенту может быть превращено (прямо или косвенно) в соединение Формулы (I).
В контексте настоящего описания алкильная группа означает, циклический или ациклический, насыщенный или ненасыщенный (например алкенил или алкинил) гидрокарбильный радикал с разветвленной или нормальной цепью. Когда указанный гидрокарбильный радикал является циклическим, алкиленовая группа содержит предпочтительно от 3 до 12 атомов углерода (C3-C12), более предпочтительно - от 5 до 10 атомов углерода (C5-C10), более предпочтительно - от 5 до 7 атомов углерода (C5-C7). Когда указанный гидрокарбильный радикал является ациклическим, алкильная группа содержит предпочтительно от 1 до 16 атомов углерода (C1-C16), более предпочтительно - от 1 до 6 атомов углерода (C1-C6).
В контексте настоящего описания подходящая арильная группа означает ароматическую группу, содержащую от 5 до 14 кольцевых атомов. Примером Ar является фенил или нафтил. Данная ароматическая группа может представлять собой гетероароматическую группу, содержащую один, два, три или четыре гетероатома, предпочтительно один гетероатом, независимо выбранные из группы, состоящей из О, N и S. Примеры таких гетероароматических групп включают пиридил, пирролил, фуранил и тиофенил.
Алкильная и арильная группы могут быть замещенными или незамещенными. Когда указанные группы являются замещенными, обычно они содержат от одного до трех заместителей, предпочтительно - один заместитель. Заместители могут включать атомы галогенов, которые представляют собой атомы F, Cl, Br и I, и галогенметильные группы, такие как CF3 и CCl3; кислород-содержащие группы, такие как оксо, гидрокси, карбокси, карбоксиC1-16алкил, алкокси, алкоил, алкоилокси, арилокси, арилоил и арилоилокси; азотсодержащие группы, такие как амино, C1-6алкиламино, диC1-6алкиламино, циано, азид и нитро; серо-содержащие группы, такие как тиол, C1-6алкилтиол, сульфонил и сульфоксид; гетероциклические группы, которые сами могут содержать заместители; алкильные группы, такие, как определено выше, которые сами могут содержать заместители; и арильные группы, такие, как определено выше, которые сами могут являются замещенными, такие как фенил и замещенный фенил. Заместители указанных гетероциклических, алкильных и арильных групп являются такими, как определено только что выше. Заместители у R1 и/или R2 включают группировки, которые приводят к образованию соединений, у которых R1 и R2 соответствуют группировкам, соединенным с атомом альфа-C в природной альфа-аминокислоте.
В контексте настоящего описания алкокси- и арилокси-группы означают, соответственно, алкил-O- (например алкил-O-, у которого алкил представляет собой C1-C16алкил, предпочтительно C1-C6алкил) и арил-O- (например арил-O-, у которого арил представляет собой 5-14-членную ароматическую моно- или биконденсированную кольцевую группировку, необязательно содержащую 1, 2, 3 или 4 гетероатома, независимо выбранные из О, S и N, предпочтительно арил представляет собой фенил).
В контексте настоящего описания алкоильная и арилоильная группы означают, соответственно, алкил-CO- (например алкил-CO-, у которого алкил представляет собой C1-C16алкил, предпочтительно C1-C6алкил) и арил-CO- (например арил-CO-, у которого арил представляет собой 5-14-членную ароматическую моно- или биконденсированную кольцевую группировку, необязательно содержащую 1, 2, 3 или 4 гетероатома, независимо выбранные из О, S и N, предпочтительно арил представляет собой фенил).
В контексте настоящего описания алкоилокси и арилоилокси означают, соответственно, алкил-CO-O (например алкил-CO-О, у которого алкил представляет собой C1-C16алкил, предпочтительно C1-С6алкил) и арил-CO-O (например арил-CO-O, у которого арил представляет собой 5-14-членную моно- или биконденсированную ароматическую кольцевую систему, необязательно содержащую 1, 2, 3 или 4 гетероатома, независимо выбранные из О, S и N, предпочтительно арил представляет собой фенил).
В контексте настоящего описания гетероциклические группы означают группы, содержащие один или более чем один пирролил, имидазолил, пиразиолил, тиазолил, изотиазолил, оксазолил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, тетрагидрофуранил, пиранил, пиронил, пиридил, пиразинил, пиридазинил, пиперидил, пиперазинил, морфолинил, тионафтил, бензофуранил, изобензофурил, индолил, оксииндолил, изоиндолил, индазолил, индолинил, 7-азаиндолил, изоиндазолил, бензопиранил, кумаринил, изокумаринил, хинолил, изохинолил, нафтридинил, циннолинил, хиназолинил, пиридопиридил, бензоксазинил, хиноксадинил, хроменил, хроманил, изохроманил и карболинил.
Согласно одному из вариантов осуществления настоящего изобретения, подходящий Ar представляет собой нафтил, особенно 1-нафтил, то есть нафтил, связанный с атомом P через атом O, присоединенный в положении 1 нафталинового кольца.
Согласно другому варианту осуществления настоящего изобретения, подходящий Ar представляет собой фенил.
Согласно одному из вариантов осуществления настоящего изобретения, Ar является замещенным. Подходящие заместители описаны в данной заявке.
Согласно одному из вариантов осуществления настоящего изобретения, Ar представляет собой незамещенный 1-нафтил.
Согласно одному из вариантов осуществления настоящего изобретения, Ar представляет собой незамещенный фенил.
Согласно одному из вариантов осуществления настоящего изобретения, R4 выбран из группы, состоящей из H и ацетила (СН3С(=O)-), особенно предпочтительно, когда R4 представляет собой Н.
Согласно одному из вариантов осуществления настоящего изобретения, R3 выбран из группы, состоящей из бензила и представителей группы, включающей C1-C10 алкилы, особенно предпочтительно, когда R3 выбран из н-пропила, н-бутила, н-пентила и н-гексила, более предпочтительно, когда R3 представляет собой н-пентил.
Согласно одному из вариантов осуществления настоящего изобретения, R1 и R2 соответствуют группировкам, соединенным с атомом альфа-С в природной альфа-аминокислоте, описанным в данной заявке. Особенно подходящая природная альфа-аминокислота представляет собой L-аланин, соответственно, один из R1 и R2 представляет собой H, один из R1 и R2 представляет собой CH3 и атом C, к которому они присоединены, является хиральным. Согласно другим вариантам осуществления изобретения, R1 и R2 соответствуют группировкам, соединенным с атомом альфа-C в неприродной альфа-аминокислоте, например оба подходящих R1 и R2 представляют собой CH3.
Конкретные отличительные признаки изобретения, описанные выше в вариантах осуществления изобретения, могут быть объединены вместе в любых без исключения комбинациях в соединениях согласно настоящему изобретению.
Особенно подходящими соединениями согласно настоящему изобретению являются соединения, у которых Ar представляет собой 1-нафтил, R3 представляет собой бензил, один из R1 и R2 представляет собой H, один из R1 и R2 представляет собой метил и атом C, к которому присоединены R1 и R2, является L-хиральным, и соединения, у которых Ar представляет собой 1-нафтил, R3 представляет собой н-пентил, один из R1 и R2 представляет собой H, один из R1 и R2 представляет собой метил и атом C, к которому присоединены R1 и R2, является L-хиральным. Для каждого из соединений наиболее предпочтительным R4 является H.
Традиционное лечение рака с использованием химиотерапии в значительной степени основано на использовании нуклеозидных аналогов. Данные молекулы созданы, чтобы имитировать природные пиримидиновые и пуриновые нуклеозиды. После поглощения клеткой эти молекулы подвергаются фосфорилированию клеточными ферментами, такими как (дезокси)цитидинкиназа (dCK), тимидинкиназа (TK) и/или нуклеозид/нуклеотид-киназы. Впоследствии данные антиметаболиты могут мешать de novo синтезу предшественников ДНК/РНК и в конечном итоге ингибируют синтез ДНК/РНК, что определяет их цитотоксическое/цитостатическое действие (Hatse et al., 1999; Galmarini et al., 2002).
Антиметаболиты на основе фторпиримидина, такие как фторурацил (5-FU), капецитабин и 5-фтор-2'-дезоксиуридин (5-FdUrd), используются главным образом в лечении карциномы толстой кишки, молочной железы и яичника (de Bruin et al., 2006; Ishikawa et al., 1998; Walko et al., 2005). Внутри клетки данные лекарства подвергаются метаболическому превращению в 5-FdUMP, который образует стабильный ингибирующий комплекс с тимидилатсинтазой (TS) и восстановленным ко-субстратом 5,10-метилентетрагидрофолатом, тем самым блокируя связывание с данным ферментом нормального субстрата dUMP (Beck et al., 1994; Tanaka et al., 2000; Longley et al., 2003). TS представляет собой фермент, отвечающий за превращение dUMP в ТМР, и поэтому является необходимым для клеточной пролиферации, это обстоятельство делает TS привлекательной мишенью при создании лекарств. Среди фторпиримидинов, перечисленных выше, только для превращения 5-FdUrd в 5-FdUMP требуется одна метаболическая стадия, а именно стадия фосфорилирования, катализируемая ТК (Longley et al., 2003). Обязательное фосфорилирование часто является стадией, лимитирующей скорость метаболизма многих противораковых лекарств (включая 5-FdUrd), и поэтому является одним из ограничивающих факторов для терапевтического использования нуклеозидных аналогов. В связи с этим для улучшения противораковой эффективности нуклеозидных аналогов были исследованы другие стратегии (Galmarini et al., 2002).
Заряд, который несут нуклеозидмонофосфаты в физиологических условиях, является причиной плохого проникновения данных молекул через клеточную мембрану, если вообще таковое имеет место (Mehellou et al., 2009). Поэтому прямое введение уже фосфорилированных молекул с целью обойти первую стадию фосфорилирования не дает какого-либо значительного терапевтического преимущества. В связи с этим для достижения более эффективной доставки лекарств изучали различные стратегии обхода стадии фосфорилирования, лимитирующей скорость метаболизма, путем использования в качестве пролекарства различных типов нуклеозид 5'-монофосфатов (Hecker & Erion, 2008). Введение липофильных фосфорамидатных нуклеотидов (ProTide) в качестве пролекарств оказалось успешным в отношении нескольких молекул, обладающих противовирусной/противораковой активностью (Harris et al., 2001; Congiatu et al., 2006; McGuigan et al., 2010). Экранирование заряда фосфатного мотива может обеспечить хорошую пассивную диффузию пролекарств через мембрану, после чего, уже внутри клетки, пролекарство быстро превращается в соответствующий нуклеозидмонофосфат в результате ферментативного расщепления (Mehellou et al., 2009).
Микоплазмы представляют собой мельчайшие самореплицирующиеся организмы на планете, которые характеризуются отсутствием клеточной стенки и очень коротким геномом (600-1200 т.п.н.). Многие из данных бактерий являются паразитирующими и присутствуют в организме человека, являясь причиной бессимптомных инфекций (Razin et al., 1998). Показано, что данные прокариоты избирате