Способ краткосрочного хранения венозного трансплантата
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к реконструктивной сердечно-сосудистой хирургии. Для краткосрочного хранения трансплантата его размещают в емкости с со стерильной оксигенированной наноэмульсией «Перфторан». В асептических условиях канюлируют ее дистальный конец. Накладывают зигзагообразную клипсу на проксимальный конец вены и промывают вену с периодичностью 3-5 минут. При этом подачу раствора осуществляют трехкомпонентным стерильным шприцом через систему трубок и трехходовой кран. Способ позволяет повысить качество сохранности трансплантата. 3 ил.
Реферат
Способ относится к медицине, а именно к реконструктивной хирургии магистральных артерий и вен нижних конечностей, а также коронарных артерий, и может использоваться во время операции для краткосрочного хранения аутовенозных трансплантатов в период времени от изъятия до имплантации их в сосудистое русло.
Актуальность разработки определена высокой частотой использования венозных шунтов в реконструктивных операциях на магистральных артериях и венах нижних конечностей, а так же коронарных артериях [2, 7]. Длительность нахождения трансплантата ex vivo без его консервации составляет от 5 до 120 минут, что неминуемо сопровождается метаболическими изменениями в тканях трансплантата. Известно, что чувствительность пересаживаемых тканей к гипоксии имеет важное значение и даже кратковременная ишемия приводит к той или иной степени метаболических изменений таких ацидоз, истощение энергетического запаса, повреждение мембранных структур вплоть до некробиотических изменений. По данным экспериментального исследования на животных, полная реэндотелизация венозного трансплантата происходит в сроке до 4 мес [14]. Таким образом, ишемизированный венозный трансплантат является уязвимым местом осложнений транспланации [10, 12]. Эти данные находят подтверждение в клинической практике. В частности, в артериальной позиции повреждение в ходе операции эндотелия и усиленный атерогенез провоцируют гиперплазию и гипертрофию интимы и средней оболочки сосуда, и как следствие, отсроченную и позднюю несостоятельность венозного трансплантата. В 18% случаев отмечается ранняя несостоятельность шунта вследствие его тромбоза. В венозной позиции частота тромбоза трансплантата колеблется в диапазоне 4-6% в ближайшие 6 недель после операции даже при адекватной антикоагуляционной терапии [11, 13]. Все это определяет необходимость сохранения эндотелия и дальнейшего поиска дополнительных способов предотвращения осложнений трансплантации.
Наиболее распространенным способом краткосрочного хранения венозных трансплантатов является погружение их в гепаринизированный раствор NaCl: 5 тыс ЕД гепарина в 200 мл 0,9% раствора натрия хлорида [4]. Данный раствор выбран в качестве прототипа. Он прост в изготовлении, дешев, химически и биологически инертен. Однако в аутовене, хранящейся в данном растворе, нарушено протекание окислительно-восстановительных реакций, что не предотвращает возникновение ацидоза, повреждения мембран и некробиотических процессов.
Описано изобретение к патенту на состав для консервации аутовенозных трансплантатов, содержащий гепарин 25 тыс ЕД, отличающийся тем, что дополнительно включает глицин - 15 ммоль/л, цитрат калия - 35 ммоль/л, глюкозу - 30 ммоль/л, сульфат магния семиводный - 40 ммоль/л, маннитол - 15 ммоль/л, аденозинтрифосфорную кислоту 5 ммоль/л, гентамицин - 2000000 ЕД, дексаметазон 16 мг/л, инсулин - 80 ЕД/л, верапамил - 10 мг/л, вода дистилированная. Авторы сообщают о том, что данный раствор позволяет стабилизировать уровень окислительно-восстановительных реакций в эндотелии вен, который достоверно превышает аналогичные параметры в сравнении с гепаринизированным раствором натрия хлорида. Так же в литературе существуют данные о применении этого раствора в операциях. У 5-ти из 5-ти больных отмечен положительный результат в ближайшем (3 мес) и отдаленном (6 мес) периоде в виде отсутствия инфекционных осложнений и тромбоза аутовен. Однако количество клинических наблюдений не обеспечивает достоверность выводов. Так как тромбоз шунта в артериальной позиции достигает 18% случаев [2], объем выборки при 95% доверительном интервале должен составлять 227 случаев [15].
Так же известен способ подготовки сосудистых трансплантатов из большой подкожной вены. После взятия трансплантат очищают от окружающей клетчатки, отмывают от остатков крови раствором гепарина (20 тыс.Ед. на 100,0 изотонического раствора натрия хлорида). В стерильных условиях трансплантат подвергают разовому воздействию гамма-луча в дозе 2,0-2,5 Гр. По мнению авторов в результате применения способа упрощается методика подготовки трансплантата и обеспечивается более длительное сохранение его функции. Однако данный способ не профилактирует некробиотические изменения трансплантата, а сравнительные клинические данные применения метода с традиционным раствором натрия хлорида отсутствуют.
Таким образом, профилактика некробиотических изменений аутовенозного трансплантата является не решенной задачей. Наряду с необходимостью проведения сравнительных исследований существующих необходима разработка и изучение новых способов краткосрочного хранения венозных трансплантатов.
В литературе нет данных о применении перфторана при трансплантации венозных сегментов с целью их противоишемической защиты. Известно успешное применение перфторана для защиты почек [3], печени [8], а также при местном применении [1]. Основными преимуществами перфторана над другими антигипоксантами являются его интактность к тканям и органам и высокая транспортная способность. В 100 мл препарата (10 об. % субмикронная эмульсия) суммарная поверхность частичек составляет 847 кв.м., которая более чем в 12 раз превышает суммарную поверхность эритроцитов, содержащихся в таком же объеме крови - 70 кв.м. [5, 6, 9]. Перфторан растворяет в 20 раз больше кислорода и в сотни раз больше монооксида азота, чем водная среда плазмы крови. Эти факты послужили основанием для ожидания высокой противоишемической защиты эндотелия и при его краткосрочном хранении в условиях ex vivo, что замедлит некробиотические процессы и реэндотелизацию трансплантата.
Задача изобретения - повысить качество сохранности аутовенозных трансплантатов.
Поставленная задача решается благодаря способу краткосрочного хранения венозного трансплантата, включающего иссечение вены по технике «no-touch» (минимальные манипуляции при заборе трансплантата), канюлировании дистального конца вены, накладывания зигзагообразной клипсы на проксимальный конец вены и ее промывание через канюлю оксигенированной наноэмульсией «Перфторан».
В источниках патентной и научной информации не выявлены сведения, опровергающие новизну предлагаемого технического решения. Поэтому авторы полагают, что оно соответствует критериям патентоспособности, "новизна" и "изобретательский уровень".
Способ в соответствии с предлагаемым изобретением осуществляют следующим образом.
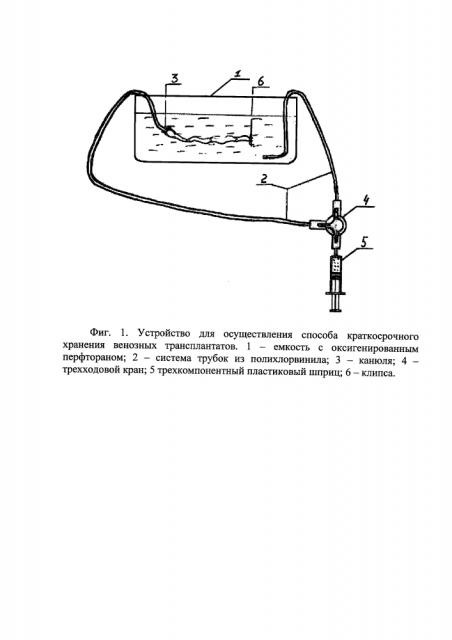
Во время проведения операции по трансплантации аутовенозных сегментов целевую вену иссекают по технике «no-touch» [16], обеспечивающей минимальные манипуляции при заборе трансплантата, притоки перевязывают. В асептических условиях вену помещают в емкость со стерильной оксигенированной наноэмульсией «Перфторан», дистальный конец вены канюлируют, затем накладывают зигзагообразную клипсу на проксимальный конец вены. Далее эмульсией из этой емкости медленно промывают вену через канюлю с периодичностью 3-5 минут. Подачу эмульсии осуществляют трехкомпонентным стерильным шприцом объемом 5 мл через систему трубок и трехходовой кран.
На фиг. 1 изображена схема устройства для осуществления способа краткосрочного хранения венозных трансплантатов, где цифрами обозначены: 1 - емкость с оксигенированным перфтораном; 2 - система трубок из полихлорвинила; 3 - канюля; 4 - трехходовой кран; 5 - трехкомпонентный пластиковый шприц; 6 - зигзагообразная клипса.
Последовательно переключая трехходовой кран, сначала нагнетают в шприц раствор из емкости, затем подают его в вену объемом, приблизительно равным объему вены, рассчитанному по формуле V=πr2l, где r - радиус проксимальной части сосуда, измеренный до вмешательства ультразвуковым методом, l - длина сосуда. Таким образом, препарат полностью расправляет вену, а зигзагообразная клипса не дает ей быстро опорожняться.
Для изучения жизнеспособности эндотелия в перфторане проведено экспериментальное исследование. Изучены фрагменты большой подкожной вены длиной 5 см, взятые интраоперационно в ходе аортокоронарного шунтирования у 58 пациентов с ишемической болезнью сердца. Вена разделялась на 5 фрагментов длиной по 1 см. С одного тотчас производилась браш-биопсия интимы с последующим приготовлением пленчатого препарата эндотелия. Оставшиеся 4 венозных фрагмента помещались в 4 пробирки с исследуемыми средами. Равными объемами по 10 мл в качестве консервантов применялись гепаринизированный 0,9% раствор NaCl, гепаринизированная аутоартериальная и аутовенозная кровь и перфторан. Последующие биопсии проводились на 15 и 30 минутах консервации. В цитологическом анализе учитывались следующие признаки деградации и некроза эндотелия: кариолизис, кариорексис, кариопикноз, разрыв кариолемы, нарушение целостности цитолемы, набуханине ядер с образованием оптической полости, выраженная метахромазия клетки.
Результаты. На 15 минуте консервации наименьшая доля клеток с необратимыми изменениями эндотелия в пробе с перфтораном Медиана - 18%, Интерквартильный размах 16%-20%. На фиг. 2 представлена диаграмма размаха доли эндотелиоцитов с признаками некробиоза в пленчатых препаратах, приготовленных из соскоба интимы. Время консервации в исследуемых средах - 15 минут.
На 30 минуте консервации минимальные значения доли эндотелиоцитов с признаками деградации в пробе с перфтораном - медиана 29%, интерквартильный размах - 26%-32%. На фиг. 3 представлена диаграмма размаха долей эндотелиоцитов с признаками некробиоза в пленчатых препаратах, приготовленных из соскоба интимы. Время консервации в исследуемых средах - 30 минут.
Заключение. Решающий фактор сохранности эндотелия венозного трансплантата - время. Минимальная деградация эндотелия венозного сегмента наблюдается непосредственно после изъятия из кровотока венозного трансплантата. При планировании краткосрочного хранения венозного сегмента (до 15 минут) в качестве среды консервации рекомендуется использовать перфторан. Если консервация предполагается более 15 минут, следует учесть высокие показатели некроза эндотелия.
Литература
1. Агапов B.C., Пиминова И.А. Оценка результатов местного применения перфторана в комплексном лечении больных с одонтогенными флегмонами лица и шеи // Стоматология. 2006. №5. С. 32-35.
2. Бокерия Л.А., Авалиани В.М., Мерзляков В.Ю. Аортокоронарное шунтирование на работающем сердце. М.: НЦССХ им. А.Н. Бакулева РАМН, 2008. 750 С.
3. Бокерия Л.А., Мовсесян Р.А., Шаталов К.В. Мультиорганный забор в условиях ЭКК и глубокой гипотермии с применением перфторанов // Трансплантология и искусственные органы. 1996. Т. 1-2. С .6-12.
4. Гришин И.Н., Савченко А.Н. Клиническая ангиология и хирургия. Минск, 1981. 148-157 С.
5. Иваницкий Г.Р. и др. Культивирование животных клеток на жидких перфторуглеродах // Дан. 1981. Т. 28. №1. С. 225-228.
6. Иваницкий Г.Р., Воробьев С.И. Кровезаменитель "Перфторан" // Вестник Российской академии наук. 1997. Т. 67. №11. С. 998-1013.
7. Казанчян П.О., Дебелый Ю.В., Кевлишвили З.У. Отдаленные результаты бедренно-тибиальных реконструкций // Хирургия. 2004. Т. 11. С. 8-11.
8. Краснов О.А. и др. Способ кнсервации печени при трансплантации // 2013. Т. 02. №19. С. 0-4.
9. Перфторуглеродные соединения в экспериментальной и клинической медицине / под ред. Г.А. Софронов. СПб, 2004. 154 С.
10. Agutter P.S., Malone Р.С., Silver I. a. Experimental Validation of Methods for Prophylaxis against Deep Venous Thrombosis: A Review and Proposal. // Thrombosis. 2012. T. 2012. C. ID 156397.
11. Raju S. и др. Axillary vein transfer in trabeculated postthrombotic veins. // J. Vase. Surg. 1999. T. 29. №6. C. 1050-62; discussion 1062-4.
12. Malone P.C., Agutter P.S. The aetiology of deep venous thrombosis. // QJM. 2006. T. 99. №9. C. 581-93.
13. Raju S., Hardy J. Technical options in venous valve reconstruction // Am J Surg. 1997. T. 173. №4. C. 301-7.
14. Raju S., Perry J.T. The response of venous valvular endothelium to autotransplantation and in vitro preservation. // Surgery. 1983. T. 94. №5. C. 770-5.
15. Объем выборки для оценки доли в генеральной совокупности [Электронный ресурс]. URL: http://pvalue.ru/PropSampleSize/.
166. Бокерия Л.А., Авалиани В.М., Буторин СП. Венозные трансплантаты и их состоятельность в ближайшем и отдаленном периодах после аортокоронарного шунтирования // Бюлл. НЦССХ им. А.Н. Бакулева РАМН, т. 14, №5, 2013.
Способ краткосрочного хранения венозного трансплантата, включающий иссечение вены по технике «no-touch» с перевязкой притоков, отличающийся тем, что для краткосрочного хранения трансплантата его размещают в емкости со стерильной оксигенированной наноэмульсией «Перфторан», в асептических условиях канюлируют ее дистальный конец, накладывают зигзагообразную клипсу на проксимальный конец вены и промывают вену с периодичностью 3-5 минут, а подачу раствора осуществляют трехкомпонентным стерильным шприцем через систему трубок и трехходовой кран.