Средство, обладающее нейропротекторными свойствами в эксперименте и способ его получения
Иллюстрации
Показать всеГруппа изобретений относится к области создания средства, обладающего нейропротекторными свойствами в эксперименте, включающего биодеградируемый полимерный матрикс на основе фиброина шелка с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемым активированным протеином С в соотношении 99-99,9:0,1-1 мас.% фиброин:пептид, а также способа его получения. Использование данной группы изобретений позволяет защитить пептид-агонист рецептора ПАР1, освобождаемый активированным протеином С, от протеолиза и регулировать скорость выхода средства в условиях эксперимента. 2 н. и 2 з.п. ф-лы, 6 ил., 1 табл., 3 пр.
Реферат
Область техники
Изобретение относится к биотехнологии и медицине, а именно к области создания средств, включающих биодеградируемые матриксы на основе фиброина шелка и пептид-агонист рецептора ПАР1.
Уровень техники
На сегодняшний день большинство используемых в терапии разных заболеваний лекарств имеют серьезные недостатки, связанные с наличием многочисленных побочных эффектов и противопоказаний. Кроме того, лечение острых тяжелых заболеваний часто связано с ограничением терапевтического окна, в течение которого необходимо использовать лекарства. Это часто сопровождается невысокой эффективностью лечебного процесса и нежелательными осложнениям и дальнейшей инвалидизацией.
Сложная ситуация складывается при лечении инсультов и тяжелых воспалительных заболеваний и травм. Ишемический инсульт - острое нарушение мозгового кровообращения, сопровождается гибелью клеток мозга и нарушением его функций вследствие тромбоза или тромбоэмболии сосудов мозга. По данным ВОЗ от инсультов в мире ежегодно умирают около 6,4 млн человек. Ежегодная смертность от инсульта в нашей стране - одна из наиболее высоких в мире. Летальность в остром периоде инсульта в России достигает 35%, возрастая на 15% к концу первого года после перенесенного инсульта. Инсульт - лидирующая причина инвалидизации населения.
Оптимизация лечения ишемического инсульта и тяжелых воспалительных заболеваний - одна из самых актуальных проблем медицины и патофизиологии.
В настоящее время для лечения ишемического инсульта, который вызван окклюзией сосуда, кроме классического применения антиоксидантов и антикоагулянтов используют технологию или механического удаления тромба(ов) в сосудах мозга, или тромболитическую терапию с помощью тканевого активатора плазминогена (ТАП). ТАП - протеолитический фермент, (утвержденный FDA, США) стимулирует лизис тромбов, активируя образование протеазы - плазмина, и восстановление кровотока (реперфузию) окклюзированного сосуда. Проводить целенаправленный тромболизис с помощью ТАП - трудная и сложная задача из-за многообразия факторов риска. ТАП вызывает не только тромболизис, ангио- и нейрогенез, но также тяжелое побочное действие, приводя к нарушению гемато-энцефалического барьера, геморрагии и гибели нейронов мозга в моделях инсульта на животных.
Как показали эксперименты на животных с экспериментальной ишемией мозга и первые доклинические исследования (в США), введение вместе с ТАП в острый период инсульта белка крови - активированного протеина С (АПС) блокирует вызванную ТАП гибель нейронов и стабилизирует ГЭБ [Mosnier L.O., Griffin J.H. Protein С anticoagulant activity in relation to anti-inflammatory and anti-apoptotic activities // Front Biosci. 2006. V. 11. P. 2381-2399; Griffin J.H., Fernandez J.A., Gale A.J., Mosnier L.O. Activated protein С // J Thromb Haemost.5 Suppl 1. 2007. P. 73-80; Zlokovic B.V., Griffin J.H. Cytoprotective protein С pathways and implications for stroke and neurological disorders // Trends Neurosci. 2011. V. 34 (4). P. 198-209].
Рецепторы, активируемые протеиназами (ПАР), опосредуют регуляторное влияние сериновых протеиназ на клетки разных тканей [Coughlin S.R. Thromb. Haemost. 2005. V. 3 (8). P. 1800-1814]. Эти рецепторы были впервые открыты в начале 1990-х годов, на данный момент их известно 4 типа - ПАР - 1, 2, 3 и 4.
ПАР-рецепторы относятся к семейству семидоменных трансмембранных рецепторов, сопряженных с G-белками. Внеклеточный N-конец ПАР содержит пептидную связь «активационного сайта», которая расщепляется сериновой протеиназой. Вновь образованный N-конец, так называемый «привязанный лиганд», взаимодействуя со второй внеклеточной петлей рецептора, приводит к изменению конформации молекулы ПАР и его активации. Активация ПАР является необратимой, после активации рецептор интернализуется и подвергается лизосомальной деградации.
Из семейства рецепторов, активируемых протеиназами, ПАР1 является наиболее изученным. ПАР1 был впервые идентифицирован как рецептор тромбина.
Настоящее изобретение подразумевает использование другого агониста ПАР1 - пептида, освобождаемого АПС при расщеплении ПАР1.
В частном варианте реализации пептид, освобождаемый АПС при расщеплении ПАР1, имеет структуру NPNDKYEPF амида.
Активированный протеин С (АПС) - сериновая протеиназа семейства трипсина образуется в фазе инициации свертывания крови в результате ограниченного протеолиза протеина С крови тромбином, связанным с тромбомодулином эндотелия. Активация протеина С комплексом тромбин-тромбомодулин существенно ускоряется при связывании протеина С с рецептором на эндотелии сосудов - эндотелиальным рецептором протеина С.
В системе гемостаза АПС играет ключевую роль в реализации антикоагулянтной функции. АПС в присутствии кофактора - протеина S блокирует образование тромбина на ранней стадии свертывания крови механизмом отрицательной обратной связи [Hanson SR, Griffin JH, Harker LA, Kelly AB, Esmon CT, Gruber A.J Clin Invest. 1993. V. 92 (4). P. 2003-12], поскольку инактивирует необходимые кофакторы свертывания крови - факторы Va и VIIIa, специфично гидролизуя в каждом по три пептидные связи.
Наряду с антикоагулянтными функциями АПС оказывает цитопротекторное, антиапоптотическое, противовоспалительное действие [Striggow F., Riek М., Breder J., Henrich-Noack P., Reymann K.G., Reiser G. The protease thrombin is an endogenous mediator of hippocampal neuroprotection against ischemia at low concentrations but causes degeneration at high concentrations // Proc Nat Acad Sci USA. 2000. V. 97. P. 2264-2269]. Недавние исследования показали, что АПС способен оказывать защитное действие при таких острых состояниях, как сепсис, диабетическая нейропатия, инсульт, рассеянный склероз и при прогрессирующих метастазах [Esmon СТ1, Glass JD. J Clin Invest. 2009. V. 119 (11). Р. 3205-7].
Показано, что АПС является нейроунокпротектором в стрессированных нейронах и в эндотелии мозга при гипоксии [Magistretti P.J. Neuron-glia metabolic coupling and plasticity // Exp Physiol. 2011. V. 96 (4). P. 407-410]. Протекторное действие АПС было продемонстрировано не только на тканях мозга, но и в других органах и тканях. В экспериментах in vivo и in vitro показано защитное действие АПС на эндотелиальные клетки легких, слизистой желудка и пупочной вены, что приводило к восстановлению барьерных функций сосудистой стенки и улучшению кровотока в органах в условиях повреждающих воздействий, например эндотоксина, стресса, тромбина [Nakamura М., Gabazza Е.С., Imoto I., Yano Y., Taguchi O., Horiki N., Fukudome K., Suzuki K., Adachi Y.J Thromb Haemost. 2005. V. 3. Р. 2721-9].
Препараты рекомбинантного АПС (рАПС, Зигрис) разрешены FDA (США) для лечения системного воспаления (сепсиса) у детей и взрослых. Было показано, что рАПС снижает смертность больных с тяжелым сепсисом. Однако недавно обнаружено, что ведение высоких концентраций рАПС на раннем этапе реперфузии не вызывало устойчивую нейропротекцию и не улучшало исход после глобальной ишемии головного мозга, остановки сердца и острого воспаления [Teschendorf Р, Padosch SA, , Albertsmeier M, Schneider A, Vogel P, Choi YH, , Popp E. Neurosci Lett. 2008. V. 448 (2). P. 194-9].
Также были созданы модифицированные препараты рАПС, лишенные антикоагулянтной активности, но сохраняющие цитопротекторные свойства. Однако их преклинические исследования только начинаются и сохраняются возможности тяжелых побочных реакций на вводимый белок [Wang Т, Lee МН, Choi Е, Pardo-Villamizar СА, Lee SB, Yang IH, Calabresi PA, Nath A. PLoS One. 2012. V. 7 (8): e43950].
Раскрытие изобретения
Задачей изобретения является создание средства, обладающего нейропротекторными свойствами в эксперименте, включающего биодеградируемый полимерный матрикс на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемым активированным протеином С, а также способа получения данного средства.
Поставленная задача решается средством, обладающем нейропротекторными свойствами в эксперименте, включающим биодеградируемый полимерный матрикс на основе фиброина шелка с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемого активированного протеина С, при этом соотношение фиброин:пептид составляет 99-99,9:0,1-1 мас. %.
Предпочтительно в качестве фиброина шелка использовать фиброин шелка кокона тутового шелкопряда Bombyx mori.
Поставленная задача решается также тем, что способ получения вышеуказанного средства включает приготовление биодеградируемого полимерного матрикса на основе фиброина шелка, иммобилизацию пептида-агониста рецепторов ПАР1 на носитель в водном растворе фиброина шелка с концентрацией от 0,05 до 0,2 мг/мл, при концентрации пептида от 1,0 до 1,5 мг/мл и сушку матрикса с иммобилизованным пептидом-агонистом рецепторов ПАР1.
Техническим результатом, достигаемым при использовании изобретения, является защита пептида-агониста рецептора ПАР1, освобождаемого активированным протеином С, от протеолиза и способность регулировать скорость выхода препарата в условиях эксперимента. А также расширение арсенала средств аналогичного назначения.
Регулировка скорости высвободившегося из матрицы пептида достигается тем, что подобраны оптимальные носители и способы иммобилизации пептида, а также их количественное содержание, которое обеспечивает необходимую скорость высвобождения пептида.
Для решения данной задачи на основе анализа научно-технической литературы и полученных ранее результатов экспериментальных исследований была определена аминокислотная последовательность для синтеза препаратов пептида-агониста ПАР1, освобождаемого АПС. Примененные методы синтеза, деблокирования, очистки и модификации пептидов позволяют быстро и с высоким выходами получить пептид-агонист рецепторов ПАР1, освобождаемого активированного протеина С.
Разнообразие форм полимерных носителей, используемых для иммобилизации пептида-агониста ПАР1, освобождаемого АПС, предполагает выбор наиболее оптимальной формы носителя, при иммобилизации на которые препарат будет демонстрировать наиболее оптимальный биологический эффект.
Направленная доставка биологически активных молекул и лекарственных средств с контролируемой скоростью в течение заданного времени - основной приоритет в создании систем доставки лекарственных препаратов. Биополимеры должны быть биологически безопасны: обладать высокой биосовместимостью, способностью к биодеградации, быть не токсичными, не вызывать иммунной реакции при введении в организм. Поиск материалов с необходимыми свойствами привел к возрождению интереса к полимерам, созданным на основе шелка. Они обладают впечатляющими механическими свойствами, иммуногенность этих белков крайне низкая и конструкции на их основе разрушаются с образованием нетоксичных продуктов. Кроме того, при работе с данными биополимерами есть возможность получения водных растворов таких полимеров, чтобы избежать потери биологической активности инкапсулируемых веществ. Наибольший интерес среди биополимеров для создания систем направленной доставки препаратов вызывает такой биополимер природного происхождения, как шелк. Шелк является натуральным полимером, который синтезируется представителями отряда Lepidoptera и класса Arachnida. Большое практическое значение имеет шелк коконов бабочек семейства Saturnidae, к которым относится тутовый шелкопряд Bombyx mori. Шелк, производимый Bombyx mori, используется в текстильной промышленности, а также в медицинской практике в качестве шовного материала. Интерес к шелку как к материалу для биомедицинских изделий вызван его уникальными свойствами, выделяющими его среди других биосовместимых материалов. Шелк обладает высокой механической прочностью и эластичностью, при этом он значительно превосходит коллаген и многие другие натуральные и синтетические полимеры по этим показателям. Кроме того, шелк термостабилен, изделия из него могут стерилизоваться обработкой при температуре до 150°С. Шелк кокона тутового шелкопряда Bombyx mori состоит из двух белков: фиброина и серицина. Фиброин - это фибриллярный белок, формирущий нити, составляющие структурную основу шелка. Серицин - гидрофильный белок, соединяющий между собой между собой отдельные фибриллы фиброина. Серицин обладает иммуногенным действием, поэтому для изготовления биомедицинских используют фиброин, очищенный методом десерицинизации. Фиброин состоит из двух цепей: тяжелой (325 кДа) и легкой (25 кДа), соединенных дисульфидными связями. Также в состав фиброина входит гликопротеид Р25 массой 25 кДа, нековалентно связанный с цепями. В нативной форме молекула существует в виде комплекса из тяжелых и легких цепей и гликопротеида в соотношении 6:6:1. Фиброин позволяет создавать на основе его водных растворов прочные и одновременно гибкие структуры. Он может быть использован для изготовления различных изделий: волокон, в том числе нановолокон, покрытий, пленок, трубок, трехмерных матриксов, гелей и микрочастиц.
В связи с этим одной из экспериментальных задач был выбор оптимальной биосовместимой и биодеградируемой полимерной матрицы на основе фиброина и способа иммобилизации синтезированного пептида-агониста рецепторов ПАР1, освобождаемого активированного протеина С, на выбранных носителях. Для решения данной задачи на основе фиброина было создано три типа носителя: покрытие, пленка и трехмерный матрикс. Для осуществления иммобилизации пептида-агониста ПАР1, освобождаемого АПС, на носителе предложено несколько способов: иммобилизация пептида-агониста рецепторов ПАР1 на разных формах полимерного носителя проводилась путем погружения пленки и трехмерного матрикса в растворы, содержащие пептид, или нанесением такого раствора на полимерное покрытие из фиброина шелка. По результатам исследований функциональной активности высвободившегося из матрицы пептида были отобраны оптимальные носители и способы иммобилизации терапевтического агента на носителе. По результатам проведенных исследований установлено, что наиболее «удачным» носителем является трехмерный матрикс, а оптимальный способ иммобилизации пептида-агониста рецепторов ПАР1, освобождаемого активированного протеина, - обработка полимерных носителей раствором пептида с концентрацией от 1,0 до 1,5 мг/мл в водном растворе фиброина шелка с концентрацией от 0,05 до 0,2 мг/мл с последующим высушиванием. Такой способ иммобилизации исследуемого пептида на полимерной матрице обеспечивает необходимую скорость высвобождения препарата.
Соотношение фиброина шелка и пептида лежит в интервале подобрано таким образом, чтобы получить средство, обладающее нейропротекторными свойствами в эксперименте, при этом не нарушая свойств полимерного матрикса на основе фиброина шелка.
Существует несколько методов получения матриксов на основе фиброина. К их числу относятся метод выщелачивания, метод лиофилизации и метод замораживания-оттаивания. Иммобилизация пептидов в полимерные матрицы или микрочастицы позволяет защитить пептиды от разрушения, а также направленно регулировать скорость их выхода как в условиях in vitro так и in vivo.
Использование пептидов-агонистов ПАР1, освобождаемых АПС, обусловлено их дешевизной по сравнению с рекомбинантным и модифицированным АПС. Однако есть опасность их быстрого расщепления пептидазами в организме.
Иммобилизация пептидов в полимерные матрицы или микрочастицы позволяет защитить пептиды от разрушения, а также регулировать скорость их выхода в условиях in vitro. В связи с этим особую значимость приобретает правильный выбор полимерной матрицы.
Использование полимерных матриц или микрочастиц на основе фиброинов шелка или полисахаридов - альгинатов и др. позволяет получать матрицы, которые являются не только биосовместимыми, но и биодеградируемыми, а следовательно, могут быть предложены для направленного нейропротекторного действия in vitro.
Однако до настоящего времени не были созданы препараты пептидов со свойствами АПС, иммобилизованные в биодеградируемые полимерные матрицы, и не было исследовано их нейропротекторное действие.
Клеточные культуры являются универсальным методом для исследования «физиологических» и патологических явлений, выяснения механизмов протекающих процессов. Для нейроисследований в качестве модельных клеток используют в основном такие виды клеток, как нейроны, астроциты и эндотелиальные клетки, что связано с тем, что данные типы клеток составляют единую функциональную единицу в организме при повреждениях нервных тканей.
В качестве модели для изучения нейропротекторного действия синтезированного пептида были выбраны тучные клетки. Это связанно с тем, что именно тучные клетки наиболее активно вовлекаются в процессы заживления ран, поскольку способны в ответ на активацию иммунными и неиммунными факторами освобождать множество сильных медиаторов. Тучные клетки секретируют широкий спектр противоспалительных медиаторов, таких как гистамин, интерлейкины, В-гексозаминидаза и др., вазоактивных и ростовых факторов, про- и антикоагулянтов, имеющих разнообразные биологические функции, благодаря которым они играют важную роль в клеточных «ансамблях», вовлекающихся в процессы воспаления, свертывания крови и репарацию тканей.
Известно, что дегрануляция и секреция медиаторов, в том числе предобразованного медиатора гистамина, происходит в ответ на воспаление и стимуляцию иммунными/неиммунными либераторами.
Как показано в лаборатории Линсберга (2009), гистамин и другие медиаторы, секретируемые тучными клетками при воспалении, являются нейротоксическими факторами. Поэтому выбор тучных клеток в качестве объекта исследования про- и антивоспалительных свойств препаратов вполне обоснован. Более того, данный тип клеток принимает участие во всех видах воспаления, например перитонита, нейровоспаления и т.д. При этом оценка эффекта препарата может осуществляться как на основе анализа высвобождения этими клетками медиаторов, воспаления, так и по их влиянию на другие клетки организма, например, нейроны при развитии нейровоспаления.
Таким образом в результате осуществления данного изобретения получают нейропротекторное средство, включающее биодеградируемый полимерный матрикс на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемого активированного протеина С. Наличие протекторного, противовоспалительного и пролиферативного действия делает такие средства востребованными в такой области, как регенеративная медицина. Данные пептиды могут быть включены в состав высокотехнологичных медицинских изделий в качестве дополнительного терапевтического агента, повышающего регенеративный потенциал изделия.
Краткое описание чертежей.
На фиг. 1 показана калибровочная кривая поглощения пептида-агониста рецепторов ПАР1, конъюгированного с FITC, в ФСБ при 495 нм.
На фиг. 2 - калибровочная кривая поглощения пептида-агониста рецепторов ПАР1, освобождаемого АПС, конъюгированного с FITC, в ДМЕМ при 495 нм.
На фиг. 3 - кинетика выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, конъюгированного с FITC, из полимерного носителя в форме покрытия в ФСБ и культуральной среде ДМЕМ.
На фиг. 4 - кинетика выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, конъюгированного с FITC, из полимерного носителя в форме пленки в ФСБ и в культуральной среде ДМЕМ.
На фиг. 5 - кинетика выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, конъюгированного с FITC, из полимерного носителя в форме трехмерного матрикса в ФСБ и в культуральной среде ДМЕМ.
На фиг. 6 - влияние нативной и иммобилизованных форм исследуемого пептида-агониста рецепторов ПАР1, освобождаемого АПС, (АП9), на секрецию гистамина перитониальными тучными клетками при их активации липополисахаридом (ЛПС, 100 нг/мл). +, *, # - р<0,05 по сравнению с соответствующим контролем (условия без АП9).
Осуществление изобретения
Настоящее изобретение подкреплено следующими примерами. Стоит отметить, что данное средство находится на экспериментальной стадии изучения, что отражено в его назначении, и примеры носят экспериментальный характер.
Пример 1. Приготовление средства, включающего биодеградируемый полимерный матрикс на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемым активированным протеином С, NPNDKYEPF амидом.
1 Этап. Подготовка рабочих растворов.
1.1. Подготовка раствора 1. Готовят раствор хлорида кальция в смеси этанола и воды. Молярное соотношение компонентов СаСl2:С2Н5OН:H2О=1:2:8.
1.2. Подготовка раствора 2. Готовят навеску нитей хирургических нестерильных (100% натуральный шелк) из расчета 150 мг на 1 мл раствора 1 и переносят в емкость с раствором 1. Инкубируют в течение 5 часов на водяной бане при 70°С. Полученный раствор центрифугируют 15 минут при 13400 об/мин и супернатант диализуют против дистиллированной воды, проводя 4 смены диализа. Полученный раствор центрифугируют 15 минут при 13400 об/мин и определяют концентрацию фиброина по оптической плотности при 280 нм. Доводят раствор до концентрации фиброина 2 мг/мл и используют на Этапе 2.
1.3. Подготовка раствора 3. Для приготовления раствора пептида навеску вещества массой 3,5 мг растворяют в 20 мкл ДМСО и доводят объем раствора до 200 мкл стерильной dH2O. И используют на стадии 2.
2. Этап. Обработка полимерного носителя.
2.1. К 150 мкл раствора 3 (концентрация - 17,5 мг/мл) добавляют 375 мкл dH2O. Таким образом, получается раствор пептида с концентрацией 5 мг/мл
2.2. В лунки 48-луночного планшета вносят по 27,2 мкл раствора пептида с концентрацией 5 мг/мл, 5 мкл раствора фиброина шелка с концентрацией 2 мг/мл и 67,8 мкл dH2О. Переносят в лунки с раствором пептида полимерные носители в виде пленки или трехмерного матрикса. Обработку полимерного покрытия проводят в лунках 48-луночного планшета, дно которых покрыто полимерной пленкой из фиброина шелка. Для этого вносят в такие лунки по 13,6 мкл раствора пептида с концентрацией 5 мг/мл, 2,5 мкл водного раствора фиброина шелка с концентрацией 2 мг/мл и 34,9 мкл dH2O. При этом количество вносимых растворов может варьироваться в следующих пределах: 20-30 мкл пептида, 2,5-10 мкл фиброина шелка, 60-77,5 мкл dH2O на 100 мкл получаемого раствора.
3. Этап. Сушка. Полимерные носители оставляют высушиваться в лунках 48-луночного планшета в течение 24 часов. Сушку проводили в ламинарном шкафу при комнатной температуре в течение 24 часов. Контроль высыхания образцов проводили путем взвешивания матриксов с иммобилизованным пептидом через 6, 9, 12, 18 и 24 часа. Было установлено, что через 18 и 24 часа масса образца не меняется.
4. Этап. Стерилизация. Проводят газовую стерилизацию с использованием этиленоксида по ГОСТ Р ИСО 18472-2009.
Пример 2. Исследование кинетики выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, из полимерного носителя.
Для исследования кинетики выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, и оценки влияния среды инкубации на кинетику выхода пептида из полимерных носителей использовали пептид, конъюгированный с флуоресцеин изотиоцианатом (FITC), строили калибровочные кривые. Для этого готовили растворы пептида, конъюгированного с FITC, с концентрацией от 0,1 мкМ до 100 мкМ в ФСБ и в среде ДМЕМ и измеряли поглощение при 495 нм спектрофотометром для микрообъемов Thermo Scientific NanoDrop 2000, позволяющим проводить измерения в объемах 0,5-2,0 мкл. Соответствующие калибровочные кривые представлены на фиг. 1 и 2.
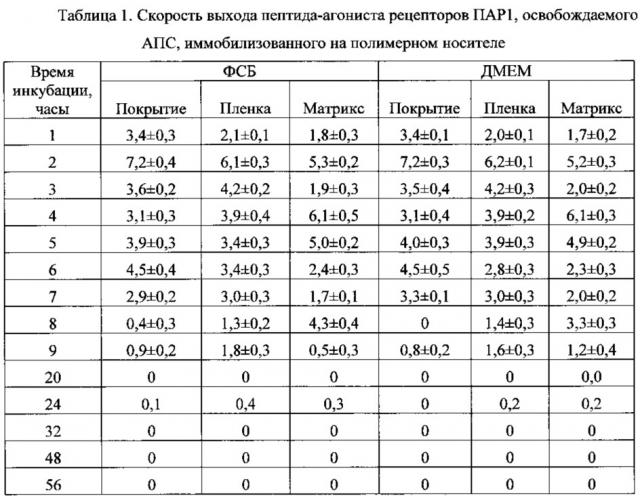
Исследование кинетики выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, и оценки влияния среды инкубации на кинетику выхода пептида из полимерных носителей проводили на образцах, синтезированных в соответствии с утвержденными лабораторными технологическими регламентами. В лунки 24-луночного планшета к экспериментальным образцам добавляли по 2 мл среды инкубации: ФСБ или культуральную среду ДМЕМ и инкубировали при 37°С в присутствии 5% СO2 56 часов. В течение первых 9 часов каждый час и через 20, 24, 32, 48 56 часов отбирали пробы для определения концентрации вышедшего пептида. Данные, полученные при анализе проб вышедшего из полимерных носителей пептида-агониста рецепторов ПАР1 в форме покрытия, пленки и трехмерного матрикса, представлены на фиг. 3-5.
Как видно из графиков на фиг. 3-5, среда инкубации не влияет на кинетику выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, иммобилизованного на разных формах полимерного носителя. В течение первых 8-9 часов концентрация пептида в среде инкубации достигает почти максимальной: 29 мкМ. По результатам анализа установлено, что скорость выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, иммобилизованного на полимерных носителях, зависит от типа носителя.
Как видно из таблицы 1, применение препаратов пептида-агониста рецепторов ПАР1, освобождаемого АПС, иммобилизованного на полимерном носителе, позволяет регулировать время высвобождения препарата и создавать оптимальные условия культивирования для различных типов клеток.
Пример 3. Исследование противовоспалительного действия иммобилизованной формы пептида-агониста рецепторов ПАР1, освобождаемого АПС, на культивируемые клетки мозга животных (астроциты) и тучные клетки в норме и при провокации воспаления in vitro.
1. Материалы
- Пептид-агонист рецепторов ПАР1, освобождаемого АПС структуры NPNDKYEPF амид.
- Экспериментальные образцы средства, представляющего собой прозрачное полимерное покрытие толщиной 0,1 мм (=100 мкм) на культуральных стеклах диаметром 24 мм из фиброина шелка с иммобилизованный пептидом-агонистом рецепторов ПАР1, освобождаемого АПС.
- Экспериментальные образцы средства, представляющего собой прозрачную пленку из фиброина шелка толщиной 0,2 мм (=200 мкм), диаметром 14 мм с иммобилизованным пептидом-агонистом рецепторов ПАР1, освобождаемого АПС.
- Экспериментальные образцы средства, представляющего собой трехмерный пористый матрикс из фиброина шелка толщиной 2 мм, диаметром 14 мм, с размером пор 50-100 мкм, степень пористости 94%, с иммобилизованным пептидом-агонистом рецепторов ПАР1, освобождаемого АПС.
2. Выделение тучных клеток из перитонеальной полости самцов крыс
Животных наркотизируют эфиром, декапитируют и обескровливают. В брюшную полость вводят 10 мл буфера Hepes-NaCL, брюхо слегка массируют в течение 2 минут. Перитонеальную жидкость собирают и центрифугируют в течение 5 минут при 800 об/мин при охлаждении. Супернатант отбрасывают, осадок суспендируют в 2 мл буфера Hepes-NaCL. Данную суспезию переносят в пробирки, содержащие 25% и 35% фиколл и центрифугируют в течение 10 минут при 1200 об/мин при охлаждении.
Пул тучных клеток при центрифугировании проходит в слой фиколла, а другие клеточные элементы концентрируются на границе раздела фиколла. Осторожно собирают клеточные элементы с границы раздела и отбрасывают. Пул тучных клеток промывают в 5 мл сбалансированного раствора. После каждого промывания клетки центрифугируют по 10 минут при 1000, 900, 800 об/мин при охлаждении. Осадок тучных клеток после последнего промывания растворяют в малом объеме сбалансированного буфера. Далее производят подсчет тучных клеток в камере Горяева. После подсчета клеточную взвесь разводят сбалансированным буфером, исходя из необходимого количества клеток в эксперименте.
Статистическая обработка данных
Статистическую обработку результатов проводят с использованием программы GraphPad Prism 6. Для анализа используют непараметрическую статистику: Ман-Уитни тест и тест Краскела-Уоллеса для несвязанных выборок. Каждый из экспериментов проводят не менее 3 раз. n - число независимых экспериментов.
3. Алгоритм испытания
Тучные клетки, полученные от каждого животного, распределяли по экспериментальным группам. В каждой группе 300 мкл клеточной суспензии инкубировали в течение часа с исследуемыми веществами при 37°С. Реакцию останавливают трехкратным объемом ледяного сбалансированного буфера. Далее пробы центрифугируют при 400g в течение 10 минут, супернатант для определения содержания гистамина отбирают (1000 мкл) и переносят в охлажденные эппендорфы. К оставшимся 200 мкл добавляют 1000 мкл сбалансированного буфера, после этого осадок ресуспендируют и разрушают клетки кипячением на водяной бане в течение 5 минут. Затем вновь центрифугируют 10 минут при 400g и отбирают 1000 мкл супернатанта для анализа остаточного гистамина в отдельные эппендорфы.
Для определения содержания гистамина в полученных пробах отбирают из эппендорфов по 500 мкл раствора и добавляют к нему 100 мкл 1N NaOH; туда же добавляют 25 мкл 0,1% раствора ортофталевого альдегида в этаноле. Образовавшийся флуорофор стабилизируют подкислением раствора. Для этого через 4 минуты добавляют 50 мкл 3N HCL. После добавления каждого реактива смесь тщательно перемешивают.
Флуоресценцию измеряют на планшетном спетрофлуорометре при 460 нм, возбуждая при 355 нм. Полученные данные по влиянию нативной и иммобилизованных форм исследуемого пептида-агониста рецепторов ПАР1, освобождаемого АПС, (АП9), на секрецию гистамина перитониальными тучными клетками при их активации липополисахаридом представлены в виде гистограммы на фиг. 6.
Исследования показали, что использование средств, включающих биодеградируемый полимерный матрикс на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемым активированным протеином С, приводит к нейропротекторному действию на модели нейровоспаления, которое характерно для ряда патологических состояний.
1. Средство, обладающее нейропротекторными свойствами в эксперименте, включающее биодеградируемый полимерный матрикс на основе фиброина шелка с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемого активированного протеина С в соотношении 99-99,9:0,1-1 мас.% фиброин:пептид.
2. Средство по п. 1, характеризующееся тем, что в качестве фиброина шелка используют фиброин шелка кокона тутового шелкопряда Bombyx mori.
3. Способ получения средства по п. 1, включающий приготовление биодеградируемого полимерного матрикса на основе фиброина шелка, иммобилизацию пептида-агониста рецепторов ПАР1 на носитель, сушку матрикса с иммобилизованным пептидом-агонистом рецепторов ПАР1, при этом иммобилизацию пептида-агониста рецепторов ПАР1 на носитель проводят в водном растворе фиброина шелка с концентрацией от 0,05 до 0,2 мг/мл, при концентрации пептида от 1,0 до 1,5 мг/мл.
4. Способ по п. 3, характеризующийся тем, что сушку матрикса с иммобилизованным пептидом-агонистом рецепторов ПАР1 осуществляют при комнатной температуре в течение 18-24 часов.