Нейропротекторное средство
Иллюстрации
Показать всеИзобретение относится к медицине и фармакологии и может быть использовано в качестве нейропротекторного средства. Предложено использовать литиевую соль аскорбиновой кислоты для защиты нейронов от глутаматного стресса. Использование изобретения позволяет повысить эффективность защиты нейронов от глутаматного стресса при пониженной токсичности. 1 табл., 8 ил., 2 пр.
Реферат
Изобретение относится к области фармакологии и может быть использовано для профилактики и лечения, заболеваний, связанных с возникновением глутаматного стресса.
Глутаматный стресс не является аналогом психологического и дезадаптационного понятия «стресс-дистресс», сформулированного Г.Селье. (Селье Г. Стресс без дистресса, М.: Прогресс, 1979, 123 с. Глутаматный стресс - это универсальный ответ клеток центральной и периферической нервной системы на воздействие избыточных (нефизиологических) концентраций возбуждающих аминокислот - глутамата и аспартата - вследствие ишемического (нарушение адекватного кровоснабжения участка мозга, очаг инсульта), генетически обусловленного иммунонейротоксического повреждения (рассеянный склероз, болезнь Гентингтона, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Альцгеймера, глаукомная оптиконейропатия), температурного, физическое (ушибленная, резаная, рваная, огнестрельная рана, разрыв, сдавление тканей мозга и т.д.). Глутаматный стресс способствует ускорению гибели нейронов и является одним из факторов риска нейродегенерации, снижает выживаемость клеток в неблагоприятных условиях, увеличивает зону повреждения мозга, препятствует процессам регенерации мозга. Глутаматный стресс приводит к развитию каскада эксайтотоксичного повреждения ведущего к гибели нервных клеток. Под действием высоких концентраций глутамата отмечается гиперактивация NMDA- и АМРА-рецепторов на поверхности поврежденных клеток, затем в клетку поступает избыточное количество ионов кальция, что активирует ряд ферментов (протеазы, эндонуклеазы и фосфолипазы), цитозольные структуры клетки рушатся, и, как следствие, клетка запускает процесс самоуничтожения (апоптоз). Глутамат - основной эксайтотоксин проявляющий отчетливую дозозависимость: чем выше концентрация глутамата, тем больше очаг и тяжелее (в т.ч. необратимо) повреждаются нейроны.
Известно применение литиевых солей в составе препаратов для лечения нейродегенеративных заболеваний, где оно используется в качестве вспомогательного компонента (US 20070298129, US 20070049565, US 20050233010).
Известно, что хлорид лития оказывает нейропротекторное действие при глутаматной токсичности нейронов мозжечка (Shao L., Cui J., Young L.T. and Wang J.F., The effect of Mood stabilizer lithium on expression and activity of glutathione-S-transferase isoenzymes, Neuroscience. 2008. v. 151(2), p.518-524).
Известно наличие у катионов лития кардио- и нефропротекторных свойств. Изучается терапевтические механизмы действия солей лития при состояниях, связанных остановкой кровообращения, что открывает возможность использования солей лития в анестезиологии и реаниматологии (В.В. Мороз и др. Механизмы повреждения и защиты клетки при ишемии/реперфузии и экспериментальное обоснование применения препаратов на основе лития в анестезиологии, Обзор, Общая реаниматологии, 2013, IX. 1 стр. 63-72).
Известно существование нейропротективного и нейротрофического синергизма между катионами лития и нейропептидами церебролизина. Экспериментально подтверждено, что нейропептиды церебролизина потенцируют таргетную доставку ионов лития в мозг и усвоение их нейронами (О.А. Громова и др. Фармакокинетический и фармакодинамический синергизм между нейропептидами и литием в реализации нейротрофического и нейропротективного действия церебролизина. Неврология и психиатрия №3, 2015).
Однако в известных публикациях не прослеживается влияния аниона, с которым связан катион лития, на нейропротекторные свойства солей.
Наиболее близким по технической сущности и достигаемому результату к предложенному изобретению является техническое решение, в котором предложено в качестве нейропротекторного средства и средства защиты от глутаматного стресса нейронов использовать литиевую соль коменовой кислоты. Приведены сведения о влиянии литиевой соли коменовой кислоты на глутаматную цитотоксичность в культуре зернистых клеток мозжечка крысят. При этом действие комената лития на глутаматную цитотоксичность в культуре нейронов мозжечка крысят оценивалось по сравнению с действиями коменовой кислотой и хлорида лития по отдельности. Авторы указывают на больший эффект при применении комената лития по сравнению с коменовой кислотой и хлоридом лития (RU 247722, 2013).
Недостатком известного средства является то, что анион коменовой кислоты не является эндогенной молекулой метаболома организма человека. В силу этого анион коменовой кислоты нуждается в биотрансформации и выведении продуктов деградации используемого средства из организма.
Кроме того, увеличение в последние годы числа больных разнообразной неврологической патологией (например, цереброваскулярная патология, ишемический инсульт, черепно-мозговая травма, нейродегенеративные заболевания), при которой отмечается повышение выброса глутамата и аспартата нейронами, требует расширения арсенала доступных средств, обладающих выраженными свойствами для защиты нейронов от повышенного уровня глутамата (т.н. глутаматного стресса нейронов).
Задачей настоящего изобретения является создание доступного нейропротекторного средства, обладающего повышенной степенью защиты нейронов от глутаматного стресса при пониженной токсичности.
Поставленная задача решается описываемым средством защиты нейронов от глутаматного стресса, в качестве которого используют литиевую соль аскорбиновой кислоты.
Сведения об использовании литиевой соли аскорбиновой кислоты (аскорбата лития) для защиты нейронов от глутаматного стресса не обнаружены авторами в известном уровне техники.
Ранее было предложено использовать аскорбат лития в следующих областях медицины. Известно использование аскорбата лития в качестве в качестве гемапротекторного средства (RU 2351326, 2009), в качестве средства, повышающего активность нейтрофилов (RU 2226391. 2004). Аскорбат лития рекомендован также для использования в составе средств, обладающих антибактериальной, антиоксидантной, и иммуностимулирующей активностью (RU 2535140, 2014, RU 2372081, 2009, RU 2444358, 2012).
Использованная авторами литиевая соль аскорбиновой кислоты получена следующим образом.
Готовят суспензию аскорбиновой кислоты в дистиллированной воде. При нагревании и постоянном перемешивании в суспензию порционно вводят карбонат лития, или гидроксид лития, либо оба упомянутых соединения лития. Производят нагревание суспензии до полного растворения компонентов реакционной смеси, осуществляют кристаллизацию осадка, промывку и сушку. Высушенные кристаллы соли подвергают двойной перекристаллизации в растворе этилового или изопропилового спирта при охлаждении, последующей промывке спиртом и сушке. В результате был получен высокочистый аскорбат лития с выходом до 95%. Использование в процессе получения аскорбата лития метода двойной перекристаллизации соли в указанных спиртовых растворах позволило получить продукт, не содержащий посторонних анионов в виде гидроксида или карбоната, что способствует получению дополнительного эффекта, касающегося пониженной токсичности получаемого средства. Высокий выход целевого продукта позволяет масштабировать технологию получения соли до промышленного производства.
Ниже в виде примеров представлены результаты экспериментов in vivo, подтверждающие наличие высоких адаптогенных свойств у аскорбата лития, а также результаты воздействия аскорбата лития на выживаемость нейронов in vitro в условиях глутаматного стресса.
В дальнейшем изобретение поясняется конкретными примерами и проиллюстрировано на фигурах, на которых представлены:
На фиг. 1 - Фиксированная культура клеток мозжечка, окрашенная трипановым синим.
На фиг. 2 - Дозозависимый глутамат защитный эффект аскорбата лития.
На фиг. 3 - Эмпирические функции распределения чисел выживших КЗН при различных концентрациях аскорбата лития (мМ).
На фиг. 4 - Нейропротекторный эффект аскорбата лития при цитотоксическом действии глутамата (100 мМ) на КЗН.
На фиг. 5 - Нейропротекторный эффект аскорбата лития при цитотоксическом воздействии глутамата.
На фиг.6 - Нейропротекторный эффект аскорбата лития, введенного в культуру за 3 часа до цитотоксического воздействия глутамата.
На фиг. 7 - Число выживших нейронов, подсчитанное на окрашенных препаратах.
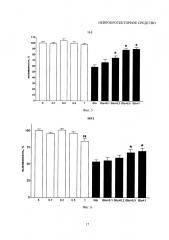
На фиг. 8 - Гиперфосфорилирование тау-белка в гиппокампе крыс в условиях хронического стресса по сравнению с контролем.
Пример 1.
В эксперименте использованы 7-8-суточные культуры зернистых нейронов мозжечка, полученные методом ферментно-механической диссоциации клеток мозжечка 7-дневных крыс по методике [Andreeva N.A., Stel'mashuk E.V., Isaev N.K., Ostrovskaya R.U., Gudasheva Т.A., Viktorov I.V. Neiroprotektornye effekty nootropnogo dipeptida GVS-111 pri kislorodno-glyukoznoi deprivatsii, glutamatnoi toksichnosti i oksidativnom stresse in vitro. // Byull. eksperim. biol. med. 2000. т.130. №10. с. 418-421.]. Крыс подвергали летальной дозе эфирного наркоза, после чего 5 минут стерилизовали 70% спиртом, извлекали мозжечок и переносили его в пластиковую чашку Петри с фосфатным буфером, лишенным ионов кальция и магния. Фрагменты ткани инкубировали 15 мин при 37°С в фосфатном буфере, содержащем 0,05% трипсина, 0,2% ЭДТА и 0,8% глюкозы. После инкубации ткань промывали в двух сменах фосфатного буфера и один раз в питательной среде культивирования, в которой затем подвергали механической диссоциации. В состав среды входило 90% минимальной среды «Игла», 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 5 мМ КС1 и 10 мМ буфера Hepes, рН 7,2-7,4.
Суспензию клеток центрифугировали 1 мин при 1000 об/мин, супернатант удаляли, а осадок ресуспендировали в питательной среде. Культивирование производили в 96-луночных пластиковых планшетах, покрытых полиэтиленимином или полилизином, в питательной среде, где уровень хлорида калия был доведен до 25 мМ. В каждую ячейку планшета добавляли по 0,1 мл суспензии клеток.
Культивирование производили 7-8 суток в СO2-инкубаторе, заполненном газовой смесью (95% воздуха +5% СO2), при температуре 35,5°С и относительной влажности 98%. К этому сроку культивированные зернистые нейроны (КЗН) достигают своей морфологической и нейрохимической зрелости. Состояние культур контролировали ежедневно и на каждом этапе эксперимента путем визуального просмотра в инвертированном микроскопе при фазовом контрасте.
Раствор аскорбата лития готовили из свежеприготовленного сухого вещества, полученного способом, описанным выше, непосредственно перед внесением в среду культивирования. Препарат взвешивали, растворяли в PBS, раствор стерилизовали фильтрацией и добавляли в питательную среду на вторые сутки in vitro на весь срок культивирования (до 7 суток). Исходя из исходной концентрации вещества (10 мМ) его минимально возможное разведение для добавления к культурам, при условии сохранения необходимых свойств питательной среды, составляло 1:10, т.е. 1 мМ. 96-луночные пластиковые планшеты позволяли тестировать сразу 4 различные концентрации образцов. Были выбраны следующие концентрации: 0,1, 0,2, 0,5 и1,0 мМ.
Зернистые нейроны мозжечка легко идентифицировались в культурах прижизненно как небольшие, 7-10 мкм в диаметре, округлые или овальные клетки. Количественную оценку выживаемости производили с помощью прямого подсчета КЗН с нормальной морфологией на фиксированных препаратах, окрашенных трипановым синим. На этих препаратах хорошо видны ядра нейронов, занимающие большую часть тела клетки и окруженные тонким ободком цитоплазмы (см. фиг. 1).
На фиг. 1 представлена фиксированная культура клеток мозжечка, окрашенная трипановым синим. А - контроль, Б - обработка 24 часа глутаматом. Зеленые стрелки указывают на КЗН с нормальной морфологией, желтые - на ядра глиальных клеток, красные - на пикнотические ядра погибших КЗН. Масштаб 15 мкм.
На каждую точку брали по 3 культуры, в каждой из которых фотографировали и просчитывали последовательно по 5 полей зрения (как минимум 45 полей из 9 культур в 3 независимых экспериментов). Количество нейронов с неизмененной морфологией в контрольных культурах принимали за 100% выживаемости. Для статистического анализа использовали тест ANOVA с поправками Бонферрони/Даннетта и непараметрический тест Колмогорова-Смирнова, который отличается высокой чувствительностью и применим к анализу выборок чисел вне зависимости от выполнимости условия нормальности распределения. Различия между группами считали достоверными при р<0,05. Результаты выражали как среднее±стандартное отклонение.
Глутамат (Sigma, USA, N.G-1626) при добавлении к культурам оказывал дозозависимый токсический эффект (см. фиг. 2).
На фиг. 2 показано влияние глутамата (Glu) на выживаемость культур (подсчет морфологически не измененных нейронов на фиксированных препаратах, окрашенных трипановым синим).
Выбор концентрации (из трех использованных) проводили в каждом опыте таким образом, чтобы выживаемость КЗН составляла 30-80% от контроля. Именно такая выживаемость позволяет выявить действие различных веществ на процесс гибели клеток. При выживаемости менее 30 или более 80% нейропротекторные эффекты могут не обнаружиться. В исследованиях использовали подсчет клеток при действии предполагаемых нейропротекторов, добавляя в питательную среду подобранные токсические концентрации глутамата (100-500 мкМ).
Дозозависимый глутамат защитный эффект аскорбата лития
Как показал анализ эмпирических функций распределения средних чисел с использованием теста Колмогорова-Смирнова, в культуре клеток мозжечка аскорбат лития (без добавления глутамата) в диапазоне концентраций от 0,1 до 1,0 мМ нетоксичен для КЗН (см. фиг. 3).
На фигуре 3 представлены эмпирические функции распределения чисел выживших КЗН при различных концентрациях концентраций от 0,1 до 1,0 мМ аскорбата лития (мМ). В культуре клеток мозжечка аскорбат лития (без добавления глутамата) нетоксичен для КЗН.
Тест Колмогорова-Смирнова
В культуре клеток мозжечка аскорбат лития (без добавления глутамата) в диапазоне концентраций от 0,1 до 1,0 мМ нетоксичен для КЗН.
С помощью фигур 4-6 проиллюстрировано решение поставленной задачи с достижением заявленного технического результата
На фигуре 4 показан нейропротекторный эффект аскорбата лития при цитотоксическом действии глутамата (100 мМ) на КЗН. Эмпирические функции распределения чисел (тест Колмогорова-Смирнова) выживших КЗН при действии глутамата в отсутствие (Glu) и в присутствии (Glu+) аскорбата лития в диапазоне концентраций от 0,1 до 1,0 мМ. Показаны достоверные отличия для всех использованных концентраций аскорбата лития по сравнению с действием глутамата без добавления препарата. Указаны значения максимального отклонения «D», на основе которого рассчитывается статистическая достоверность отличий между функциями распределения.
На фигуре 5 показан нейропротекторный эффект аскорбата лития при цитотоксическом воздействии глутамата. Белые столбики - аскорбат лития (0,1-1,0 мМ) в отсутствие глутамата, черные - в тех же концентрациях в присутствии 100 мкМ глутамата (Glu). К - контроль. Для каждого столбика просчитано по 30 полей зрения. * - р<0,01 по сравнению с глутаматом без добавления препарата.
Анализ полученных данных с использованием теста ANOVA показал, что выживаемость нейронов при цитотоксическом действии глутамата в присутствии аскорбата лития в диапазоне концентраций от 0,1 до 1 мМ начиная с концентрации 0,2 мМ достоверно повышалась в среднем на 12%, причем наблюдался дозозависимый эффект (см. фиг. 5).
Исследованы нейропротекторные свойства аскорбата лития при его добавлении в культуры всего за 3 часа до воздействия глутамата. В соответствии с результатами теста ANOVA обнаружен защитный эффект, хотя и менее выраженный, при котором выживаемость нейронов достоверно повышалась на 8% при концентрации препарата 0,5 мМ (фиг. 6).
На фигуре 6 продемонстрирован нейропротекторный эффект аскорбата лития, введенного в культуру за 3 часа до цитотоксического воздействия глутамата. Белые столбики - аскорбат лития (0,1-1,0 мМ) в отсутствие глутамата, черные - в тех же концентрациях в присутствии 100 мкМ глутамата (Glu). К - контроль. Для каждого столбика просчитано по 15 полей зрения. * - р<0,01 по сравнению с глутаматом без добавления препарата.
На фигуре 7 продемонстрировано число выживших нейронов, подсчитанное на окрашенных препаратах, на которых хорошо заметно, что присутствие в питательной среде аскорбата лития препятствует деструкции КЗН под воздействием глутамата. На данной фигуре нейропротекторное действие аскорбата лития при нейроцитотоксическом действии глутамата (100 мкМ, 24 ч) в культуре клеток мозжечка. КЗН указано стрелками. Нейроны после апоптоза выглядят как круги темного оттенка с меньшим радиусом, чем выжившие нейроны. Окраска фиксированных культур трипановым синим. Масштаб 15 мкм.
Анализ данных, представленных в виде иллюстраций, показал следующее.
При цитотоксическом действии глутамата (100 мкМ) аскорбат лития в исследованном диапазоне концентраций оказывал выраженный нейропротекторный эффект. Результаты анализа функций распределения средних чисел выживших нейронов при всех концентрациях аскорбата лития показал достоверное отличие от результатов, полученных при действии глутамата без добавления препарата (фиг. 5). Использование даже минимальной концентрации аскорбата лития (0,1 мМ) приводило к достоверному отличию (D=0,19, Р=0,049). При повышении концентрации заявленного средства выраженность отличий возрастала (значения максимального уклонения «D» возрастали, а значения Р снижались), а при самой высокой концентрации (1,0 мМ) отличия между глутаматной токсичностью и интактным контролем были на грани статистической значимости (D=0,17, Р=0,059).
Таким образом, аскорбат лития во всем исследованном диапазоне концентраций (0,1-1,0 мМ) достоверно повышает выживаемость нейронов при воздействии глутамата.
Были проведены сравнительные исследования солей лития с разными анионами. Проведенные исследования показали следующее.
Использование хлорида лития и комената лития также демонстрировало защитный эффект при глутаматном стрессе, однако выживаемость нейронов была достоверное ниже (р=0,0048, р=0,006). Карбонат лития вообще не оказывал защитного действия и даже снижал выживаемость нейронов на фоне концентраций глутамата 250 мкМ и 500 мкМ. Низкая биодоступность катионов лития, связанных с другими анионами неорганических кислот, недостаточно защищает клетки, особенно при высоких концентрациях глутамата. Коменат лития, принятый за прототип предложенного изобретения, оказывает выраженное дозозависимое защитное действие при концентрациях глутатмата 50...250 мкМ, но по сравнению с аскобатом лития коменат лития является достоверно менее эффектным средством защиты от глутаматного стресса.
Полученные сравнительные результаты приведены ниже в таблице 1.
Динамика изменения выживаемости нейронов в процентах подверженных воздействию глутамата в концентрации 50, 100 и 250 мкМ на фоне превентивного внесения (за 3 часа до воздействия глутамата) препаратов лития в культуру нейроцитов.
Пример 2
Содержание животных в очень тесной клетке, исключающей движение животного, - т.н. иммобилизационный стресс - провоцирует развитие дегенерации нервных структур. Хронический иммобилизационый стресс в течение 4 недель приводил к повышенному выбросу глутамата и гиперфосфорилированию тау-белка в гиппокампе. Другими признаками глутамат индуцированной нейродегенерации являлось снижение уровней структурных нейрональных белков - белка, ассоциированного с микротрубочками (map2) и гамма-синуклеина. Идентификация гиперфосфорилированного тау-белка с использованием антител подтвердила данные иммуногистохимии и указала на повышение его уровня при хронической иммобилизации, сопровождающейся повышенным выбросом глутамата в течение 4 недель, по сравнению с группой животных, также подверженных в течение 4 недель хронической иммобилизации, но получающих аскорбат лития в дозе 1…50 мкг/кг веса, проиллюстрирована на фиг. 8. Дотации аскорбата лития 1…50 мкг/кг веса в течение 4…12 недель до проведения эксперимента и 1…6 недель после показали выраженный защитный эффект.
На фигуре 8 представлены данные по гиперфосфорилированию тау-белка в гиппокампе крыс в условиях 4 недельного иммобилизационного хронического стресса (рис. сверху) и при превентивном использовании аскорбата лития в дозе 30 мкг/кг веса в течение 4 недель до создания модели (рис. снизу).
А. Иммуногистохимическая идентификация гиперфосфорилированного тау-белка (анти-PHF). Окрашивание ядер гематоксилином. Масштаб 200 мкм.
Б. Идентификация гиперфосфорилированного тау-белка с использованием антител (иммуноблот).
Полученные авторами данные свидетельствуют о выраженных адаптогенных свойствах аскорбата лития в условиях стресса, моделируемого in vivo и in vitro, и о тесной взаимосвязи между стрессом и нейродеструктивными процессами на клеточном уровне, индуцируемых гиперактивацией глутаматных рецепторов.
Данные о защитном действие соли лития на основе коменовой кислоты (средство по прототипу) на уровни структурных нейрональных белков, ассоциированных с воздействием глутамата на белки, поддерживающие синтез микротрубочек (map2), и уровнем гамма-синуклеина, в прототипе отсутствуют.
Анализ вышеприведенных результатов подтверждает достижение заявленного технического результата в объеме совокупности существенных признаков, включенных в формулу изобретения.
Нейропротектрное средство для защиты нейронов от глутаматного стресса на основе соли лития, отличающееся тем, в качестве соли лития используют литиевую соль аскорбиновой кислоты.