Анальгетический пептид из морской анемоны
Иллюстрации
Показать всеИзобретение относится к биологически активному пептиду из морской анемоны Metridium senile, имеющей следующую аминокислотную последовательность H2N-Asnl-Ile2-Ile3-Val4-Gly5-Gly6-Cys7-Ile8-Lys9-Cysl0-His11-Val12-Lys13-Asnl4-Alal5-Serl6-Glyl7-Argl8-Cysl9-Val20-Arg21-Ile22-Val23-Gly24-Cys25-Gly26-Val27-Asp28-Lys29-Val30-Pro31-Asp32-Leu33-Phe34-Ser35-СООН, обладающему анальгетическим действием за счет ингибирования функциональной активности ионного канала TRPA1. Пептид может быть использован как лекарственное средство один или совместно с другими компонентами для облегчения болевых состояний у людей и животных, обусловленных участием TRPA1 рецепторов, а также для выяснения топологии и молекулярных механизмов функционирования TRPA1 каналов, изучения распределения TRPA1 каналов в живых организмах, в тест-системах для обнаружения и тестирования новых препаратов, направленных против боли и/или воспаления, агонистов и антагонистов рецептора TRPA1 или для получения антител, применяемых в научных и медицинских целях. 10 ил., 13 пр.
Реферат
Изобретение относится к биохимии, конкретно к биологически активным пептидам, обладающим анальгетическим или противовоспалительным действием, которые могут найти применение в медицине или научных исследованиях.
В настоящее время одной из основных причин обращения людей за врачебной помощью является боль. Патологическая боль, появляющаяся при различных состояниях, представляет собой нежелательное явление, резко снижающее качество жизни, работоспособность и вызывающее страдания. До 40% взрослого населения развитых стран страдает от хронической боли. Наиболее широко в качестве анальгетических препаратов традиционно используются: морфин (и другие опиоиды), аспирин (а также другие нестероидные противовоспалительные средства) и разнообразные вещества неспецифического действия (антиконвульсанты, антидепрессанты). Несмотря на большой ассортимент анальгетических средств различной химической природы, некоторые типы болевых состояний, например различные нейропатии, практически нечувствительны к этим агентам. Кроме того, неспецифичность действия вышеперечисленных веществ в ряде случаев вызывает нежелательные побочные эффекты, что сильно ограничивает возможность их применения.
В последнее время особое внимание было уделено разработке и получению принципиально новых анальгетических средств, специфично действующих на молекулярные механизмы возникновения боли с минимальными побочными эффектами, что подразумевает использование высокоселективных агентов, способных направленно включать, выключать или модифицировать определенный фрагмент на пути прохождения болевого сигнала от очага поражения в головной мозг.
Болевой сигнал проходит по афферентным нейронам от источника боли в ЦНС, в этом процессе задействованы различные популяции нейронов, среди которых важными считаются, в том числе, те, которые экспрессируют в большом количестве ионные каналы типа TRPV1 и TRPA1.
TRPA1 рецептор - один из ключевых в семействе TRP. Многочисленные исследования показали его участие в распознавании, как термических, так и механических стимулов не только у млекопитающих, но и у других видов животных. При экзогенной экспрессии в культивируемых клетках, TRPA1 отвечает на нежелательный холод (<17°С). Нокаут TRPA1 каналов у мышей на ранней стадии развития приводит к потере слуха, связанной с механочувствительностью [Venkatachalam K., Montell С. TRP channels. // Annu. Rev. Biochem. 2007. Vol. 76. P. 387-417].
Активируют TRPA1 соединения, содержащиеся в пряных продуктах, такие как аллилизотиоцианата (AITC) и коричный альдегид, раздражители из окружающей среды (акролеин, слезоточивый газ), и многочисленные эндогенные медиаторы, такие как реактивный кислород, азот или карбонил, перекись водорода и другие. Своеобразный способ активации канала состоит в его связывании с активаторами ковалентной связью через окисление нескольких остатков цистеина и лизина [Nassini R. et al. The TRPA1 channel in inflammatory and neuropathic pain and migraine. // Rev. Physiol. Biochem. Pharmacol. 2014, Vol. 167. P. 1-43, Zygmunt P.M., Hogestatt E.D. TRPA1. // Handb. Exp. Pharmacol. 2014. Vol. 222. P. 583-630]. Столь широкий спектр активаторов делает TRPA1 одним из важных сенсоров для определения окислительного стресса, так как эндогенные соединения накапливаются и, активируя канал, провоцируют тем самым воспалительные боли. Это позволяет непосредственно увязывать возникновение окислительного стресса и развитие воспалительной или нейропатической боли [Trevisan G. et al. Mechanisms involved in abdominal nociception induced by either TRPV1 or TRPA1 stimulation of rat peritoneum // Eur. J. Pharmacol. 2013, Vol. 714, №1-3. P. 332-344, Trevisan G. et al. Gallic acid functions as a TRPA1 antagonist with relevant antinociceptive and antiedematogenic effects in mice. // Naunyn. Schmiedebergs. Arch. Pharmacol. 2014, Vol. 387, №7. P. 679-689].
Кроме того, была обнаружена способность непосредственно активировать TRPA1 метилглиоксалем, который является реактивным метаболитом, накапливающимся внутриклеточно при сахарном диабете и хронических болезнях почек [Brownlee M. Biochemistry and molecular cell biology of diabetic complications // Nature 2001, Vol. 414, №6865, P. 813-820, Nakayama K. et al. Plasma alpha-oxoaldehyde levels in diabetic and nondiabetic chronic kidney disease patients. // Am. J. Nephrol. 2008. Vol. 28, №6, P. 871-878]. Этот факт усиливает значимость данного канала при разработке новых лекарственных средств. Недавно было показано, что человеческий TRPA1, но не TRPA1 грызунов или макаки, может быть непосредственно активирован протонами [de la Roche J. et al. The molecular basis for species-specific activation of human TRPA1 protein by protons involves poorly conserved residues within transmembrane domains 5 and 6. // J Biol Chem. 2013. Vol. 288, №28, P. 20280-20292]. Протонная активация была показана в диапазоне рН 6.0-7.0, который хорошо соотносится с пределами колебаний физиологического уровня рН при ацидозе тканей. Этот интересный факт подчеркивает функциональное родство TRPA1 и TRPV1, которые оба являются терморецепторами, оба чувствительны к изменению рН и часто экспрессируются совместно в одном типе нейронов.
Практическое применение лигандов к TRPA1 рецепторам широко обсуждается в связи с вовлеченностью этих рецепторов в разнообразные физиологические процессы. При этом перспективными считаются, как агонисты, способные возбуждать или усиливать ответ рецепторов, так и антагонисты, уменьшающие проводимость этого канала. Пока больше опубликовано данных по антагонистам TRPA1 рецепторов, которые все имеют непептидную структуру и преимущественно оценивались в экспериментах in vitro на линиях клеток, экспрессирующих TRPA1 человека или грызунов. К недостаткам таких соединений относится не доказанная эффективность их как анальгетиков на животных моделях, где эти соединения могут иметь плохую биодоступность, неспецифичность действия, токсичность и/или серьезные побочные действия.
Среди антагонистов TRPA1, для которых были получены и опубликованы результаты экспериментов in vivo, следует рассматривать следующие низкомолекулярные соединения:
1) 4-(4-Хлорфенил)-3-метил-3-бутен-2-он оксим или АР-18 молекула, производная от коричного альдегида, который сам по себе активирует TRPA1. АР-18 блокирует активацию рецептора коричным альдегидом с IC50 3.1 мкМ для экспрессированных в СНО рецепторов человека и 4.5 мкМ для экспрессированных рецепторов мышей. В тестах на животных в дозе 1 мМ/мышь (что соотвествует порядка 1 гр/кг) было отмечено снижение болевой чувствительности механической и температурной [Petrus M. et al. A role of TRPA1 in mechanical hyperalgesia is revealed by pharmacological inhibition. // Mol. Pain. 2007, Vol. 3, P. 40]. Высокая активная доза компонента является существенным недостатком этого соединения.
2) 2-(1,3-Диметил-2,6-диокси-1,2,3,6-тетрагидро-7H-пурин-7-ил)-N-(4-изопропилфенил)ацетамид или НС-030031 - TRPA1 антагонист, способный ингибировать AITC-вызванные токи in vitro IC50 6.2 мкМ. На контактной модели дерматита, вызванного оксозалоном, НС-030031 при оральном применение в дозе 100 мг/кг НС-030031 снижает болевые ощущения и механическую гиперчувствительность [Caceres A.I. et al. A sensory neuronal ion channel essential for airway inflammation and hyperreactivity in asthma. // Proc. Natl. Acad. Sci. U. S. A. 2009, Vol. 106, №22, P. 9099-9104, Andre E. et al. Cigarette smoke-induced neurogenic inflammation is mediated by alpha, beta-unsaturated aldehydes and the TRPA1 receptor in rodents. // J. Clin. Invest. 2008, Vol. 118, №7, P. 2574-2582]. Высокая активная доза компонента является существенным недостатком этого соединения.
3) (1E,3E)-1-(4-фторфенил)-2-метил-1-пентен-3-он оксим или А-967079 при оральном применении показывает купирование боли у грызунов, вызванной AITC, или при остеоартрите с ED50: 23.2 мг/кг. [Chen J. et al. Selective blockade of TRPA1 channel attenuates pathological pain without altering noxious cold sensation or body temperature regulation. // Pain 2011, Vol. 152, №5, P. 1165-1172]. Высокая активная доза компонента является существенным недостатком этого соединения.
4) 2-(1,3-диметил-2,6-диоксо-1,2,3,6-тетрагидро-7H-пурин-7-Ил)-N-[4-(1-метилпропил)фенил]ацетамид или СНЕМ-5861528 - снижает механическую гиперчувствительность (после введения капсаицина и уменьшает механическую аллодинию при введении в цереброспинальную жидкость. Эффективен в дозе 5-10 мкг/мышь [Wei H. et al. Spinal transient receptor potential ankyrin 1 channel contributes to central pain hypersensitivity in various pathophysiological conditions in the rat. // Pain 2011, Vol. 152, №3, P. 582-591, Wei H. et al. Spinal transient receptor potential ankyrin 1 channel induces mechanical hypersensitivity, increases cutaneous blood flow, and mediates the pronociceptive action of dynorphin A. // J. Physiol. Pharmacol. 2013, Vol. 64, №3, P. 331-340]. Высокая активная доза компонента является существенным недостатком этого соединения.
5) Антагонист GRC 17536 от фармацевтической компании Гленмарк успешно прошел фазу 2а клинических исследований, в том числе среди пациентов с болезненной диабетической нейропатией. Химическая формула соединения не раскрывается. В модели индуцированного лимонной кислотой кашля на морских свинках показана эффективность этого компонента в дозе 60 и 100 мг/кг [Mukhopadhyay I. et al. Transient receptor potential ankyrin 1 receptor activation in vitro and in vivo by pro-tussive agents: GRC 17536 as a promising anti-tussive therapeutic. // PLoS One 2014, Vol. 9, №5, P. e97005]. Высокая активная доза компонента является существенным недостатком этого соединения.
Среди агонистов описан эффект для (2E)-2-[7-фтор-1,2-дигидро-1-(2-метилпропил)-2-оксо-3Н-индол-3-илиден]уксусной кислоты или ASP7663. Этот компонент действует как слабительное и как средство купирования болей в животе. Активная доза 1 мг/кг при перерольном введении, при внутривенном введении эффект не воспроизводился [Kojima R. et al. Effects of novel TRPA1 receptor agonist ASP7663 in models of drug-induced constipation and visceral pain. // Eur. J. Pharmacol. 2014, Vol. 723, P. 288-293] Неэффективность соединения при внутривенном введении характеризует это соединение как вещество с плохой биодоступностью, что является существенным недостатком.
Изобретение решает задачу расширения арсенала анальгетических и противовоспалительных лекарственных препаратов нового поколения, имеющих направленное действие на клеточную мишень, а именно, на ионный канал TRPA1, участвующий в восприятии, обработке и передаче болевых сигналов. По своей структуре - соединение пептидной природы, активирующее TRPA1, заявляемый пептид не имеет мировых аналогов.
Заявляемый пептид, именуемый Ms 9а-1 (полное название по классификации τ-AnmTX Ms 9a-1), оказывает выраженный потенцирующий эффект на канал или вызванные токи через канал (Фиг. 6 и 7).
Заявляемый пептид может быть использован как анальгетик для облегчения болевых состояний, обусловленных участием TRPA1 рецепторов в патологических процессах таких как: хроническая боль, комплексный местный болевой синдром, невропатическая боль, послеоперационная боль, боль от ревматоидного артрита, боль от остеоартрита, боль в спине, висцеральная боль, онкологическая боль, повышенная чувствительность к боли, невралгия, мигрень, диабетическая невропатия, ишиас, ВИЧ-индуцированная невропатия, фибромиалгия, повреждения нерва, ишемия, нейродегенерация, инсульт и постинсультные боли, рассеянный склероз, заболевания органов дыхания, астма, кашель, воспалительного расстройства, воспаление пищевода, гастроэзофагеальная рефлюксная болезнь, синдром раздраженного кишечника, воспалительные заболевания кишечника, гиперчувствительность органов таза, недержание мочи, цистит, ожоги, псориаз, экзема, рвота, язва желудка или двенадцатиперстной кишки, зуд.
Поставленная задача решается за счет структуры пептида Ms 9a-1, имеющего следующую аминокислотную последовательность:
H2N-Asnl-Ile2-Ile3-Val4-Gly5-Gly6-Cys7-Ile8-Lys9-Cysl0-His11-Val12-Lys13-Asnl4-Alal5-Serl6-Glyl7-Argl8-Cysl9-Val20-Arg21-Ile22-Val23-Gly24-Cys25-Gly26-Val27-Asp28-Lys29-Val30-Pro31-Asp32-Leu33-Phe34-Ser35-СООН.
Ms 9a-1 является соединением полипептидной природы, его аминокислотная последовательность содержит 35 аминокислотных остатков, и его структура стабилизирована 2 дисульфидными связями, что делает молекулу, с одной стороны, чрезвычайно стабильной и устойчивой к деградации, а с другой стороны, снижает затраты на ее синтез и как следствие этого улучшает потребительские свойства препаратов на его основе.
Заявляемый анальгетический пептид может быть выделен хроматографическими методами из секрета нематоцистов морских анемон, синтезирован химическими методами из отдельных аминокислот или получен в виде рекомбинантного белка генно-инженерными методами. Структура белка-предшественника заявляемого пептида (Фиг. 1) получена на основании нуклеотидной последовательности матричных РНК, имеющих нижеследующую структуру:
или
Первый ген кодирует в открытой рамке считывания 98 аминокислотных остатков и стоп кодон для белка предшественника Ms1. Сигнальный пептид из 21 аминокислотного остатка предшествует структуре пробелка, содержащего два зрелых пептида Ms 9a-1 и Ms 9a-2, между которыми расположен выщепляемый дипептид. Семь С-концевых аминокислотных остатков Ms1 удаляются посттрансляционно. Второй ген кодирует белок предшественник Ms2 длиной в 93 аминокислотных остатка, который имеет идентичный сигнальный пептид и зрелый пептид Ms 9a-1. Отличие второго белка предшественника Ms2 в С-концевой части, где содержится пептид Ms 9a-3, после которого расположен короткий выщепляемый при созревании дипептид (Фиг. 2). Заявляемый активный анальгетический пептид Ms 9a-1 может быть получен из любого из двух белков предшественников и не имеет никаких пост-трансляционных модификаций в своем составе.
Заявляемый пептид проявляет анальгетическую активность на млекопитающих, что было показано в тестах на мышах линии CD-1, как для модели тепловой гиперчувствительности после введения полного адъювант Фрейнда (ПАФ) (Фиг. 10), так и на модели воспаления, вызванной подкожным введением AITC (Фиг. 9). В экспериментах in vitro заявляемый пептид способен проявлять выраженный потенциирующий эффект на токи через TRPA1 каналы крысы, экспрессированные в ооцитах лягушки при возбуждении химическими активаторами, таким как диклофенак и AITC (Фиг. 7 и 8), или на линии клеток СНО, экспрессирующих эти рецепторы (Фиг. 6).
Изобретение иллюстрируют следующие фигуры.
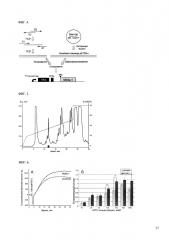
ФИГ. 1 Аминокислотные последовательности белков предшественников Ms1 и Ms2. Аминокислотные последовательности сигнальных и зрелых пептидов в составе этих белков подчеркнуты. Жирным шрифтом выделена последовательность активного пептида.
ФИГ.2 Сравнение аминокислотной последовательности пептида Ms 9a-1 с ближайшими структурными гомологами. Справа приведен расчетный % гомологии к структуре активного пептида. Снизу приведена схема замыкания дисульфидных связей для пептидов этой структурной группы. Сравнение сделано для Ms 9a-2 и Ms 9a-3, синтезирующихся в составе общего белка предшественника с активным пептидом; пептидом морской анемоны U-SHTX-Sdd11 (C0HJB4) из Homostichanthus duerdeni; петидом Bcg III 23.41 (P86467) из морской анемоны Bunodosoma cangicum; пептидами SHTX-I/SHTX-2 (P0C7W7) из морской анемоны Stichodactyla haddoni; токсином Ugr 9a-1 (S4S1V7) из морской анемоны Urticina grebelnyi; пептидным токсином Am-1 (P69929) из морской анемоны Antheopsis maculata.
ФИГ. 3 Выделение активного пептида из природного сырья. А. Профиль элюции образца яда, предочищенного на SPE Chromabond® Cig ее 15 мл/2000 мг (Macherey-Nagel, Германия), на обращено-фазной колонке 250×10 мм Jupiter C5 (Phenomenex, США) при скорости элюции 5 мл/мин. Б. Профиль элюции активной фракции на обращено-фазной колонке 250×3 мм Synergi Fusion-RP (Phenomenex, США) при скорости элюции 0.5 мл/мин. Использованы градиенты концентрации ацетонитрила (указаны линией) в присутствии 0.1% ТФУ, время элюции активных фракций на каждом этапе выделено черным прямоугольником.
ФИГ. 4. Схема клонирования гена пептида Ms 9a-1. Место вставки аминокислотного остатка Met для последующего расщепления бромцианом отмечено черным треугольником, черные прямоугольники обозначают домен тиоредоксина и последовательность 6 гистидинов для металло-аффинной хроматографии.
ФИГ. 5. ВЭЖХ гидролизата 10 мг химерного белка на обращеннофазной колонке Jupier C5 (Phenomenex, США) 10×250 мм. Разделение со скоростью 5 мл/мин проводили в линейном градиенте концентрации ацетонитрила (обозначено линией) в присутствии 0.1% ТФУ. Детекция при длине волны 210 нм. Время элюции Ms 9a-1 выделено черным цветом.
ФИГ. 6. Измерение модулирующей активности Ms 9a-1 на линии клеток СНО, экспрессирующих рецепторы rTRPA1. А. Кривые роста кальциевого ответа для обработанных реагентом Фура-4 клеток предварительно инкубированных с природным пептидом в концентрации 500 нМ и контрольных клеток. Для активации тока через мембраны клеток стимулировали их 100 мкМ аллилизотиоцианата (AITC). Б. Эффект модулирующего действия пептида Ms 9a-1 в концентрации 1 мкМ на [Са2+] ответ, вызываемый различными концентрациями агониста - AITC. Значение относительного сигнал рассчитывали как разницу флюоресценции на 35 и на 2 секунде деленную на флюоресценцию на 2 секунде.
ФИГ. 7. Влияние Ms 9a-1 на TRPA1 каналы крысы, экспрессированные в ооцитах X.laevis. A фрагмент записи потенцирующего эффекта Ms 9a-1 в различной концентрации на токи, вызванные аппликацией 500 мкМ диклофенака; Б. Кривая зависимости относительного ответа диклофенак-индуцированных токов TRPA1 от концентрации пептида. Для каждой точки концентрации приведено стандартное отклонение, как результат 3-7 независимых измерений.
ФИГ. 8. Влияние Ms 9a-1 на TRPA1 каналы крысы, экспрессированные в ооцитах X.laevis, при активации различными химическими агентами. А. Пример записи тока, вызываемого последовательными добавлениями 300 мкМ диклофенака; Б. Пример записи тока, где после аппликации отмываемого агента (диклофенака) используется добавление необратимого агониста (AITC).
ФИГ. 9. Анальгетический эффект Ms 9a-1 в тесте воспаления, вызванном AITC. Пептид вводился в дозе 0.3 мг/кг за 30 мин до введения AITC. А. Сравнение количества облизываний воспаленной конечности; Б. Сравнение времени поджатая лапы в течении 5 минутного интервала после введения AITC; В. Размер лапы до и после введения AITC. Приведено стандартное отклонение для 9 повторов. Статистически достоверные различия от контрольной группы (по Т-критерию Стьюдента) отмечены *** - р<0.001, * - р<0.05.
ФИГ. 10. Анальгетический эффект Ms 9a-1 в тесте тепловой гиперчувствительности, вызванной ПАФ. А. Приведено измеренное время отдергивания лапы (n=9) для контрольных животных и животных после инъекции пептида в дозе 0.3 мг/кг; Б. Размер отека лапы. Статистически достоверные различия от контрольной группы «физ. р-р» (по Т-критерию Стьюдента) отмечены *** - р<0.001, ** - р<0.01.
Изобретение иллюстрируют примеры.
Пример 1. Выделение анальгетического пептида Ms 9a-1.
Морские анемоны вида Metridium senile содержат в холодной морской воде при температуре 12°С, извлекают и помещают в чистую плоскую посуду для сбора яда из специальных стрекательных клеток нематоцистов, расположенных по всему телу. Животных первоначально обмывают дистиллированной водой для удаления загрязнений и помещают в ванну. Далее с помощью низкочастотного электрического стимулятора проводят раздражение поверхностных клеток подачей на один плоский электрод повторяющихся импульсов с частотой 10 Гц при постоянной силе тока 160 мА, а второй электрод помещают в ванну, где животное расположено в минимальном объеме дистиллированной воды. Используют короткие серии импульсов для предотвращения возможных термических ожогов животных. Выделяющийся секрет смывают дистиллированной водой, содержащей ингибиторы протеолитических ферментов 1 мМ фенилметилсульфонилфторида (ФМСФ) и 5 мМ этилендиаминтетрауксусной кислоты (ЭДТА), в чистую посуду. Далее животные помещаются в холодную морскую воду для реабилитации и кормления, после чего новую процедуру повторного сбора яда можно повторять через две недели.
Секрет концентрируют и очищают от механических примесей и высокомолекулярных соединений методом твердофазной экстракции на обращено-фазных сорбентах Chromabond® C18 ес 45 мл/5000 мг (Macherey-Nagel, Германия). Для уравновешивания и двух стадий промывки используют 0.1% раствор ТФУ, для элюции пептидной фракции используют 70% раствор ацетонитрила содержащий 0.1% ТФУ. Фракцию активных пептидов элюируют в минимальном объеме 4.5 мл, после чего упаривают органический растворитель и лиофилизуют для последующего хранения при -20°С.
Выделение и очистку анальгетического пептида проводят по разработанной схеме (Фиг. 3), включающей два этапа обращено-фазной (ОФ) ВЭЖХ на колонках Jupiter C5 и Synergi Fusion-RP (Phenomenex, США). Детектирование хроматографических фракций на всех стадиях выделения проводят спектрофотометрически при длине волн 210 и 280 нм. При разделении используют летучие растворы: вода с 0.1% ТФУ и ацетонитрил с 0.1% ТФУ. Разделение проводят в линейном градиенте концентрации ацетонитрила от 0 до 40% за 60 минут (этап 1) и от 0 до 30% за 1 минуту, далее от 30 до 50% за 30 минут (этап 2).
Активность промежуточных фракций подтверждают в биологических тесах на животных или методами электрофизиологии на каналах TRPA1 крысы, экспрессированных в ооцитах лягушек. Чистота анальгетического пептида после 2 второго этапа выделения контролируется масс-спектрометрически, при большом проценте примесей, вся фракция повторно разделяется на той же колонке при тех же условиях, что описаны для второго этапа ОФ ВЭЖХ.
Пример 2. Установление частичной аминокислотной последовательности.
Определение N-концевой аминокислотной последовательности очищенного пептида проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Precise 492 (Applied Biosystems, США). В результате устанавливают аминокислотную последовательность первых 24 аминокислотных остатков:
H2N-Asn1-Ile2-Ile3-Val4-Gly5-Gly6-Cys7-Ile8-Lys9-Cys10-His11-Val12-Lys13-Asn14-Ala15-Ser16-Gly17-Arg18-Cys19-Val20-Arg21-Ile22-Val23-Gly24
Пример 3. Установление структуры гена и полной аминокислотной последовательности Ms 9a-1.
Для получения суммарной фракции мРНК используют свежепрепарированный образец морской анемоны (50 мг), гомогенизируют пестиком в 0.5 мл буфера для выделения РНК RNAwiz (Ambion, Канада), инкубируют при комнатной температуре 5 мин, затем добавляют 0.1 мл хлороформа, встряхивают и инкубируют еще 10 мин. Полученную смесь центрифугируют при температуре 4°С (15 мин, 14000 g) и отбирают верхнюю водную фазу. Последовательно добавляют 0.25 мл дистиллированной воды и 0.5 мл изопропанола, центрифугируют при температуре 4°С (15 мин, 14000 g). К осадку добавляют 1 мл 75% этилового спирта, и осаждают центрифугированием при температуре 4°С (5 мин, 14000 g). Осадок РНК подсушивают на воздухе и растворяют в 50 мкл дистиллированной воды, не содержащей РНКаз. Концентрацию РНК определяют спектрофотометрически.
Для синтеза первой цепи кДНК, 5 мкг суммарной РНК смешивают с праймером Сар(Т)20: (AAG CAG TGG ТАА САА CGC AGA GTA C(T)30N-1N, где N = смесь A,C,G,T; и N-1 = смесь A,G,C), доводят дистиллированной водой объем смеси до 12 мкл, инкубируют 5 мин при температуре 70°С и охлаждают в ледяной бане. Добавляют 4 мкл 5-кратного реакционного буфера (250 мМ Трис-HCl (рН 8.3 при 25°С), 250 мМ KCl, 20 мМ MgCl2, 50 мМ дитиотреитола), 1 мкл ингибитора рибонуклеаз RNAsin (Promega), 2 мкл 10 мМ dNTP. Инкубируют 5 мин при температуре 37°С. Реакцию проводят 1 час при температуре 42°С, добавляя в реакционную смесь 1 мкл (200 ед. активности) обратной транскриптазы RevertAid™ (Fermentas, Латвия).
Для определения полной нуклеотидной последовательности генов, кодирующих белки-предшественники пептида Ms 9а-1, синтезируют: один универсальный праймер Т7 сар (GTA ATA CGA CTC ACT ATA GGG САА GCA GTG GTA АСА ACG CAG AGT); два вырожденных праймера, рассчитанных из частичной аминокислотной последовательности искомого белка, для определения 3'-концевой последовательности MS-d1 (GTA GGA GGN TGY ATH AAR TGY CA) and MS-d2 (GGT CGA TGT GTG AGN ATH GTN GG); и два специфичных праймера для определения 5'-концевой последовательности MS-r1 (АСА GCC GGC GAT ACG ААС АСА) and MS-r2 (CCA TTG GAA ТСТ TGT GTA TGA С).
ПЦР проводят с использованием Taq полимеразы (Евроген) при следующих условиях 94°С - 20 сек, 55°С - 20 сек, 72°С 60 сек, 35 циклов. Амплифицированные фрагменты около 150 п.о. (в эксперименте по определению 3'-концевой последовательности) или около 600 п.о. (в эксперименте по определению 5'-концевой последовательности) клонируют в плазмиду pAL-TA (Евроген). Нуклеотидную последовательность нескольких клонов определяют на многоканальном автоматическом секвенаторе PRISM 3100-Avant (ABI-Perkin Elmer). Полноразмерные структуры генов, кодирующих белок-предшественник Ms1 и белок-предшественник Ms2, определяют после множественного выравнивания всех полученных последовательностей (Фиг. 1).
Правильность конечной аминокислотной последовательности подтверждают сравнением расчетных и измеренных молекулярных масс пептида. Уникальность последовательности активного пептида подтверждают сравнением с базой данных известных аминокислотных последовательностей (Фиг. 2).
Пример 4. Определение относительной молекулярной массы.
Индивидуальность очищенного пептида подтверждают масс-спектрометрическим анализом. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре Ultraflex II TOF/TOF (Bruker Daltonik, Германия), с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют α-циано-4-гидроксикоричную кислоту (10 мг/мл) в 50%-ном (v/v) ацетонитриле, содержащем 0.1%-ную (v/v) ТФУ. Для калибровки прибора используют стандартную смесь пептидов с диапазоном молекулярных масс 700-3500 Да (Sigma).
Измеренная средняя молекулярная масса природного полипептида Ms 9a-1 составляет 3654.6 Да. Расчетная средняя молекулярная масса 3654.4 отличается от измеренной на 0.2 Да. С учетом точности метода определения масс, выносится заключение об отсутствии любой пост-трансляционной модификации у данного пептида.
Пример 5. Создание генно-инженерной конструкции для получения рекомбинантного Ms 9a-1.
Для получения генно-инженерной конструкции, способной экспрессировать Ms 9a-1 в клетках Е.coli, с помощью биоинформатических методов аминокислотную последовательность преобразуют в нуклеотидную с учетом оптимизации использования кодонов в клетке хозяине (Е.coli). Синтезируют 4 олигонуклеотидных праймера, перекрывающих полную аминокислотную последовательность белка и содержащие остаток метионина и сайты для рестриктазы EcoRV: MS-dir1 (TAG ААТ ТСА TGA АТА ТТА TTG TGG GCG GCT GCA ТТА ААТ G), MS-dir2 (GGG CGG CTG CAT TAA ATG ССА ТОТ GAA ААА TGC GTC CGG CCG TTG), MS-rev1 (GAC TCG AGC TAG GAA AAC AGA TCC GGC ACT ТТА TCC ACG CCG CA), MS-rev2 (CAC TTT АТС CAC GCC GCA GCC CAC ААТ ACG CAC GCA ACG GCC GGA CGC AT). С праймерами MS-dir1 и MS-rev1 проводят первый раунд ПЦР. Получаемую амплифицированную ДНК используют как матрицу для второго раунда ПЦР, которую проводят с парой праймеров MS-dir2 и MS-rev2. Оба раунда ПЦР проводят при сходных условиях 94°С - 20 сек, 55°С - 20 сек, 72°С 20 сек, 25 циклов используя Taq полимеразу (Евроген).
Последовательность Ms 9a-1 вставляют в плазмиду после гена тиоредоксина и последовательности 6 аминокислотных остатков гистидина для прокариотической экспрессии в виде водорастворимого химерного белка (Фиг. 4). Для этого, после обработки рестриктазой EcoRV собранный ген Ms 9a-1 и экспрессирующий вектор pET32b+ (Novagen) лигируют друг с другом. В результате получают плазмиду, кодирующую слитный белок под контролем Т7 промотера. Полученную плазмиду трансформируют в клетки XL1-Blue и проверяют правильность ориентации вставки, сборки и лигирования ееквенированием.
Пример 6. Получение рекомбинантного Ms 9a-1.
Клетки BL21(DE3) трансформируют экспрессионным вектором pET32+Ms 9a-1. После селекции на чашках с антибиотиком (ампициллин), клетки пересеивают в 200 мл колбы и выращивают до оптической плотности ~0.6 при перемешивании и аэрации. Индукцию экспрессии проводят добавлением изопропил-β-D-1-тиогалактопиранозида до концентрации 0.2 мМ, после чего растят клетки еще 12 часов при 24°С. Клетки осаждают и ресуспендируют в буфере для дезинтеграции (20 мМ Трис-HCl рН 7.2, 150 мМ NaCl). Дезинтегрируют клетки ультразвуком, осаждают клеточный дебрис центрифугированием. Целевой слитный белок содержится в растворимой фракции.
В результате экспрессии созданной конструкции, наработка рекомбинантного Ms 9a-1 происходит в составе слитного белка с тиоредоксином, где последовательность тиоредоксина совместно с полигистидиновым тяжем предшествует активному пептиду. Метало-аффинную хроматографию на Со2+-сорбенте проводят в буфере (20 мМ Трис-HCl рН 7.2, 150 мМ NaCl), для элюирования химерного белка используют буфер (150 мМ имидазола, 300 мМ NaCl, 20 мМ Tris, рН 7.5). К раствору химерного белка (1 мг/мл) добавляют концентрированную соляную кислоту до концентрации 0.2 М и, расщепляют бромцианом 15 часов в темноте, используя 600-кратный молярный избыток бромциана к химерному белку. Растворитель и избыток бромциана удаляют в вакуумном концентраторе, далее смесь продуктов ограниченного протеолиза растворяют в хроматографическом буфере А (0.1% ТФУ) и наносят на колонку с обращенной фазой Jupier C5 (Phenomenex) 10×250 мм для выделения целевого пептида (Фиг. 5). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 0 до 60% (v/v) в 0.1%-ной (v/v) ТФУ в течение 60 минут со скоростью элюции 5 мл/мин. Детекцию осуществляют по оптическому поглощению при 210 нм.
Контроль чистоты и правильности синтеза рекомбинантного пептида проверяют при помощи масс-спектрометрического анализа, сравнением хроматографических подвижностей природного и рекомбинантного пептида на аналитической колонке Luna C18 (Phenomenex) 2×150 мм, а также сравнением биологических свойств.
Пример 7. Измерение активности пептида методом Са2+ имиджинга на клеточной линии СНО.
Для анализа используют готовую клеточную линию СНО, стабильно экспрессирующую TRPA1 рецептор крысы. Для этого кДНК рецептора TRPA1 клонируют в вектор pcDNA4/TO (Invitrogene), который позволяет обеспечить индуцируемую экспрессию в клеточных линиях млекопитающих. Для трансфекции выбирают СНО клетки, содержащие регуляторный вектор pcDNA6/TR, кодирующий тетрациклиновый репрессор. Эти клетки трансфецируют плазмидой pcDNA4/TO-rTRPA1. Селекцию клеток проводят 2 недели на антибиотике blastieidin (5 мкг/мл) и zeocin (250 мкг/мл) в стандартных условиях (среда для культивирования клеток - DMEM/F12 (1:1) (Invitrogene), содержащая 1х раствор пенициллина-стрептомицина (Invitrogene), 10% фетальной бычьей сыворотки (HyClone), условия - 5% CO2, 37°С), после чего клетки рассевают на 96-луночный планшет для культивирования отдельных колоний. После проверки специфичного ответа клеток-моноклонов на специфичный агонист, отдельные клеточные линии замораживают в среде с добавлением 10% ДМСО. Полученные стабильные клеточные линии, зкспрессирующие крысиный TRPA1 рецептор в ответ на индукцию тетрациклином, хранят при температуре жидкого азота в клеточном музее.
Клеточную линию из музея размораживают, переносят на 6-луночные планшеты или клеточные матрасы, культивируют в стандартных условиях, в стандартной клеточной среде с антибиотиками, пересевая 2-3 раза после достижения состояния монослоя. Клетки для анализа высевают в черные плоскодонные 96-луночные планшеты из расчета 75000 клеток на лунку и культивируют ночь при 37°С на полной клеточной среде с добавлением тетрациклина в концентрации 1 мкг/мл. Полученные клетки, экспрессирующие TRPA1 рецептор крысы, окрашивают реагентом Фура-4 с помощью набора для измерения уровня цитоплазматического кальция Fluo-4 Direct™ Calcium Assay Kits (Invitrogene), последовательно инкубируют в темноте 60 мин при 37°С и 60 мин при 25°С.
Изучаемый активный пептид в серии последовательных разведении добавляют к подготовленным клеткам в объеме 20 мкл на лунку, в качестве контроля используют буферный раствор HBSS (рН 7.4) в том же объеме. Для каждой концентрации пептида проводят не менее 6 измерений. Измерение уровня внутриклеточного Са2+ проводят сразу после добавления пептида с использованием планшетного спектрофлюориметра со встроенной автоматической системой дозирования жидкости NOVOstar (BMG labtech, Германия). Флуоресцентный сигнал при λвозб = 485 нм и λэмис = 520 нм измеряют при комнатной температуре в течении 40 секунд. Специфическое свечение инициируют добавлением на 3 секунде 10 мкл раствора специфического агониста TRPA1 (1 мМ раствор AITC в HBSS, конечная концентрация агониста составляет 100 мкМ). Относительную флуоресценцию для каждой лунки рассчитывают, как разницу значений измеренного сигнала при насыщении на 35 сек и сигнала, измеренного на 2 сек, до добавления агониста. Относительный сигнал рассчитывают делением значения относительной флуоресценции на значение флуоресценции на 2 сек.
Пример 8. Влияние Ms 9а-1 на TRPA1 каналы в клетках СНО.
Предварительная короткая инкубация Ms 9а-1 с клетками СНО, экспрессирующими канал TRPA1, приводит к усилению свечению клеток, что является результатом потенцирующего влияния пептида на канал TRPA1. Добавление пептида к клеткам, которые экспрессируют другие типы рецепторов, или к неиндуцированным клеткам не приводит к изменению уровня регистрируемого сигнала в тесте. Значимую потенциацию сигнала при активации 100 мкМ AITC наблюдают в диапазоне концентрации пептида 1-3000 нМ. Пример регистрируемого сигнала для 500 нМ пептида представлен на Фиг 6А.
Потенциирующий эффект Ms 9а-1 зависит от концентрации агониста (AITC) в тесте. Максимальный усиливающий эффект (35-55%) наблюдают при концентрации агониста 100 и 300 мкМ (ФИГ. 6Б). Большие концентрации агониста приводят к агонист-индуцированной десенсибилизации рецептора TRPA1, что выражается в замедлении и падении уровня активации рецептора в контроле. В низких концентрациях агониета усиливающий эффект Ms 9а-1 имеет большой статистический разброс и низкий уровень достоверности, которую оценивают с помощью t-теста Стюдента.
Пример 9. Экспрессия каналов TRPA1 в ооцитах лягушки.
РНК, кодирующую канал TRPA1, получают при помощи набора реагентов RiboMAX Large Scale RNA Production System (Promega) для чего к 33 мкл расщепленной и очищенной плазмиды, содержащей Т7 промотер перед кодирующей областью гена TRPA1 крысы, добавляют 20 мкл 5-кратного буфера для транскрипции (400 мМ HEPES-KOH, 120 мМ MgCl2, 10 мМ спермедина, 200 мМ дитиотриэтола), 20 мкл смеси рибонуклеозидтрифосфатов (25 мМ АТР, СТР, UTP и 2 мМ GTP), 7 мкл Cap-аналога (в концентрации 40 мМ) и 10 мкл Т7 РНК полимеразы (Promega). Реакционную смесь инкубируют 3 часа при 37°С. Очистку РНК проводят методом «фенол/хлороформом». Полученные образцы растворяют в воде, анализируют в агарозном гель-электрофорезе и хранят при температуре -80°С несколько недель.
Каналы TRPA1 получают в результате их экспрессии в мембранах ооцитов лягушки Xenopus laevis. Для этого выделенные из яичника самки ооциты обрабатывают коллагеназой типа I или типа II (Sigma-Aldrich, США) в концентрации 1 мг/мл в течение 2 часов для снятия фолликулярной оболочки. Дефолликулированные ооциты помещают в стерильную среду ND96 (NaCl 96 мМ, KCl 2 мМ, CaCl2 1.8 мМ, MgCl2 1 мМ, HEPES 5 мМ титрованный NaOH до значения рН 7.4) и выдерживают ночь при температуре 15-16°С. Инъекцию 2.5 - 10 нг мРНК канала TRPA1 крысы (AY496961.1) производят под бинокулярным микроскопом МБС-10 (Россия) с помощью микроинъектора Eppendorf 5242 (Германия). После инъекции ооциты хранят в течение 2-3 дней при температуре 19°С, а затем до 7 дней при температуре 15°С в ND-96 среде, которую предварительно титруют NaOH до рН 7.4 и в которую дополнительно добавляют антибиотик гентамицин до концентрации 50 мкг/мл и пируват до концентрации 5 мМ.
Пример 10. Влияние Ms 9а-1 на токи TRPA1.
Измерение ионных токов через TRPA1 каналы проводят при частоте 100 Гц методом двухэлектродной фиксации мембранного потенциала, используя усилитель GeneClamp 500 (Axon Instruments, США) в рабочей камере со свободным объемом 45 мкл. Данные фильтруют при частоте 20 Гц и оцифровывают при помощи АЦП L780 (LCard, Россия), используя самодельные программы. Микроэлектроды заполняют 3 М раствором KCl. Эксперименты проводят при комнатной температуре в ламинарном потоке раствора ND96 без ионов Са2+ (100 мМ NaCl, 2.5 мМ KCl, 1 мМ MgCl2, 5 мМ HEPES титрованный NaOH до рН 7.4) со скоростью 1 мл/мин. Мембранный потенциал клетки поддерживают на уровне -20 мВ, для измерения тока через каналы применяют ступенчатый скачок потенциала до +80 мВ длительностью в 200 мсек с интервалом активации 4 сек. Специфичный ток через клеточную мембрану регистрируют после добавления специфичных агонистов к TRPA1 в буфере не содержащим ионы Са2+ - это диклофенак в концентрации 300-500 мкМ, или AITC в концентрации 100 мкМ.
Аппликацию тестируемого образца начинают за 5 сек до подачи в измерительную камеру агониста. Всего используют 8 различных концентраций пептида не менее чем в трех повторах, для которых измеряют амплитуду исходящего тока через TRPA1 (Фиг. 7А). Процент потенцирования наблюдаемых токов вычисляют как отношение амплитуды тока при аппликации пептида к усредненной амплитуде пика контрольных токов до и после аппликации пептида. При концентрациях пептида более 1 мкМ наблюдают максимальное потенцирование тока на 80%. По результатам измерений всех концентраций строят кривую зависимости % тока относительно контроля к концентрации пептида (Фиг. 7Б). На основании этой кривой определяют значения 50% эффективной концентрации ЕС50 30.0±8.6 нМ и коэффициент Хилла 0.62±0.15.
Возникающие токи при активации диклофенаком обратимо отмываются промыв