Связывающие il-1 белки
Иллюстрации
Показать всеНастоящая группа объектов изобретения относится к области биотехнологии и иммунологии. Предложен биспецифический связывающий белок, который содержит первую полипептидную цепь, включающую два вариабельных домена тяжелой цепи антитела, и вторую полипептидную цепь, включающую два вариабельных домена легкой цепи антитела, (DVD-Ig). Белок по изобретению связывает IL-1β человека и IL-1α человека. В дополнение рассмотрена выделенная молекула нуклеиновой кислоты, вектор экспрессии, клетка-хозяин и основанный на их использовании способ получения связывающего белка по изобретению. Кроме того, представлена фармацевтическая композиция, способы понижения активности IL-1 человека и способ лечения субъекта-человека от воспалительного нарушения. Белок по настоящему изобретению обладает нейтрализующей активностью в отношении IL-1β человека и IL-1α человека и, таким образом, может найти дальнейшее применение в терапии заболеваний, связанных с IL-1. 9 н. и 6 з.п. ф-лы, 17 табл., 4 пр.
Реферат
Перекрестная ссылка на родственные заявки
По данной заявке испрашивается приоритет по временной заявке США №61/334917, поданной 14 мая 2010 года, и по временной заявке США №61/425701, поданной 21 декабря 2010 года, содержание которых включено в настоящее описание в качестве ссылки в полном объеме.
Область изобретения
Настоящее изобретение относится к связывающим IL-1 белкам, и, в частности, к их применению для профилактики и/или лечения острых и хронических иммунологических заболеваний, таких как ревматоидный артрит, остеоартрит, псориаз, рассеянный склероз и другие аутоиммунные заболевания.
Уровень техники, к которому относится изобретение
Цитокины, такие как интерлейкин-1 (IL-1) и фактор некроза опухоли (TNF), представляют собой молекулы, продуцируемые различными клетками, такими как моноциты и макрофаги, которые являются медиаторами воспалительных процессов. Интерлейкин-1 представляет собой цитокин с широким диапазоном биологических и физиологических эффектов, включая лихорадку, синтез простагландинов (например, в фибробластах, мышечных клетках и эндотелиальных клетках), активацию T-лимфоцитов и продуцирование интерлейкина-2.
Основными представителями суперсемейства IL-1 являются IL-1α, IL-1β и антагонист рецептора IL-1 (IL-1Ra, IL-1RA, IL-1ra, IL-1Rα). IL-1α и IL-1β представляют собой провоспалительные цитокины, вовлеченные в иммунную защиту против инфекции. IL-1Rα представляет собой молекулу, которая конкурирует за связывание рецептора с IL-1α и IL-1β, блокируя их участие в активации иммунной системы. В последние годы к суперсемейству IL-1 были добавлены другие молекулы, включая IL-18 (см. Dinarello et al., FASEB J., 8(15): 1314-3225 (1994); Huising et al., Dev. Comp. Immunol., 28(5):395-413 (2004)) и еще шесть генов со структурной гомологией с IL-1α, IL-1β или IL-IRA. Эти последние шесть представителей называются IL1F5, IL1F6, IL1F7, IL1F8, IL1F9 и IL1F10. В соответствии с этим, IL-1α, IL-1β и IL-1RA были переименованы на IL-1F1, IL-1F2 и IL-1F3, соответственно (см. Sims et al., Trends Immunol., 22(10): 536-537 (2001); Dunn et al., Trends Immunol., 22(10): 533-536 (2001)). Описан следующий предполагаемый представитель семейства IL-1, названный IL-33 или IL-1F11, хотя это название не является официально признанным в базе данных по номенклатуре семейств генов HGNC.
Как IL-1α, так и IL-1β продуцируются макрофагами, моноцитами и дендритными клетками. Они формируют важную часть воспалительного ответа организма против инфекции. Эти цитокины увеличивают экспрессию факторов адгезии на эндотелиальных клетках, обеспечивая трансмиграцию лейкоцитов – клеток, которые осуществляют борьбу с патогенами, в область инфекции, и регулируют терморегуляторный центр гипоталамуса, что приводит к увеличенной температуре тела, которая проявляется как лихорадка. Таким образом, IL-1 называют эндогенным пирогеном. Увеличенная температура тела помогает иммунной системе организма осуществлять борьбу с инфекцией. IL-1 также является важным для регуляции гемопоэза. Продуцирование IL-1β в периферической ткани также ассоциировано с гипералгезией (повышенная чувствительность к боли), связанной с лихорадкой (Morgan et al., Brain Res., 1022(1-2): 96-100 (2004)). По большей части, эти две формы IL-1 связываются с одним и тем же клеточным рецептором. Этот рецептор состоит из двух родственных, но не идентичных, субъединиц, которые передают внутриклеточные сигналы через каскад, который по большей части является общим с определенными другими рецепторами. Они включают Toll-семейство врожденных иммунных рецепторов и рецептор для IL-18. IL-1α и IL-1β также обладают сходными биологическими свойствами, включая индукцию лихорадки, медленноволнового сна и нейтрофилии, активацию T- и B-лимфоцитов, пролиферацию фибробластов, цитотоксичность в отношении определенных клеток, индукцию коллагеназ, синтез белков острой фазы печенью и увеличенное продуцирование колониестимулирующих факторов и коллагена.
кДНК, кодирующие две различных формы IL-1, были выделены и экспрессированы; эти кДНК соответствуют двум продуктам генов, называемым IL-1β (Auron et al., Proc. Natl. Acad. Sci. USA, 81: 7907-7911 (1984)) и IL-1α (Lomedico et al., Nature, 312: 458-462 (1984)). IL-1β является преобладающей формой, продуцируемой моноцитами человека, на уровне как мРНК, так и белка. Эти две формы IL-1 человека обладают гомологией аминокислот, составляющей только 26%. Несмотря на их различающиеся полипептидные последовательности, эти две формы IL-1 имеют структурное сходство (Auron et al., J. Mol. Cell Immunol., 2: 169-177 (1985)), в том, что гомология аминокислот ограничена отдельными областями молекулы IL-1.
IL-1α и IL-1β продуцируются в качестве белков-предшественников. Иными словами они продуцируются в качестве длинного белка, который затем процесссируется с высвобождением более короткой активной молекулы, которую называют зрелым белком. Зрелый IL-1β, например, высвобождается из Pro-IL-1β после расщепления определенным представителем семейства белков-каспаз, называемым каспазой-1 или интерлейкин-1-конвертирующим ферментом (ICE). 3-мерная структура каждого представителя суперсемейства IL-1 человека состоит из 12-14 β-цепей, образующих белок в форме бочонка.
Хотя в последние десятилетия работы с открытия этого важного провоспалительного цитокина описано множество антител к IL-1, остается потребность в усовершенствованных антителах, которые могут эффективно опосредовать или нейтрализовывать активность IL-1 при воспалительном ответе и аутоиммунных нарушениях, и для применения в детекции IL-1β в образцах и тканях.
Сущность изобретения
Это изобретение относится к белкам, которые связывают IL-1α и IL-1β человека. Связывающие белки по изобретению включают, но не ограничиваются ими, антитела, их антигенсвязывающие части и поливалентные полиспецифические связывающие белки, такие как DVD-IgTM, которые могут связывать IL-1α и IL-1β человека. Также изобретение относится к способам получения и применения связывающих IL-1α и IL-1β белков, описанных в настоящем описании, а также различных композиций, которые можно использовать в способах детекции IL-1α и IL-1β в образце или в способах лечения или профилактики расстройства у индивидуума, которое ассоциировано или предположительно ассоциировано с активностью IL-1.
В одном варианте осуществления изобретение относится к связывающему белку, содержащему первую и вторую полипептидные цепи, где указанная первая полипептидная цепь содержит первый VD1-(X1)n-VD2-C-(X2)n, где:
VD1 представляет собой первый вариабельный домен тяжелой цепи;
VD2 представляет собой второй вариабельный домен тяжелой цепи;
C представляет собой константный домен тяжелой цепи;
X1 представляет собой линкер при условии, что он не является CH1;
X2 представляет собой Fc-область; и
n независимо представляет собой 0 или 1; и
где указанная вторая полипептидная цепь содержит второй VD1-(X1)n-VD2-C-(X2)n, где:
VD1 представляет собой первый вариабельный домен легкой цепи;
VD2 представляет собой второй вариабельный домен легкой цепи;
C представляет собой константный домен легкой цепи;
X1 представляет собой линкер при условии, что он не является CH1;
X2 не содержит Fc-область; и
n независимо представляет собой 0 или 1;
где в указанной первой полипептидной цепи VD1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-148, 196, 198, 200, 202, 204, 206, 208 и 210; и VD2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 213 и 227;
где в указанной второй полипептидной цепи VD1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 149-189, 197, 199, 201, 203, 205, 207, 209 и 211; и VD2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 216 и 229; и
где связывающий белок связывает IL-1β человека и IL-1α человека.
В одном варианте осуществления связывающий белок, описанный выше, содержит первую полипептидную цепь, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 212, 217, 226, 230, 232, 234 и 236.
В другом варианте осуществления связывающий белок, описанный выше, содержит вторую полипептидную цепь, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 215, 218, 228, 231, 233, 235 и 237. В другом аспекте изобретения связывающий белок содержит первую и вторую полипептидные цепи, где указанная первая полипептидная цепь содержит первый VD1-(X1)n-VD2-C-(X2)n, где:
VD1 представляет собой первый вариабельный домен тяжелой цепи;
VD2 представляет собой второй вариабельный домен тяжелой цепи;
C представляет собой константный домен тяжелой цепи;
X1 представляет собой линкер при условии, что он не является CH1;
X2 представляет собой Fc-область; и
n независимо представляет собой 0 или 1; и
где указанная вторая полипептидная цепь содержит второй VD1-(X1)n-VD2-C-(X2)n, где:
VD1 представляет собой первый вариабельный домен легкой цепи;
VD2 представляет собой второй вариабельный домен легкой цепи;
C представляет собой константный домен легкой цепи;
X1 представляет собой линкер при условии, что он не является CH1;
X2 не содержит Fc-область; и
n независимо представляет собой 0 или 1;
где в указанной первой полипептидной цепи VD1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 213 и 227; и VD2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-148, 196, 198, 200, 202, 204, 206, 208 и 210;
где в указанной второй полипептидной цепи VD1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 216 и 229; и VD2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 149-189, 197, 199, 201, 203, 205, 207, 209 и 211; и
где связывающий белок связывает IL-1β человека и IL-1α человека.
В другом варианте осуществления связывающий белок, описанный выше, содержит первую полипептидную цепь, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 219 и 221.
В другом варианте осуществления связывающий белок, описанный выше, содержит вторую полипептидную цепь, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220 и 222.
В другом аспекте изобретение относится к связывающему белку, описанному выше, где:
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 212, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 215, 228, 231, 233 и 235;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 217, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 218 и 237;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 219, то указанная вторая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 220;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 221, то указанная вторая полипептидная цепь содержит SEQ ID NO: 222;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 226, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 228, 215, 231, 233 и 235;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 230, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 231, 215, 228, 233 и 235;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO:232, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 233, 215, 228, 231 и 235;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 234, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 235, 215, 228, 231 и 233; и
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 236, то указанная вторая полипептидная цепь содержит SEQ ID NO: 237.
В другом аспекте изобретение относится к белку, описанному выше, где:
указанная первая полипептидная цепь содержит SEQ ID NO: 212, и указанная вторая полипептидная цепь содержит SEQ ID NO: 215; или
указанная первая полипептидная цепь содержит SEQ ID NO: 217, и указанная вторая полипептидная цепь содержит SEQ ID NO: 218; или
указанная первая полипептидная цепь содержит SEQ ID NO: 219, и указанная вторая полипептидная цепь содержит SEQ ID NO: 220; или
указанная первая полипептидная цепь содержит SEQ ID NO: 221, и указанная вторая полипептидная цепь содержит SEQ ID NO: 222; или
указанная первая полипептидная цепь содержит SEQ ID NO: 226, и указанная вторая полипептидная цепь содержит SEQ ID NO: 228; или
указанная первая полипептидная цепь содержит SEQ ID NO: 230, и указанная вторая полипептидная цепь содержит SEQ ID NO: 231; или
указанная первая полипептидная цепь содержит SEQ ID NO: 232, и указанная вторая полипептидная цепь содержит SEQ ID NO: 233; или
указанная первая полипептидная цепь содержит SEQ ID NO: 234, и указанная вторая полипептидная цепь содержит SEQ ID NO: 235; или
указанная первая полипептидная цепь содержит SEQ ID NO: 236, и указанная вторая полипептидная цепь содержит SEQ ID NO: 237.
В одном варианте осуществления связывающий белок по изобретению, описанный выше, содержит две первых полипептидных цепи и две вторых полипептидных цепи.
В другом аспекте в связывающем белке, описанном выше, X1 или X2 представляет собой аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 26-57, 233, 224 и 225.
В другом варианте осуществления изобретение относится к связывающему белку, описанному выше, где Fc-область выбрана из группы, состоящей из Fc-области с нативной последовательностью и Fc-области с вариантной последовательностью. В другом варианте осуществления Fc-область выбрана из группы, состоящей из Fc-области из IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE и IgD.
В другом варианте осуществления изобретение относится к конъюгату связывающего белка, который содержит связывающий белок, описанный выше, и дополнительно содержит средство. Такие средства включают, но не ограничиваются ими, молекулу иммуноадгезии, радиофармацевтическое средство, лекарственное средство и цитотоксическое средство. Предпочтительные радиофармацевтические средства включают, но не ограничиваются ими, радиоактивную метку, фермент, флуоресцентную метку, люминесцентную метку, биолюминесцентную метку, магнитную метку и биотин. Предпочтительные радиоактивные метки, пригодные для изобретения, включают, но не ограничиваются ими, метки, выбранные из группы, состоящей из: 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm. Предпочтительное терапевтическое или цитотоксическое средство включает, но не ограничивается ими, антиметаболит, алкилирующее средство, антибиотик, фактор роста, цитокин, антиангиогенное средство, антимитотическое средство, антрациклин, токсин и апоптотическое средство.
Также изобретение относится к связывающему белку, содержащему антигенсвязывающий домен, где связывающий белок способен связывать IL-1β человека и антигенсвязывающий домен содержит шесть CDR, т.е. CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3, как определено ниже:
CDR-H1: X1-Y-D-M-S (SEQ ID NO: 190), где:
X1 представляет собой S, K или R;
CDR-H2: Y-X2-S-X4-G-G-X7-G-T-Y-Y-P-D-X14-X15-K-G (SEQ ID NO:191), где;
X2 представляет собой I или V;
X4 представляет собой S или H;
X7 представляет собой G или A;
X14 представляет собой T или S; и
X15 представляет собой V или А;
CDR-H3: G-G-V-X4-K-G-X7-F-D-X10 (SEQ ID NO: 192), где:
X4 представляет собой T или Y;
X7 представляет собой Y или C; и
X10 представляет собой V, E, L, M, Q или Y;
CDR-L1: R-A-S-G-N-I-X7-X8-X9-L-X11 (SEQ ID NO: 193), где:
X7 представляет собой H, Y или W;
X8 представляет собой N, G, T, Q, E, H, D или K;
X9 представляет собой Y или W; и
X11 представляет собой T, A или N;
CDR-L2: X1-A-K-X4-L-X6-X7 (SEQ ID NO: 194), где:
X1 представляет собой N, Q или D;
X4 представляет собой T, N, I, E или S;
X6 представляет собой A, M или E; и
X7 представляет собой D, E, S или A; и
CDR-L3: Q-X2-F-W-X5-X6-P-X8-X9 (SEQ ID NO: 195), где:
X2 представляет собой H или Q;
X5 представляет собой S, N, T, K, R или M;
X6 представляет собой I или L;
X8 представляет собой Y или A; и
X9 представляет собой T, I и N;
за исключением случая, где, когда CDR-H1 представляет собой S-Y-D-M-S (SEQ ID NO: 17), тогда:
CDR-H2 не может представлять собой Y-I-S-S-G-G-G-G-T-Y-Y-P-D-T-V-K-G (SEQ ID NO: 18);
CDR-H3 не может представлять собой G-G-V-T-K-G-Y-F-D-V (SEQ ID NO: 19);
CDR-L1 не может представлять собой R-A-S-G-N-I-H-N-Y-L-T (SEQ ID NO: 20);
CDR-L2 не может представлять собой N-A-K-T-L-A-D (SEQ ID NO: 21); и
CDR-L3 не может представлять собой Q-H-F-W-S-I-P-Y-T (SEQ ID NO: 22).
В одном варианте осуществления выделенный связывающий белок, описанный выше, содержит по меньшей мере одну CDR, которая содержит аминокислотную последовательность, выбранную из группы последовательностей CDR, состоящей из:
В другом варианте осуществления связывающий белок, описанный выше, содержит по меньшей мере три CDR, где CDR взяты из набора CDR, выбранного из группы наборов CDR, состоящих из:
В одном варианте осуществления связывающий белок, описанный выше, содержит CDR из двух наборов CDR, выбранных из описанной выше группы наборов CDR.
В другом варианте осуществления изобретение относится к связывающему белку, содержащему CDR из двух наборов CDR из представленной выше группы, где два набора CDR выбраны из группы, состоящей из:
| набор 1 CDR и набор 2 CDR | набор 101 CDR и набор 102 CDR |
| набор 3 CDR и набор 4 CDR | набор 103 CDR и набор 104 CDR |
| набор 5 CDR и набор 6 CDR | набор 105 CDR и набор 106 CDR |
| набор 7 CDR и набор 8 CDR | набор 107 CDR и набор 108 CDR |
| набор 9 CDR и набор 10 CDR | набор 109 CDR и набор 110 CDR |
| набор 11 CDR и набор 12 CDR | набор 111 CDR и набор 112 CDR |
| набор 13 CDR и набор 14 CDR | набор 113 CDR и набор 114 CDR |
| набор 15 CDR и набор 16 CDR | набор 115 CDR и набор 116 CDR |
| набор 17 CDR и набор 18 CDR | набор 117 CDR и набор 118 CDR |
| набор 19 CDR и набор 20 CDR | набор 119 CDR и набор 120 CDR |
| набор 21 CDR и набор 22 CDR | набор 121 CDR и набор 122 CDR |
| набор 23 CDR и набор 24 CDR | набор 123 CDR и набор 124 CDR |
| набор 25 CDR и набор 26 CDR | набор 125 CDR и набор 126 CDR |
| набор 27 CDR и набор 28 CDR | набор 127 CDR и набор 128 CDR |
| набор 29 CDR и набор 30 CDR | набор 129 CDR и набор 130 CDR |
| набор 31 CDR и набор 32 CDR | набор 131 CDR и набор 132 CDR |
| набор 33 CDR и набор 34 CDR | набор 133 CDR и набор 134 CDR |
| набор 35 CDR и набор 36 CDR | набор 135 CDR и набор 136 CDR |
| набор 37 CDR и набор 38 CDR | набор 137 CDR и набор 138 CDR |
| набор 39 CDR и набор 40 CDR | набор 139 CDR и набор 140 CDR |
| набор 41 CDR и набор 42 CDR | набор 141 CDR и набор 142 CDR |
| набор 43 CDR и набор 44 CDR | набор 143 CDR и набор 144 CDR |
| набор 45 CDR и набор 46 CDR | набор 145 CDR и набор 146 CDR |
| набор 47 CDR и набор 48 CDR | набор 147 CDR и набор 148 CDR |
| набор 49 CDR и набор 50 CDR | набор 149 CDR и набор 150 CDR |
| набор 51 CDR и набор 52 CDR | набор 151 CDR и набор 152 CDR |
| набор 53 CDR и набор 54 CDR | набор 153 CDR и набор 154 CDR |
| набор 55 CDR и набор 56 CDR | набор 155 CDR и набор 156 CDR |
| набор 57 CDR и набор 58 CDR | набор 157 CDR и набор 158 CDR |
| набор 59 CDR и набор 60 CDR | набор 159 CDR и набор 160 CDR |
| набор 61 CDR и набор 62 CDR | набор 161 CDR и набор 162 CDR |
| набор 63 CDR и набор 64 CDR | набор 163 CDR и набор 164 CDR |
| набор 65 CDR и набор 66 CDR | набор 165 CDR и набор 166 CDR |
| набор 67 CDR и набор 68 CDR | набор 167 CDR и набор 168 CDR |
| набор 69 CDR и набор 70 CDR | набор 169 CDR и набор 170 CDR |
| набор 71 CDR и набор 72 CDR | набор 171 CDR и набор 172 CDR |
| набор 73 CDR и набор 74 CDR | набор 173 CDR и набор 174 CDR |
| набор 75 CDR и набор 76 CDR | набор 175 CDR и набор 176 CDR |
| набор 77 CDR и набор 78 CDR | набор 177 CDR и набор 178 CDR |
| набор 79 CDR и набор 80 CDR | набор 179 CDR и набор 180 CDR |
| набор 81 CDR и набор 82 CDR | набор 181 CDR и набор 182 CDR |
| набор 83 CDR и набор 84 CDR | набор 183 CDR и набор 184 CDR |
| набор 85 CDR и набор 86 CDR | набор 185 CDR и набор 186 CDR |
| набор 87 CDR и набор 88 CDR | набор 187 CDR и набор 188 CDR |
| набор 89 CDR и набор 90 CDR | набор 189 CDR и набор 190 CDR |
| набор 91 CDR и набор 92 CDR | набор 191 CDR и набор 192 CDR |
| набор 93 CDR и набор 94 CDR | набор 193 CDR и набор 194 CDR |
| набор 95 CDR и набор 96 CDR | набор 195 CDR и набор 196 CDR |
| набор 97 CDR и набор 98 CDR | набор 197 CDR и набор 198 CDR |
| набор 99 CDR и набор 100 CDR | набор 199 CDR и набор 200 CDR |
В другом варианте осуществления связывающий белок, описанный выше, дополнительно содержит акцепторную каркасную область человека. Предпочтительно, каркасная область человека содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7-10, 13-16, 25, 240-316 и 317-381. В одном варианте осуществления связывающий белок по изобретению содержит последовательность каркасной области человека, выбранную из группы, состоящей из SEQ ID NO: 7-10 и 13-16.
Связывающие белки по изобретению включают белки, которые содержат акцепторную каркасную область человека, содержащую по меньшей мере одну аминокислотную замену в каркасной области, где аминокислотная последовательность каркасной области по меньшей мере на 65% идентична последовательности указанной акцепторной каркасной области человека и содержит по меньшей мере 70 аминокислотных остатков, идентичных указанной акцепторной каркасной области человека.
В другом варианте осуществления связывающий белок содержит акцепторную каркасную область человека, где указанная акцепторная каркасная область содержит по меньшей мере одну аминокислотную замену в ключевом остатке каркасной области, причем указанный остаток выбран из группы, состоящей из: остатка, соседнего с CDR; остатка участка гликозилирования; редкого остатка; остатка, способного взаимодействовать с IL-1β человека; остатка, способного взаимодействовать с CDR; канонического остатка; контактного остатка между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи; остатка в зоне Vernier; и остатка в области, которая перекрывается между определяемой по Chothia CDR1 вариабельной областью тяжелой цепи и определяемой по Kabat первой каркасной областью тяжелой цепи.
В иллюстративном варианте осуществления связывающий белок по изобретению содержит ключевой остаток, где указанный ключевой остаток выбран из группы, состоящей из: 2H, 4H, 24H, 26H, 27H, 29H, 34H, 35H, 37H, 39H, 44H, 45H, 47H, 48H, 49H, 50H, 51H, 58H, 59H, 60H, 63H, 67H, 69H, 71H, 73H, 76H, 78H, 91H, 93H, 94H, 2L, 4L, 25L, 29L, 27bL, 33L, 34L, 36L, 38L, 43L, 44L, 46L, 47L, 48L, 49L, 55L, 58L, 62L, 64L, 71L, 87L, 89L, 90L, 91L, 94L, 95L (все согласно нумерации по Kabat). Иллюстративная подгруппа этих остатков для гуманизации связывающего белка по изобретению состоит из 27H, 48H, 67H, 69H, 93H, 36L, 43L, 46L, 47L, 49L, 58L, 71L и 87L.
В другом варианте осуществления связывающий белок по изобретению содержит консенсусный вариабельный домен человека.
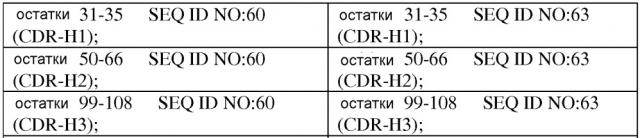
В одном варианте осуществления связывающий IL-1β белок по изобретению содержит по меньшей мере один вариабельный домен, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-189.
В другом варианте осуществления связывающий белок по изобретению содержит по меньшей мере одни вариабельную область (или домен) тяжелой цепи (VH), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-148, 196, 198, 200, 202, 204, 206, 208 и 210.
В другом варианте осуществления связывающий белок по изобретению содержит по меньшей мере одну вариабельную область (домен) легкой цепи (VL), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 149-189.
В другом варианте осуществления связывающий белок согласно изобретению содержит по меньшей мере одну область VH, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-148, 196, 198, 200, 202, 204, 206, 208 и 210, и по меньшей мере одну область VL, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 149-189, 197, 199, 201, 203, 205, 207, 209 и 211.
В одном варианте осуществления связывающий белок по изобретению изобретение содержит два вариабельных домена, где два вариабельных домена содержат аминокислотные последовательности, выбранные из группы, состоящей из:
В другом варианте осуществления связывающий IL-1β белок, описанный в настоящем описании, выбран из группы, состоящей из: молекулы иммуноглобулина; scFv; моноклонального антитела; антитела человека; химерного антитела; гуманизированного антитела; однодоменного антитела; Fab-фрагмента; Fab’-фрагмента; F(ab’)2; Fv; и связанного дисульфидной связью Fv. В предпочтительном варианте осуществления связывающий IL-1β белок представляет собой антитело человека.
В одном аспекте изобретения связывающий белок, описанный в настоящем описании, способен модулировать биологическую функцию IL-1. В другом аспекте связывающий белок, описанный в настоящем описании, способен нейтрализовать IL-1.
В одном варианте осуществления связывающий белок, описанный в настоящем описании, имеет константу скорости ассоциации (Kon) для IL-1β, выбранную из группы, состоящей из: по меньшей мере приблизительно 102 M-1c-1; по меньшей мере приблизительно 103 M-1c-1; по меньшей мере приблизительно 104 M-1c-1; по меньшей мере приблизительно 105 M-1c-1; и по меньшей мере приблизительно 106 M-1c-1, при измерении поверхностным плазмонным резонансом.
В другом варианте осуществления связывающий белок, описанный в настоящем описании, имеет константу скорости диссоциации (Koff) для IL-1β, выбранную из группы, состоящей из: не более чем приблизительно 10-3 c-1; не более чем приблизительно 10-4 c-1; не более чем приблизительно 10-5 c-1; и не более чем приблизительно 10-6 c-1, при измерении поверхностным плазмонным резонансом.
В другом варианте осуществления связывающий белок, описанный в настоящем описании, имеет константу диссоциации (KD) для IL-1β, выбранную из группы, состоящей из: не более чем приблизительно 10-7 M; не более чем приблизительно 10-8 M; не более чем приблизительно 10-9 M; не более чем приблизительно 10-10 M; не более чем приблизительно 10-11 M; не более чем приблизительно 10-12 M; и не более чем 10-13 M.
В одном аспекте изобретение относится к конструкции связывающего белка, которая содержит связывающий белок, описанный в настоящем описании, и дополнительно содержит линкер или константный домен иммуноглобулина. В одном варианте осуществления конструкция связывающего белка содержит связывающий белок, где связывающий белок выбран из группы, состоящей из: молекулы иммуноглобулина, связанного дисульфидной связью Fv, моноклонального антитела, scFv, химерного антитела, антитело с пересаженной CDR, диантитела, гуманизированного антитела, полиспецифического антитела, Fab, антитела с двойной специфичностью, Fab’, биспецифического антитела, и F(ab’)2, DVD-IgTM и Fv.
В одном варианте осуществления конструкция связывающего белка содержит константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из константного домена IgM человека, константного домена IgG4 человека, константного домена IgG1 человека, константного домена IgE человека, константного домена IgG2 человека и константного домена IgG3 человека и константного домена IgA человека.
В другом варианте осуществления конструкция связывающего белка содержит константный домен иммуноглобулина, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
Также изобретение относится к конъюгату связывающего белка, который содержит конструкцию связывающего белка, описанную в настоящем описании, и дополнительно содержит средство, выбранное из группы, состоящей из молекулы иммуноадгезии, радиофармацевтического средства, лекарственного средства и цитотоксического средства. Радиофармацевтические средства, которые пригодны в качестве частей средства в конъюгатах связывающего белка, описанных в настоящем описании, включают, но не ограничиваются ими, радиоактивную метку, фермент, флуоресцентную метку, люминесцентную метку, биолюминесцентную метку, магнитную метку и биотин. В одном варианте осуществления радиоактивная метка выбрана из группы, состоящей из: 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm.
В другом варианте осуществления конъюгат связывающего белка содержит средство, которое является терапевтическим или цитотоксическим средством, выбранным из группы, состоящей из: антиметаболита, алкилирующего средства, антибиотика, фактора роста, цитокина, антиангиогенного средства, антимитотического средства, антрациклина, токсина и апоптотического средства.
В одном варианте осуществления связывающий белок, конструкция связывающего белка или конъюгат связывающего белка, описанные в настоящем описании, обладают паттерном гликозилирования человека.
Связывающие белки, конструкции связывающего белка и конъюгаты связывающего белка, описанные в настоящем описании, могут существовать в качестве растворимых белков или в качестве кристаллов. В одном варианте осуществления такие кристаллы представляют собой не содержащие носителя фармацевтические кристаллы с контролируемым высвобождением. В другом варианте осуществления кристаллические формы связывающего белка, конструкции связывающего белка или конъюгата связывающего белка, описанных в настоящем описании, имеют большее время полужизни in vivo, чем их растворимые аналоги. В другом варианте осуществления кристаллы связывающего белка, конструкции связывающего белка или конъюгата связывающего белка, описанных в настоящем описании, сохраняют биологическую активность их растворимых аналогов.
Композиции по изобретению включают композицию для высвобождения кристаллизованного связывающего белка, конструкции связывающего белка или конъюгата связывающего белка, описанных в настоящем описании, включающую:
(a) состав, где указанный состав содержит кристаллизованный связывающий белок, конструкцию связывающего белка или конъюгат связывающего белка, описанные в настоящем описании, и ингредиент; и
(b) по меньшей мере один полимерный носитель.
Полимерные носители, пригодные в композициях по изобретению, включают, но не ограничиваются ими, один или несколько из группы, состоящей из: поли(акриловой кислоты), поли(цианоакрилатов), поли(аминокислот), поли(ангидридов), поли(депсипептида), поли(сложных эфиров), поли(молочной кислоты), поли(молочной и гликолевой кислоты) или PLGA, поли(b-гидроксибутирата), поли(капролактона), поли(диоксанона); поли(этиленгликоля), поли((гидроксипропил)меткриламида), поли[(органо)фосфазена], поли(сложных ортоэфиров), поли(винилового спирта), поли(винилпирролидона), сополимеров малеинового ангидрида-алкилвинилового простого эфира, полиолов pluronic, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированных полисахаридов, их смесей и сополимеров.
В другом аспекте ингредиент композиции по изобретению выбран из группы, состоящей из альбумина, сахарозы, трегалозы, лактита, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтиленгликоля и полиэтиленгликоля.
Также изобретение относится к фармацевтическим композициям, содержащим связывающий белок, конструкцию связывающего белка или конъюгат связывающего белка, описанные в настоящем описании, и фармацевтически приемлемый носитель. Фармацевтические композиции по изобретению, кроме того, могут содержать по меньшей мере одно дополнительное средство. В одном варианте осуществления такое дополнительное средство включает, но не ограничивается ими: терапевтическое средство, радиофармацевтическое средство, цитотоксическое средство, ингибиторы ангиогенеза; ингибиторы киназ; блокаторы костимуляторных молекул; блокаторы молекул адгезии; антитело против цитокина или его функциональный фрагмент; метотрексат; циклоспорин; рапамицин; FK506; поддающуюся детекции метку или репортер; антагон